Рязанцев Д.И. et al. Анализ риска развития тромбоэмболических осложнений при эндопротезировании суставов у пациентов пожилого возраста в раннем послеоперационном периоде // Вестник ИвГМА. 2016. Vol. 21, № 2. P. 35–39.
Копенкин С.С. Профилактика венозных тромбоэмболических осложнений в ортопедической хирургии: новые возможности // Вестник травматологии и ортопедии им. Н. Н. Приорова. 2010. № 1. P. 35–38.
Rosenfeld B.A. et al. Neuroendocrine stress hormones do not recreate the postoperative hypercoagulable state // Anesth. Analg. Anesth Analg, 1998. Vol. 86, № 3. P. 640–645.
Гайтон А.К., Холл Д.Э. Медицинская физиология. М.:Логосфера / ed. Кобрина В.И.. пер. с англ. 2008. 1296 p.
Falck-Ytter Y. et al. Prevention of VTE in orthopedic surgery patients. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 SUPPL. P. e278S-e325S.
Freedman K.B. et al. A meta-analysis of thromboembolic prophylaxis following elective total hip arthroplasty // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 2000. Vol. 82, № 7. P. 929–938.
Migita K. et al. Venous thromboembolism after total joint arthroplasty: Results from a Japanese multicenter cohort study // Arthritis Res. Ther. BioMed Central Ltd., 2014. Vol. 16, № 4.
Sarmiento A., Goswami A. Thromboembolic disease prophylaxis in total hip arthroplasty // Clin. Orthop. Relat. Res. Lippincott Williams and Wilkins, 2005. № 436. P. 138–143.
Hamilton W.G. et al. Mechanical thromboembolic prophylaxis with risk stratification in total knee arthroplasty. // J. Arthroplasty. Churchill Livingstone Inc., 2015. Vol. 30, № 1. P. 43–45.
Geerts W.H. et al. Prevention of venous thromboembolism: American College of Chest Physicians evidence-based clinical practice guidelines (8th edition) // Chest. American College of Chest Physicians, 2008. Vol. 133, № 6 SUPPL. 6. P. 381S-453S.
Di Nisio M., van Es N., Büller H.R. Deep vein thrombosis and pulmonary embolism // The Lancet. Lancet Publishing Group, 2016. Vol. 388, № 10063. P. 3060–3073.
Kahn S.R. The post-thrombotic syndrome // Hematology. Bulgarian Medical Society of Hematology, 2016. Vol. 2016, № 1. P. 413–418.
Ast M.P. et al. Clinical outcomes of patients with non-fatal VTE after total knee arthroplasty // J. Arthroplasty. 2014. Vol. 29, № 1. P. 37–39.
Лебедев А.К., Кузнецова О.Ю. Тромбоз глубоких вен нижних конечностей. Клинические рекомендации. // Российский семейный врач. 2015. Vol. 19, № 3. P. 4–16.
Хирургические болезни. Учебно-методическое пособие. / ed. Чернядьева С.А. Екатеринбург, 2019. 20 p.
Российские клинические рекомендации по профилактике и лечению ВТЭО // Флебология. 2015. Vol. 9, № 4, выпуск 2. P. 4–52.
Kitchen L. et al. Emergency department management of suspected calf-vein deep venous thrombosis: A diagnostic algorithm // Western Journal of Emergency Medicine. eScholarship, 2016. Vol. 17, № 4. P. 1–7.
Roy P.M. et al. Appropriateness of diagnostic management and outcomes of suspected pulmonary embolism // Ann. Intern. Med. American College of Physicians, 2006. Vol. 144, № 3. P. 157–164.
Kitchen L. et al. Emergency Department Management of Suspected Calf-Vein Deep Venous Thrombosis: A Diagnostic Algorithm. // West. J. Emerg. Med. eScholarship, 2016. Vol. 17, № 4. P. 384–390.
Bernardi E. et al. Serial 2-point ultrasonography plus D-dimer vs whole-leg color-coded Doppler ultrasonography for diagnosing suspected symptomatic deep vein thrombosis: A randomized controlled trial // JAMA - J. Am. Med. Assoc. JAMA, 2008. Vol. 300, № 14. P. 1653–1659.
Michiels J.J. et al. Diagnosis of deep vein thrombosis, and prevention of deep vein thrombosis recurrence and the post-thrombotic syndrome in the primary care medicine setting anno 2014. // World J. Crit. care Med. Baishideng Publishing Group Inc., 2015. Vol. 4, № 1. P. 29–39.
Righini M., Robert-Ebadi H. Diagnosis of acute Pulmonary Embolism // Hamostaseologie. Georg Thieme Verlag, 2018. Vol. 38, № 1. P. 11–21.
Dronkers C.E.A. et al. Towards a tailored diagnostic standard for future diagnostic studies in pulmonary embolism: communication from the SSC of the ISTH // J. Thromb. Haemost. Blackwell Publishing Ltd, 2017. Vol. 15, № 5. P. 1040–1043.
Pollack C. V. et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: Initial report of EMPEROR (multicenter emergency medicine pulmonary embolism in the real world registry) // J. Am. Coll. Cardiol. J Am Coll Cardiol, 2011. Vol. 57, № 6. P. 700–706.
Wells P.S. et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis // N. Engl. J. Med. N Engl J Med, 2003. Vol. 349, № 13. P. 1227–1235.
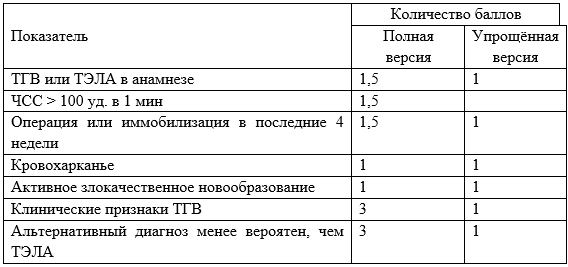
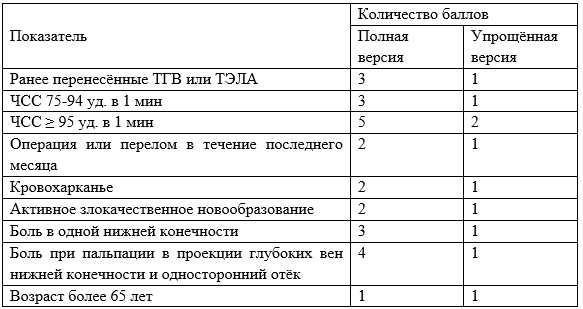
Modi S. et al. Wells criteria for DVT is a reliable clinical tool to assess the risk of deep venous thrombosis in trauma patients // World J. Emerg. Surg. BioMed Central Ltd., 2016. Vol. 11, № 1.
Douma R.A. et al. Validity and clinical utility of the simplified Wells rule for assessing clinical probability for the exclusion of pulmonary embolism // Thromb. Haemost. 2009. Vol. 101, № 1. P. 197–200.
Douma R.A. et al. Original Research Performance of 4 Clinical Decision Rules in the Diagnostic Management of Acute Pulmonary Embolism. A prospective cohort study // Ann. Intern. Med. American College of Physicians, 2011. Vol. 154, № 11. P. 709–718.
van Es N. et al. The original and simplified Wells rules and age-adjusted D-dimer testing to rule out pulmonary embolism: an individual patient data meta-analysis. // J. Thromb. Haemost. Blackwell Publishing Ltd, 2017. Vol. 15, № 4. P. 678–684.
Wells P.S. et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer - PubMed. 2000. Vol. 83, № 3. P. 416–420.
Shen J.H. et al. Comparison of the Wells score with the revised Geneva score for assessing suspected pulmonary embolism: a systematic review and meta-analysis // J. Thromb. Thrombolysis. Springer New York LLC, 2016. Vol. 41, № 3. P. 482–492.
van Es N. et al. The original and simplified Wells rules and age-adjusted D-dimer testing to rule out pulmonary embolism: an individual patient data meta-analysis // J. Thromb. Haemost. Blackwell Publishing Ltd, 2017. Vol. 15, № 4. P. 678–684.
Kamolratanapiboon K., Tantanate C. Inappropriate use of D-dimer and impact on the test characteristics for deep vein thrombosis exclusion // Scand. J. Clin. Lab. Invest. Taylor and Francis Ltd, 2019. Vol. 79, № 6. P. 431–436.
Zhang Y. et al. The rate of missed diagnosis of lower-limb DVT by ultrasound amounts to 50% or so in patients without symptoms of DVT: A meta-analysis // Medicine (United States). Lippincott Williams and Wilkins, 2019. Vol. 98, № 37.
Zhang L. et al. Correlation analysis between plasma D-dimer levels and orthopedic trauma severity - PubMed // Chin Med J. 2012. Vol. 125, № 17. P. 3133–3136.
Yoshiiwa T. et al. Analysis of measured D-dimer levels for detection of deep venous thrombosis and pulmonary embolism after spinal surgery // J. Spinal Disord. Tech. 2011. Vol. 24, № 4.
Stein P.D. et al. D-Dimer for the Exclusion of Acute Venous Thrombosis and Pulmonary Embolism: A Systematic Review // Annals of Internal Medicine. American College of Physicians, 2004. Vol. 140, № 8.
Huisman M. V. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography // J. Am. Med. Assoc. American Medical Association, 2006. Vol. 295, № 2. P. 172–179.
Wells P.S. et al. Excluding pulmonary embolism at the bedside without diagnostic imaging: Management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and D-dimer // Ann. Intern. Med. American College of Physicians, 2001. Vol. 135, № 2. P. 98–107.
Pomero F. et al. Accuracy of emergency physician-performed ultrasonography in the diagnosis of deep-vein thrombosis: A systematic review and meta-analysis // Thromb. Haemost. Thromb Haemost, 2013. Vol. 109, № 1. P. 137–145.
Shiver S.A. et al. Prospective comparison of emergency physician-performed venous ultrasound and CT venography for deep venous thrombosis // Am. J. Emerg. Med. Am J Emerg Med, 2010. Vol. 28, № 3. P. 354–358.
Righini M. et al. Diagnosis of pulmonary embolism by multidetector CT alone or combined with venous ultrasonography of the leg: a randomised non-inferiority trial // Lancet. Lancet, 2008. Vol. 371, № 9621. P. 1343–1352.
Le Gal G. et al. A positive compression ultrasonography of the lower limb veins is highly predictive of pulmonary embolism on computed tomography in suspected patients // Thromb. Haemost. Thromb Haemost, 2006. Vol. 95, № 6. P. 963–966.
Lemech L.D. et al. Is bilateral duplex scanning necessary in patients with symptoms of deep venous thrombosis? // ANZ Journal of Surgery. 2004. Vol. 74, № 10. P. 847–851.
Jawa R.S. et al. Venous thromboembolic disease in trauma and surveillance ultrasonography // J. Surg. Res. 2011. Vol. 167, № 1. P. 24–31.
Katz D.S. et al. CT Venography in Suspected Pulmonary Thromboembolism // Semin. Ultrasound, CT MRI. W.B. Saunders, 2004. Vol. 25, № 1. P. 67–80.
Kanne J.P., Lalani T.A. Role of Computed Tomography and Magnetic Resonance Imaging for Deep Venous Thrombosis and Pulmonary Embolism // Circulation. 2004. Vol. 109, № 12 SUPPL.
Rahaghi F.N., Minhas J.K., Heresi G.A. Diagnosis of Deep Venous Thrombosis and Pulmonary Embolism: New Imaging Tools and Modalities // Clinics in Chest Medicine. W.B. Saunders, 2018. Vol. 39, № 3. P. 493–504.
Loud P.A. et al. Deep venous thrombosis with suspected pulmonary embolism: Detection with combined CT venography and pulmonary angiography // Radiology. Radiological Society of North America Inc., 2001. Vol. 219, № 2. P. 498–502.
Lemech L.D. et al. Is bilateral duplex scanning necessary in patients with symptoms of deep venous thrombosis? // ANZ Journal of Surgery. ANZ J Surg, 2004. Vol. 74, № 10. P. 847–851.
Song K. et al. The preoperative incidence of deep vein thrombosis (DVT) and its correlation with postoperative DVT in patients undergoing elective surgery for femoral neck fractures // Arch. Orthop. Trauma Surg. Springer Verlag, 2016. Vol. 136, № 10. P. 1459–1464.
Zhang B.F. et al. Deep vein thrombosis in bilateral lower extremities after hip fracture: A retrospective study of 463 patients // Clin. Interv. Aging. Dove Medical Press Ltd., 2018. Vol. 13. P. 681–689.
Cho Y.H. et al. Preoperative incidence of deep vein thrombosis after hip fractures in Korean // CiOS Clin. Orthop. Surg. Korean Orthopaedic Association, 2015. Vol. 7, № 3. P. 298–302.
Smith E.B., Parvizi J., Purtill J.J. Delayed surgery for patients with femur and hip fractures-risk of deep venous thrombosis // J. Trauma. J Trauma, 2011. Vol. 70, № 6. P. E113–E116.
Профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии. Российские клинические рекомендации. // Травматология и ортопедия России. 2012. Vol. 63, № 1. P. 3–24.
Fu Y.H. et al. Deep vein thrombosis in the lower extremities after femoral neck fracture: A retrospective observational study // J. Orthop. Surg. SAGE Publications Ltd, 2020. Vol. 28, № 1.
Dermody M. et al. The utility of screening for deep venous thrombosis in asymptomatic, non-ambulatory neurosurgical patients // J. Vasc. Surg. J Vasc Surg, 2011. Vol. 53, № 5. P. 1309–1315.
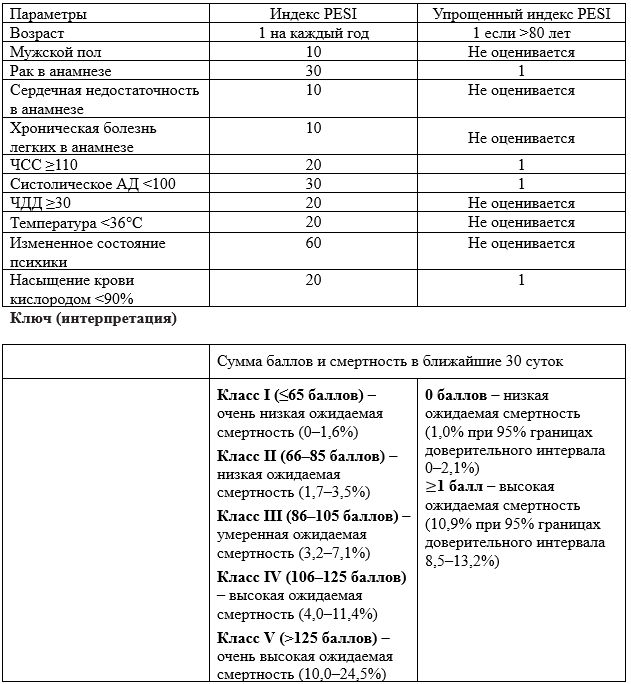
Tak T. et al. Acute Pulmonary Embolism: Contemporary Approach to Diagnosis, Risk-Stratification, and Management // Int. J. Angiol. Thieme Medical Publishers, Inc., 2019. Vol. 28, № 2. P. 100–111.
Abusibah H. et al. Ambulatory management of pulmonary embolism // Br. J. Hosp. Med. (Lond). NLM (Medline), 2018. Vol. 79, № 1. P. 18–25.
Moore C., McNamara K., Liu R. Challenges and Changes to the Management of Pulmonary Embolism in the Emergency Department // Clinics in Chest Medicine. W.B. Saunders, 2018. Vol. 39, № 3. P. 539–547.
Kearon C. et al. Antithrombotic therapy for VTE disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 SUPPL. P. e419S-e496S.
Kearon C. et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report // Chest. American College of Chest Physicians, 2016. Vol. 149, № 2. P. 315–352.
Garcia D.A. et al. Parenteral anticoagulants - Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 SUPPL. P. e24S-e43S.
Agnelli G. et al. Oral apixaban for the treatment of acute venous thromboembolism // N. Engl. J. Med. Massachussetts Medical Society, 2013. Vol. 369, № 9. P. 799–808.
Cosmi B. et al. A randomized double-blind study of low-molecular-weight heparin (parnaparin) for superficial vein thrombosis: STEFLUX (Superficial ThromboEmbolism and Fluxum) // J. Thromb. Haemost. 2012. Vol. 10, № 6. P. 1026–1035.
Decousus H. et al. Fondaparinux for the treatment of superficial-vein thrombosis in the legs // N. Engl. J. Med. Massachussetts Medical Society, 2010. Vol. 363, № 13. P. 1222–1232.
Decousus H. A pilot randomized double-blind comparison of a low-molecular-weight heparin, a nonsteroidal anti-inflammatory agent, and placebo in the treatment of superficial vein thrombosis // Arch. Intern. Med. Arch Intern Med, 2003. Vol. 163, № 14. P. 1657–1663.
Cote L.P. et al. Comparisons between Upper and Lower Extremity Deep Vein Thrombosis: A Review of the RIETE Registry // Clinical and Applied Thrombosis/Hemostasis. SAGE Publications Inc., 2017. Vol. 23, № 7. P. 748–754.
Schastlivtsev I. et al. Rivaroxaban in the treatment of upper extremity deep vein thrombosis: A single-center experience and review of the literature // Thromb. Res. Elsevier Ltd, 2019. Vol. 181. P. 24–28.
van den Houten M.M.L. et al. Treatment of upper-extremity outflow thrombosis. // Phlebology. SAGE Publications Ltd, 2016. Vol. 31, № 1 Suppl. P. 28–33.
Aschwanden M. et al. Effect of prolonged treatment with compression stockings to prevent post-thrombotic sequelae: A randomized controlled trial // J. Vasc. Surg. J Vasc Surg, 2008. Vol. 47, № 5. P. 1015–1021.
Ginsberg J.S. et al. Prevention and treatment of postphlebitic syndrome: Results of a 3-part study // Arch. Intern. Med. Arch Intern Med, 2001. Vol. 161, № 17. P. 2105–2109.
Konstantinides S. V. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) // European Respiratory Journal. European Respiratory Society, 2019. Vol. 54, № 3.
Lee A.Y.Y. et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer // N. Engl. J. Med. 2003. Vol. 349, № 2. P. 146–153.
Woodruff S. et al. Low-molecular-weight-heparin versus a coumarin for the prevention of recurrent venous thromboembolism in high- and low-risk patients with active cancer: a post hoc analysis of the CLOT Study // J. Thromb. Thrombolysis. Springer New York LLC, 2019.
Bates S.M. et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: Venous thromboembolism in the context of pregnancy // Blood Advances. American Society of Hematology, 2018. Vol. 2, № 22. P. 3317–3359.
Shin W.C. et al. Preoperative prevalence of and risk factors for venous thromboembolism in patients with a hip fracture an indirect multidetector CT venography study // Journal of Bone and Joint Surgery - American Volume. Lippincott Williams and Wilkins, 2016. Vol. 98, № 24. P. 2089–2095.
Marti C. et al. Systemic thrombolytic therapy for acute pulmonary embolism: A systematic review and meta-analysis // European Heart Journal. Oxford University Press, 2015. Vol. 36, № 10. P. 605–614.
Dua A. et al. Variability in the Management of Superficial Venous Thrombophlebitis across Practitioners Based in North America and the Global Community // Thrombosis. Hindawi Limited, 2014. Vol. 2014. P. 1–6.
Di Nisio M., Wichers I.M., Middeldorp S. Treatment for superficial thrombophlebitis of the leg // Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2018. Vol. 2018, № 2.
Wichers I. et al. Treatment of superficial vein thrombosis to prevent deep vein thrombosis and pulmonary embolism: a systematic review // Haematologica. 2005. Vol. 90, № 5.
Mismetti P. et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs anticoagulation alone on risk of recurrent pulmonary embolism: A randomized clinical trial // JAMA - J. Am. Med. Assoc. American Medical Association, 2015. Vol. 313, № 16. P. 1627–1635.
Bikdeli B. et al. Inferior Vena Cava Filters to Prevent Pulmonary Embolism: Systematic Review and Meta-Analysis // J. Am. Coll. Cardiol. Elsevier USA, 2017. Vol. 70, № 13. P. 1587–1597.
Shao M. et al. Application of inferior vena cava filters in prevention of peri-operative pulmonary embolism in patients with bone fracture combined with deep venous thrombosis: a report of 572 cases // Zhonghua Wai Ke Za Zhi. 2012. Vol. 50, № 5. P. 418–421.
Pan Y. et al. A single-center retrospective study on the intraluminal implantation of inferior vena cava filter for the lower extremity trauma patients with deep venous thrombosis // Zhonghua Wai Ke Za Zhi. 2014. Vol. 52, № 4. P. 254–257.
Whitlock R.P. et al. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 SUPPL. P. e576S-e600S.
Golemi I. et al. Venous thromboembolism prophylaxis using the Caprini score // Disease-a-Month. 2019. Vol. 65. P. 249–298.
Ахтямов И.Ф. et al. Эффективность электронейростимуляции как метода профилактики тромбоэмболических осложнений при эндопротезировании тазобедренного сустава. 2017. Vol. 8, № 109. P. 29–35.
Guyatt G.H. et al. Executive summary: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. 2012. Vol. 141, № 2 SUPPL. P. 7S-47S.
National Guideline Centre. Venous thromboembolism in over 16s: Reducing the risk of hospital-acquired deep vein thrombosis or pulmonary embolism // Natl. Inst. Heal. Care Excell. 2018. Vol. 2, № March.
Jenny J.Y., Pabinger I., Samama C.M. European guidelines on perioperative venous thromboembolism prophylaxis // Eur. J. Anaesthesiol. Lippincott Williams and Wilkins, 2018. Vol. 35, № 2. P. 123–129.
Arthroplasty Society of Australia guidelines for VTE prophylaxis for hip and knee arthroplasty: Australian Orthopaedic Association [Electronic resource]. 2018. URL: https://www.health.qld.gov.au/clinical-%0Apractice/guidelines-procedures/medicines/safety (accessed: 11.09.2020).
Anderson D.R. et al. Aspirin versus low-molecular-weight heparin for extended venous thromboembolism prophylaxis after total hip arthroplasty: A randomized trial // Ann. Intern. Med. Ann Intern Med, 2013. Vol. 158, № 11. P. 800–806.
Касимова А.Р., Божкова С. Влияние фармакологической тромбопрофилактики, турникета и дренирования на геморрагические осложнения в ранние сроки после эндопротезирования коленного сустава: предварительные результаты // Травматология и ортопедия России. 2019. Vol. 25, № 3. P. 70–80.
Заболотских И.Б. et al. Периоперационное ведение больных, получающих длительную антитромботическую терапию. Клинические рекомендации // Анестезиология и реаниматология. 2014. № 4. P. 4–14.
Ревишвили А.Ш. et al. Особенности оказания экстренной и неотложной медицинской помощи пациентам, получающим прямые оральные антикоагулянты // Вестник аритмологии. 2018. № 92. P. 59–72.
Schulman S. et al. Venous Thromboembolic Diseases: Diagnosis, Management and Thrombophilia Testing: Observations on NICE Guideline [NG158] // Thromb. Haemost. Georg Thieme Verlag KG, 2020.
Borgen P.O. et al. Similar Clinical Outcomes with Preoperative and Postoperative Start of Thromboprophylaxis in THA: A Register-based Study // Clin. Orthop. Relat. Res. Springer New York LLC, 2017. Vol. 475, № 9. P. 2245–2252.
Venker B.T. et al. Safety and Efficacy of New Anticoagulants for the Prevention of Venous Thromboembolism After Hip and Knee Arthroplasty: A Meta-Analysis // Journal of Arthroplasty. Churchill Livingstone Inc., 2017. Vol. 32, № 2. P. 645–652.
Pedersen A.B. et al. Venous thromboembolism in patients having knee replacement and receiving thromboprophylaxis: A Danish population-based follow-up study // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 2011. Vol. 93, № 14. P. 1281–1287.
Guijarro R. et al. Venous thromboembolism and bleeding after total knee and hip arthroplasty: Findings from the Spanish national discharge database // Thromb. Haemost. Thromb Haemost, 2011. Vol. 105, № 4. P. 610–615.
Raphael I.J. et al. Aspirin: An alternative for pulmonary embolism prophylaxis after arthroplasty? // Clinical Orthopaedics and Related Research. Springer New York LLC, 2014. Vol. 472, № 2. P. 482–488.
An V.V.G. et al. Aspirin as Thromboprophylaxis in Hip and Knee Arthroplasty: A Systematic Review and Meta-Analysis // Journal of Arthroplasty. Churchill Livingstone Inc., 2016. Vol. 31, № 11. P. 2608–2616.
Касимова А.Р., Божкова С. Применение различных групп лекарственных средств для фармакологической тромбопрофилактики после больших ортопедических операций в клинической практике // Флебология. 2018. Vol. 12, № 4. P. 306–313.
Tveit D.P. et al. Chronic dialysis patients have high risk for pulmonary embolism // Am. J. Kidney Dis. 2002. Vol. 39, № 5. P. 1011–1017.
Li Q. et al. Chronic Kidney Dysfunction Can Increase the Risk of Deep Vein Thrombosis after Total Hip and Knee Arthroplasty // Biomed Res. Int. Hindawi, 2017. Vol. 2017.
Lu H.Y., Liao K.M. Increased risk of deep vein thrombosis in end-stage renal disease patients // BMC Nephrol. BMC Nephrology, 2018. Vol. 19, № 1. P. 9–14.
Nutescu E.A. et al. Low-molecular-weight heparins in renal impairment and obesity: Available evidence and clinical practice recommendations across medical and surgical settings // Ann. Pharmacother. 2009. Vol. 43, № 6. P. 1064–1083.
Lazrak H.H. et al. Safety of low-molecular-weight heparin compared to unfractionated heparin in hemodialysis: a systematic review and meta-analysis // BMC Nephrol. BMC Nephrology, 2017. Vol. 18, № 1. P. 1–12.
Karaoui L.R. et al. Enoxaparin 20 mg for thromboprophylaxis in severe renal impairment // J. Int. Med. Res. 2019. Vol. 47, № 1. P. 225–234.
Grootendorst D.C. et al. CLINICIAN ’ S CORNER Cardiovascular and Noncardiovascular // Jama. 2009. Vol. 302, № 16. P. 1782–1789.
Tsai M.H., Fang Y.W., Leu J.G. Tinzaparin provides lower lipid profiles in maintenance hemodialysis patients: A cross-sectional observational study // Sci. World J. Hindawi Publishing Corporation, 2014. Vol. 2014.
Polkinghorne K.R., McMahon L.P., Becker G.J. Pharmacokinetic studies of dalteparin (Fragmin), enoxaparin (clexane), and danaparoid sodium (orgaran) in stable chronic hemodialysis patients // Am. J. Kidney Dis. 2002. Vol. 40, № 5. P. 990–995.
Aursulesei V., Costache I.I. Anticoagulation in chronic kidney disease: from guidelines to clinical practice // Clin. Cardiol. 2019. Vol. 42, № 8. P. 774–782.
Huang H.F. et al. The effect of anticoagulants on venous thrombosis prevention after knee arthroscopy: a systematic review // Int. Orthop. Springer Verlag, 2019. Vol. 43, № 10. P. 2303–2308.
Salzler M.J. et al. Complications after arthroscopic knee surgery // American Journal of Sports Medicine. Am J Sports Med, 2014. Vol. 42, № 2. P. 292–296.
Graham W.C., Flanigan D.C. Venous thromboembolism following arthroscopic knee surgery: A current concepts review of incidence, prophylaxis, and preoperative risk assessment // Sports Medicine. Sports Med, 2014. Vol. 44, № 3. P. 331–343.
Zheng G. et al. No effectiveness of anticoagulants for thromboprophylaxis after non-major knee arthroscopy: a systemic review and meta-analysis of randomized controlled trials // Journal of Thrombosis and Thrombolysis. Springer New York LLC, 2018. Vol. 45, № 4. P. 562–570.
Jameson S.S. et al. Venous thromboembolic events following foot and ankle surgery in the English National Health Service // J. Bone Jt. Surg. - Ser. B. J Bone Joint Surg Br, 2011. Vol. 93 B, № 4. P. 490–497.
Calder J.D.F. et al. Meta-analysis and suggested guidelines for prevention of venous thromboembolism (VTE) in foot and ankle surgery // Knee Surgery, Sport. Traumatol. Arthrosc. Springer Verlag, 2016. Vol. 24, № 4. P. 1409–1420.
Weisman M.H.S. et al. Venous Thromboembolic Prophylaxis in Foot and Ankle Surgery: A Review of Current Literature and Practice // Foot and Ankle Specialist. SAGE Publications Ltd, 2017. Vol. 10, № 4. P. 343–351.
Felcher A.H. et al. AIncidence and risk factors for venous thromboembolic disease in podiatric surgery // Chest. American College of Chest Physicians, 2009. Vol. 135, № 4. P. 917–922.
Jameson S.S. et al. Venous thromboembolic events are rare after shoulder surgery: Analysis of a national database // J. Shoulder Elb. Surg. J Shoulder Elbow Surg, 2011. Vol. 20, № 5. P. 764–770.
Ojike N.I. et al. Venous thromboembolism in shoulder surgery: a systematic review. // Acta orthopaedica Belgica. 2011. Vol. 77, № 3. P. 281–289.
Sager B. et al. Timing and Risk Factors for Venous Thromboembolism After Rotator Cuff Repair in the 30-Day Perioperative Period // Arthrosc. - J. Arthrosc. Relat. Surg. W.B. Saunders, 2019. Vol. 35, № 11. P. 3011–3018.
Mosenthal W.P. et al. Thromboprophylaxis in spinal surgery // Spine. Lippincott Williams and Wilkins, 2018. Vol. 43, № 8. P. E474–E481.
Shiqing W. et al. Efficacy of low molecular weight heparin in spinal trauma patients after part concentrated screw surgery and its influence on blood parameters and the incidence of deep venous thrombosis // Med. Hypotheses. Churchill Livingstone, 2019. Vol. 132.
Faraoni D. et al. European guidelines on perioperative venous thromboembolism prophylaxis // Eur. J. Anaesthesiol. Lippincott Williams and Wilkins, 2018. Vol. 35, № 2. P. 90–95.
Gill S.K. et al. Mechanical prophylaxis, early mobilisation and risk stratification: as effective as drugs for low risk patients undergoing primary joint replacement. Results in 13,384 patients // Surgeon. Elsevier Ltd, 2019.
Routhier N., Tagalakis V., Bouchard-Duchene V. Venous thromboembolism (VTE) prophylaxis - Symptoms, diagnosis and treatment | BMJ Best Practice US [Electronic resource]. 2017. URL: https://bestpractice.bmj.com/topics/en-us/1087 (accessed: 15.09.2020).
Chung W.S. et al. Increased risk of deep vein thrombosis and pulmonary thromboembolism in patients with spinal cord injury: A nationwide cohort prospective study // Thromb. Res. Elsevier Ltd, 2014. Vol. 133, № 4. P. 579–584.
Сомонова О.В. et al. Практические рекомендации по профилактике и лечению тромбрэмболических осложнений у онкологических больных // Злокачественные опухоли: Практические рекомендации RUSSCO. 2017. Vol. 3s2. P. 553–558.
Хороненко В.Э. et al. Периоперационная профилактика венозных тромбоэмболических осложнений в плановой онкохирургии // Исследования и практика в медицине. QUASAR, LLC, 2016. Vol. 3, № 4. P. 61–69.
Kim S.M. et al. Risk factors for post-operative venous thromboembolism in patients with a malignancy of the lower limb // Bone Jt. J. British Editorial Society of Bone and Joint Surgery, 2013. Vol. 95 B, № 4. P. 558–562.
Morii T. et al. Venous thromboembolism in the management of patients with musculoskeletal tumor // J. Orthop. Sci. Springer Tokyo, 2010. Vol. 15, № 6. P. 810–815.
Nathan S.S. et al. Proximal deep vein thrombosis after hip replacement for oncologic indications // J. Bone Jt. Surg. - Ser. A. J Bone Joint Surg Am, 2006. Vol. 88, № 5. P. 1066–1070.
Patel A.R. et al. Aspirin and compression devices versus low-molecular-weight heparin and PCD for VTE prophylaxis in orthopedic oncology patients // J. Surg. Oncol. J Surg Oncol, 2010. Vol. 102, № 3. P. 276–281.
Ruggieri P. et al. Clinically significant thromboembolic disease in orthopedic oncology: An analysis of 986 patients treated with low-molecular-weight heparin // J. Surg. Oncol. John Wiley and Sons Inc., 2010. Vol. 102, № 5. P. 375–379.
Singh V.A., Yong L.M., Vijayananthan A. Is DVT prophylaxis necessary after oncology lower limb surgery? A pilot study // Springerplus. SpringerOpen, 2016. Vol. 5, № 1.
Carrier M. et al. Systematic review: The Trousseau syndrome revisited: Should we screen extensively for cancer in patients with venous thromboembolism? // Annals of Internal Medicine. American College of Physicians, 2008. Vol. 149, № 5. P. 323–333.
Watson H.G. et al. Guideline on aspects of cancer-related venous thrombosis // Br. J. Haematol. 2015. Vol. 170, № 5. P. 640–648.
Kaiser C.L. et al. Predictors of venous thromboembolism in patients with primary sarcoma of bone // Surg. Oncol. Elsevier Ltd, 2017. Vol. 26, № 4. P. 506–510.
Mitchell S.Y. et al. Venous thromboembolism in patients with primary bone or soft-tissue sarcomas // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 2007. Vol. 89, № 11. P. 2433–2439.
Ramo B.A. et al. Incidence of symptomatic venous thromboembolism in oncologic patients undergoing lower-extremity endoprosthetic arthroplasty // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 2011. Vol. 93, № 9. P. 847–854.
Yamaguchi T. et al. Deep-vein thrombosis after resection of musculoskeletal tumours of the lower limb // Bone Jt. J. British Editorial Society of Bone and Joint Surgery, 2013. Vol. 95 B, № 9. P. 1280–1284.
Fleischer A.E. et al. American College of Foot and Ankle Surgeons’ Clinical Consensus Statement: Risk, Prevention, and Diagnosis of Venous Thromboembolism Disease in Foot and Ankle Surgery and Injuries Requiring Immobilization // J. Foot Ankle
Llau J. V., Kamphuisen P., Albaladejo P. European guidelines on perioperative venous thromboembolism prophylaxis // Eur. J. Anaesthesiol. Lippincott Williams and Wilkins, 2018. Vol. 35, № 2. P. 139–141.
Fleisher L.A. et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery A report of the American College of Cardiology/American Heart Association task force on practice guidelines // Circulation. Lippincott Williams and Wilkins, 2014. Vol. 130, № 24. P. e278–e333.
Heidbuchel H. et al. Updated European Heart Rhythm Association Practical Guide on the use of non-Vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation // Europace. Oxford University Press, 2015. Vol. 17, № 10. P. 1467–1507.
Raval A.N. et al. Management of patients on Non-Vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting // Circulation. Lippincott Williams and Wilkins, 2017. Vol. 135, № 10. P. e604–e633.
Eikelboom J.W. et al. Emergency care of patients receiving non-vitamin K antagonist oral anticoagulants // British Journal of Anaesthesia. Elsevier Ltd, 2018. Vol. 120, № 4. P. 645–656.
Matharu G.S. et al. Clinical effectiveness and safety of aspirin for venous thromboembolism prophylaxis after total hip and knee replacement: a systematic review and meta-analysis of randomized clinical trials. JAMA Intern Med. 2020 Mar 1;180(3):376-384.
Singjie LC. Et al. Clinical effectiveness and safety of aspirin and other anticoagulants for venous thromboembolism prophylaxis after major orthopedic surgery: a systematic review and meta-analysis of randomized clinical trials. EFORT Open Rev. 2022 Dec 21;7(12):792-799.
Hashimoto Y, Komiya E, Nishino K, Nishida Y, Masuda A, Nakamura H. Postoperative D-dimer levels predict venous thromboembolisms detected with contrast-enhanced computerized tomography in patients undergoing anterior cruciate ligament reconstruction. BMC Musculoskelet Disord. 2023 Feb 6;24(1):95.
Qiu YH, Zhang YH, Wu ZC, Yang Z, Zhu GX, Miao SL, Chen BC, Chen FF. Outcomes after open and endovascular treatment for mesenteric artery embolism patients: a retrospective inverse probability of treatment-weighted analysis. Eur J Trauma Emerg Surg. 2024 Dec;50(6):2883-2893.
Kumagai G, Wada K, Kudo H, Asari T, Ichikawa N, Ishibashi Y. D-dimer monitoring combined with ultrasonography improves screening for asymptomatic venous thromboembolism in acute spinal cord injury. J Spinal Cord Med. 2020 May;43(3):353-357.
Fu C, Chen YY, Zhu F, Liu J. Analysis of the Occurrence of Acute Pulmonary Embolism in the ICU Ward and Related Risk Factors Predicting Its Severity. Heart Surg Forum. 2022 Mar 17;25(2):E190-E195.
Wang H, Lv B, Li W, Wang S. The Impact of D-Dimer on Postoperative Deep Vein Thrombosis in Patients with Thoracolumbar Fracture Caused by High-Energy Injuries. Clin Appl Thromb Hemost. 2022 Jan-Dec;28:10760296211070009.
Cho JH, Kim JB, Lee DG. Correlation Between D-Dimer Level and Deep Venous Thrombosis in Patients With Acute Spinal Cord Injuries. Am J Phys Med Rehabil. 2020 Jul;99(7):613-616.
Wang Y, Liang X, Wang S, Wang Y, Qin L, Chen D, Jiang Y, Zhang H. Analysis of the Risk Factors for Elevated D-Dimer Level After Breast Cancer Surgery: A Multicenter Study Based on Nursing Follow-Up Data. Front Oncol. 2022 Jul 19;12:772726.
Nepal G, Kharel S, Bhagat R, Ka Shing Y, Ariel Coghlan M, Poudyal P, Ojha R, Sunder Shrestha G. Safety and efficacy of Direct Oral Anticoagulants in cerebral venous thrombosis: A meta-analysis. Acta Neurol Scand. 2022 Jan;145(1):10-23.
Beyer-Westendorf J, Schellong SM, Gerlach H, Rabe E, Weitz JI, Jersemann K, Sahin K, Bauersachs R; SURPRISE investigators. Prevention of thromboembolic complications in patients with superficial-vein thrombosis given rivaroxaban or fondaparinux: the open-label, randomised, non-inferiority SURPRISE phase 3b trial. Lancet Haematol. 2017 Mar;4(3):e105-e113.
Ageno W, Mantovani LG, Haas S, Kreutz R, Monje D, Schneider J, van Eickels M, Gebel M, Zell E, Turpie AG. Safety and effectiveness of oral rivaroxaban versus standard anticoagulation for the treatment of symptomatic deep-vein thrombosis (XALIA): an international, prospective, non-interventional study. Lancet Haematol. 2016 Jan;3(1):e12-21.
Bontinis A, Pouliopoulou I, Bontinis V, Liakopoulos V, Giannopoulos A, Chatzimpalasi T, Ktenidis K. Anticoagulants for the treatment of isolated lower limb superficial vein thrombosis a Bayesian network meta-analysis of randomized controlled trials. Thromb Res. 2024 Sep;241:109101.
Kandula V, Shah PV, Thirunavu VM, Yerneni K, Karras C, Abecassis ZA, Hopkins B, Bloch O, Potts MB, Jahromi BS, Tate MC. Low-molecular-weight Heparin (enoxaparin) versus unfractionated heparin for venous thromboembolism prophylaxis in patients undergoing craniotomy. Clin Neurol Neurosurg. 2022 Dec;223:107482.
Samama CM, Lecoules N, Kierzek G, Claessens YE, Riou B, Rosencher N, Mismetti P, Sautet A, Barrellier MT, Apartsin K, Jonas M, Caeiro JR, van der Veen AH, Roy PM; FONDACAST Study Group. Comparison of fondaparinux with low molecular weight heparin for venous thromboembolism prevention in patients requiring rigid or semi-rigid immobilization for isolated non-surgical below-knee injury. J Thromb Haemost. 2013 Oct;11(10):1833-43.
Eriksson BI, Zachrisson BE, Teger-Nilsson AC, Risberg B. Thrombosis prophylaxis with low molecular weight heparin in total hip replacement. Br J Surg. 1988 Nov;75(11):1053-7.
Beyer-Westendorf J. Controversies in venous thromboembolism: to treat or not to treat superficial vein thrombosis. Hematology Am Soc Hematol Educ Program. 2017 Dec 8;2017(1):223-230.
Xiaoyu Wu, Huaqin Wang, Ya Tan, Xiaoju Tan, Xinge Zhao, Xiaoling Liu, Wenli Wang. Barriers and facilitators for improving oral anticoagulant medication adherence in lower extremity deep venous thrombosis patients after spinal surgery: A qualitative study using the COM-B model, International Journal of Orthopaedic and Trauma Nursing, 56, (101155), (2025)
Schulman S., Kearon C., Kakkar A.K., et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013;368:709—718.
Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, Porcari A, Raskob GE, Weitz JI; AMPLIFY-EXT Investigators. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013 Feb 21;368(8):699-708.
Amin A, Jing Y, Trocio J, Lin J, Lingohr-Smith M, Graham J. Evaluation of medical costs avoided when new oral anticoagulants are used for extended treatment of venous thromboembolism based on clinical trial results. J Thromb Thrombolysis. 2015 Aug;40(2):131-8.
Robertson L, Kesteven P, McCaslin JE. Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of deep vein thrombosis. Cochrane Database Syst Rev. 2015 Jun 30 ;( 6):CD010956. Update in: Cochrane Database Syst Rev. 2023 Apr 14; 4:CD010956.
Wang X, Ma Y, Hui X, Li M, Li J, Tian J, Wang Q, Yan P, Li J, Xie P, Yang K, Yao L. Oral direct thrombin inhibitors or oral factor Xa inhibitors versus conventional anticoagulants for the treatment of deep vein thrombosis. Cochrane Database Syst Rev. 2023 Apr 14;4(4):CD010956.
Schulman S, Granqvist S, Holmström M, Carlsson A, Lindmarker P, Nicol P, et al. The duration of oral anticoagulant therapy after a second episode of venous thromboembolism. The duration of anticoagulation trial study group. N Engl J Med. 1997;336(6):393–8
Girard P, Decousus M, Laporte S, Buchmuller A, Hervé P, Lamer C, Parent F, Tardy B; PREPIC Study Group. Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy. Am J Respir Crit Care Med. 2001 Sep 15;164(6):1033-7.
Jiang YQ, Wang LY, Hu SQ, Li XL, Zhou J, Qi Q, Dong J. Is it safe for the spinal metastasis patients with preoperative deep vein thrombosis to use low-molecular-weight heparin before surgery? A prospective study. J Clin Neurosci. 2023 Aug;114:32-37.
Kahale LA, Hakoum MB, Tsolakian IG, Matar CF, Terrenato I, Sperati F, Barba M, Yosuico VE, Schünemann H, Akl EA. Anticoagulation for the long-term treatment of venous thromboembolism in people with cancer. Cochrane Database Syst Rev. 2018 Jun 19;6(6):CD006650.
Wells PS, Anderson DR, Rodger MA, Forgie MA, Florack P, Touchie D, Morrow B, Gray L, O'Rourke K, Wells G, Kovacs J, Kovacs MJ. A randomized trial comparing 2 low-molecular-weight heparins for the outpatient treatment of deep vein thrombosis and pulmonary embolism. Arch Intern Med. 2005 Apr 11;165(7):733-8.
Lim W, Dentali F, Eikelboom JW, Crowther MA. Meta-analysis: low-molecular-weight heparin and bleeding in patients with severe renal insufficiency. Ann Intern Med. 2006 May 2;144(9):673-84.
Merli G, Spiro TE, Olsson CG, Abildgaard U, Davidson BL, Eldor A, Elias D, Grigg A, Musset D, Rodgers GM, Trowbridge AA, Yusen RD, Zawilska K; Enoxaparin Clinical Trial Group. Subcutaneous enoxaparin once or twice daily compared with intravenous unfractionated heparin for treatment of venous thromboembolic disease. Ann Intern Med. 2001 Feb 6;134(3):191-202.
Robertson L, Jones LE. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev. 2017 Feb 9;2(2):CD001100.
Wang L, Xu Z, Zhang L. A Comparison Between Fondaparinux Sodium and Low-Molecular-Weight Heparin in Preventing Patients Undergoing Hip Replacement from Deep Vein Thrombosis. J Musculoskelet Neuronal Interact. 2024 Jun 1;24(2):185-191.
King RW, Wooster MD, Veeraswamy RK, Genovese EA. Contemporary rates of inferior vena cava filter thrombosis and risk factors. J Vasc Surg Venous Lymphat Disord. 2022 Mar;10(2):313-324.
Tran TT, Bjarnason H, McDonald J, Goss B, Kim B, Houghton DE, Stavem K, Kløw NE. Does prophylactic inferior vena cava filter reduce the hazard of pulmonary embolism and mortality in severe trauma? A single center retrospective comparative study. Eur J Radiol Open. 2020 Dec 10;8:100299.
Huang J, Dai X, Zhang X, Li J, Huang M, Liu C, Zhao Z, Xiao L, Liu L, Li N, Kong J, Han X. Retrievable inferior vena cava filter to prevent pulmonary embolism in patients with fractures and deep venous thrombosis of lower extremities: a single-center experience. J Int Med Res. 2021 Apr;49(4):3000605211006591.
Balabhadra S, Kuban JD, Lee S, Yevich S, Metwalli Z, McCarthy CJ, Huang SY, Tam A, Gupta S, Sheth SA, Sheth RA. Association of Inferior Vena Cava Filter Placement With Rates of Pulmonary Embolism in Patients With Cancer and Acute Lower Extremity Deep Venous Thrombosis. JAMA Netw Open. 2020 Jul 1;3(7):e2011079.
Makary MS, Koso M, Yoder M. Inferior vena cava filter thromboprophylaxis in surgical cancer patients. J Surg Oncol. 2024 Aug;130(2):257-264.
Ahmed O, Yu Q, Paul J, Navuluri R, Funaki B, Van Ha T. Meta-Analysis of the Usefulness of Inferior Vena Cava Filters in Massive and Submassive Pulmonary Embolism. Am J Cardiol. 2020 Aug 1;128:54-59.
Ahmed O, Kim YJ, Patel MV, Luu HH, Scott B, Cohen K. Efficacy and Safety of Mechanical IVC Filtration for Preventing Pulmonary Embolism in High-Risk Orthopedic Patients Undergoing Total Hip or Knee Arthroplasty. J Arthroplasty. 2021 Jul;36(7):2586-2590.
CRISTAL Study Group; Sidhu VS, Kelly TL, Pratt N, Graves SE, Buchbinder R, Adie S, Cashman K, Ackerman I, Bastiras D, Brighton R, Burns AWR, Chong BH, Clavisi O, Cripps M, Dekkers M, de Steiger R, Dixon M, Ellis A, Griffith EC, Hale D, Hansen A, Harris A, Hau R, Horsley M, James D, Khorshid O, Kuo L, Lewis P, Lieu D, Lorimer M, MacDessi S, McCombe P, McDougall C, Mulford J, Naylor JM, Page RS, Radovanovic J, Solomon M, Sorial R, Summersell P, Tran P, Walter WL, Webb S, Wilson C, Wysocki D, Harris IA. Effect of Aspirin vs Enoxaparin on Symptomatic Venous Thromboembolism in Patients Undergoing Hip or Knee Arthroplasty: The CRISTAL Randomized Trial. JAMA. 2022 Aug 23;328(8):719-727.
Jones A, Al-Horani RA. Venous Thromboembolism Prophylaxis in Major Orthopedic Surgeries and Factor XIa Inhibitors. Med Sci (Basel). 2023 Aug 11;11(3):49.
Migliorini F, Maffulli N, Velaj E, Bell A, Kämmer D, Hildebrand F, Hofmann UK, Eschweiler J. Antithrombotic prophylaxis following total hip arthroplasty: a level I Bayesian network meta-analysis. J Orthop Traumatol. 2024 Jan 9;25(1):1.
Liu HZ, Liang J, Hu AX. The efficacy and safety of aspirin in preventing venous thrombosis in major orthopedic surgery: An updated meta-analysis of randomized controlled trials. Medicine (Baltimore). 2023 Oct 20;102(42):e35602.
Cionac Florescu S., Anastase D.M., Munteanu A.M., Stoica I.C., Antonescu D. Venous thromboembolism following major orthopedic surgery. Maedica. 2013;8:189–194.
Deitelzweig S.B., McKean S.C., Amin A.N., Brotman D.J., Jaffer A.K., Spyropoulos A.C. Prevention of venous thromboembolism in the orthopedic surgery patient. Cleve Clin. J. Med. 2008;75((Suppl. S3)):S27–S36.
Alsheikh K., Hilabi A., Aleid A., Alharbi K.G., Alangari H.S., Alkhamis M., Alzahrani F., AlMadani W. Efficacy and Safety of Thromboprophylaxis Post-Orthopedic Surgery. Cureus. 2021;13:e19691.
Etscheidt J., Shahien A., Gainey M., Kronenfeld D., Niu R., Freccero D., Smith E. Review of Therapeutic Options for the Prevention of VTE in Total Joint Arthroplasty. Geriatrics. 2020;5:18.
Sobieraj DM, Coleman CI, Tongbram V, Chen W, Colby J, Lee S, Kluger J, Makanji S, Ashaye A, White CM. Comparative effectiveness of low-molecular-weight heparins versus other anticoagulants in major orthopedic surgery: a systematic review and meta-analysis. Pharmacotherapy. 2012 Sep;32(9):799-808.
Yang Z, Liu X, Dai S, Liu K, Zhang Y, Sun J, Yin X. [Effectiveness of low molecular weight heparin for prevention of deep vein thrombosis after total hip arthroplasty]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2010 Sep;24(9):1058-61. Chinese. PMID: 20939473.
Harrison-Brown M, Scholes C, Douglas SL, Farah SB, Kerr D, Kohan L. Multimodal thromboprophylaxis in low-risk patients undergoing lower limb arthroplasty: A retrospective observational cohort analysis of 1400 patients with ultrasound screening. J Orthop Surg (Hong Kong). 2020 Jan-Apr;28(2):2309499020926790.
Hull R.D., Pineo G.F., Francis C., Bergqvist D., Fellenius C., Soderberg K., Holmqvist A., Mant M., Dear R., Baylis B., et al. Low-molecular-weight heparin prophylaxis using dalteparin in close proximity to surgery vs warfarin in hip arthroplasty patients: A double-blind, randomized comparison. The North American Fragmin Trial Investigators. Arch. Intern. Med. 2000;160:2199–2207.
Eriksson B.I., Dahl O.E., Rosencher N., Kurth A.A., van Dijk C.N., Frostick S.P., Prins M.H., Hettiarachchi R., Hantel S., Schnee J., et al. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: A randomised, double-blind, non-inferiority trial. Lancet. 2007;370:949–956.
Lassen M.R., Gallus A., Raskob G.E., Pineo G., Chen D., Ramirez L.M. ADVANCE-3 Investigators. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N. Engl. J. Med. 2010;363:2487–2498
Mottier D, Girard P, Couturaud F, Lacut K, Le Moigne E, Paleiron N, Guellec D, Sanchez O, Cogulet V, Laporte S, Marhic G, Mismetti P, Presles E, Robert-Ebadi H, Mahé I, Plaisance L, Reny JL, Darbellay Farhoumand P, Cuvelier C, Le Henaff C, Lambert Y, Danguy des Deserts M, Rousseau Legrand C, Boutreux S, Bleher Y, Decours R, Trinh-Duc A, Armengol G, Benhamou Y, Daumas A, Guyot SL, De Carvalho H, Lamia B, Righini M, Meyer G, Le Gal G. Enoxaparin versus Placebo to Prevent Symptomatic Venous Thromboembolism in Hospitalized Older Adult Medical Patients. NEJM Evid. 2023 Aug;2(8):EVIDoa2200332.
Hovik O, Amlie EJ, Jenssen KK. No Increased Risk of Venous Thromboembolism in High-Risk Patients Continuing Their Dose of 75 mg Aspirin Compared to Healthier Patients Given Low-Molecular-Weight Heparin. J Arthroplasty. 2021 Oct;36(10):3589-3592.
Karthikeyan G., Eikelboom J.W., Turpie A.G., Hirsh J. Does acetyl salicylic acid (ASA) have a role in the prevention of venous thromboembolism? Br. J. Haematol. 2009;146:142–149.
Imperiale T.F., Speroff T. A meta-analysis of methods to prevent venous thromboembolism following total hip replacement. JAMA. 1994;271:1780–1785.
Westrich G.H., Bottner F., Windsor R.E., Laskin R.S., Haas S.B., Sculco T.P. VenaFlow plus Lovenox vs VenaFlow plus aspirin for thromboembolic disease prophylaxis in total knee arthroplasty. J. Arthroplast. 2006;21((Suppl. S2)):139–143.
Drescher F.S., Sirovich B.E., Lee A., Morrison D.H., Chiang W.H., Larson R.J. Aspirin versus anticoagulation for prevention of venous thromboembolism major lower extremity orthopedic surgery: A systematic review and meta-analysis. J. Hosp. Med. 2014;9:579–585.
Li C, Hirsh J, Xie C, Johnston MA, Eikelboom JW. Reversal of the anti-platelet effects of aspirin and clopidogrel. J Thromb Haemost. 2012 Apr;10(4):521-8.
Manfredi VM, Machado MB, Barbato NG, Takata ET, Dobashi ET. EFFECTIVENESS OF DEEP VENOUS THROMBOSIS PREVENTION IN TOTAL HIP ARTHROPLASTY. Acta Ortop Bras. 2021 Nov-Dec;29(6):293-296.
Kakkar A.K., Brenner B., Dahl O.E., Eriksson B.I., Mouret P., Muntz J., Soglian A.G., Pap A.F., Misselwitz F., Haas S., et al. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: A double-blind, randomised controlled trial. Lancet. 2008;372:31–39.
Anderson D.R., Dunbar M., Murnaghan J., Kahn S.R., Gross P., Forsythe M., Pelet S., Fisher W., Belzile E., Dolan S., et al. Aspirin or Rivaroxaban for VTE Prophylaxis after Hip or Knee Arthroplasty. N. Engl. J. Med. 2018;378:699–707.
Planes A., Vochelle N., Darmon J.Y., Fagola M., Bellaud M., Huet Y. Risk of deep-venous thrombosis after hospital discharge in patients having undergone total hip replacement: Double-blind randomised comparison of enoxaparin versus placebo. Lancet. 1996;348:224–228
Bergqvist D., Benoni G., Björgell O., Fredin H., Hedlundh U., Nicolas S., Nilsson P., Nylander G. Low-molecular-weight heparin (enoxaparin) as prophylaxis against venous thromboembolism after total hip replacement. N. Engl. J. Med. 1996;335:696–700.
Dahl O.E., Andreassen G., Aspelin T., Müller C., Mathiesen P., Nyhus S., Abdelnoor M., Solhaug J.H., Arnesen H. Prolonged thromboprophylaxis following hip replacement surgery--results of a double-blind, prospective, randomised, placebo-controlled study with dalteparin (Fragmin) Thromb. Haemost. 1997;77:26–31.
Lassen M.R., Borris L.C., Anderson B.S., Jensen H.P., Skejø Bro H.P., Andersen G., Petersen A.O., Siem P., Hørlyck E., Jensen B.V., et al. Efficacy and safety of prolonged thromboprophylaxis with a low molecular weight heparin (dalteparin) after total hip arthroplasty--the Danish Prolonged Prophylaxis (DaPP) Study. Thromb. Res. 1998;89:281–287
Andersen BS. Postoperative activation of the haemostatic system--influence of prolonged thromboprophylaxis in patients undergoing total hip arthroplasty. Haemostasis. 1997 Sep-Oct;27(5):219-27
Comp P.C., Spiro T.E., Friedman R.J., Whitsett T.L., Johnson G.J., Gardiner G.A., Jr., Landon G.C., Jové M., Enoxaparin Clinical Trial Group Prolonged enoxaparin therapy to prevent venous thromboembolism after primary hip or knee replacement. Enoxaparin Clinical Trial Group. J. Bone Joint Surg. Am. 2001;83:336–345.
White R.H., Romano P.S., Zhou H., Rodrigo J., Bargar W. Incidence and time course of thromboembolic outcomes following total hip or knee arthroplasty. Arch. Intern. Med. 1998;158:1525–1531.
Eikelboom J.W., Quinlan D.J., Douketis J.D. Extended-duration prophylaxis against venous thromboembolism after total hip or knee replacement: A meta-analysis of the randomised trials. Lancet. 2001;358:9–15.
Fisher W.D., Agnelli G., George D.J., Kakkar A.K., Lassen M.R., Mismetti P., Mouret P., Turpie A.G. Extended venous thromboembolism prophylaxis in patients undergoing hip fracture surgery—the SAVE-HIP3 study. Bone Joint J. 2013;95:459–466.
Forster R., Stewart M. Anticoagulants (extended duration) for prevention of venous thromboembolism following total hip or knee replacement or hip fracture repair. Cochrane Database Syst. Rev. 2016;3:CD004179.
Heit J.A., Elliott C.G., Trowbridge A.A., Morrey B.F., Gent M., Hirsh J. Ardeparin sodium for extended out-of-hospital prophylaxis against venous thromboembolism after total hip or knee replacement. A randomized, double-blind, placebo-controlled trial. Ann. Intern. Med. 2000;132:853–861.
Eriksson B.I., Borris L.C., Friedman R.J., Haas S., Huisman M.V., Kakkar A.K., Bandel T.J., Beckmann H., Muehlhofer E., Misselwitz F., et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N. Engl. J. Med. 2008;358:2765–2775.
Hoffmann P, Keller F. Increased major bleeding risk in patients with kidney dysfunction receiving enoxaparin: a meta-analysis. Eur J Clin Pharmacol. 2012 May;68(5):757-65.
Reinecke H, Engelbertz C, Bauersachs R, Breithardt G, Echterhoff HH, Gerß J, Haeusler KG, Hewing B, Hoyer J, Juergensmeyer S, Klingenheben T, Knapp G, Christian Rump L, Schmidt-Guertler H, Wanner C, Kirchhof P, Goerlich D. A Randomized Controlled Trial Comparing Apixaban With the Vitamin K Antagonist Phenprocoumon in Patients on Chronic Hemodialysis: The AXADIA-AFNET 8 Study. Circulation. 2023 Jan 24;147(4):296-309.
Sacks J, Luc SA. Evaluation of Enoxaparin for Inpatient Venous Thromboembolism Prophylaxis in End-Stage Renal Disease Patients on Hemodialysis. Hosp Pharm. 2021 Dec;56(6):718-724.
Hull R.D., Pineo G.F., Francis C., Bergqvist D., Fellenius C., Soderberg K., Holmqvist A., Mant M., Dear R., Baylis B., et al. Low-molecular-weight heparin prophylaxis using dalteparin in close proximity to surgery vs warfarin in hip arthroplasty patients: A double-blind, randomized comparison. The North American Fragmin Trial Investigators. Arch. Intern. Med. 2000;160:2199–2207.
Woodruff S, Feugère G, Abreu P, et al: A Bikdeli hoc analysis of dalteparin versus oral anticoagulant (VKA) therapy for the prevention of recurrent venous thromboembolism (rVTE) in patients with cancer and renal impairment. J Thromb Thrombolysis 42:494-504, 2016
Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, Grosso MA, Kakkar AK, Kovacs MJ, Mercuri MF, Meyer G, Segers A, Shi M, Wang TF, Yeo E, Zhang G, Zwicker JI, Weitz JI, Büller HR; Hokusai VTE Cancer Investigators. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. N Engl J Med. 2018 Feb 15;378(7):615-624.
Kay AB, Morris DS, Woller SC, Stevens SM, Bledsoe JR, Lloyd JF, Collingridge DS, Majercik S. Trauma patients at risk for venous thromboembolism who undergo routine duplex ultrasound screening experience fewer pulmonary emboli: A prospective randomized trial. J Trauma Acute Care Surg. 2021 May 1;90(5):787-796.
Al-Sharydah AM, Alshahrani MS, Maghrabi K, Tashkandi W, Amer M. Ultrasound surveillance for deep venous thrombosis and subsequent venous thromboembolism in adults with trauma: A systematic review and meta-analysis. Medicine (Baltimore). 2023 Oct 27;102(43):e35625.
Akram, F., Fan, B.E., Tan, C.W. et al. The clinical application of venous ultrasound in diagnosis and follow-up of lower extremity deep vein thrombosis (DVT): a case-based discussion. Thrombosis J 21, 110 (2023)
Espada C, Bura-Riviere A, Amado C, Loring M, Mastroiacovo D, Monreal M; RIETE Investigators. Timing and characteristics of venous thromboembolism after noncancer surgery. J Vasc Surg Venous Lymphat Disord. 2021 Jul;9(4):859-867.e2.
Eikelboom JW, Quinlan DJ, Douketis JD. Extended-duration prophylaxis against venous thromboembolism after total hip or knee replacement: a meta-analysis of the randomised trials. Lancet. 2001 Jul 7;358(9275):9-15.
Douketis JD, Eikelboom JW, Quinlan DJ, Willan AR, Crowther MA. Short-duration prophylaxis against venous thromboembolism after total hip or knee replacement: a meta-analysis of prospective studies investigating symptomatic outcomes. Arch Intern Med. 2002 Jul 8;162(13):1465-71.
Arnesen H, Dahl OE, Aspelin T, Seljeflot I, Kierulf P, Lyberg T. Sustained prothrombotic profile after hip replacement surgery: the influence of prolonged prophylaxis with dalteparin. J Thromb Haemost. 2003 May;1(5):971-5.
Jiang H, Meng J, Guo T, Zhao JN, Wang YC, Wang J, Qiu Y, Ding H. Comparison of Apixaban and Low Molecular Weight Heparin in Preventing Deep Venous Thrombosis after Total Knee Arthroplasty in Older Adults. Yonsei Med J. 2019 Jul;60(7):626-632.
Powers P.J., Gent M., Jay R.M., Julian D.H., Turpie A.G., Levine M., Hirsh J. A randomized trial of less intense postoperative warfarin or aspirin therapy in the prevention of venous thromboembolism after surgery for fractured hip. Arch. Intern. Med. 1989;149:771–774.
Kapoor A., Ellis A., Shaffer N., Gurwitz J., Chandramohan A., Saulino J., Ishak A., Okubanjo T., Michota F., Hylek E., et al. Comparative effectiveness of venous thromboembolism prophylaxis options for the patient undergoing total hip and knee replacement: A network meta-analysis. J. Thromb. Haemost. 2017;15:284–294.
Hull R., Raskob G., Pineo G., Rosenbloom D., Evans W., Mallory T., Anquist K., Smith F., Hughes G., Green D., et al. A comparison of subcutaneous low-molecular-weight heparin with warfarin sodium for prophylaxis against deep-vein thrombosis after hip or knee implantation. N. Engl. J. Med. 1993;329:1370–1376.
Friedman R.J., Davidson B.L., Heit J., Kessler C., Elliott C.G., Cabanas V., Chenault C., Dall D., Chandler D.R., Drennan D., et al. RD heparin compared with warfarin for prevention of venous thromboembolic disease following total hip or knee arthroplasty. RD Heparin Arthroplasty Group. J. Bone Joint Surg. Am. 1994;76:1174–1185
Ettema HB, Kollen BJ, Verheyen CC, Büller HR. Prevention of venous thromboembolism in patients with immobilization of the lower extremities: a meta-analysis of randomized controlled trials. J Thromb Haemost. 2008 Jul;6(7):1093-8.
Dolovich LR, Ginsberg JS, Douketis JD, Holbrook AM, Cheah G. A meta-analysis comparing low-molecular-weight heparins with unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch Intern Med. 2000 Jan 24;160(2):181-8.
Leclerc J.R., Geerts W.H., Desjardins L., Laflamme G.H., L’Espérance B., Demers C., Kassis J., Cruickshank M., Whitman L., Delorme F. Prevention of venous thromboembolism after knee arthroplasty. A randomized, double-blind trial comparing enoxaparin with warfarin. Ann. Intern. Med. 1996;124:619–626.
Fitzgerald RHJr Spiro T.E., Trowbridge A.A., Gardiner GAJr Whitsett T.L., O’Connell M.B., Ohar J.A., Young T.R., Enoxaparin Clinical Trial Group Prevention of venous thromboembolic disease following primary total knee arthroplasty. A randomized, multicenter, open-label, parallel-group comparison of enoxaparin and warfarin. J. Bone Joint Surg. Am. 2001;83:900–906.
Hamulyák K., Lensing A.W., van der Meer J., Smid W.M., van Ooy A., Hoek J.A. Subcutaneous low-molecular weight heparin or oral anticoagulants for the prevention of deep-vein thrombosis in elective hip and knee replacement? Fraxiparine Oral Anticoagulant Study Group. Thromb. Haemost. 1995;74:1428–1431.
Gallus A, Jackaman J, Tillett J, Mills W, Wycherley A. Safety and efficacy of warfarin started early after submassive venous thrombosis or pulmonary embolism. Lancet. 1986 Dec 6;2(8519):1293-6.
Erkens PM, Prins MH. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD001100.
Leroyer C, Bressollette L, Oger E, Mansourati J, Chèze-Le Rest C, Nonent M, Buchmuller A, Tardy B, Decousus H, Parent F, Simonneau G, Juste K, Ill P, Abgrall JF, Clavier J, Mottier D. Early versus delayed introduction of oral vitamin K antagonists in combination with low-molecular-weight heparin in the treatment of deep vein thrombosis. a randomized clinical trial. The ANTENOX Study Group. Haemostasis. 1998 Mar-Apr;28(2):70-7.
Mismetti P., Laporte S., Zufferey P., Epinat M., Decousus H., Cucherat M. Prevention of venous thromboembolism in orthopedic surgery with vitamin K antagonists: A meta-analysis. J. Thromb. Haemost. 2004;2:1058–1070.
Raskob G.E., Hirsh J. Controversies in timing of the first dose of anticoagulant prophylaxis against venous thromboembolism after major orthopedic surgery. Chest. 2003;124((Suppl. S6)):379S–385S.
Francis C.W., Pellegrini VDJr Totterman S., Boyd ADJr Marder V.J., Liebert K.M., Stulberg B.N., Ayers D.C., Rosenberg A., Kessler C., Johanson N.A. Prevention of deep-vein thrombosis after total hip arthroplasty. Comparison of warfarin and dalteparin. J. Bone Joint Surg. Am. 1997;79:1365–1372.
Colwell C.W., Jr., Collis D.K., Paulson R., McCutchen J.W., Bigler G.T., Lutz S., Hardwick M.E. Comparison of enoxaparin and warfarin for the prevention of venous thromboembolic disease after total hip arthroplasty. Evaluation during hospitalization and three months after discharge. J. Bone Joint Surg. Am. 1999;81:932–940
Samama C.M., Vray M., Barré J., Fiessinger J.N., Rosencher N., Lecompte T., Potron G., Basile J., Hull R., Desmichels D., et al. Extended venous thromboembolism prophylaxis after total hip replacement: A comparison of low-molecular-weight heparin with oral anticoagulant. Arch. Intern. Med. 2002;162:2191–2196.
Spain DA, Richardson JD, Polk HC Jr, Bergamini TM, Wilson MA, Miller FB. Venous thromboembolism in the high-risk trauma patient: do risks justify aggressive screening and prophylaxis? J Trauma. 1997 Mar;42(3):463-7; discussion 467-9.
Prabhakaran K, Gogna S, Lombardo G, Latifi R. Venous Thromboembolism in Geriatric Trauma Patients-Risk Factors and Associated Outcomes. J Surg Res. 2020 Oct;254:327-333.
Tung EC, Yu SY, Shah K, Kinkade A, Tejani AM. Reassessment of venous thromboembolism and bleeding risk in medical patients receiving VTE prophylaxis. J Eval Clin Pract. 2020 Feb;26(1):18-25.
Ben-Aharon I, Stemmer SM, Leibovici L, Shpilberg O, Sulkes A, Gafter-Gvili A. Low molecular weight heparin (LMWH) for primary thrombo-prophylaxis in patients with solid malignancies - systematic review and meta-analysis. Acta Oncol. 2014 Sep;53(9):1230-7.
Brunetti ND, Gesuete E, De Gennaro L, et al: Direct oral anti-coagulants compared with vitamin-K inhibitors and low-molecular-weight-heparin for the prevention of venous thromboembolism in patients with cancer: A meta-analysis study. Int J Cardiol 230:214- Carrier M, Cameron C, Delluc A, et al: Efficacy and safety of anticoagulant therapy for the treatment of acute cancer-associated thrombosis: A systematic review and meta-analysis. Thromb Res 134:1214-1219, 2014
Fagarasanu A, Alotaibi GS, Hrimiuc R, et al: Role of extended thromboprophylaxis after abdominal and pelvic surgery in cancer patients: A systematic review and meta-analysis. Ann Surg Oncol 23:1422-1430, 2016
Fuentes HE, Oramas DM, Paz LH, et al: Meta-analysis on anticoagulation and prevention of thrombosis and mortality among patients with lung cancer. Thromb Res 154:28-34, 2017
Gómez-Outes A, Terleira-Fernández AI, Lecumberri R, Suárez-Gea ML, Vargas-Castrillón E. Direct oral anticoagulants in the treatment of acute venous thromboembolism: a systematic review and meta-analysis. Thromb Res. 2014 Oct;134(4):774-82.
Kahale LA, Hakoum MB, Tsolakian IG, et al: Oral anticoagulation in people with cancer who have no therapeutic or prophylactic indication for anticoagulation. Cochrane Database Syst Rev 12:CD006466, 2017
Kahale LA, Hakoum MB, Tsolakian IG, et al: Anticoagulation for the long-term treatment of venous thromboembolism in people with cancer. Cochrane Database Syst Rev 6:CD006650, 2018
Larsen TB, Nielsen PB, Skjøth F, et al: Non-vitamin K antagonist oral anticoagulants and the treatment of venous thromboembolism in cancer patients: A semi systematic review and meta-analysis of safety and efficacy outcomes. PLoS One 9:e114445, 2014
Li A, Garcia DA, Lyman GH, et al: Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for treatment of cancer associated thrombosis (CAT): A systematic review and meta-analysis. Thromb Res 173:158-163, 2019
Matar CF, Kahale LA, Hakoum MB, et al: Anticoagulation for perioperative thromboprophylaxis in people with cancer. Cochrane Database Syst Rev 7:CD009447, 2018
Posch F, Königsbrügge O, Zielinski C, et al: Treatment of venous thromboembolism in patients with cancer: A network meta-analysis comparing efficacy and safety of anticoagulants. Thromb Res 136:582-589, 2015
Prins MH, Lensing AW, Brighton TA, et al: Oral rivaroxaban versus enoxaparin with vitamin K antagonist for the treatment of symptomatic venous thromboembolism in patients with cancer (EINSTEIN-DVT and EINSTEIN-PE): A pooled subgroup analysis of two randomised controlled trials. Lancet Haematol 1:e37-e46, 2014
Rojas-Hernandez CM, Oo TH, García-Perdomo HA: Risk of intracranial hemorrhage associated with therapeutic anticoagulation for venous thromboembolism in cancer patients: A systematic review and meta-analysis. J Thromb Thrombolysis 43:233-240, 2017
Thein KZ, Yeung SJ, Oo TH: Primary thromboprophylaxis (PTP) in ambulatory patients with lung cancer receiving chemotherapy: A systematic review and meta-analysis of randomized controlled trials (RCTs). Asia Pac J Clin Oncol 14:210-216, 2018
Tun NM, Guevara E, Oo TH: Benefit and risk of primary thromboprophylaxis in ambulatory patients with advanced pancreatic cancer receiving chemotherapy: A systematic review and meta-analysis of randomized controlled trials. Blood Coagul Fibrinolysis 27:270-274, 2016
Vedovati MC, Germini F, Agnelli G, et al: Direct oral anticoagulants in patients with VTE and cancer: A systematic review and meta-analysis. Chest 147:475-483, 2015
Yu Y, Lv Q, Zhang B, et al: Adjuvant therapy with heparin in patients with lung cancer without indication for anticoagulants: A systematic review of the literature with meta-analysis. J Cancer Res Ther 12:37-42, 2016 (suppl)
Carrier M, Abou-Nassar K, Mallick R, et al: Apixaban to prevent venous thromboembolism in patients with cancer. N Engl J Med 380:711-719, 2019
Ek L, Gezelius E, Bergman B, et al: Randomized phase III trial of low-molecular-weight heparin enoxaparin in addition to standard treatment in small-cell lung cancer: The RASTEN trial. Ann Oncol 29:398-404, 2018
Jung YJ, Seo HS, Park CH, Jeon HM, Kim JI, Yim HW, Song KY. Venous Thromboembolism Incidence and Prophylaxis Use After Gastrectomy Among Korean Patients With Gastric Adenocarcinoma: The PROTECTOR Randomized Clinical Trial. JAMA Surg. 2018 Oct 1;153(10):939-946.
Song JQ, Xuan LZ, Wu W, et al: Low molecular weight heparin once versus twice for thromboprophylaxis following esophagectomy: A randomised, double-blind and placebo-controlled trial. J Thorac Dis 7:1158-1164, 2015
Vedovati MC, Becattini C, Rondelli F, et al: A randomized study on 1-week versus 4-week prophylaxis for venous thromboembolism after laparoscopic surgery for colorectal cancer. Ann Surg 259:665-669, 2014
Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C, Hale D, Dunn JA, Lyman GH, Hutchinson C, MacCallum P, Kakkar A, Hobbs FDR, Petrou S, Dale J, Poole CJ, Maraveyas A, Levine M. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). J Clin Oncol. 2018 Jul 10;36(20):2017-2023.
Khorana AA, Soff GA, Kakkar AK, et al: Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer. N Engl J Med 380:720-728, 2019
Prandoni P, Bruchi O, Sabbion P, Tanduo C, Scudeller A, Sardella C, Errigo G, Pietrobelli F, Maso G, Girolami A. Prolonged thromboprophylaxis with oral anticoagulants after total hip arthroplasty: a prospective controlled randomized study. Arch Intern Med. 2002 Sep 23;162(17):1966-71.
Kučera T, Malý R, Urban K, Sponer P. Prevence tromboembolické nemoci po implantaci totální endoprotézy kyčelního kloubu [Venous thromboembolism prophylaxis after total hip arthroplasty]. Acta Chir Orthop Traumatol Cech. 2011;78(2):101-5. Czech.
Planes A, Vochelle N, Darmon JY, Fagola M, Bellaud M, Huet Y. Risk of deep-venous thrombosis after hospital discharge in patients having undergone total hip replacement: double-blind randomised comparison of enoxaparin versus placebo. Lancet. 1996 Jul 27;348(9022):224-8.
Zhang H, Lin J, Li H, Guan Z, Zhou D, Kou B, Wei W. [Effects of thromboprophylaxis duration on coagulation indicators after total hip replacement]. Zhonghua Yi Xue Za Zhi. 2014 Feb 25;94(7):525-8.
Eriksson BI, Lassen MR; PENTasaccharide in HIp-FRActure Surgery Plus Investigators. Duration of prophylaxis against venous thromboembolism with fondaparinux after hip fracture surgery: a multicenter, randomized, placebo-controlled, double-blind study. Arch Intern Med. 2003 Jun 9;163(11):1337-42.
Kawaji H, Ishii M, Tamaki Y, Hamasaki M, Ishikawa H, Sasaki K, Dairaku K, Takagi M. Postoperative prophylactic effect of fondaparinux for prevention of deep venous thrombosis after cemented total hip replacement: a comparative study. Mod Rheumatol. 2012 Apr;22(2):216-22.
Comp PC, Spiro TE, Friedman RJ, Whitsett TL, Johnson GJ, Gardiner GA Jr, Landon GC, Jové M; Enoxaparin Clinical Trial Group. Prolonged enoxaparin therapy to prevent venous thromboembolism after primary hip or knee replacement. Enoxaparin Clinical Trial Group. J Bone Joint Surg Am. 2001 Mar;83(3):336-45.
Manganelli D, Pazzagli M, Mazzantini D, Punzi G, Manca M, Vignali C, Palla A, Troiani R, Rossi G. Prolonged prophylaxis with unfractioned heparin is effective to reduce delayed deep vein thrombosis in total hip replacement. Respiration. 1998;65(5):369-74.
Andersen BS. Postoperative activation of the haemostatic system--influence of prolonged thromboprophylaxis in patients undergoing total hip arthroplasty. Haemostasis. 1997 Sep-Oct;27(5):219-27.
Dahl OE, Andreassen G, Aspelin T, Müller C, Mathiesen P, Nyhus S, Abdelnoor M, Solhaug JH, Arnesen H. Prolonged thromboprophylaxis following hip replacement surgery--results of a double-blind, prospective, randomised, placebo-controlled study with dalteparin (Fragmin). Thromb Haemost. 1997 Jan;77(1):26-31.
Nilsson PE, Bergqvist D, Benoni G, Björgell O, Fredin H, Hedlund U, Nicolas S, Nylander G. The post-discharge prophylactic management of the orthopedic patient with low-molecular-weight heparin: enoxaparin. Orthopedics. 1997 Feb;20 Suppl:22-5.
Kolb G, Bodamer I, Galster H, Seidlmayer C, Grambach K, Koudela K, Eisele RR, Becker C, Paal V, Spannagel U, Brom J, Weidinger G; Long-term Thromboprophylaxis Study Group. Reduction of venous thromboembolism following prolonged prophylaxis with the low molecular weight heparin Certoparin after endoprothetic joint replacement or osteosynthesis of the lower limb in elderly patients. Thromb Haemost. 2003 Dec;90(6):1100-5.
Kalkwarf KJ, Yang Y, Mora S, Wolf DA, Robertson RD, Holcomb JB, Drake SA. The silent killer: Previously undetected pulmonary emboli that result in death after discharge. Injury. 2023 Nov;54(11):111016. doi: 10.1016/j.injury.2023.111016. Epub 2023 Sep 6.
Li Z, Liu X, Li L, Cao P, Zhang G, Jiao Z, Wang F, Hao Q, Li Y, Zhang Y. Development and validation of a predictive nomogram for lower extremity deep vein thrombosis dislodgement in orthopedic patients. Front Surg. 2023 Mar 31;10:1148024.
Cao Z, Guo J, Li Q, Wu J, Li Y. Comparison of efficacy and safety of different tourniquet applications in total knee arthroplasty: a network meta-analysis of randomized controlled trials. Ann Med. 2021 Dec;53(1):1816-1826.
Aschwanden, M., Labs, K. H., & Engel, H. (2001). Acute deep vein thrombosis: Early mobilization does not increase the frequency of pulmonary embolism. Journal of Thrombosis and Haemostasis, 85, 42-46.
Buller, H. R., Agnelli, G., Hull, R. D., Hyers, T. M., Prins, M. H., & Raskob, G. E. (2004). Antithrombotic therapy for venous thromboembolic disease: The seventh American College of Chest Physicians’ Conference on antithrombotic and thrombolytic therapy. Chest, 126(Suppl.), 4015-4285.
Partsch, H. (2000). Compression and walking versus bed rest in the treatment of proximal deep venous thrombosis with low molecular weight heparin. Journal of Vascular Surgery, 32, 861-869.
Partsch, H. (2001). Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation. Journal of Vascular Diseases, 30, 195-204.
Partsch, H. (2005). Immediate ambulation and leg compression in the treatment of deep vein thrombosis. Disease a Month, 51, 135-140.
Schellong, S., Schwarz, T., Kropp, J., Prescher, Y., BeutheinBaumann, B., & Daniel, W. (1999). Bed rest in deep vein thrombosis and the incidence of scintigraphic pulmonary embolism. Thrombosis and Haemostasis, 82, 127-129.
Trujillo-Santos, J., Perea-Milla, E., Jimenez-Puente, A., SanchezCantalejo, E., del Toro, J., Grau, E., et al. (2005). Bed rest or ambulation in the initial treatment of patients with acute deep vein thrombosis or pulmonary embolism: Findings from the RIETE registry. Chest, 127, 1631-1636.
Mian O, Matino D, Roberts R, McDonald E, Chan AKC, Chan HHW. Potential Risk Factors Contributing to Development of Venous Thromboembolism for Total Knee Replacements Patients Prophylaxed With Rivaroxaban: A Retrospective Case-Control Study. Clin Appl Thromb Hemost. 2020 Jan-Dec;26:
Hernandez AJ, Almeida AM, Fávaro E, Sguizzato GT. The influence of tourniquet use and operative time on the incidence of deep vein thrombosis in total knee arthroplasty. Clinics (Sao Paulo). 2012 Sep;67(9):1053-7.
Prins MH, Hirsh J. A comparison of general anesthesia and regional anesthesia as a risk factor for deep vein thrombosis following hip surgery: a critical review. Thromb Haemost. 1990 Dec 28;64(4):497-500.
Price MJ, Walder JS, Baker BA, Heiselman DE, Jakubowski JA, Logan DK, Winters KJ, Li W, Angiolillo DJ. Recovery of platelet function after discontinuation of prasugrel or clopidogrel maintenance dosing in aspirin-treated patients with stable coronary disease: the recovery trial. J Am Coll Cardiol. 2012 Jun 19;59(25):2338-43.
Thiele T, Sümnig A, Hron G, Müller C, Althaus K, Schroeder HW, Greinacher A. Platelet transfusion for reversal of dual antiplatelet therapy in patients requiring urgent surgery: a pilot study. J Thromb Haemost. 2012 May;10(5):968-71
Vilahur G, Choi BG, Zafar MU, Viles-Gonzalez JF, Vorchheimer DA, Fuster V, Badimon JJ. Normalization of platelet reactivity in clopidogrel-treated subjects. J Thromb Haemost. 2007 Jan;5(1):82-90.
Chatterjee S. et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: A meta-analysis//JAMA – J. Am. Med. Assoc. 2014. Vol. 311, N 23. P. 2414-2421.
Daniels LB, Parker JA, Patel SR, Grodstein F, Goldhaber SZ. Relation of duration of symptoms with response to thrombolytic therapy in pulmonary embolism. Am J Cardiol 1997;80:184-188.
Goldhaber SZ, Come PC, Lee RT, Braunwald E, Parker JA, Haire WD, Feldstein ML, Miller M, Toltzis R, Smith JL, Taveira da Silva AM, Mogtader A, McDonough TJ. Alteplase versus heparin in acute pulmonary embolism: randomised trial assessing right-ventricular function and pulmonary perfusion. Lancet 1993;341:507-511.
Dalla-Volta S, Palla A, Santolicandro A, Giuntini C, Pengo V, Visioli O, Zonzin P, Zanuttini D, Barbaresi F, Agnelli G, Morpurgo M, Marini MG, Visani L. PAIMS 2: alteplase combined with heparin versus heparin in the treatment of acute pulmonary embolism. Plasminogen activator Italian multicenter study 2. J Am Coll Cardiol 1992;20:520-526.
Kline JA, Nordenholz KE, Courtney DM, Kabrhel C, Jones AE, Rondina MT, Diercks DB, Klinger JR, Hernandez J. Treatment of submassive pulmonary embolism with tenecteplase or placebo: cardiopulmonary outcomes at 3 months: multicenter double-blind, placebo-controlled randomized trial. J Thromb Haemost 2014;12:459-468.
Becattini C, Agnelli G, Salvi A, Grifoni S, Pancaldi LG, Enea I, Balsemin F, Campanini M, Ghirarduzzi A, Casazza F. Bolus tenecteplase for right ventricle dysfunction in hemodynamically stable patients with pulmonary embolism. Thromb Res 2010;125:e82-e86.
te Raa GD, Ribbert LS, Snijder RJ, Biesma DH. Treatment options in massive pulmonary embolism during pregnancy; a case-report and review of literature. Thromb Res. 2009 May;124(1):1-5.
Mercer RM, Bowen JS, Armstrong RJ. All contraindications to thrombolysis for life-threatening pulmonary embolus should be considered relative. BMJ Case Rep. 2013 Dec 10;2013.
Cruz G, Pedroza S, Giraldo M, Peña AD, Calderón CA, Quintero IF. Intraoperative circulatory arrest secondary to high-risk pulmonary embolism. Case series and updated literature review. BMC Anesthesiol. 2023 Dec 18;23(1):415.
Ning D, Zhou L, Fu MY, Shi G. Safety and efficacy of thrombolytic therapy in the treatment of early pulmonary embolism after thoracic surgery. J Thorac Dis. 2024 Oct 31;16(10):6417-6426.
Endorsed by the European Society of Gynecology (ESG), the Association for European Paediatric Cardiology (AEPC), and the German Society for Gender Medicine (DGesGM), Authors/Task Force Members, , ESC Guidelines on the management of cardiovascular diseases during pregnancy: The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC), European Heart Journal, Volume 32, Issue 24, December 2011, Pages 3147–3197.
Sitkin S.I., Kolgushkin G.A., Shishko Yu.K., Elizova A.V., Khizhnyak B.I, Yankov V.G., Ronenson A.M. The case of the successful use of thrombolysis in combination of cardiopulmonary resuscitation during massive pulmonary embolism in childbed after elective caesarean section. Russian Journal of Anaesthesiology and Reanimatology = Anesteziologiya i Reanimatologiya. 2013;(6):54-6.
Nolan JP, Soar J, Zideman DA, Biarent D, Bossaert LL, Deakin C, Koster RW, Wyllie J, Böttiger B; ERC Guidelines Writing Group. European Resuscitation Council Guidelines for Resuscitation 2010 Section 1. Executive summary. Resuscitation. 2010 Oct;81(10):1219-76.
Molina JE, Hunter DW, Yedlicka JW, Cerra FB. Thrombolytic therapy for postoperative pulmonary embolism. Am J Surg. 1992 Apr;163(4):375-80; discussion 380-1.
Кириенко А. И., Леонтьев С. Г., Яровая Е. Б. с соавт, Неиммуногенная стафилокиназа — тромболитический препарат в лечении массивной тромбоэмболии легочной артерии: результаты клинического исследования ФОРПЕ. Российский кардиологический журнал. 2024;29(11):6157.
Martillotti G, Boehlen F, Robert-Ebadi H, Jastrow N, Righini M, Blondon M. Treatment options for severe pulmonary embolism during pregnancy and the postpartum period: a systematic review. J Thromb Haemost 2017;15:1942-1950.
Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, Blomstro¨m-Lundqvist C, Cıfkova R, De Bonis M, Iung B, Johnson MR, Kintscher U, Kranke P, Lang IM, Morais J, Pieper PG, Presbitero P, Price S, Rosano GMC, Seeland U, Simoncini T, Swan L, Warnes CA; ESC Scientific Document Group. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018;39:3165-3241.
Romualdi E, Dentali F, Rancan E, Squizzato A, Steidl L, Middeldorp S, Ageno W. Anticoagulant therapy for venous thromboembolism during pregnancy: a systematic review and a meta-analysis of the literature. J Thromb Haemost 2013;11:270-281.
Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141:e691S-e736S.
Greer IA, Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood 2005;106:401-407.
Ni Ainle F, Wong A, Appleby N, Byrne B, Regan C, Hassan T, Milner M, Sullivan AO, White B, O’Donnell J. Efficacy and safety of once daily low molecular weight heparin (tinzaparin sodium) in high risk pregnancy. Blood Coagul Fibrinolysis 2008;19:689-692.
GHERMAN R.B. et al. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy//Obstet. Gynecol. 1999. Vol. 94, N 5. P. 730-734.
Brenner B. Haemostatic changes in pregnancy//Thromb. Res. 2004. Vol. 114, N 5-6 SPEC. ISS. P. 409-414.
Ahearn GS, Hadjiliadis D, Govert JA, Tapson VF. Massive pulmonary embolism during pregnancy successfully treated with recombinant tissue plasminogen activator: a case report and review of treatment options. Arch Intern Med 2002;162:1221-7.
Turrentine MA, Braems G, Ramirez MM. Use of thrombolytics for the treatment of thromboembolic disease during pregnancy. ObstetGynecolSurv. 1995;50:534-541.
Ben Halima N, Sghaier A, Thabet H, Mesaouadi Y, Ragmoun H. Thrombolysis for pulmonary embolism during pregnancy . About four cases. Tunis Med. 2018 Jan;96(1):80-83.
Leonhardt G, Gaul C, Nietsch HH, Buerke M, Schleussner E. Thrombolytic therapy in pregnancy. J Thromb Thrombolysis. 2006 Jun; 21(3):271-6.
Boehler K, Kittler H, Stolkovich S, Tzaneva S. Therapeutic effect of compression stockings versus no compression on isolated superficial vein thrombosis of the legs: a randomized clinical trial. Eur J Vasc Endovasc Surg. 2014 Oct;48(4):465-71. doi: 10.1016/j.ejvs.2014.06.047.
Saini V, Samra T, Ahuja N, Sethi S. A prospective randomized study to evaluate safety and efficacy of heparin topical solution (1000 IU/ml) compared to heparin topical gel (200 IU/g) in prevention of infusion-associated phlebitis. Indian J Pharmacol. 2018 Nov-Dec;50(6):344-349. doi: 10.4103/ijp.IJP_201_17
Uncu H. A comparison of low-molecular-weight heparin and combined therapy of low-molecular-weight heparin with an anti-inflammatory agent in the treatment of superficial vein thrombosis. Phlebology. 2009 Apr;24(2):56-60. doi: 10.1258/phleb.2008.008025.
Parvizi, J. Low-Dose Aspirin Is Effective Chemoprophylaxis Against Clinically Important Venous Thromboembolism Following Total Joint Arthroplasty: A Preliminary Analysis / J. Parvizi, R. Huang, C. Restrepo [et al.] // J. Bone Joint Surg. Am. – 2017. – Vol. 99, N 2. – P. 91-98.
Любимов Е.А. Опыт использования ацетилсалициловой кислоты в комплексной профилактике венозных тромбоэмболических осложнений после 152 артропластики коленного сустава / Е.А. Любимов, Л.В. Борисова, С.А. Хрипунов, Е.В. Преображенская // Флебология. – 2020. – Т. 14, № 3. – С. 207-213.
Профилактика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов Флебология 2023, т. 17, № 3, с. 152-296 https://doi.org/10.17116/flebo202317031152
Wu H, Zhou L, Wang Q, Wang T, Liang S. Aspirin versus low-molecular-weight heparin for thromboprophylaxis after orthopaedic surgery: a systematic review and meta-analysis. Blood Coagul Fibrinolysis. 2024 Jun 1;35(4):187-195. doi: 10.1097/MBC.0000000000001300.
O’toole RV, Stein DM, O’hara NN, Frey KP, Taylor TJ, Scharfstein DO, et al. Aspirin or low-molecular-weight heparin for thromboprophylaxis after a fracture. New Engl J Med 2023; 388:203–213]
Ingerslev, J., Vanek, T. & Culic, S. Use of recombinant factor VIIa for emergency reversal of anticoagulation. Journal of Postgraduate Medicine, 2007, 53: 17–22
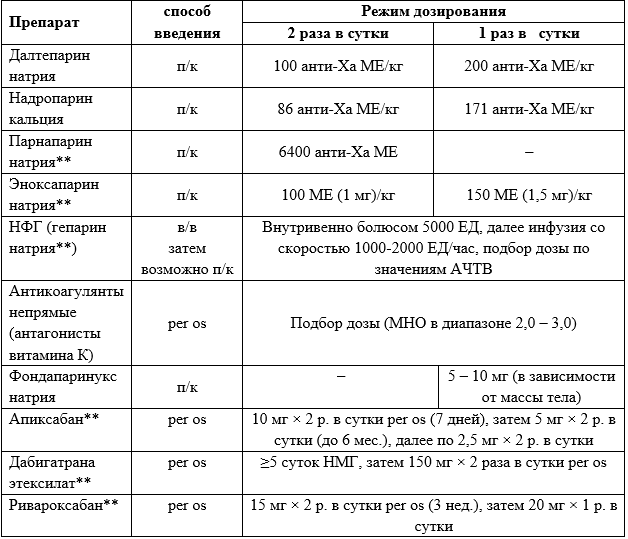

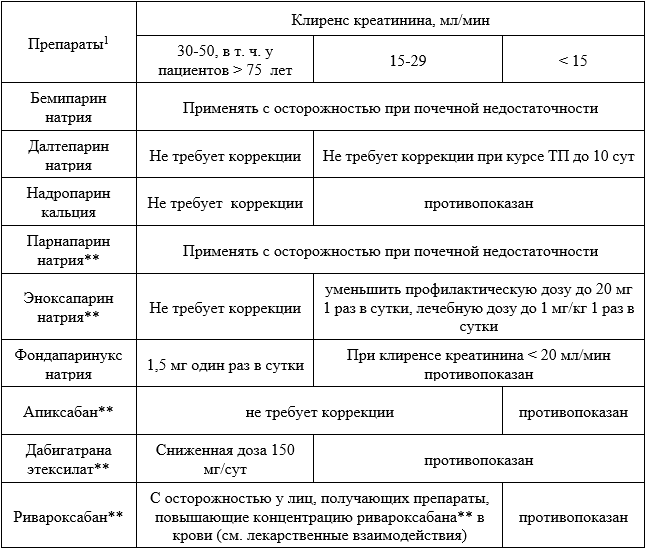
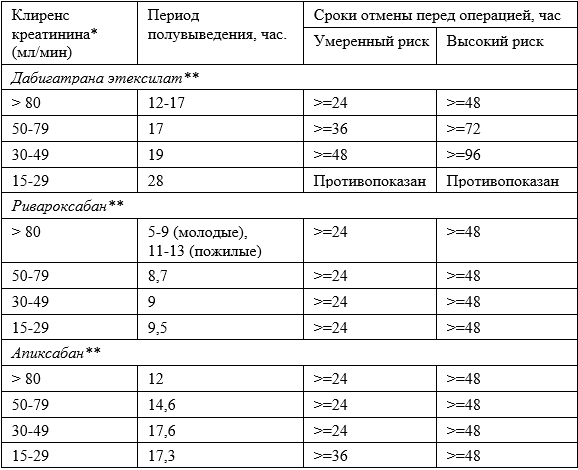
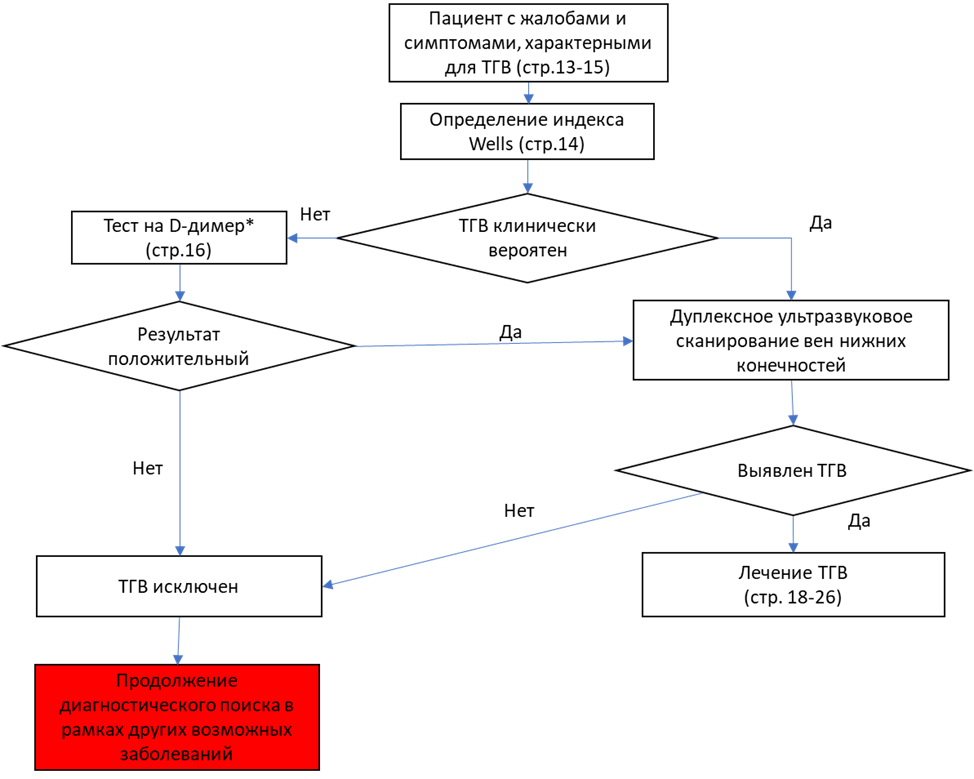 * - У больных с повреждениями опорно-двигательного аппарата изолированное повышение уровня Д-димера не может рассматриваться как патогномоничный признак ВТЭО. Однако нормальный уровень Д-димера позволяет с высокой вероятностью исключить наличие ВТЭО (см. п. 2.3.)
* - У больных с повреждениями опорно-двигательного аппарата изолированное повышение уровня Д-димера не может рассматриваться как патогномоничный признак ВТЭО. Однако нормальный уровень Д-димера позволяет с высокой вероятностью исключить наличие ВТЭО (см. п. 2.3.)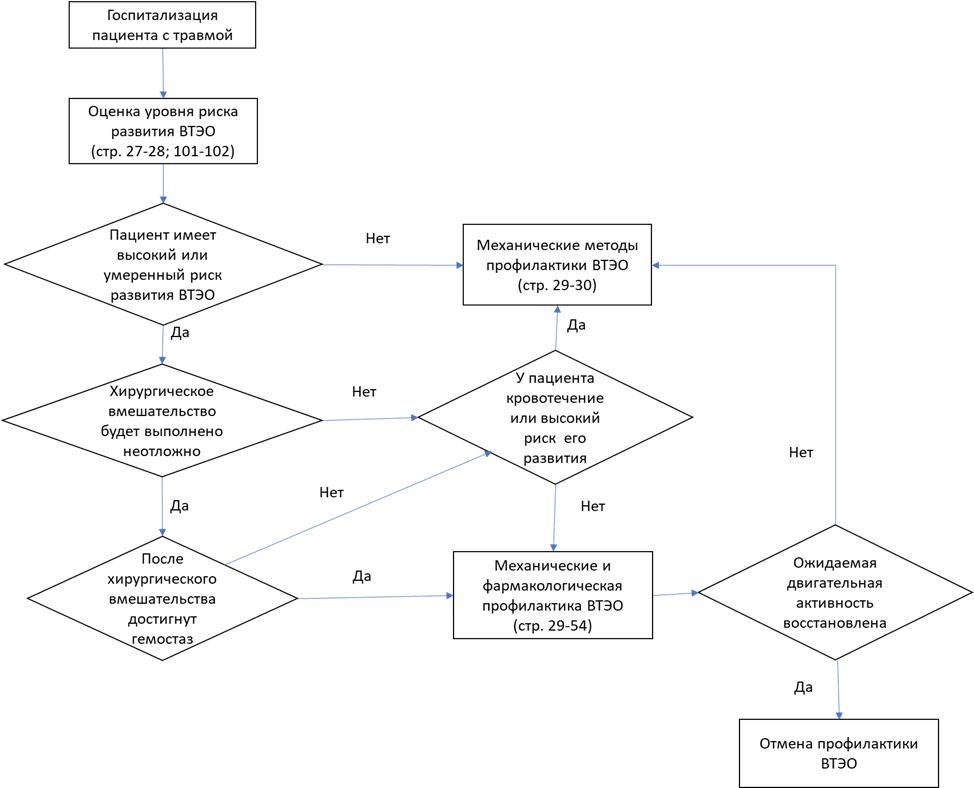 Название алгоритма 2 в клинических рекомендациях «Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии»:
Название алгоритма 2 в клинических рекомендациях «Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии»: