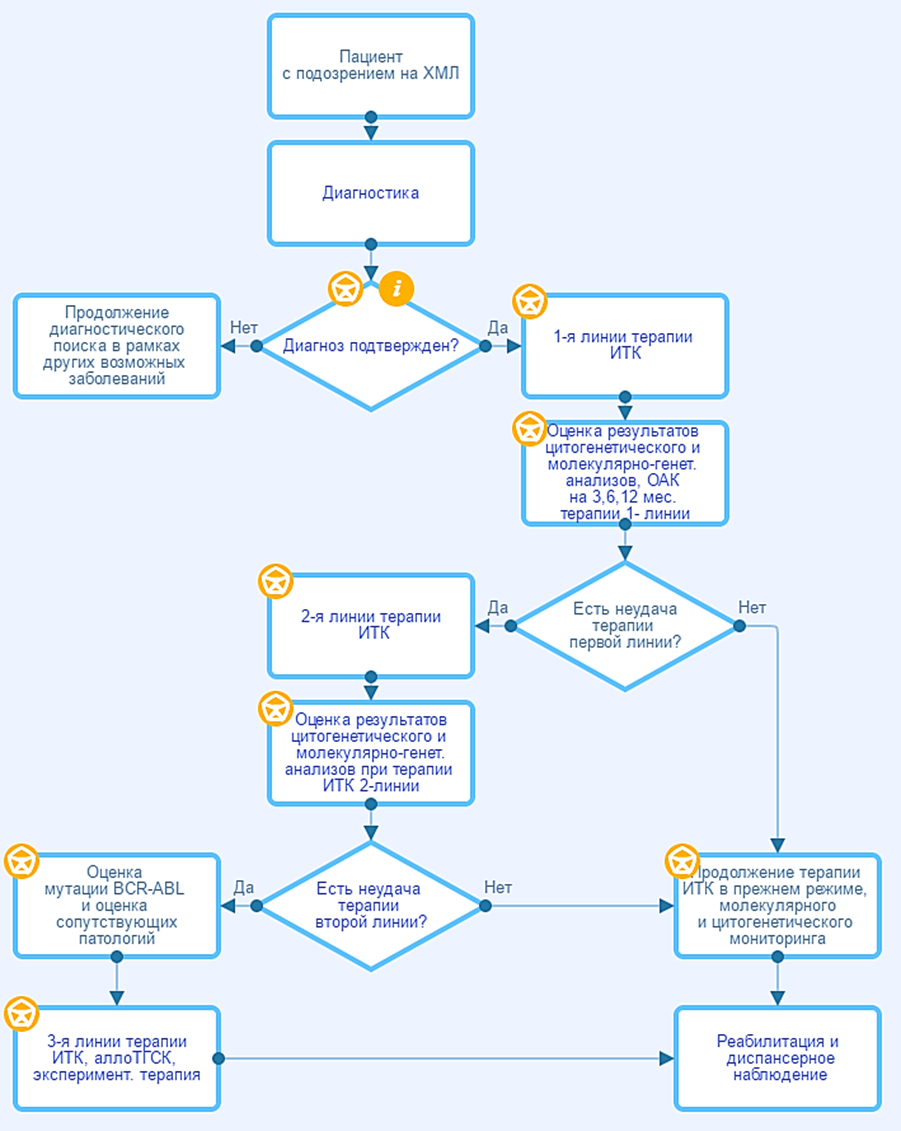
Общие принципы лечения
Цель современной терапии ХМЛ – максимальное подавление Ph‑положительного опухолевого клона, предупреждение развития резистентности и обеспечение длительной выживаемости при хорошем качестве жизни. Основным средством терапии и стандартом лечения в настоящее время является применение ингибиторов тирозинкиназы BCR-ABL (ИТК). Данные препараты обладают способностью таргетного (целенаправленного) воздействия на BCR::ABL1-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза ХМЛ. Механизм действия ИТК обусловлен блокадой АТФ‑связывающего кармана молекулы BCR::ABL1, что лишает белок BCR::ABL1 тирозинкиназной активности, дающей опухолевым клеткам пролиферативное преимущество.
Соблюдение принципа непрерывного и постоянного воздействия на опухолевый клон является основой эффективности лечения. Перерывы в приеме ИТК могут способствовать снижению эффективности терапии. Регулярный контроль результатов терапии с помощью молекулярно-генетических методов, своевременная оценка ответа на лечение и переключение на следующую линию ИТК в случае резистентности к проводимой терапии являются ключевыми факторами, влияющим на отдаленные результаты выживаемости при ХМЛ. Аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК) рассматривается для пациентов ХМЛ ХФ с неудачей терапии 2-х и более линий ИТК, в продвинутых фазах ХМЛ (ФА и БК), при наличии мутации T315I в гене BCR::ABL1 и неэффективности понатиниба или асциминиба, а также при непереносимости всех доступных ИТК.
Терапия ИТК показана всем пациентам ХМЛ. Режим приема ежедневно, длительно, постоянно. Начальная доза их не зависит от пола, массы тела, роста, расы пациента. Прием препаратов можно начинать при любом числе лейкоцитов. Возможность отмены ИТК у пациентов со стабильным глубоким МО описана в разделе 6.
При постоянном воздействии ИТК происходят редукция опухолевого клона и восстановление нормального гемопоэза, снижается риск прогрессирования заболевания, увеличивается длительная выживаемость пациентов. Достижение большого молекулярного ответа (БМО) является основным целевым результатом терапии и прогностически благоприятным фактором длительной выживаемости без прогрессирования при условии постоянной терапии.
Критерии определения гематологического цитогенетического, молекулярного ответов при терапии ИТК у всех пациентов с ХМЛ представлены в табл. 3.
Таблица 3. Критерии гематологического, цитогенетического и молекулярного ответов [1,10,11, 129, 130].
Вид ответа | Определение |
Гематологический (клинико-гематологический) | |
Полный (ПГО) | Лейкоциты менее 10 × 109/л Базофилы менее 5 % В гемограмме нет миелоцитов, промиелоцитов, миелобластов Тромбоциты менее 450 × 109/л Селезенка не пальпируется |
Цитогенетический1 | |
Полный (ПЦО) | Ph‑хромосома в метафазах не определяется (Ph+ 0%) |
Частичный (ЧЦО) | Ph‑хромосома в 1-35 % метафаз (Ph+ 1-35 %) |
Малый (МЦО) | Ph‑хромосома в 36-65 % метафаз (Ph+ 36-65 %) |
Минимальный (МинЦО) | Ph‑хромосома в 66-95 % метафаз (Ph+ 66-95 %) |
Отсутствие (нет ЦО) | Ph‑хромосома в более 95% метафаз (Ph+ >95%) |
Молекулярный3 | |
БМО (МО3,0) | Соотношение BCR::ABL1 /ABL1 ≤0,1 % и >0,01% по международной шкале (IS) |
Глубокий МО | МО 4,0 | Соотношение BCR::ABL1 /ABL BCR::ABL1 ≤0,01% и >0,0032% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥10000 и <32000 копий |
МО 4,5 | Соотношение BCR::ABL1 /ABL1≤0,0032% и >0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥32 000 и <100 000 копий |
МО 5,0 | Соотношение BCR::ABL1 /ABL1≤0,001% по международной шкале (IS) или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥100 000 копий |
3.1. Лекарственное лечение у взрослых пациентов
3.1.1. Препараты для терапии ХМЛ и режим дозирования
Выбор ИТК у всех больных выполняется с учетом сопутствующей патологии, мутационного статуса, фазы ХМЛ.
В Российской Федерации для лечения ХМЛ у взрослых в настоящее время зарегистрированы ИТК BCR-ABL первого поколения (ИТК1) иматиниб** и ИТК второго поколения (ИТК2) нилотиниб**, дазатиниб**, бозутиниб**. У взрослых больных все указанные ИТК зарегистрированы для терапии в первой и последующих линиях терапии.
3.1.2. Первая линия терапии ИТК пациентов с ХМЛ
- Рекомендуется всем пациентам при впервые выявленном положительном по филадельфийской хромосоме ХМЛ в ХФ, использование иматиниба** как препарата 1 линии для терапии ХМЛ в режиме монотерапии [18-19]. (см. таб. 5)
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
- Рекомендуется всем пациентам при впервые выявленном положительном по филадельфийской хромосоме ХМЛ в ФА использование иматиниба** как препарата 1 линии для терапии ХМЛ в режиме монотерапии и всем пациентам в БК как препарата 1 линии в режиме монотерапии и в комбинации с другими противоопухолевыми препаратами [20–24].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: иматиниб** – ИТК первого поколения с селективностью в отношении BCR::ABL1 тирозинкиназы, также способен ингибировать c‑KIT, PDGFR-киназную активность. При применении иматиниба** в 1 линии терапии общая выживаемость к 11 годам составляет 83 %, выживаемость без прогрессирования до ФА и БК – 92%, частота прогрессирования болезни к 11 годам терапии не превышает 7%. Полный цитогенетический (ПЦО) достигается у 83 % пациентов [19].
У большинства пациентов сохраняются хорошее качество жизни и трудоспособность.
Абсолютных противопоказаний для применения иматиниба** не зарегистрировано,
Следует тщательно наблюдать за пациентами с низкой фракцией выброса сердца
Следует тщательно наблюдать за пациентами с низкой скоростью клубочковой фильтрации
Наиболее частыми причинами плохой переносимости иматиниба** являются:
- задержка жидкости,
- симптомы со стороны желудочно-кишечного тракта,
- мышечные спазмы,
- боли в суставах,
- кожная сыпь
- повышенная утомляемость
Многие из этих нежелательных явлений проходят со временем или после короткого прерывания лечения. У пациентов с хронической токсичностью 1-2 степени возможно длительное снижение дозы иматиниба** при условии достижения и сохранения БМО [101].
Доза составляет 400 мг иматиниба** в сутки для ХФ и 600 мг иматиниба** в сутки для ФА и БК [19–23]. Препарат рекомендовано принимать однократно во время еды, запивая полным стаканом воды. Дозы препарата для взрослых в зависимости от фазы ХМЛ указаны в табл. 4.
Снижение дозы необходимо проводить при развитии явлений токсичности.
Таблица 4. Дозы иматиниба** при лечении взрослых пациентов с ХМЛ.
Доза | ХФ | ФА и БК |
Стартовая доза | 400 мг/сут | 600 мг/сут |
Повышение дозы (+1) | 600 мг/сут | 800 мг /сут |
Повышение дозы (+2) | 800 мг/сут | – |
Снижение дозы (–1) | 300 мг/сут | 400 мг/сут |
- Рекомендуется всем взрослым пациентам в ХФ использование нилотиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [25]. (см. таб. 5)
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: нилотиниб** – мощный, высокоселективный ингибитор BCR-ABL1 тирозинкиназы. Имеет большее сродство к ней по сравнению с иматинибом**, активен в отношении большинства мутаций BCR-ABL1. Выпускается в виде капсул по 150 и 200 мг. В 1 линии терапии показан пациентам с ХФ ХМЛ в начальной дозе 600 мг/сут [25]. Прием осуществляется по 300 мг 2 раза в сутки с интервалом примерно 12 часов. Рекомендован прием препарата строго натощак, так как пища значительно увеличивает биодоступность препарата (до 80 %), что ведет к увеличению концентрации нилотиниба** в плазме. Принимать препарат следует не ранее чем через 2 часа после еды; после приема нилотиниба** пищу следует принимать не ранее чем через 1 час. Капсулы необходимо запивать достаточным количеством воды.
При развитии токсических явлений доза нилотиниба** может быть снижена до 400 мг 1 раз в сутки (табл. 5).
При терапии нилотинибом** следует мониторировать показатели состояния сердечно-сосудистой системы.
Наличие в анамнезе ишемической болезни сердца, цереброваскулярных болезней, окклюзионных заболеваний периферических артерий является строгим противопоказанием для применения нилотиниба** в качестве первой линии терапии.
Пациенты с артериальной гипертензией, гиперхолестеринемией и сахарным диабетом также имеют повышенный риск при применении нилотиниба** [101]
- Рекомендуется всем пациентам в ХФ использование дазатиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [26]. (см. таб. 5)
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: дазатиниб** – многоцелевой препарат, взаимодействующий со многими тирозинкиназными и нетирозинкиназными белками. Он ингибирует следующие тирозинкиназы: BCR::ABL и семейства SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2, PDGFRβ, PDGFRα. Способен in vitro ингибировать рост клеточных линий с гиперэкспрессией BCR::ABL, активацией альтернативных онкогенных путей, включающих киназы семейства SRC (LYN, HCK). Показана возможность препарата проникать через гематоэнцефалический барьер.
Рекомендуемая доза дазатиниба** для ХФ составляет 100 мг/сут [26]. При явлениях токсичности доза дазатиниба** пациентам в ХФ может быть снижена до 50 мг 1 раз (табл. 5). Данных об эффективности повышения дозы дазатиниба** до 140 мг/сут при резистентности к стандартной дозе нет. В связи с этим в клинической практике увеличение дозы препарата при недостаточной эффективности его стандартной дозы нецелесообразно.
Терапия дазатинибом** сопряжена с повышенным риском развития плевральных выпотов (до 37%), которые могут развиваться даже после нескольких лет ранее неосложненного лечения. В редких случаях развивается легочная артериальная гипертензия. Наличие в анамнезе плевро-пульмональных или перикардиальных заболеваний являются строгими противопоказаниями к применению дазатиниба** в качестве препарата первой линии терапии [101].
- Рекомендуется всем взрослым пациентам в ХФ использование бозутиниба** как препарата первой линии для терапии ХМЛ в режиме монотерапии [100]. (см. таб. 5)
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: Бозутиниб** – ингибитор киназы BCR-ABL1, а также киназ семейства SRC, в том числе SRC, LYN и HCK. Препарат обладает минимальной ингибирующей активностью в отношении рецепторов PDGFR. Стандартная доза для терапии в 1-ой линии у пациентов в ХФ составляет 400 мг в сутки. В случае нежелательных явлений, препятствующих продолжению терапии в стандартной дозе, доза может быть снижена до 300 мг 1 раз в сутки (табл. 5). Нет данных об эффективности повышения дозы бозутиниба** при неэффективности стандартной дозы препарата. В связи с этим в клинической практике увеличение дозы препарата при недостаточной эффективности его стандартной дозы нецелесообразно.
Никаких сопутствующих состояний и серьезных противопоказаний для терапии бозутинибом** не выявлено.
Обычно преходящая диарея встречается у 30% пациентов, что может быть беспокоящим побочным эффектом.
Может наблюдаться временное повышение активности аминотрансфераз, в основном в первые недели или месяцы лечения [101].
Применение ИТК2 (нилотиниб**, дазатиниб**, бозутиниб**) в 1 линии лечения по сравнению с иматинибом** достоверно более эффективно по снижению вероятности прогрессирования ХМЛ и более высокой частоте достижения глубокого МО в более ранние сроки. Применение нилотиниба** в первой линии в дозе 600 мг/сут позволило через 1 год терапии достичь БМО у 77% пациентов по сравнению с достижением БМО у 60% пациентов, получавших 400 мг/сут иматиниба**. К 5 годам терапии глубокий МО4,5 достигнут у 54% пациентов в группе нилотиниба** 600 мг/сут в сравнении с 31% пациентов в группе иматиниба** [25]. Сравнение дазатиниба** в дозе 100 мг/сут с иматинибом** в дозе 400 мг/сут в 1 линии также показало преимущество в достижении БМО к 1 году лечения: у 76% пациентов, получавших дазатиниб**, против 64% пациентов на терапии иматинибом** [26]. Применение бозутиниба** в первой линии в дозе 400 мг/сут позволило через 2 года терапии достичь БМО у 67% пациентов по сравнению с достижением БМО у 57,5% пациентов, получавших 400 мг/сут иматиниба**
Нилотиниб** и дазатиниб** обеспечивают более высокую частоту достижения МО4 и МО4,5 по сравнению с иматинибом**, что может увеличить число пациентов, готовых в перспективе к контролируемому наблюдению без терапии. К 5 годам терапии глубокий МО4,5 достигнут у 42% пациентов в группе дазатиниба** в сравнении с 33 % пациентов в группе иматиниба** [25,26]. Также имеются данные и о большей частоте МО4,5 при лечении бозутинибом** по сравнению с иматинибом**: 47,4% и 36,6% соответственно к 5 году терапии [106]. При этом возможность развития неблагоприятных событий (например, окклюзии периферических сосудов при применении нилотиниба**, развитие плеврального выпота при длительной терапии дазатинибом**) требует оценки соответствующих факторов риска у пациентов [26,29–31]. Профиль токсичности иматиниба** является наиболее безопасным, а опыт применения в 1 линии лечения – наиболее длительным в сравнении с другими ИТК. Также это наиболее доступный на сегодняшний день препарат. Однако, вероятность быстрого достижения БМО и глубокого МО при лечении иматинибом** по сравнению с ИТК2 ниже [25,26]. Иматиниб** может быть оптимальной терапией для пациентов с группой низкого риска, больных старше 60 лет и/или пациентов с сопутствующими заболеваниями, ограничивающими назначение ИТК2.
3.1.3. Вторая и следующие линии терапии ИТК пациентов с ХМЛ
- Рекомендуется взрослым пациентам в ХФ использование нилотиниба**, дазатиниба** и бозутиниба** как препаратов 2-й и последующих линий для терапии ХМЛ в режиме монотерапии. [32–34, 37] (см. таб. 5)
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4) - для нилотиниба** и бозутиниба** у взрослых.
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых.
- Рекомендуется взрослым пациентам в ФА использование нилотиниба**, дазатиниба** и бозутиниба** как препаратов 2-й и последующих линий для терапии ХМЛ в режиме монотерапии. [36,111-113]. (см. таб. 5)
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4) - для нилотиниба** и бозутиниба** у взрослых.
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых
- Рекомендуется взрослым пациентам в БК использование дазатиниба** и бозутиниба** как препаратов 2 и последующих линий в режиме монотерапии, а также в комбинации с другими противоопухолевыми препаратами [35,36]. (см. таб. 5)
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4) - для бозутиниба** у взрослых.
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2) - для дазатиниба** у взрослых.
Комментарии: применение ИТК2 во 2-ой линии терапии ХМЛ эффективно как при непереносимости, так и при резистентности к иматинибу**. Во 2-ой линии терапии нилотиниб** назначается в дозе 800 мг/сут в ХФ и ФА [34]. Применение дазатиниба** во 2-ой линии терапии у пациентов в ХФ ХМЛ при непереносимости или резистентности к иматинибу** позволило добиться БМО у 55% пациентов при непереносимости и у 43% – при резистентности [32]. Использование дазатиниба** в ФА позволило достичь ПЦО у 24% больных [27]. Применение этого препарата при БК позволило получить большой цитогенетический ответ у 25% пациентов с миелоидным БК и 50% пациентов с лимфоидным БК в течение 24 месяцев, однако эти ответы не были длительными [35]. Рекомендуемая доза дазатиниба** во 2-ой и последующих линиях для ХФ составляет 100 мг/сут, а для ФА и БК 140 мг/сут.
Бозутиниб** также оказался эффективным у пациентов с резистентностью или непереносимостью предшествующей терапии иматинибом**. При медиане наблюдения ≥24 мес. кумулятивная частота достижения ПГО и ПЦО составила 77% и 46% соответственно, БМО и глубокий МО были получены у 35% и 28% [37]. Бозутиниб** также показал эффективность у пациентов с неудачей терапии не только иматинибом**, но и ИТК2 (дазатиниб**, нилотиниб**). ПГО, ПЦО и БМО достигли 62/86 (72%), 16/72 (22%) и 20/78 (25%) пациентов соответственно после терапии иматинибом** и дазатинибом**. Эти же показатели были зарегистрированы у 20/26 (77%), 5/24 (21%) и 1/19 (5%) пациентов, ранее получавших иматиниб** и нилотиниб** [33]. Таким образом, небольшая доля пациентов с предшествующей неудачей терапии двумя ИТК на фоне приема бозутиниба** могла достигать не только ПГО, но и более глубоких (цитогенетических и молекулярных) ответов.
- Рекомендуется терапия понатинибом пациентам в ХФ, ФА и БК ХМЛ с резистентностью или непереносимостью ИТК2, а также всем пациентам с мутацией T315I в гене BCR::ABL1 вне зависимости от предшествующей терапии [107, 108]
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: понатиниб относится к 3-ему поколению ИТК. Понатиниб показал эффективность в том числе и у пациентов с мутацией T315I в гене BCR::ABL1. У пациентов с резистентностью к ИТК2 понатиниб предпочтительнее, чем альтернативный ИТК2, при условии отсутствия факторов риска сердечно-сосудистых осложнений [107, 108]. Рекомендуемая изначальная доза понатиниба составляет 45 мг 1 раз в сутки. Сердечно-сосудистые нежелательные реакции (артериальные окклюзии или венозные тромбозы) возникают примерно в 30% случаев и имеют дозозависимый характер. При достижении полного цитогенетического ответа доза понатиниба может быть снижена до 15 мг в сутки. У пациентов в ХФ ХМЛ без мутации T315I и при наличии факторов риска сердечно-сосудистых событий целесообразно снижение начальной дозы понатиниба до 30 мг или 15 мг 1 раз в сутки. Повышение дозы до 45 мг в сутки может быть рассмотрено у пациентов без оптимального ответа на терапию понатинибом в сниженных дозах при наличии клинической целесообразности с учетом факторов сердечно-сосудистого риска.
- Рекомендуется терапия асциминибом пациентам в ХФ ХМЛ с резистентностью или непереносимостью двух или более ИТК, а также всем пациентам с мутацией T315I в гене BCR::ABL1 вне зависимости от предшествующей терапии [109, 110]
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: Асциминиб представляет собой STAMP- ингибитор (специально нацеленный на миристоиловый карман ABL), который показал высокую эффективность и хороший профиль безопасности по результатами исследований фазы I и III у пациентов с хроническим миелоидным лейкозом с неудачей к предшествующей терапии ИТК, в том числе и у пациентов с мутацией T315I в гене BCR::ABL1[109,110]. У пациентов с резистентностью к ИТК2 асциминиб предпочтительнее, чем альтернативный ИТК2. У пациентов в ХФ ХМЛ с мутацией T315I в гене BCR::ABL1 и факторами риска сердечно-сосудистых осложнений асциминиб предпочтительнее понатиниба. Рекомендуемая суточная доза асциминиба составляет 80 мг у пациентов без мутации T315I в гене BCR::ABL1. Препарат асциминиб можно принимать внутрь либо в дозе 80 мг один раз в сутки примерно в одно и то же время каждый день, либо в дозе 40 мг два раза в сутки примерно через 12-часовые интервалы. У пациентов в ХФ ХМЛ с мутацией T315I в гене BCR::ABL1 суточная доза составляет 400 мг в сутки в режиме приема 200 мг внутрь два раза в сутки примерно через 12-часовые интервалы. Для коррекции нежелательных реакций дозу асциминиба можно снизить до 40 мг в сутки (40 мг в один прием или 20 мг два раза в сутки) у пациентов без мутации T315I в гене BCR::ABL1 и до 160 мг 2 раза в сутки у пациентов с мутацией T315I в гене BCR::ABL1.
3.1.4. Принципы выбора ИТК при смене терапии
- Рекомендуется выбор ИТК с учетом сопутствующей патологии для предотвращения нежелательных явлений при терапии у пациентов с ХМЛ [10, 11, 38].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: С учетом профиля токсичности ИТК применяют с осторожностью при некоторых перечисленных ниже заболеваниях и состояниях.
Нилотиниб**
- Панкреатит с клинической симптоматикой в анамнезе – в редких случаях отмечено обострение панкреатита, может наблюдаться повышение активности амилазы, липазы
- Сахарный диабет – на фоне терапии нилотинибом** возможно появление гипергликемии
- Атеросклеротическое поражение сосудов, кардиоваскулярные ишемические события, окклюзионная болезнь периферических артерий – продемонстрирована повышенная вероятность их развития у пациентов с уже имеющимися факторами риска развития сердечно-сосудистых заболеваний по сравнению с имеющейся в общей популяции [39].
Дазатиниб**
- Хронические сердечно-сосудистые заболевания, хронические обструктивные заболевания легких, бронхиальная астма, плевральный или перикардиальный выпоты в анамнезе, пневмония, травма грудной клетки – факторы, влияющие на частоту развития плевральных выпотов [26, 29, 30, 40]
- Хронические заболевания ЖКТ с высоким риском развития кровотечений, постоянный прием антиагрегантов (АТХ B01AC Антиагреганты кроме гепарина) – дазатиниб** обладает антиагрегантным эффектом [41].
Бозутиниб**
- тяжелое нарушение функции печени и почек [42].
Понатиниб
- Атеросклеротическое поражение сосудов, кардиоваскулярные ишемические события, окклюзионная болезнь периферических артерий, наличие тромбозов в анамнезе – продемонстрирована повышенная вероятность развития артериальных окклюзий [42].
Все ИТК следует применять с осторожностью у пациентов с удлиненным интервалом QT, а также с клинически выраженной сердечной недостаточностью, дисфункцией левого желудочка, аритмиями. Следует избегать одновременного применения ИТК как с индукторами, так и ингибиторами изофермента CYP3A, а также с препаратами, удлиняющими интервал QT [43].
- Рекомендуется выбор ИТК при терапии ХМЛ с учетом мутаций гена BCR::ABL1 по результатам молекулярно-генетического исследования точечных мутаций гена bcr-abl (химерный ген, образованный слиянием области кластера разрывов на 22 хромосоме и гена тирозин-киназы Абельсона на 9 хромосоме) [44–50].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: мутации BCR::ABL определяют чувствительность лейкозных клеток к воздействию определенного ИТК. На момент диагностики мутационный статус целесообразно определять при дебюте ХМЛ в ФА и БК. Также наличие мутаций тирозинкиназного домена BCR::ABL1 необходимо исследовать при неудаче терапии и перед сменой ИТК. Исследование точечных мутаций BCR::ABL1 может быть выполнено методом секвенирования по Сэнгеру или методом высокопроизводительного секвенирования (NGS). Наиболее часто встречающиеся мутации могут быть также определены при помощи аллель-специфичной ПЦР. Следует отметить, что чувствительность данных методов существенно различается и составляет 15%-20% для секвенирования по Сэнгеру, 2-3% для высокопроизводительного секвенирования [ELN 2020 ] и 1% для аллель-специфичной ПЦР
Выбор ИТК в зависимости от выявленных мутаций BCR::ABL1:
- F317L/V/I/C, T315A –нилотиниб**, бозутиниб** , асциминиб или понатиниб
- V299L – нилотиниб** , асциминиб или понатиниб
- Y253H, E255V/K, F359V/I/C – дазатиниб**, бозутиниб**, асциминиб или понатиниб
- T315I – асциминиб или понатиниб
Терапия ИТК 1-ого и 2-ого поколения (иматиниб**, нилотиниб**, дазатиниб**, бозутиниб**) малоэффективна при наличии мутации T315I [50, 51]. При выявлении данной мутации рекомендуются терапия ИТК 3-его поколения понатинибом или STAMP-ингибитором асциминибом. [107, 108, 109, 110]
- При невозможности переключения на понатиниб или асциминиб взрослым пациентам рекомендован поиск HLA‑идентичного донора и выполнение аллоТГСК [52–54].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: До выполнения аллоТГСК или переключения на ИТК, потенциально эффективных при наличии мутации T315I, возможно продолжение терапии препаратом, который обеспечивает максимальный клинический эффект (сохранение ПГО, хорошая переносимость)
Таблица 5. Дозы нилотиниба**, дазатиниба** и бозутиниба** для взрослых пациентов с ХМЛ (см. соответствующие тезисы-рекомендации).
Доза препарата | Нилотиниб** | Дазатиниб** | Бозутиниб** |
|---|
| 1-я линия терапии ХФ | 2-я линия терапии ХФ и ФА | 1 и 2 линии терапии ХФ | 1 и 2 линии терапии ФА и БК | 1-я линия терапии ХФ | 2 и последующие линии терапии ХФ, ФА и БК |
Стартовая доза | 600 мг в сут (300 мг х 2 раза в сут) | 800 мг в сут (400 мг х 2 раза в сут) | 100 мг х 1 раз в сут | 140 мг х 1 раз в сут | 400 мг х 1 раз в сут | 500 мг х 1 раз в сут |
Снижение дозы согласно инструкции по применению | 400 мг х 1 раз в сут | 400 мг х 1 раз в сут | 50 мг х 1 раз в сут | 100 мг х 1 раз в сут | 300 мг х 1 раз в сут | 400 мг х 1 раз в сут 300 мг х 1 раз в сут |
3.1.5. Диагностика на этапе лечения (мониторинг результатов терапии ИТК у пациентов с ХМЛ)
- Рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента для оценки эффективности и переносимости терапии ИТК [11–13, 15, 55, 56, 101].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
- Рекомендуется при длительной глубокой цитопении на фоне лечения ИТК вне зависимости от стадии ХМЛ рекомендуется выполнение трепанобиопсии с последующим патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга [10, 101].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: для своевременной оценки результатов терапии и возможных нежелательных явлений терапии необходимо регулярно выполнять мониторинг клинико- лабораторных показателей (табл. 6). Принимая во внимание необходимость длительного приема препаратов, целесообразна регулярная беседа с пациентом с целью контроля приверженности терапии.
Таблица 6. Частота динамического обследования пациентов с ХМЛ, получающих ИТК.
Исследование | Периодичность мониторинга |
Общий (клинический) анализ крови | Каждые 15 дней до достижения и подтверждения ПГО, далее – как минимум каждые 3 месяца или чаще по мере необходимости |
Цитогенетическое исследование биопсийного (операционного) материала костного мозга (кариотип(не менее 20 метафаз)1,5 | На 3-м, 6-м и 12-м месяцах терапии. В случае достижения ПЦО на 3-м месяце и подтверждении на 6-м месяце – исследование на 12 мес. может не выполняться В случае неудачи терапии по данным молекулярного мониторинга на любом этапе терапии. При наличии ДХА высокого риска, выявленных в дебюте или в ходе терапии, в Ph+ клетках целесообразен цитогенетический мониторинг не реже 1 раза в год
Если в ходе количественной ПЦР-РВ соотношение BCR::ABL1/ABL1 составляет менее 1%,то выполнение исследования нецелесообразно |
- Определение экспрессии мРНК BCR-ABLp210 (количественное) 2,3
или - Определение экспрессии мРНК BCR-ABLp190 (количественное) – в случае транскрипта р190 2,3
| Каждые 3 мес до достижения БМО, затем постоянно не реже 1 раза в 6 месяцев 4 |
Молекулярно-генетическое исследование точечных мутаций гена bcr-abl (химерный ген, образованный слиянием области кластера разрывов на 22 хромосоме и гена тирозин-киназы Абельсона на 9 хромосоме) | При неудаче терапии первой или последующих линий ИТК, при переходе на другие ИТК или другие виды терапии, в дебюте заболевания у больных с ФА или БК |
Анализ крови биохимический общетерапевтический | Каждые 15 дней в течение 1-го месяца терапии; 1 раз в месяц в течение первых 3-х месяцев терапии; далее 1 раз в 3-6 месяцев. При необходимости мониторинга токсичности показан более частый контроль |
Регистрация электрокардиограммы. | На первом году 1 раз в 3-6 месяцев для контроля интервала QT. При нормальных показателях –далее 1 раз в год. У пациентов с факторами риска сердечно-сосудистых событий рекомендован мониторинг по клиническим показаниям. При переходе на другие ИТК: перед началом нового ИТК и через неделю приема нового ИТК |
Прицельная рентгенография органов грудной клетки или флюорография легких. | 1 раз в год или чаще по клиническим показаниям |
Примечания:
1 у пациентов с атипичными транскриптами BCR::ABL1, а также криптическими вариантами транслокации t(9;22) рекомендуется применение метода FISH для мониторинга. Следует подчеркнуть, что значения менее или равные 1% BCR::ABL-позитивных клеток соответствуют ПЦО (0% Ph+). Однако при величинах более 1% по данным FISH корреляции между результатами СЦИ и FISH нет [N. Testoni et al 2009].
2 результаты определения экспрессии BCR::ABL1 следует выдавать в процентах по международной шкале (IS). Этого можно достичь тремя способами: использованием фактора конверсии, получаемого лабораторией при проведении стандартизации; применением аттестованных калибраторов или коммерческих тест-систем, представляющих свои результаты в % по IS.
3 Необходимо указывать количество копий контрольного гена ABL1. При количестве копий контрольного гена ABL1 менее 10 000 копий результат не может быть выдан, и анализ должен быть проведен повторно.
4Возможен более частый контроль для оценки стабильности глубокого молекулярного ответа перед фазой ремиссии без лечения. См «Возможность отмены терапии ИТК у пациентов с глубоким молекулярным ответом» в разделе 7
5 Для пациентов без неудачи терапии стандартное цитогенетическое исследование костного мозга выполняется в тех случаях, когда стандартизированный молекулярный мониторинг невозможен.
3.1.6. Тактика ведения в зависимости от результатов терапии
- Рекомендуется взрослым пациентам с неудачей терапии иматинибом** переход на ИТК2 (нилотиниб**, дазатиниб**, бозутиниб**) [27, 32–34, 36, 37,101].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: эффект терапии 1 линии может быть расценен как оптимальный, неудача терапии, предупреждение (табл. 7).
При неудаче терапии иматинибом** в 1 линии показан переход на ИТК2 с учетом переносимости и мутационного статуса. В условиях ограниченного доступа ИТК2 при неудаче терапии иматинибом** в 1 линии необходимо безотлагательно повысить дозу иматиниба** до 600–800 мг с учетом переносимости, в качестве временной меры до перевода на ИТК2. У пациентов с высокой группой риска по J.E. Sokal или ELTS (табл. 2), ДХАв Ph‑положительных клетках (которые являются прогностически неблагоприятными факторами) предпочтительнее быстрое переключение на ИТК2, чем повышение дозы иматиниба**.
При неудаче терапии ИТК2 в 1 линии лечения показана смена препарата на другой ИТК2; в интересах пациентов рассмотреть варианты экспериментального лечения в рамках клинических исследований, показано выполнить HLA‑типирование сиблингов при их наличии. Эффективность увеличения дозы ИТК2 в 1 линии недостаточно доказана и поэтому нецелесообразна.
При оптимальном ответе продолжают лечение тем же препаратом ИТК.
При отсутствии оптимального ответа рекомендовано проверить приверженность пациента к терапии и возможное лекарственное взаимодействие.
При констатации предупреждения на терапии иматинибом** и ИТК2 целесообразно рассмотреть вопрос о смене терапии или продолжить прием препарата в прежней дозе на фоне тщательного мониторинга эффективности терапии и обеспечить готовность к смене терапии в случае констатации неудачи.
Таблица 7. Критерии ответа на терапию ИТК в первой и второй линиях лечения у пациентов в ХФ и ФА.
Срок терапии | Оптимальный ответ | Предупреждение | Неудача терапии |
На момент диагноза | | ДХА высокого риска в Ph+ клетках, группа высокого риска по ELTS | |
3 месяца | BCR::ABL1≤10% Ph+ ≤35% | BCR::ABL1>10% при однократном исследовании Ph+ 36–95% | Нет ПГО BCR::ABL1>10%, подтвержденный повторным анализом через 1-3 месяца Ph+ >95% |
6 месяцев | BCR::ABL1≤1% Ph+ 0% | BCR::ABL1>1%–10% Ph+1–35% | BCR::ABL1>10% Ph+ >35% |
12 месяцев | BCR::ABL1≤0,1% (БМО) Ph+ 0% | BCR::ABL1>0,1–1% Ph+ 0% | BCR::ABL1>1% Ph+ >0% |
В дальнейшем и в любое время | BCR::ABL1≤0,1% | BCR::ABL1>0,1–1% | BCR::ABL1>1% Мутации BCR::ABL1, приводящие к резистентности ДХА высокого риска в Ph+ клетках |
Примечания. Под значением экспрессии BCR::ABL1, указанным в таблице, понимается соотношение BCR::ABL1/ABL1 по международной шкале
Для пациентов, планирующих ремиссию без лечения, оптимальный ответ (в любое время) составляет BCR::ABL1≤ 0,01% (МО4).
3.1.8. Терапия при неудаче второй и последующих линий лечения
- Рекомендуется пациентам с неудачей двух и более линий терапии ХМЛ переход на другой ИТК или выполнение аллоТГСК [33, 60, 61].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
Комментарий: Критерии ответа на терапию ИТК в первой и второй линиях представлены в таблице 7. Возможности терапии при неудаче 2-х и более линий терапии ИТК ограничены. В качестве терапевтических опций рассматриваются перевод на другой ИТК2, выполнение аллоТГСК, включение пациента в клинические исследования или программы раннего доступа к незарегистрированным в России ИТК третьего и последующих поколений. При отсутствии альтернатив, регулярный прием ИТК показан в том числе и в случае отсутствия цитогенетического ответа на терапию для уменьшения рисков прогрессирования и смерти по сравнению с терапией только цитостатическими препаратами. Все зарегистрированные препараты ИТК могут быть использованы в качестве второй или последующих линий терапии. [101]
3.1.9. Циторедуктивная и цитостатическая терапия
- Рекомендуется циторедуктивная терапия для уменьшения опухолевой массы в дебюте заболевания до верификации диагноза и начала терапии ИТК, циторедуктивная и цитостатическая терапии при отсутствии гематологического ответа на терапии всеми доступными ИТК, невозможности другой терапии, с паллиативной целью в том числе и в сочетании с ИТК [10, 11, 62–66].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: В ХФ ХМЛ применение химиопрепаратов проводится в режиме монохимиотерапии, которая назначается в следующих случаях:
- для уменьшения массы опухоли на период обследования до получения результатов цитогенетического исследования или молекулярно-генетического исследования и для поддержания гематологического ответа;
- когда проведение другой терапии невозможно: непереносимость всех ИТК.
С циторедуктивной целью у взрослых применяется гидроксикарбамид** в дозе 20–30 мг/кг/сут, с учетом показателей анализа крови, меркаптопурин**. Прием гидроксикарбамида** должен быть регулярным, так как при отмене препарата уровень лейкоцитов вновь быстро увеличивается. Исследование уровня лейкоцитов в крови и других показателей гемограммы (исследование уровня общего гемоглобина в крови + исследование уровня тромбоцитов в крови + дифференцированный подсчёт лейкоцитов (лейкоцитарная формула).) необходимо осуществлять еженедельно.
Для лечения осложнений, связанных с синдромом лизиса опухоли (гиперурикемии, нефропатии) в период циторедукции, обязательным является введение адекватного объема жидкости (до 2–2,5 л/м2 поверхности тела при отсутствии сердечной недостаточности), аллопуринола**) в дозе 300–600 мг/сут. В случае признаков лейкостаза (нарушения микроциркуляции: энцефалопатия, снижение зрения, почечная недостаточность) с симптоматической целью показан лейкаферез.
- Рекомендуется пациентам с БК ХМЛ проведение полихимиотерапии по схемам лечения острых лейкозов в зависимости от фенотипа бластов в комбинации с наиболее эффективным для конкретного пациента ИТК. Возможна монотерапия ИТК при невозможности проведения сочетанной терапии [62–66].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: Выбор интенсивности терапии зависит от текущего соматического статуса пациента, возраста и перспектив проведения АллоТГСК. Проведение АллоТГСК показано только после достижения гематологической ремиссии БК.
3.1.10. Терапия препаратами интерферона
- Рекомендуется взрослым пациентам монотерапия препаратами #интерферона альфа-2b** (ИФ-α**) в дозировках от 3 млн. МЕ через день до 6 млн. МЕ ежедневно в период беременности, при непереносимости всех доступных ИТК. [11, 67, 102, 127].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: терапия препаратами #ИФ-α** проводится в особых случаях, когда терапия ИТК не показана. Применение #ИФ-α** возможно в период беременности, в случае непереносимости всех доступных ИТК у больных в ХФ. Эффективность #ИФ-α** при ФА и БК не доказана.
3.2. Иное лечение
3.2.1. Показания к аллогенной ТГСК при ХМЛ
- Рекомендуется аллогенная ТГСК: при неудаче терапии 2-х линий ИТК или при неудаче ИТК2 в первой линии; при затяжных рецидивирующих цитопениях на фоне терапии ИТК; при наличии мутации T315I и неэффективности понатиниба и/или асциминиба; при БК в дебюте ХМЛ или в случае прогрессирования до БК на фоне терапии (только после достижении второй ХФ); в случае прогрессирования до ФА на фоне терапии (только после достижении второй ХФ)[53, 54 ,68–72].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: аллогенная ТГСК показана в ХФ ХМЛ - при неудаче терапии 2-х линий ИТК или ИТК-2ого поколения в первой линии и/или при наличии мутации T315I (при неэффективности или отсутствии возможности назначения понатиниба или асциминиба) и/или в случае непереносимости ИТК (рецидивирующие затяжные цитопении 3-4ст на любой линии терапии в особенности при выявлении дополнительных хромосомных аномалий в Ph-негативных клетках, а также в случае аплазии или фиброза костного мозга по данным морфологического исследования трепанобиоптата костного мозга, негематологическая персистирующая токсичность 2-4ст на всех доступных ИТК) в отсутствии оптимального ответа [52,53].
В случае дебюта ХМЛ в ФА – при неудаче терапии первой линии ИТК и/или недостижении оптимального ответа на 2-х линиях ИТК и/или в любое время при наличии мутации T315I (при неэффективности или отсутствии возможности назначения понатиниба). В случае дебюта ХМЛ в БК или при прогрессии в БК.
В ФА, развившейся в ходе терапии ИТК, а также в БК - всем пациентам сразу после достижения ХФ на фоне ИТК и/или сочетания ИТК с химиотерапией. Выполнение аллоТГСК вне гематологического ответа (редукция бластоза <10% в крови и костном мозге, регресс всех экстрамедуллярных очагов и санация ликвора) не показано. [73,74].
3.2.2. Сопроводительная терапия
При возникновении острого или хронического болевого синдрома пациенту проводится обезболивающая терапия согласно существующим протоколам обезболивания [77, 78].
При развитии цитопенического или геморрагического синдрома в ходе проведении терапии ИТК или другими противоопухолевыми препаратами может возникнуть необходимость в заместительных гемотрансфузиях компонентов крови.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
3.3. Лекарственная терапия ХМЛ у детей
В целом, так же как у взрослых пациентов молодого и среднего возраста начальной терапией всех пациентов в ХФ и ФА является применения ИТК, а при лечении пациентов, диагностированных в фазе БК – сочетанное применение ИТК2 в сочетании с химиотерапией, диктуемой линейной принадлежностью бластной популяции (лимфобластная, миелобластная, смешанно-линейная). В настоящее время для применения у детей с ХМЛ зарегистрированы ИТК иматиниб** (у детей старше 2 лет), дазатиниб** (у детей старше 3 лет) и #нилотиниб**. Исследования по применению бозутиниба**, асциминиба и понатиниба в популяции лиц младше 18 лет продолжаются.
- Алло-ТГСК на современном этапе рекомендуется пациентам, диагностированным в БК после проведения химиотерапии в сочетании с ИТК2. Также выполнение аллоТГСК рекомендовано пациентам, отвечающим критериям неудачи терапии после переключения на ИТК2, в случае если неудача терапии не обусловлена нарушениями приверженности к лечению. .[114,115,116]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Первая линия терапии ИТК детей с ХФ ХМЛ
- Рекомендуется детям в ХФ использование иматиниба**, #нилотиниба** или дазатиниба** как препарата 1 линии для терапии ХМЛ в ХФ в режиме монотерапии. [117,118,119,120,121]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: В отношении всех трех препаратов проведены исследования 1, 2 и 3-й фазы, показавшие одинаковую эффективность в отношении выживаемости; при этом вероятность достижения критериев оптимального ответа была несколько выше в группах пациентов, получавших ИТК2. Дозировки лекарственных препаратов указаны в Таблице 13 [117, 118, 119, 120, 121].
В связи с отсутствием рандомизированных исследований, критерии выбора стартового препарата для терапии пациентов в ХФ являются в большей мере немедицинскими – наличие гарантий своевременного и непрерывного обеспечения и удобство приема препарата. В частности, #нилотиниб**, прием которого, в отличие от иматиниба** и дазатиниба**, должен осуществляться дважды в день натощак, может представлять существенные проблемы для применения в возрастной группе до 18 лет.
Таблица 13. Дозировка ИТК в терапии первой линии детей с ХФ ХМЛ [120].
Препарат | Максимальная доза |
Иматиниб** (у детей старше 2 лет) | 600 мг |
340 мг/м2 х 1 раз в день | |
300 мг/м2 х 1 раз в день | |
260 мг/м2 х 1 раз в день | |
#Нилотиниб** | |
230 мг/м2 х 2 раза в день | 400 мг |
Дазатиниб** (у детей старше 3 лет) | |
Вес тела 10-20 кг - 40 мг 20-30 кг - 60 мг 30-45 кг -70 мг | 100 мг при весе от 45 кг |
Примечание: Пациентам, не имеющим возможности проглотить капсулу целиком прием препарата допускается в разведенном виде, для этого используют воду или яблочный сок.
Исследования 1 фазы не выявили максимально переносимых дозировок иматиниба** в диапазоне 200-570 мг/м2 в сутки; также применение различных дозировок иматиниба** не показало значимых преимуществ в достижении критериев оптимального ответа.
Сопроводительная терапия детей с ХМЛ, начинающих терапию ИТК, проводится в соответствие с рекомендациями для взрослых, и направлена на предотвращение синдрома лизиса опухоли (см. выше).
Существенным побочным эффектом терапии ИТК, в частности иматиниба**, у детей является задержка роста, особенно в препубертатном периоде [122]. Дополнительным фактором, который может оказывать на рост и развитие ребенка, является повышенный риск развития гипотиреоза при применении ИТК [123]. Помимо ранее озвученных нарушений, эндокринная дисфункция может проявляться гипергликемией, бесплодием, низким уровнем витамина Д [127].
Вторая линия терапии ИТК детей с ХФ ХМЛ
- В случае недостижения оптимального ответа через 12 месяцев от начала терапии, неудаче лечения на любом этапе (см критерии оценки ответа выше) или непереносимости иматиниба рекомендуется смена терапии на ИТК2, после проведения исследования мутаций киназного домена BCR::ABL1. При их наличии выбирается тот ИТК, к которому мутация/мутации чувствительна [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае недостижения оптимального ответа или неудаче лечения ИТК2 (см. выше) рекомендуется назначение альтернативного ИТК2 (дазатиниб** (у детей старше 3 лет) или #нилотиниб**) если мутационный анализ не выявил «резистентных» мутаций киназного домена BCR::ABL1 [128, 129, 130].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- В случае непереносимости ИТК2 рекомендуется назначение альтернативного ИТК2 или иматиниба** (у детей старше 2 лет) [128, 129, 130].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Третья и более линии терапии детей с ХФ ХМЛ
В случае неудачи лечения на любом этапе (см. критерии выше) или непереносимости иматиниба**, #нилотиниба** и дазатиниба** пациент является кандидатом на проведение аллоТГСК. По решению врачебной комиссии может быть назначен любой из ИТК3 в соответствии с мутационным статусом BCR::ABL1 [128, 129, 130].
Первая линия терапии ИТК детей, впервые диагностированных в ФА ХМЛ
- Всем детям, диагностированным в ФА ХМЛ рекомендуется лечение ИТК2. Дозировка препаратов ИТК2: #нилотиниба** 230 мг/м2 х 2 раза в сутки (макс 400 мг х 2 раза в сутки) [124], дазатиниба** (у детей старше 3 лет) в дозах, указанных в Таблице 13. Коррекция дозы осуществляется в соответствии с инструкцией к лекарственному препарату ИТК [128, 129, 130].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Критерии эффективности ИТК2, диагностированных в ФА ХМЛ – те же, что и при лечении ИТК2 у взрослых. При недостижении оптимального ответа в «точках» контроля эффективности или при прогрессии заболевания пациент является кандидатом на аллоТГСК и сдерживающую терапию («бридж-терапия») ИТК3.
Первая линия терапии ИТК детей, впервые диагностированных в БК ХМЛ
- Всем детям, диагностированным в БК ХМЛ, рекомендуется лечение ИТК2. Дозировка #нилотиниба** 230 мг/м2 х 2 раза в сутки (макс 400 мг х 2 раза в сутки), дазатиниба** (у детей старше 3 лет) в дозах, указанных в Таблице 13 в сочетании с химиотерапией, в соответствии с линейной принадлежностью бластных клеток. При лимфоидном БК предпочтительно применение дазатиниба** в связи с его лучшим проникновением в ЦНС и потенциально лучшей активностью в отношении возможной нейролейкемии [128, 129, 130].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Критерии эффективности ИТК2 у детей, диагностированных в ФА ХМЛ, те же, что и при лечении ИТК2 у взрослых. При недостижении оптимального ответа в «точках» контроля эффективности или при прогрессии заболевания пациент является кандидатом на алло-ТГСК и сдерживающую терапию («бридж-терапия») ИТК3.
Терапия детей с прогрессией в ФА или БК на фоне терапии ИТК.
Пациенты с прогрессией на фоне терапии ИТК являются кандидатами на аллоТГСК, которая должна быть выполнена в кратчайшие сроки. Сдерживающая терапия альтернативными ИТК в таких случаях должна основываться на результатах мутационного анализа BCR::ABL1, а дополнительная химиотерапия - на результатах молекулярно-генетического анализа и данных СЦИ [128, 129, 130].
Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint