Цели лечения:
o Обеспечивать максимально высокое качество жизни пациента;
o Предупреждать и лечить обострения хронического инфекционно-воспалительного процесса в бронхолёгочной системе;
o Предупреждать и лечить обострения инфекционно-воспалительного процесса в околоносовых пазухах (ОНП) для уменьшения степени нисходящей контаминации бронхолегочной системы;
o Обеспечить физическое развитие пациента согласно возрастным нормам (достижение оказателей физического развития в границе 25-75 перцентиль после коррекции нутритивного статуса, рекомендуемая цель - 50 перцентиль);
o Обеспечить профилактику осложнений;
o Лечение осложнений (псевдо-Барттер синдром, мекониевый илеус, СДИО, МАСД (муковисцидоз-ассоциированный сахарный диабет) цирроз печени без\с синдромом портальной гипертензии, гиперспленизмом, ЖКБ (желчнокаменная болезнь), полипозный риносинусит, БЭН (белково-энергетическая недостаточность), кровохаркание, кровотечения легочные, кровотечения из ВРВП (варикозно расширенных вен пищевода) и верхней трети желудка.
Обязательные составляющие лечения:
o Диетотерапия;
o Заместительная терапия недостаточности экзокринной функции поджелудочной железы;
o Муколитическая терапия;
o Дренирование бронхиального дерева и лечебная физкультура;
o Антибактериальная терапия;
o Витаминотерапия;
o Терапия осложнений [1,2,5].
3.1 Консервативное лечение
3.1.1 Муколитическая терапия
- Рекомендовано всем пациентам с МВ (за исключением имеющих медицинские противопоказания) проведение активной муколитической терапии с целью уменьшения вязкости мокроты и облегчения ее эвакуации [1,2,5,21].
(УУР – C, УДД – 5).
Комментарии: выбор лекарственных средств определяется индивидуально.
Выбор пути введения: предпочтение отдается ингаляционному введению муколитиков (АТХ Муколитические препараты).
Оценка эффективности лечения: клинически (оценка суточного количества мокроты, изменений ее консистенции, оценка степени дыхательной недостаточности).
Оценка безопасности лечения: клинически (специальных стандартизованных методик оценки безопасности этих лекарственных средств не существует, подбор осуществляется в присутствии врача-пульмонолога или врача-педиатра/врача-терапевта, специализирующегося на оказании медицинской помощи пациентам с муковисцидозом).
Дополнительные замечания: все способы разжижения мокроты необходимо комбинировать с удалением ее из дыхательных путей, используя методы кинезитерапии. Перед сеансом кинезитерапии желательно, а при наличии бронхообструкции – обязательно, перед ингаляциями муколитиков провести ингаляции бронхолитиков.
В клинической практике для муколитической терапии используются:
o Дорназа альфа** - разрывает водородные связи молекул ДНК, которые являются основной составляющей гнойной мокроты, и является базисной муколитической терапией, обеспечивает эффект в течение суток. Применяется ингаляционно в дозе 2,5 мг в сутки; при необходимости (распространенные бронхоэктазы- 5 мг в сутки (по 2,5 мг х 2 раза в день через небулайзер); хронический полипозный синусит - 5 мг в сутки (2,5 мг – через небулайзер, 2,5 мг - с использованием универсальной ингаляционной системы с функцией пульсирующей подачи аэрозоля по 1,25мг=1,25мл в каждый носовой ход) [1,2,21,150].
o 3% или 6 % или 7% гипертонический раствор натрия хлорида** с 0,01% и 0,1% натрием гиалуронатом (зарегистрирован как медицинское изделие - раствор для ингаляционной терапии с органическими веществами) применяется ингаляционно через небулайзер по 5 мл 2 раза в день, улучшает клиренс дыхательных путей и является базисной муколитической терапией с быстрым муколитическим эффектом [1,2,21,151,37,152,153,154,155,156,157,158,159,160,161], также может применяться 3% гипертонический раствор натрия хлорида**, особенно у детей младшего возраста [152].
o Маннитол** в форме порошка для ингаляций улучшает клиренс дыхательных путей, способствует гидратации слизи [2,21,162].
Маннитол** применяется в дозе 400 мг дважды в день через специальный ингалятор. Перед назначением маннитола** пациент должен пройти тест на бронхиальную гиперреактивность при назначении начальной дозы в соответствии с инструкцией к препарату. Противопоказан детям до 6 лет. Повышает комплаентность подростков [163].
Маннитол** и 3%, 6%, 7% гипертонический раствор натрия хлорида** с 0,001% и 0,1% натрием гиалуронатом являются муколитиками быстрого действия и сочетаются с дорназой альфа**.
Муколитическая терапия подбирается пациентам индивидуально специалистом, имеющим опыт ведения пациентов с муковисцидозом, амбулаторно на приеме врача или в стационаре при наличии показаний к госпитализации.
Согласно данным регистра пациентов с муковисцидозом в 2021 году [5] дорназу альфа** в РФ в виде воспроизведенного препарата получали 95% пациентов. Переносимость препаратов дорназы альфа** сопоставима [165,438,439,440,441].
По данным европейского регистра 2021 г. медиана назначения дорназы альфа** у пациентов 6 и старше лет 86,2%, назначение у детей младше 3 лет – в среднем 43,6%, у детей 3-5 лет – 69,2%, что свидетельствует о взаимозаменяемости муколитических средств, в частности, при нежелательных побочных реакциях (при замене дорназы альфа** используются 3%, 6%, 7% р-р натрия хлорида** с 0,01% и 0,1% натрия гиалуронатом или маннитол**) [166].
Показаниями к отмене дорназы альфа** для нижних дыхательных путей являются:
- наличие комплекса показателей на фоне таргетной терапии: нормализация функции хлорного CFTR канала при отсутствии грамотрицательной флоры, легочного микобактериоза, MRSA, бронхоэктазов и наличии нормальных показателей функции внешнего дыхания (Исследование неспровоцированных дыхательных объемов и потоков (спирометрия) с динамическим наблюдение в последующем
- нежелательные реакции , при этом дорназу альфа** заменяют на 3%, 6%, 7% р-р натрия хлорида** с 0,01% и 0,1% натрия гиалуронатом или маннитол**).
Основанием служат данные регистров разных стран, где дорназа альфа используется с меньшей частотой [442,443].
Показаниями к отмене дорназы альфа** с использованием универсальной ингаляционной системы с функцией пульсирующей подачи аэрозоля через носвые канюли на фоне таргетной терапии являются:
- отсутствие патологических изменений по данным спиральной компьютерной томографии придаточных пазух носа (КТ ОНП) через год от старта терапии при условии организации динамического наблюдения со стороны врача-оториноларинголога в последующем [167].
3.1.2 Бронхолитическая терапия
- Рекомендовано назначение ингаляционной бронхолитической терапии пациентам с МВ при наличии обратимой или частично обратимой бронхиальной обструкции (прирост уровня ОФВ1 после ингаляции препарата для лечения обструктивных заболеваний дыхательных путей (бронхолитика) >15%) с целью улучшения эвакуации мокроты, перед применением ингаляцией противомикробных препаратов системного действия (ингаляционных), гипертонического раствора натрия хлорида**, перед кинезитерапией (Дыхательные упражнения дренирующие) [1,2,5,21].
(УУР – C, УДД – 5).
Комментарий: противопоказанием является индивидуальная непереносимость.
- Рекомендуется пациентам с МВ в качестве бронхолитической терапии назначить бронхолитический препарат из групп: селективные β2-адреномиметики или адренергические средства в комбинации с антихолинергическими или антихолинергические средства либо другой препарат для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям в режиме «по требованию» [1,2,21,164,168,169,170].
(УУР – B, УДД – 2).
Комментарий: в режиме «по требованию» используется селективный бета-2-адреномиметик сальбутамол** в монотерапии или в сочетании с ипратропия бромидом** или фиксированная комбинация фенотерол + ипратропия бромид** или тиотропия бромид** либо другой препарат для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям.
Использование дозированных аэрозольных ингаляторов обязательно со спейсером, при назначении ингаляционных бронхолитиков (препаратов для лечения обструктивных заболеваний дыхательных путей) (селективный бета-2-адреномиметик сальбутамол** в монотерапии или в сочетании с М-холинергническими препаратами (ипратропия бромид**) или фиксированная комбинация фенотерол + ипратропия бромид** или препараты пролонгированного действия (тиотропия бромид**) либо другого препарата для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям) пациентам с тяжелой бронхообструкцией (ОФВ1 <30% от должного) ингаляции должны проводиться при помощи небулайзера.
Выбор пути введения препарата для лечения обструктивных заболеваний дыхательных путей: предпочтение отдается ингаляционному пути введения.
Оценка эффективности лечения: клинически (симптомы бронхообструкции) и по данным спирометрии.
Оценка безопасности лечения: клинически и по результатам объективного осмотра (число сердечных сокращений, сердечный ритм).
Применение препаратов вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет.
3.1.3 Антибактериальная терапия (АБТ)
3.1.3.1 Общие принципы антибактериальной терапии
- Рекомендована антибактериальная терапия (плановые курсы АБП в виде ингаляций через небулайзер или совместно с таблетированными формами, или внутривенно) всем пациентам с легочными проявлениями МВ, у которых отмечается обострение МВ (включая обострения на фоне острой респираторной инфекции) или выявляются новые патогенные возбудители респираторной инфекции в количестве более 105 колониеобразующих единиц при плановом микробиологическом исследовании (Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы, Определение чувствительности к антибактериальным препаратам микроорганизмов, выделенных из мокроты, Определение чувствительности к противогрибковым препаратам грибов, выделенных из мокроты) с целью эрадикации причиннозначимых микроорганизмов [2,5,21,171,172,173,174].
(УУР – В, УДД – 2).
Комментарий: для грамотрицательной микрофлоры (P. aeruginosa, В. cepacia complex, Stenotrophomonas maltophilia, Achromobacter spp), MRSA, нетуберкулезных микобактерий или при их хроническом высеве значение имеет любое количество колоний, определенное по результатам микробиологического исследования.
- При проведении антибактериальной терапии (АБТ) пациентам с муковисцидозом рекомендовано ориентироваться на чувствительность выделенного из бронхолегочной системы микроорганизма (Pseudomonas aeruginosa, MRSA, Burkholderia cepacia complex, Stenotrophomonas maltophilia, Staphylococcus aureus и Haemophilus infuenzae и др.) к антибактериальным препаратам с целью повышения эффективности лечения [2].
(УУР – C, УДД – 5).
Комментарии: лабораторное определение чувствительности микроорганизма к антибиотикам (Определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам) не всегда полностью совпадает с клиническим ответом на проводимую терапию [2,5,21,172,173,174].
При выборе противомикробного препарата системного действия целесообразно учесть эффективность ранее проводимых курсов антибактериальной терапии [2].
Пациентам с МВ назначают максимальные возрастные дозы препаратов или дозы, рекомендуемые для пациентов с МВ. В связи с тяжестью заболевания, необходимостью максимальных дозировок антимикробных препаратов и дефицитом лекарственных форм для ингаляционного применения в мировой клинической практике традиционно применяются off-label (вне инструкции) противомикробные препараты системного действия (инъекционные) в виде ингаляций [89,175,176,177,178,179,180,181,182,183].
o Противопоказания: определяются индивидуально и зависят от индивидуальной непереносимости (в том числе аллергии), характера сопутствующих заболеваний (главным образом заболевания печени и почек) и возраста пациента.
o Выбор лекарственных средств определяется: видом возбудителя, выявленного у пациента; чувствительностью возбудителя (in vitro) к данному АБП; фазой заболевания (обострения – ремиссия); продолжительностью инфекционного процесса (хроническая инфекция – впервые выявленный возбудитель); эффективностью терапии предшествующего обострения легочной инфекции (данные о природной резистентности основных патогенов, характерных для пациентов с МВ представлен в Приложении А3.4).
o Выбор пути введения определяется: видом возбудителя, выявленного у пациента; фазой заболевания (обострение – ремиссия); продолжительностью инфекционного процесса (хроническая инфекция – впервые выявленный возбудитель); местом оказания медицинской помощи (амбулаторная – стационарная); эффективностью предшествующей антибактериальной терапии. Внутривенное введение антибиотиков начинается в стационаре с курсом лечения 14-21 день. Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31.12.2018 г.№ 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг». По показаниям до постановки, в процессе использования и после снятия порт-системы (порта инфузионного/инъекционного, имплантируемого***) может проводиться дуплексное сканирование артерий верхних конечностей, дуплексное сканирование вен верхних конечностей Лечение может проводиться в стационаре и в амбулаторных условиях. Внутримышечный путь введения при муковисцидозе применяться не должен в связи с необходимостью длительных частых курсов терапии, так как при МВ имеются особенности в фармакокинетике АМГ, β-лактамных антибиотиков, выражающиеся в увеличении объема распределения на килограмм массы тела и снижении периода полувыведения. Увеличение системного клиренса за счет ускорения метаболизма в печени и увеличение почечного клиренса определяют необходимость применения высоких доз антибиотиков с более частым их введением [2,21,176,184,185,186,187].
o Безопасность: в связи с применением у пациентов с муковисцидозом высоких доз, длительных курсов и комбинаций антибактериальных препаратов, одновременной терапии лекарственными препаратами разных групп, а также в связи с возможным нарушением функции печени, следует осуществлять соответствующие контролирующие мероприятия (клинические, лабораторные, инструментальные) для мониторирования возможных нежелательных эффектов лекарственных препаратов, их предупреждения и, при необходимости, терапии [2,189].
- При острой респираторной инфекции пациентам с муковисцидозом рекомендовано назначение антибактериальной терапии в домашних условиях согласно профилю чувствительности выделенной респираторной микрофлоры в сязи с активацией хронического воспалительного процесса на фоне присоединения острой респираторной инфекции [2,21,89].
(УУР – С, УДД – 5).
Оценка эффективности АБТ: клинически (лихорадка, респираторные симптомы), по данным лабораторных методов обследования (лейкоцитоз, уровень С-реактивного белка, по показаниям - прокальцитонина (исследование уровня прокальцитонина в крови)) и по данным микробиологического исследования (микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы, Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы, Определение чувствительности к антимикробным препаратам микроорганизмов, выделенных из бронхоальвеолярной лаважной жидкости, Определение чувствительности к противогрибковым препаратам грибов, выделенных из бронхоальвеолярной лаважной жидкости, Определение чувствительности к антибактериальным препаратам микроорганизмов, выделенных из мокроты, Определение чувствительности к противогрибковым препаратам грибов, выделенных из мокроты) (эрадикация возбудителя, персистирование, суперинфекция, снижение выделения возбудителя <104 колониеобразующих единиц или отрицательный результат посева и т.д.).
Оценка безопасности лечения: зависит от применяемого лекарственного средства (ЛС) и проводится с учетом возможных нежелательных явлений.
Дополнительные замечания:
1. При назначении АБП следует использовать комбинации ЛС с различным механизмом действия (например, Бета-лактамные антибактериальные препараты, пенициллины/Другие бета-лактамные антибактериальные препаратыв комбинации с аминогликозидами). При выделении в мокроте пациента одновременно двух микроорганизмов выбор АБП зависит от свойств более резистентного возбудителя.
2. Одновременное назначение препаратов для ингаляционного и внутривенного путей введения одной фармакологической группы не рекомендуется. Возможно назначение ингаляционной и внутривенной АБТ одновременно по решению консилиума специалистов и с учетом фармакологической группы препаратов.
3. Применение АБП в виде ингаляций через небулайзер:
- может проводиться как в стационаре, так и в домашних условиях;
- для решения вопроса о назначении ингаляционной терапии следует провести спирометрию до первой ингаляции противомикробного препарата системного действия (ингаляционно) и через несколько минут после ингаляции (для выявления возможного бронхоспазма (при отсутствии возрастных и/или иных противопоказаний)) (см. раздел «Бронхолитическая терапия») - перед ингаляцией АБП необходимо провести ингаляцию бронхолитика (препарата для лечения обструктивных заболеваний дыхательных путей). Симпатомиметики для ингаляционного применения, например, сальбутамол** 2,5 мг через небулайзер (или дозированный аэрозольный ингалятор по 200 – 400 мкг с использованием спейсера) за 15-30 минут до ингаляции антибиотика в монотерапии или в сочетании с ипратропия бромидом** или фиксированная комбинация фенотерол + ипратропия бромид** или тиотропия бромид**) или другие препараты для лечения обструктивных заболеваний дыхательных путей, муколититические препараты, а также дренаж (дыхательные упражнения дренирующие);
- при ингаляции АБП в домашних условиях желательно использовать небулайзер, оснащенный фильтром для выдыхаемого воздуха;
- при ингаляции АБП предпочтительнее применять мундштук, по сравнению с маской. Следует рекомендовать пациентам переходить на применение мундштука в максимально ранние сроки, как правило, с 3-х летнего возраста [190]. Вдыхание препарата лучше осуществлять через рот, применение носовых зажимов во время ингаляции увеличивает эффективность лечения;
- при проведении ингаляций в условиях медицинской организации и амбулаторно пациенты с МВ, должны пользоваться индивидуальным небулайзером с возможностью замены каждые 3 месяца комплекта распылителя и трубки воздуховода и фильтра;
- оптимальной для пациента с МВ является ингаляционная система с низкопоточным компрессором (уровень потока сжатого воздуха до 6 л/мин.), с производительностью 0,15 мл-0,25 мл/мин., снабженная системой контроля инспираторного потока и системой клапанов вдоха и выдоха, позволяющей сократить потери медикамента в окружающую среду, обеспечивающий максимальную эффективность терапии, приспособленный к химической и термической дезинфекции и к автоклавированию;
- для введения медикамента в ОНП применяется ингаляционная система с функцией пульсирующей подачи аэрозоля;
- в качестве мобильного устройства возможно использование мэш-небулайзера - ингаляционного прибора, состоящего из блока управления и аэрозольного модуля, включающего в себя резервуар для медикамента, аэрозольную головку, спейсер\накопитель, оснащенный системой клапанов вдоха и выдоха и мундштуком. Скорость распыления в диапазоне 0,3-0,7 мл\мин., с нераспыляемым (остаточным) объемом не более 0,5 мл. Все части аэрозольного модуля должны подлежать термической дезинфекции. Для пациента с МВ важно производить замену компонентов мэш-небулайзера каждые 3 месяца [191].
4. Применение АБП внутрь используется для терапии обострений МВ (включая обострения на фоне ОРИ) в домашних условиях или для профилактического лечения пациентов, хронически инфицированных P. aeruginosa, В. cepacia comрlex, MRSA, Achromobacter spp., НТМБ.
5. Применение АБП внутривенно показано:
- при тяжелых обострениях МВ (лечение в условиях медицинской организации) (не менее, чем двумя препаратами);
- в тех случаях, когда применение АБП внутрь и ингаляционно оказалось неэффективным;
- для плановой терапии пациентов, инфицированных P. aeruginosa, В. cepacia comрlex, MRSA, Achromobacter spp., нетуберкулезными микобактериями;
- при ухудшении течения заболевания и появлении новых симптомов у пациентов, получающих АБП внутрь.
6. Организация внутривенной терапии в амбулаторных условиях способствует повышению комплаентности, профилактике обострений. Пребывание в больнице отягощается риском перекрестного и суперинфицирования резистентными к противомикробным препаратам системного действия штаммами микроорганизмов, стрессом, пропуском школьных занятий. Кроме того, пребывание пациента в стационаре значительно дороже, чем амбулаторное лечение. Катетеризация вен давно стала рутинной медицинской процедурой в мире для обеспечения различных видов внутривенной терапии. Проведение внутривенной терапии через периферический венозный катетер (катетер периферический) или порт-систему (порт инфузионный/инъекционный, имплантируемый***) является практически безопасным, если соблюдаются основные условия: метод должен стать постоянным и привычным в практике, должен быть обеспечен безупречный уход за катетером. Катетер устанавливается в условиях дневного стационара или выездной бригадой на дому [2,192,193,194,195].
Профиль пациента, которому может проводиться внутривенная антибактериальная терапия в домашних условиях
1. Опыт ранее проводимой внутривенной антибактериальной терапии в условиях стационара.
2. Пациент, нуждающийся в проведении планового курса антибактериальной терапии, или имеющий обострение хронического бронхолегочного процесса, не требующий круглосуточного наблюдения медицинским специалистом, в том числе пациенты с тяжелым течением заболевания в стабильном состоянии, получающие на дому кислородотерапию (обеспечены концентратором кислорода, аппаратурой для неинвазивной вентиляции легких).
3. Положительное отношение пациента и членов семьи к проведению внутривенной антибактериальной терапии, отсутствие неврологических и психогенных нарушений, которые могут препятствовать безопасному проведению лечения в домашних условиях.
Условия, необходимые для начала терапии в домашних условиях:
1. Удовлетворительные санитарные условия проживания семьи.
2. Способность пациента или его родственников к обучению правилам ухода за катетером/порт-системой, прохождение обучения практическим навыкам.
3. Комплаентность семьи по выполнению рекомендации врача за предыдущий период наблюдения.
4. Предварительный осмотр специалистом по муковисцидозу в условиях медицинского учреждения, первое введение антибактериального препарата/препаратов в ЛПУ (стационар одного дня, дневной стационар), оценка переносимости терапии, за исключением случаев, когда уже имеется опыт применения конкретного лекарственного препарата.
5. Подписание информированного согласия пациентом/законными представителями
(подробная информация – в методических рекомендациях «Организация внутривенной терапии пациентам с муковисцидозом в амбулаторных условиях».
3.1.3.2 Антибактериальная терапия при высеве метициллинчувствительного Staphylococcus aureus (MSSA) и Haemophilus influenzae
- Рекомендовано при выборе антибактериальных препаратов системного действия для терапии пациентов с муковисцидозом с высевом Staphylococcus aureus и Haemophilus influenzae применять ЛС в соответствии с чувствительностью с целью эрадикации причиннозначимого возбудителя (препараты, дозировки и кратность введения, представлены в таблицах 10,11) [2].
(УУР – C, УДД – 5).
Таблица 10. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/ бронхиального секрета Staphylococcus aureus (MSSA)
Антибактериальный препарат | Суточные дозы для детей | Суточные дозы для взрослых | Способ введения | Кратность введения |
|---|
Амоксициллин + [Клавулановая кислота1]** (суспензия для приема внутрь – противопоказана детям до 3 месяцев, таблетки диспергируемые противопоказаны детям по 2 лет, таблетки, покрытые пленочной оболочкой противопоказаны детям до 12 лет и с массой тела менее 40 кг) | 60-90 мг/кг (расчет по амоксициллину) | 1,5-2 г (расчет по амоксициллину) | Внутрь | 2-32 |
90-120 мг/кг | 3,6-4,8 г | В/в | 3-4 |
Оксациллин** | 200-300 мг/кг | 4-12 г | В/в | 4-6 |
Цефалексин** (капсулы 250 мг противопоказаны детям до 10 лет, таблетки 250 мг – противопоказаны детям до 7 лет) | 25-50-100 мг/кг | 2-4 г | Внутрь | 3-4 |
Цефазолин** | 100-150 мг/кг | 4-6 г | В/в | 2-3 |
Цефуроксим** (суспензия для приема внутрь – противопоказана детям до 3 мес., таблетки – противопоказаны детям до 3 лет) | 20 -30 мг/кг | 0,5 – 1 г | Внутрь | 2 |
150-200 мг/кг | 3–9 г | В/в | 3-4 |
Цефтриаксон** | 50-80 мг/кг | 4 г | В/в | 1-2 |
Цефепим** (противопоказан детям до 2 мес. жизни) | 100–150 мг/кг | 4-6 г | В/в | 2-3 |
Азитромицин** (таблетки 125 мг – противопоказаны до 3 лет, суспензия для приема внутрь – противопоказана детям до 6 мес.) | >6 мес.-10 мг/кг | 500 мг | Внутрь | 1 Курс 7-10 дней |
Кларитромицин** (таблетки – противопоказаны детям до 12 лет) | 15 мг/кг | 1 г | Внутрь | 2 |
Джозамицин** (противопоказание - при массе тела более 10 кг) | 40–50 мг/кг | 1-3 г | Внутрь | 2-3 |
Клиндамицин** (р-р для в/в и в/м введения противопоказан детям до 3 лет, капсулы противопоказаны детям до 8 лет с массой тела до 25 кг) | 20-40 мг/кг | 1,8-2,4 г | Внутрь | 3-4 |
Детям старше 3х лет 40 мг/кг | 2,4-2,7 г | В/в | 3-4 |
Доксициклин** (противопоказан детям до 8 лет) | Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг, в последующие дни - 2-4 мг/кг. Детям с массой тела более 45 кг - как взрослым | 1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
Ко-тримоксазол [Сульфаметоксазол + Триметоприм]** (суспензия для приема внутрь – противопоказана детям до 6 недель, таблетки противопоказаны детям до 3 лет, раствор для инфузий противопоказан детям до 3 лет) | 6-10 мг/кг по триметоприму при тяжелой инфекции возможно увеличение дозы на 50% | 320 мг по триметоприму | Внутрь В/в | 2 |
Тиамфеникола глицинат ацетилцистеинат | 250 мг (в первые 2-3 дня лечения доза может быть увеличена в 2 раза) | 500 мг (в первые 2-3 дня лечения доза может быть увеличена в 2 раза) | Ингаляции | 2 |
Примечание: 1 - При расчёте дозы Амоксициллин + [Клавулановая кислота]** следует ограничивать количество клавулановой кислоты до ≤ 10 мг/кг/сут во избежание побочных эффектов со стороны ЖКТ и подбирать формы с меньшим относительным содержанием клавулановой кислоты [513,514].
2- в возрасте с 2 до 5 лет назначается 3 раза в день [196,197,198,199].
Таблица 11. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета Haemophilus influenzae
Антибиотик | Суточные дозы для детей | Суточные дозы для взрослых | Способ введения | Кратность введения |
|---|
Амоксициллин** | 60-90 мг/кг | 1,5-2 г | Внутрь | 2-31 |
Амоксициллин + [Клавулановая кислота2]** (суспензия для приема внутрь – противопоказана детям до 3 месяцев, таблетки диспергируемые противопоказаны детям по 2 лет, таблетки, покрытые пленочной оболочкой противопоказаны детям до 12 лет и с массой тела менее 40 кг) | 60-90 мг/кг (расчет по амоксициллину) | 1,5-2 г (расчет по амоксициллину) | Внутрь | 2-3 |
90-120 мг/кг | 3,6-4,8 | В/в | 3-4 |
Цефуроксим** (суспензия для приема внутрь – противопоказана детям до 3 мес., таблетки – противопоказаны детям до 3 лет) | 20 -30 мг/кг | 0,5 – 1 г | Внутрь | 2 |
150- 200 мг/кг | 3–9 г | В/в | 3-4 |
Цефиксим (суспензия для приема внутрь – противопоказана детям до 6 месяцев, таблетки диспергируемые противопоказаны детям с массой тела до 25 кг, таблетки, покрытые пленочной оболочкой и капсулы противопоказаны детям до 12 лет) | 8 мг/кг | 400 мг | Внутрь | 1-2 |
Цефтриаксон** | 50-80 мг/кг | 4 г | В/в | 1-2 |
Цефотаксим** | 100-150 мг/кг | 2-8 г | В/в | 2-4 |
Цефепим** (противопоказан детям до 2 мес. жизни) | Дети с массой тела˂40 кг 100–150 мг/кг; Детям с массой тела ˃40 кг – 4-6 г– | 4-6 г | В/в | 2-3 |
Доксициклин** (противопоказан детям до 8 лет) | Дети с массой тела до 45 кг в первый день - 4 мг/кг, в последующие дни - 2-4 мг/кг. Детям с массой тела более 45 кг - как взрослым | 1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
Тиамфеникола глицинат ацетилцистеинат | 500 -1000 мг | 1000 мг | Ингаляции | 2 |
Примечание: 1- в возрасте с 2 до 5 лет назначается 3 раза в день [196,197,198,199].
2 - При расчёте дозы Амоксициллин+[Клавулановая кислота]** следует ограничивать количество клавулановой кислоты до ≤ 10 мг/кг/сут во избежание побочных эффектов со стороны ЖКТ и подбирать формы с меньшим относительным содержанием клавулановой кислоты [513,514].
3.1.3.3 Антибактериальная терапия при MRSA (метициллинрезистентный стафилококк) - инфекции
- При первичном высеве MRSA у стабильных пациентов (вне обострения хронического воспалительного процесса) в качестве первой линии терапии при отсутствии противопоказаний рекомендуется назначение двух антибактериальных препаратов per os в течение 14-21 дня, чаще это комбинация рифампицина** с ко-тримоксазолом [Сульфаметоксазол + Триметоприм]** или фузидовой кислотой (табл.12) [2,21,133].
(УУР – C, УДД – 5).
Комментарии:
o у пациентов старше 12 лет рифампицин** может сочетаться с доксициклином** (#миноциклином) для приёма per os (табл.12). Допускается монотерапия доксициклином** или Сульфаметоксазолом + Триметоприм** (табл.12) [6, 7]. Необходимо помнить о гепатотоксичности препаратов.
o Возможной альтернативой является использование #ванкомицина** в форме для инъекционного применения ингаляционно (применение вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет) в течение 3-4 недель [175,176,181,182,183,200,201] (табл. 12).
o С учетом знаний о местах возможной колонизации MRSA, параллельно, одновременно с началом эрадикационной терапии, необходима обработка кожи, полости носа и ротоглотки антисептиками, а также дезинфекция окружающей среды:
1) эндоназально мупироцин 2% 2 раза в день + обработка кожи водным раствором хлоргексидина** 0,5% в течение 5 дней;
3) полоскание полости рта 0,5% водным раствором хлоргексидина** в течение 2-х недель;
4) генеральная уборка жилого помещения;
5) ежедневная смена нательного белья в течение 5 дней;
6) стирка постельных принадлежностей, белья, полотенец в режиме высокой температуры еженедельно в течение всего периода лечения;
7) после инициации лечения необходима смена зубных щеток, расчесок, шариковых дезодорантов, губной помады;
8) все члены семьи, а также домашние животные должны быть обследованы и, в случае идентификации MRSA, санированы.
- При первичном высеве MRSA у нестабильных пациентов (при обострении хронического воспалительного процесса), рекомендуется проведение внутривенной или пероральной терапии в течение 2-х недель линезолидом** или тейкопланином, прочими антибактериальными препаратами системного действия, активными в отношении MRSA (табл.12) [2,176,200,201,202].
(УУР – C, УДД – 5).
Комментарии: у пациентов с частыми обострениями при хроническом инфицировании MRSA возможно использование ингаляций #ванкомицина** в форме для инъекционного применения в непрерывном или курсовом режиме (табл.12) [200,201]. При первом высеве MRSA на фоне проводимой таргетной терапии в качестве препарата первой динии следует использовать линезолид внутрь в течение 14 дней [133].
Таблица 12. Антибактериальные препараты системного действия, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета метициллинрезистентного Staphylococcus aureus (MRSA)1.
Антибактериальный препарат | Суточная доза для Детей | Суточная доза для взрослых | Способ Введения | Кратность введения |
|---|
Рифампицин** (в монотерапии не назначают) (противопоказан детям до 1 года) | 20 мг/кг/сут. (максимально 600 мг в сутки) | 600-1200 мг | Внутрь | 2 |
Ко-тримоксазол [Сульфаметоксазол + Триметоприм]** (суспензия для приема внутрь – противопоказана детям до 6 недель, таблетки противопоказаны детям до 3 лет, раствор для инфузий противопоказан детям до 3 лет) | 6-10 мг/кг/сут. по триметоприму, при тяжелой инфекции возможно увеличение дозы на 50% | 320 мг по триметоприму | Внутрь | 2 |
В/в |
Фузидовая кислота (противопоказана детям до 3 лет) | 40-60 мг/кг #<1 года: 15 мг/кг 3 раза в день #(до 3 лет) 1-4 года: 250 мг 3 раза в день 5-12 лет: 500 мг 3 раза в день > 12 лет: 750 мг 3 раза в день | 2250 мг | Внутрь | 3 |
Клиндамицин** (противопоказан детям до 3 лет) | 20-40 мг/кг/сут. | 1,8-2,4 г | Внутрь | 3-4 |
40 мг/кг/сут. | 1,8-2,7 г | В/в | 3-4 |
Доксициклин** (противопоказан детям до 8 лет) | Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг/сут., в последующие дни - 2-4 мг/кг/сут. Детям с массой тела более 45 кг - как взрослым | 1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
Тигециклин** (противопоказан детям до 8 лет) | В возрасте 8-11 лет - 2,4 мг/кг/сут. максимальная доза - 100 мг Доза с 12 до 17 лет составляет 100 мг. | Начальная доза - 200 мг, далее 100 мг | В/в в течение 30-60 мин. | 2 |
Линезолид** (таблетированные формы противопоказаны детям до 12 лет) | до 12 лет – 20-40 мг/кг/сут. (максимально 600 мг). Старше 12 лет - 1200 мг | 1200 мг | Внутрь, В/в | 3 – до 12 лет, 2 -старше 12 |
Ванкомицин** | 40 мг/кг/сут. | 2 г | В/в | 2-4 |
#Ванкомицин** (формы для инъекционного применения)1 | 250 мг 2 раза в день. К отмеренной дозе добавить хлорида натрия** 0,9% до 4 мл | 500 мг | Ингаляционно | 2 |
Тейкопланин | >1 месяца - 10мг/кг (макс. 400 мг) вводятся 3 дозы каждые 12 часов (нагрузочная доза). Последующие 24 часа 10 мг/кг (макс. 400 мг) однократно/сут. | 800 мг | В/в | 1-2 |
Цефтаролина фосамил** | 2 мес.-2 года 24 мг/кг. От 2-128 лет 36 мг/кг, 12-18 лет 36 мг/кг – разовая доза (Разовая доза не должна превышать 400 мг) | 600 мг | В/в | 2 |
Телаванцин** | Пациентам старше 18 лет | 10 мг/кг | В/в (не менее 60 мин.) | 1 |
Примечания: # - применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет.
1 - [89,175,176,181,182,183,200,201].
Эпидемиологические исследования демонстрируют, что MRSA ассоциируется со сниженной лёгочной функцией, большей потребностью в медикаментозной терапии и худшей выживаемостью. Для эрадикации возбудителя используют достаточно агрессивные схемы лечения.
3.1.3.4 Антибактериальная терапия при выявлении в мокроте/бронхиальном секрете P.aeruginosa
- Рекомендуется одновременное назначение 2–3 противомикробных препаратов системного действия из разных групп, что предотвращает развитие устойчивости P.aeruginosa и способствует достижению максимального клинического эффекта (эрадикации P. aeruginosa) (табл.13) [2,5,21,171,172,173,203,204].
(УУР – C, УДД – 5).
Комментарии: наиболее часто применяют комбинации аминогликозидов с цефалоспоринами 3–4 поколения (табл.13). Целесообразно периодически менять комбинации противомикробных препаратов системного действия, эффективных в отношении синегнойной палочки. Следует помнить, что лабораторное определение чувствительности микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию.
В тяжелых случаях, при нестабильном состоянии, допускается непрерывное применение препарата [205].
Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов незарегистрированными в РФ лекарственными препаратами по жизненным показаниям (Приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у пациентов по жизненным показаниям» от 9 августа 2005 г. № 494).
Таблица 13. Антибактериальные препараты системного действия, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета P. аeruginosa.
Антибактериальный препарат | Суточная доза для детей | Суточные дозы для взрослых | Способ введения | Кратность введения |
|---|
Амикацин** | 20-30 мг/кг | 700 – 1500 г | в/в | 1 |
Гентамицин** | 10 мг/кг | 10 мг/кг | в/в | 1 |
Ципрофлоксацин** (противопоказан детям с муковисцидозом до 5 лет) | #<1 мес. 30 мг/кг; >1 мес. 40 мг/кг (750 мг - макс.) | 1,5 г | Внутрь | 2-3 |
10 мг/кг | 800 мг | в/в | 2 |
#Левофлоксацин ** (противопоказан до 18 лет) | 16–20 мг/кг | 500-1000 мг/сут. | Внутрь | 1-2 |
16–20 мг/кг | 1000 мг | в/в | 2 |
Колистиметат натрия | Дети с массой тела до 40 кг: доза 75000 - 150000 ЕД/кг/сут., разделенная на три введения. Для детей с массой тела более 40 кг: применяются дозы, рекомендованные для взрослых и подростков | 6 млн. ЕД | в/в | 31 |
Цефтазидим** | 150 – 250 мг/кг | 6-9 г | в/в | 2-3 |
Цефепим** (противопоказан детям до 2 мес. жизни) | 100–150 мг/кг | 4-6 г | в/в | 2-3 |
Цефепим + [сульбактам] (противопоказан детям до 2 мес. жизни) | с 2 месяцев - 50-80 мг/кг | 4 г | в/в | 2-3 |
Цефтазидим + [авибактам] ** | с 3 мес. | 750/1500 мг | в/в | 3 |
Цефтолозан + [Тазобактам]** | #90-120 мг/кг | 9 г | в/в | 3 (в случае, если МПК для P. aerugenosa равна или более 2 мг/л - 30-40 мг/кг (по цефтолозану) 4 введения в сутки (каждые 6 часов)) |
Пиперациллин + [Тазобактам](противопоказан детям до 2 лет) | 270-360 мг/кг | 13,5 г | в/в | 3-4 |
Цефоперазон + [Сульбактам]** | 150-200 мг/кг | 8 г | в/в | 2 |
Азтреонам (противопоказан до возраста 9 мес.) | 150-250 мг/кг | 8 г | в/в | 4 |
Имипенем + Циластатин** (противопоказан детям до 3 мес. жизни) | 50 – 100 мг/кг по имипенему | 2-4 г | в/в | 3-4 |
Меропенем ** (противопоказан детям до 3 мес. жизни) | 60-120 мг/кг | 3-6 г | в/в | 3 |
Дорипенем | до 18 лет не применяется | 3000 мг | в/в | 3 |
Биапенем | до 18 лет не применяется | 1,2 г | в/в | 2 |
Фосфомицин** (противопоказан детям до 12 лет) | 0,2 – 0,4 г/кг | 10 – 12 г | в/в | 3-4 |
Примечания: 1 - Сообщалось о применении колистиметата натрия в дозах свыше 150000 ЕД/кг/сут. у детей с муковисцидозом. Данные в отношении применения или величины нагрузочной дозы у детей с жизнеугрожающими инфекциями отсутствуют. Рекомендации по режиму дозирования у детей с нарушением функции почек отсутствуют. Способ введения и приготовления: Препарат можно вводить внутривенно в виде медленной инфузии в течение 30 - 60 минут. Пациентам с полностью имплантированным устройством венозного доступа препарат можно вводить в виде болюсной инъекции в течение не менее 5 минут в дозе до 2 млн ЕД в 10 мл растворителя [196,197,198,199].
# - Применение лекарственого препарата у детей вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии медицинской организации при наличии подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет.
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальую непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущеcтвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и приказ Минздрава России (от 24 ноября 2021 г. №1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов»). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента.
Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов незарегистрированными в РФ лекарственными препаратами по жизненным показаниям (Приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494).
- Рекомендуется проведение профилактических курсов антибактериальной терапии при хронической колонизации нижних дыхательных путей P. аeruginosa, для увеличения продолжительности жизни пациентов [2,89,176,201,202].
(УУР – C, УДД – 5).
Комментарий: следует помнить, что проведение профилактических курсов антибактериальной терапии практически не сказывается на устойчивости штаммов микроорганизмов только при своевременной смене применяемых препаратов.
При частых обострениях инфекционно-воспалительного процесса в бронхолёгочной системе следует увеличивать продолжительность курсов антибактериальной терапии до 3 недель и более, использовать внутривенный способ введения и /или сокращать интервалы между курсами и/или между курсами в/в терапии применять ципрофлоксацин** в таблетках. Ципрофлоксацин** применяется также при каждой острой респираторной инфекции и обострении бронхолегочного процесса легкой степени)[1,5,37,171,174,176,206,207]. У детей младше 5 лет назначать ципрофлоксацин** по решению врачебного консилиума ввиду отсутствия альтернативного АБП.
Стратегия антибиотикотерапии P. aeruginosa инфекции при МВ
Эрадикация Pseudomonas aeruginosa при первичном высеве
- При отсутствии у пациента клинически значимых респираторных симптомов, при минимальных структурных изменениях в лёгких и при условии проведения бактериологического мониторинга не реже 4-х раз в год рекомендуется проведение одного из 2-х режимов антибактериальной терапии с целью эрадикации P. aeruginosa для увеличения продолжительности жизни и профилактики снижения функции легких для всех возрастов пациентов [10,11,31]:
- ингаляции тобрамицина** в виде раствора 300 мг х 2 раза в день или в виде капсул с порошком для ингаляций (обе лекарственные формы противопоказаны для детей до 6 лет) 112 мг х 2 раза в день в течение 28 дней [1,2,5,21,171,172,173],
(УУР – А, УДД – 2),
возможна комбинация с ципрофлоксацином** (табл.13) в течение 3-х недель [1,2,21,89,171,172,173,176,202].
(УУР – А, УДД – 2).
или
- комбинация ингаляционного колистиметата натрия (1млн. ЕД (80 мг) х 2 раза в день у детей младше 8-10 лет, 2 млн. ЕД (160 мг) х 2 раза в день у пациентов 8-10 лет и старше) [176] в течение 3-х месяцев в сочетании с ципрофлоксацином** (табл.13) per os из расчета 30-40 мг/кг/сутки в два приёма в течение от 3 недель до 3-х месяцев в зависимости от возраста [2,21,176,202].
(УУР – С, УДД – 5).
Комментарии: в настоящее время безопасность и эффективность ингаляционного тобрамицина** доказана у детей с 6-месячного возраста [208].
Колистиметат натрия применяется без возрастных ограничений.
В случае использования ингаляционного антибиотика впервые, первая ингаляция должна проводиться под врачебным наблюдением. При наличии явлений бронхоспазма за 10-15 минут до ингаляции следует использовать бронхолитики.
Через 7 – 14 дней после окончания курса антибактериальной терапии необходимо провести бактериологическое исследование мокроты (глубокого орофарингеального мазка [176]) для оценки эффективности эрадикационной терапии [2].
У стабильных пациентов с более тяжёлым заболеванием лёгких (при наличии сформировавшихся бронхоэктазов, ателектазах, низких функциональных показателях), в отсутствии должного бактериологического контроля (реже, чем 1 раз в 3 месяца) возможно инициирующее длительное применение ингаляций тобрамицина** в непрерывном режиме до 3-6 месяцев (по решению лечащего врача) [176]. Возможно добавление к терапии перорального ципрофлоксацина** в течение 3-4 недель [2]. Курсы рекомендуется проводить 1 раз в 3 мес., при необходимости – чаще.
Доза Колистиметата натрия может быть увеличена до 2 млн. ЕД (160 мг во флаконе) х 3 раза в сутки
- При наличии клинически значимых респираторных симптомов, признаков обострения бронхолёгочного процесса, у некомплаентых пациентов рекомендован двухнедельный курс внутривенной комбинированной (два препарата) антисинегнойной терапии с целью эрадикации возбудителя [89,176,202,207].
(УУР – С, УДД – 5).
Комментарии: предпочтение отдаётся комбинации цефтазидима** с аминогликозидами (тобрамицин** или амикацин**). В случае сочетания P. aeruginosa cо S. aureus рекомендуется комбинация меропенема** с тобрамцином** или амикацином** (табл. 13) [89].
Контроль эффективности также показан через 7-14 дней после окончания терапии.
Интермиттирующая и хроническая инфекции P. aeruginosa
При интермиттирующей инфекции P. aeruginosa возможность санации дыхательных путей пациентов с МВ значительно выше, чем при хронической. В многолетних исследованиях показано, что активная антимикробная терапия позволяет предупредить или отсрочить развитие хронической P. aeruginosa инфекции более чем у 80% пациентов с МВ.
- Рекомендовано, если эрадикация P.аeruginosa после проведенного курса антибиотикотерапии у пациента с муковисцидозом не произошла, и у пациента развилась хроническая синегнойная инфекция, назначение ингаляционной противосинегнойной терапии (тобрамицин** (капсулы с порошком для ингаляций, раствор для ингаляций) или колистиметат натрия (раствор для ингаляций)) (табл. 14) [289].
(УУР – С, УДД – 5).
Комментарии: позволяет уменьшить риск развития обострений бронхолегочного процесса, степень выраженности респираторных проявлений, сократить число курсов таблетированной или внутривенной антибактериальной терпи и улучшить показатели функции внешнего дыхания [2,89].
Таблица 14. Схема антибактериальной терапии при хронической синегнойной инфекции [2,21,207].

Примечание: # - применение у детей лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет;
# - Офлоксацин – противопоказан детям (до 18 лет);
Противопоказания для остальных ЛС – см. табл.13.
3.1.3.5 Антибактериальная терапия при высеве из мокроты/бронхиального секрета Burkholderia cepacia complex
Общие правила антимикробной терапии:
- Рекомендуется при инфицировании Burkholderia cepacia complex немедленная антибактериальная терапиия вследствие ее высокой вирулентности [1,2,89,176,201,202,209,210].
(УУР – C, УДД – 5).
Комментарий: инфицирование Burkholderia cepacia complex достоверно ухудшает клиническое состояние пациента и прогноз. Есть отдельные сообщения об успешной эрадикации некоторых изолятов Burkholderia cepacia complex c применением ранней агрессивной антибактериальной терапии до формирования хронической инфекции. При этом следует учесть, что доказательная база в отношении терапии при данной инфекции в настоящее время невелика. Препараты, применяемые при данной инфекции представлены в таблице 15.
- Рекомендовано для терапии пациента с муковисцидозом с высевом Burkholderia cepacia complex, как при первичном высеве, так и для лечения обострения бронхолегочного процесса отдавать предпочтение комбинации из трёх препаратов (как более эффективной), курсом от 3 недель и более, а также комбинировать внутривенный и ингаляционный и/или пероральный путь введения антибактериальных препаратов [176,201,211].
(УУР – C, УДД – 5).
Комментарии: наибольшую активность in vitro сохраняют Цефтазидим**, Цефтазидим + авибактам**, Пиперациллин + Тазобактам, Меропенем**, Имипенем**, #Сульфаметоксазол + Триметоприм** и #Тетрациклины. В клинических исследованиях наиболее эффективны Меропенем**, #Тобрамицин**, #Сульфаметоксазол + Триметоприм**, #Пиперацилин + Тазобактам, #Доксициклин** и #Цефтазидим** (табл.15). Для оптимизации исходов «cepacia syndrome» рекомендуется обязательное включение в схему лечения #Сульфаметоксазол + Триметоприма**. Эффективно применение трёхкомпонентной схемы внутривенного введения Меропенема**, Тобрамицина** с Цефтазидимом** в течение 2 -х недель и более (табл.15) **[1,2,176,201,213].
o Эффективна длительная, от 3 до 12 недель, терапия пероральными препаратами #Сульфаметоксазолм + Триметоприм** и/или #Доксициклин** и/или #Хлорамфеникол** (на фоне внутривенной терапии или после нее) (табл. 15). При хронической инфекции Burkholderia cepacia complex рекомендуется прием таблетированных форм #Сульфаметоксазола + Триметоприма** (табл.15) [1,2,176,201].
o Большинство микроорганизмов Burkholderia cepacia complex демонстрируют резистентность к антипсевдомонадным антибиотикам, включая природную резистентность к Колистиметату натрия и аминогликозидам. В то же время, накоплена информация об эффективности применения Тобрамицина**(противопоказан детям до 6 лет) [1,2,176,201,213].
o В ряде случаев при крайне тяжелом течении болезни (терапия сепация-синдрома) допустимо сочетание двух бета-лактамных антибактериальных препаратов, пенициллинов или других бета-лактамных антибактериальных препаратов (β-лактамных антибиотиков) (внутривенно + внутривенно и внутривенно + ингаляционно) и применения сверхвысоких доз антибиотиков (по решению консилиума или врачебной комиссии). Имеется положительный опыт применения трех бета-лактамных антибактериальных препаратов, пенициллинов или других бета-лактамных антибактериальных препаратов (β-лактамных антибиотиков), включая два карбапенема. Целесообразна ротация и наращивание доз антибактериальных препаратов до стабилизации клинико-рентгенологической и лабораторной картины [1,2,176,211,213]. Рекомендуется проводить курсы 1 раз в 3 мес., при необходимости – чаще.
- Для детей старше 12 лет и взрослых рекомендовано ингаляционное применение #Тобрамицина** (в виде раствора или в виде капсул с порошком для ингаляций), а также #Меропенема** и #Цефтазидима**, предназначенных для внутривенного использования чередуя по 1 мес. в течении года или 6 раз в год (табл.15). Возможно ингаляционное применение #тиамфеникола глицината ацетилцистината (табл.15). Выбор ингаляционного антибиотика осуществляется в зависимости от клинической эффективности, переносимости и результата чувствительности в посеве мокроты [2,89,175,176,201].
(УУР – C, УДД – 5).
Комментарий: об эрадикации Burkholderia cepacia complex можно судить только через год после последнего положительного результата посева при условии, как минимум, трёх отрицательных бактериологических анализов мокроты. В отношении пациентов с положительными результатами посевов на Burkholderia cepacia complex, проводится политика строжайшего инфекционного контроля и гигиенических мер [2].
Таблица 15. Антибактериальная терапия применяемая у пациентов с муковисцидозом, при эрадикации и терапии инфекции, вызванной Burkholderia cepacia compleх [2,89,175,176,201]
Антибактериальный препарат | Суточная доза для детей | Суточная доза для взрослых | Способ введения | Кратность введения/сут |
|---|
Цефтазидим + [Авибактам]** (противопоказан детям до 3 мес. жизни) | В возрасте 3-6 мес. 40 мг/кг/10 мг/кг; В возрасте 6 мес.-18 лет 50 мг/кг/12,5 мг/кг (максимально 2000/500 мг) | 7,5 г (15 г при сепация-синдроме) | В/в | 3 |
#Цефтазидим** (форма для инъекционного применения) | 2г | 2 г | Ингаляции | 2 |
#Цефтазидим** | 300 мг/кг | 9 г (12 г при сепация-синдроме) | В/в | 3 |
Меропенем** (противопоказан детям до 3 мес. жизни) | 120 мг/кг | 6,0 г (9 г при сепация- синдроме) | В/в | 3 |
#Дорипенем | Не разрешен | 1,5-3,0 (4,5 г при сепация-синдроме) | В/в | 3 |
Пиперациллин + [Тазобактам] (противопоказан детям до 3 мес. жизни) | 400-500 мг/кг | 13,5 г | В/в | 3 |
#Азтреонам (противопоказан детям до 9 мес. жизни) | 150-250 мг | 8 г | В/в | 2-4 |
# Ко-тримоксазол [Сульфаметоксазол + Триметоприм]** (суспензия для перорального применения - противопоказана детям до 6 нед., инъекционная форма - противопоказание до 3 лет) | 20 мг/кг (по триметоприму) | 2880 мг | В/в и внутрь | 3 |
#Миноциклин (противопоказан детям до 8 лет) | После 8 лет: 2-3 мг/кг | 200 мг | Внутрь | 1-2 |
Ципрофлоксацин** (противопоказан детям до 5 лет с МВ и высевом P.aeruginosa, по остальным показаниям - до 18 лет) | <1 мес. 30 мг/кг; >1 мес. 40 мг/кг (750 мг - макс.) [8,9] | 1,5 г | Внутрь | 2 |
10 мг/кг | 800 мг | В/в | 2 |
#Левофлоксацин ** | 16–20 мг/кг | 500-1000 мг/сут. | Внутрь | 1-2 |
16–20 мг/кг | 1000 мг | В/в | 2 |
Доксициклин** (противопоказан детям до 8 лет) | Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг, в последующие дни - 2-4 мг/кг. Детям с массой тела более 45 кг - как взрослым | 1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
#Хлорамфеникол** (таблетки противопоказаны детям до 3 лет или с массой тела ˂20кг) | 50-100 мг/кг | 2 – 4 г | Внутрь, В/в | 3-4 |
#Тиамфеникола глицинат ацетилцистеинат | 500-1000 мг | 1000 мг | Ингаляции | 2 |
Примечания: при наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и приказ Минздрава России от 24 ноября 2021 г. № 1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов»). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
# - Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии, при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
3.1.3.6 Антибактериальная терапия при высеве из бронхиального секрета Achromobacter spp.
Общие правила антимикробной терапии:
- При высеве из бронхиального секрета Achromobacter spp. рекомендовано применять антибактериальную терапию в соответствии с чувствительностью микроорганизма (таблица 16) [1,2,89,175,176,216,217,219].
(УУР – C, УДД – 5).
Комментарии: Аchromobacter spp. характеризуется мультирезистентностью, способностью формировать биофильм, что объясняет неудачи антибактериальной эрадикационной терапии микроорганизма при хронической инфекции.
Повторный высев Achromobacter spp., сопровождающийся увеличением продукции специфических преципитирующих антител, ассоциируется с более быстрым падением лёгочной функции, сопоставимым с таковым при хронической синегнойной инфекции (к заболеванию предрасполагает иммунодефицит).
Наиболее активными антибактериальными препаратами для внутривенного введения являются пиперациллин-тазобактам, #меропенем** и #сульфаметоксазол + триметоприм**, #цефтазидим**, #цефепим**, для ингаляций - #колистиметат натрия и #цефтазидим** (форма для инъекционного применения) (табл.16).
- Рекомендовано пациентам с МВ при первом высеве Achromobacter spp. или при обострении бронхолегочного процесса, связанном с Achromobacter spp. внутривенное введение комбинации двух антибиотиков различных классов курсом 14–21 день с целью эрадикации возбудителя:
o 1 линия – Пиперациллин + Тазобактам/#Меропенем**/ #Сульфаметоксазол + Триметоприм** (табл.16);
o 2 линия – #Цефтазидим**, #Миноциклин, #Колистиметат натрия, #Хлорамфеникол**; комбинированная терапия #Меропенем** и #Ципрофлоксацин** (Левофлоксацин**) (табл.16).
o Альтернативная терапия: #Меропенем** + #Миноциклин\#Левофлоксацин** + #Хлорамфеникол** + #Колистиметат натрия (раствор для ингаляций) (табл.16) [1,2,89,175,176,201,216,220].
(УУР – C, УДД – 5).
- После основного курса антибактериальной терапии рекомендовано назначать #Колистиметат натрия (раствор для ингаляций) на 3 месяца. Можно использовать #Сульфаметоксазол + Триметоприм** (табл.16) в течение 1 месяца [1,2,89,175,176,201,216,217,218,219,220].
(УУР – C, УДД – 5).
- Рекомендовано при хронической инфекции Achromobacter spp. у пациентов с МВ применять длительно ингаляции (информация о препаратах – табл.16):
1-я линия: #Колистиметат натрия (раствор для ингаляций).
2-я линия: #Меропенем**.
Альтернативная терапия: #Цефтазидим** и #Тобрамицин (раствор для ингаляций или капсулы с порошком для ингаляций)**.
3-я линия: Для лечения обострений, обусловленных Аchromobacter spp., используют комбинацию двух антисинегнойных антибиотиков различных классов [1,2,89,175,176,201,216,217,218,219].
Курсы рекомендуется проводить 1 раз в 3 мес., при необходимости – чаще.
(УУР – C, УДД – 5).
Таблица 16. Антибактериальная терапия, применяемая у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета Achromobacter spp. [1,2,89,175,176,201,216,217,218,219].
Антибактериальные препараты | Суточная доза для детей | Суточная Доза для взрослых | Способ введения | Кратность введения |
|---|
#Цефтазидим** (форма для инъекционного применения) | В возрасте до 2 мес.: 25 – 50 мг/кг/сут., старше 2 мес. — 50–100 мг/кг/сут. | 2 г | Ингаляции | 2 |
#Цефтазидим ** | 300 мг/кг | 9 – 12 г | В/в | 3 |
#Меропенем** (форма для инъекционного применения) | 250 - 500 мг | - | Ингаляции | 2 |
#Меропенем** | 120 мг/кг | 6 г | В/в | 3 |
Пиперациллин + Тазобактам | 400 - 500 мг/кг | 13,5 г | В/в | 3 |
# Ко-тримоксазол [Сульфаметоксазол + Триметоприм] ** | 20 мг/кг (по триметоприму) | 2880 мг | В/в и внутрь | 3 |
#Доксициклин** | Дети с массой тела до 45 кг в первый день - 4 мг/кг, в последующие дни - 2-4 мг/кг. Детям с массой тела более 45 кг - как взрослым | 1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
#Хлорамфеникол** | 50-100 мг/кг | 2 – 4 г | Внутрь, в/в | 3-4 |
#Тиамфеникола глицинат ацетилцистеинат | 500 -1000 мг | 1000 мг | Ингаляции | 2 |
Колистиметат натрия | Детям 0-2 лет: 1-2 млн. ЕД, детям старше 2 лет 2-6 млн. ЕД | 2 – 6 млн ЕД (160 мг в 1 фл.) | Ингаляции | 2-3 |
Колистиметат натрия | Дети с массой тела до 40 кг: доза 75000 - 150000 ЕД/кг/сут., разделенная на три введения. Для детей с массой тела более 40 кг: применяются дозы, рекомендованные для взрослых и подростков | 6 млн. ЕД | В\в | 3 |
#Цефоперазон + [Сульбактам]** | 150-200 мг/кг | 8 г | В/в | 2 |
#Имипенем + [Циластатин]** | 50-100 мг/кг в день по имипенему | 2-4 г | В/в | 3-4 |
#Имипенем + [Циластатин]** | 250 -500 мг | - | Ингаляции | 2 |
#Миноциклин | Детям старше 8 лет назначают в начальной дозе 4 мг/кг массы тела, в дальнейшем - 2 мг/кг массы тела каждые 12ч | Средняя начальная доза препарата для взрослых составляет 0,2 г, в дальнейшем - 0,1 г каждые 12 ч | Внутрь | 2 |
#Тобрамицин** (раствор для ингаляций) (противопоказан детям до 6 лет жизни) | 600 мг | 600 мг | Ингаляции | 2 |
Примечания: при наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и приказ Минздрава России от 24 ноября 2021 г. №1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов»). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
3.1.3.7 Антибактериальная терапия микобактериоза
Микобактериоз легких – характеризуется наличием клинических и/или рентгенологических проявлений заболевания с обязательной микробиологической идентификацией нетуберкулезных микобактерий (НТМБ).
- Рекомендуется диагностически значимыми критериями микобактериоза у пациентов с МВ считать: положительный результат на наличие кислотоустойчивых микроорганизмов (КУМ) при микроскопии препаратов с окраской по Цилю-Нильсену или люминесцентными красителями, обнаружение ДНК НТМБ методом ПЦР, наличие роста НТМБ или МБТ на питательных средах и подтверждение одного и того же вида микобактерий как минимум из двух образцов диагностического материала [241,222,230], (Приказ Минздрава России от 21.03.2003 г. № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». (Приложение 11) Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностики и лечении туберкулеза).
(УУР – С, УДД – 5).
Комментарии: приоритетным является подтверждение/исключение наличия нетуберкулезных микобактерий в диагностическом материале методами с максимальной доступной чувствительностью и специфичностью. Чтобы минимизировать вероятность расхождения в результатах, полученных разными методами, комплексное исследование должно проводиться из одной пробы диагностического материала. При отсутствии мокроты или невозможности собрать мокроту (возраст ребенка), могут исследоваться другие виды диагностических материалов (смыв с ротоглотки, промывные воды бронхов, аспирационный материал, бронхоальвеолярный лаваж, браш-биоптат).
- Рекомендовано в случае обнаружения НТМБ в диагностическом материале проведение приема (осмотра, консультации) врача-фтизиатра или врача-пульмонолога/врача-педиатра первичные/повторные, имеющего опыт лечения микобактериозов и назначение схемы препаратов, контроля эффективности лечения (препараты и НР представлены в табл. 17 и 18) [224,230,447,448,449,450,451,452,453].
(УУР – C, УДД – 5).
Комментарии:
Таблица 17. АБП, применяемые у пациентов с муковисцидозом, микобактериозом, вызванным Micobacterium avium complex (MAC) и Mycobacterium abscessus complex (MABSC)
[Клинические рекомендации «Туберкулез у детей». РОФ, 2024 г..Согласованные рекомендации Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом. С-Пб.: Благотворительный фонд «Острова», 2017 г. – 32с. Редактор перевода Н. Ю. Каширская. ISBN 978-5-9906416-6-22,222,223,224].
Антибакериальный препарат | Суточная доза для детей | Суточная доза для взрослых | Способ введения | Кратность введения |
|---|
#Амикацин** | Детям: 15-25 мг/кг Подросткам: 15-25 мг/кг Максимальная доза: 1000 мг | 15 мг/кг | В/в | 1 |
#Амикацин** | 250-500 мг | 250-500 мг | Ингаляционно | 2 |
#Азитромицин** | Детям: 10-12 мг/кг Подросткам: дозировка для взрослых Максимальная дозировка: 500 мг | 250-500 мг | Внутрь | 1 |
#Цефокситин | 150 мг/кг (максимальная доза – 12 г/день) | 200 мг/кг (максимальная доза – 12 г/день) | В/в | 3-4 |
#Кларитромицин** | 7,5 мг/кг (максимальная доза – 500 мг) | 500 мг | Внутрь | 2 |
Не рекомендуется | 500 мг | В/в | 2 |
#Ко-тримоксазол [сульфаметоксазол + триметоприм]** | 10-20 мг/кг (по триметоприму) | 1920 мг | Внутрь | 2 |
В/в | 2 |
#Этамбутол** | детям: 15 мг/кг подросткам: 15 мг/кг | 15 мг/кг | Внутрь | 1 |
#Имипенем + [циластатин]** | Расчет дозы по имипенему: При массе тела до 40 кг – 60-120 мг/кг (максимальная доза – 2000 мг), | Расчет дозы по имипенему: Пациенты с массой тела ˃50 кг: 2-2,25 г (1 г х2 р /.дн. или 750 мг х 3р./ дн.) Пациенты с массой тела ˂50 кг – 30 мг/кг (15 мг/кг х 2 р./дн.) | В/в | 2-3 |
#Линезолид** | <12 лет: 10 мг/кг 12 лет и старше: 10 мг/кг (максимальная доза- 600 мг) | 600 -1200 мг | Внутрь | 1-2 |
<12 лет: 10 мг/кг 12 лет и старше: 10 мг/кг (максимальная доза- 600 мг) | 600 – 1200 мг | В/в | 1-2 |
#Моксифлоксацин** | 7,5-10 мг/кг (максимальная доза – 400 мг в день) | 400 мг | Внутрь | 1 |
7,5-10 мг/ (максимальная доза – 400 мг в день) | 400 мг | В/в | 1 |
#Миноциклин | 2 мг/кг (максимальная доза – 200 мг) | 100 мг | Внутрь | 1-2 |
#Доксициклин** (противопоказан детям до 8 лет) | <12 лет с массой тела ˂50кг: 4мг/кг 12 лет и старше: 200 мг | 200 мг | Внутрь | 2 |
#Рифампицин** | 10-20 мг/кг (максимальная доза – 600 мг) | <50 кг 450 мг >50 кг 600 мг | Внутрь | 1 |
Рифабутин** | 5-10 мг/кг (максимальная доза – 300 мг) | 150-300 мг 150 мг, если пациент принимает сильный ингибитор изофермента CYP3A4 450-600 мг, если пациент принимает сильный стимулятор CYP3A4 | Внутрь | 1 |
#Стрептомицин** | 20-40 мг/ (максимальная доза – 1000 мг) | 15 мг/кг (максимальная доза – 1000 мг) | В/в | 1 |
#Тигециклин** | 8-11 лет: 1,2 мг/кг (максимальная доза 50 мг) 12 лет и старше: ударная доза - 100 мг, затем – 50 мг | 100 мг | В/в | 2 |
#Бедаквилин1 | Вес ≥3 кг < 10 кг – 30 мг в течение 2 нед.; затем 10 мг 3 р./нед. (пн., ср., пт.) в течение 22 недель; Вес ≥10 кг < 15 кг – 60 мг в течение 2 нед.; затем 20 мг 3 р./нед. (пн., ср., пт.) в течение 22 недель; Вес ≥16 кг < 30 кг – 200 мг в течение 2 нед.; затем 100 мг 3 р./нед. (пн., ср., пт.) в течение 22 недель; Вес ≥ 30 кг - 400 мг ежедневно в первые 2 недели, затем 200 мг 3 р./нед. (пн., ср.. пт.) | 1 раз в сутки с 3 недели перерыв между приемом препарата не менее 48 часов | Внутрь | 1 |
Примечание: # - Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
1 - Назначается по решению врачебной комиссии в течение 6 мес. в дозах, указанных в таблице. Продление приема препарата более 6 мес. обосновывает врачебная комиссия. [Клинические рекомендации «Туберкулез у детей». РОФ, 2024., Панова Л.В., Овсянкина Е.С., Крушинская Е.А., Хитева А.Ю., Пискунова О.А. Эффективность и безопасность укороченных режимов химиотерапии у детей старшего возраста и подростков, больных туберкулезом органов дыхания с множественной и широкой лекарственной устойчивостью возбудителя. Туберкулез и болезни легких. 2021;99(10):35-39 DOI: 10.21292/2075-1230-2021-99-10-35-39, Макарова М.В., Михайлова Ю.Д., Хачатурьянц Е.Н., Литвинов В.И. Лекарственная чувствительность к бедаквилину штаммов М. kansasii, выделенных в противотуберкулезных учреждениях Москвы. Эпидемиология и Вакцинопрофилактика. 2023;22(3):64-69. https://doi.org/10.31631/2073-3046-2023-22-3-64-69].
Все препараты, применяемые при Micobacterium avium complex (MAC) и Mycobacterium abscessus complex (MABSC) назначаются вне инструкции (off-label) по жизненным показаниям [224, Клинические рекомендации «Туберкулез у детей». РОФ, 2024.].
Возрастные ограничения указаны в дозировках для детей, диапазон дозировок представлен в соответствии с инструкцией к препарату, расчет приводится в соответствии с Клиническими рекомендациями РОФ «Туберкулез у детей», 2024 г. и Согласованными рекомендациями Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом [222,446,456].
Побочные реакции антибактериальных препаратов и рекомендуемые методы контроля представлены в таблице 18 [222,456]
Таблица 18. Важные побочные/токсические действия антибактериальных препаратов системного действия и рекомендуемые методы контроля за бактериями MAC и MABSC при МВ [1,2,189,222,223,224].
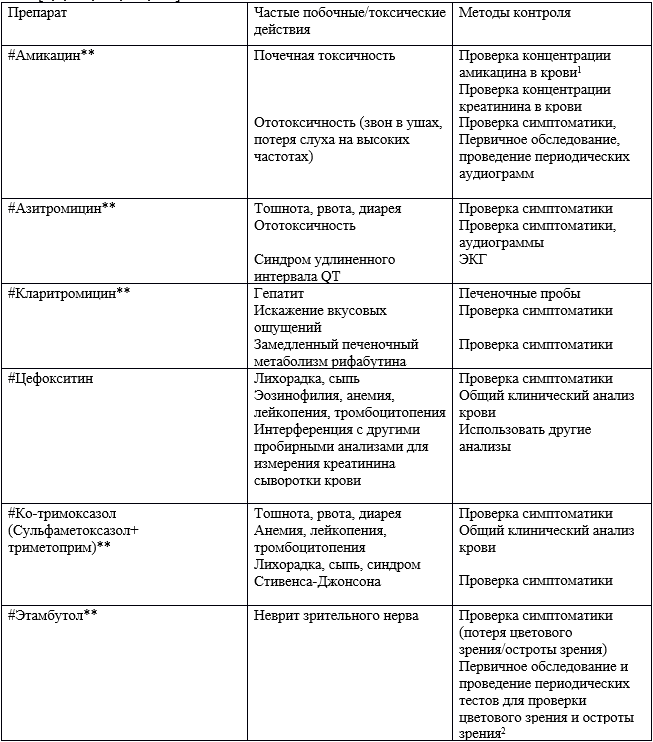
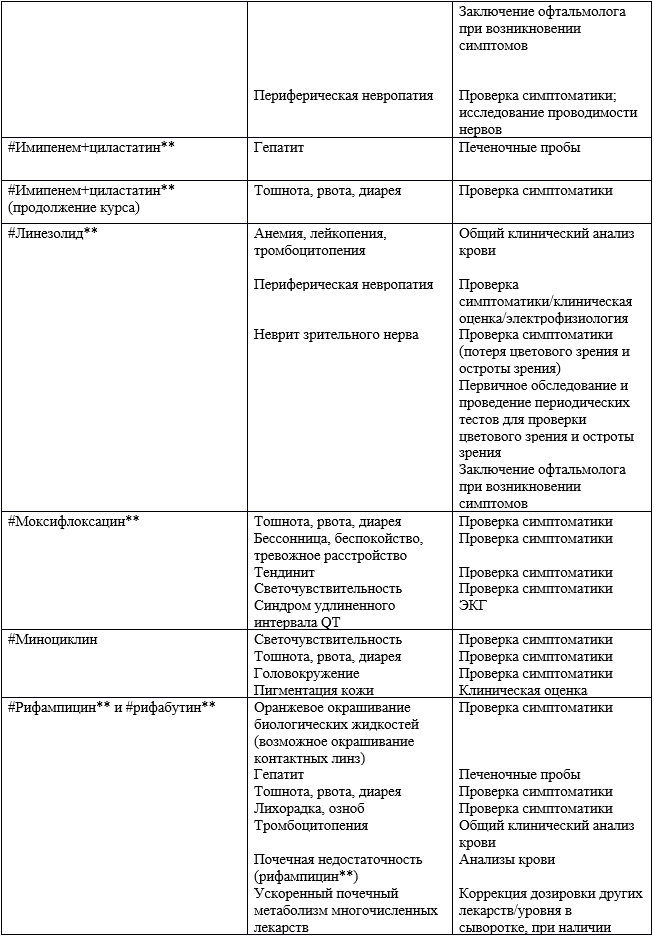
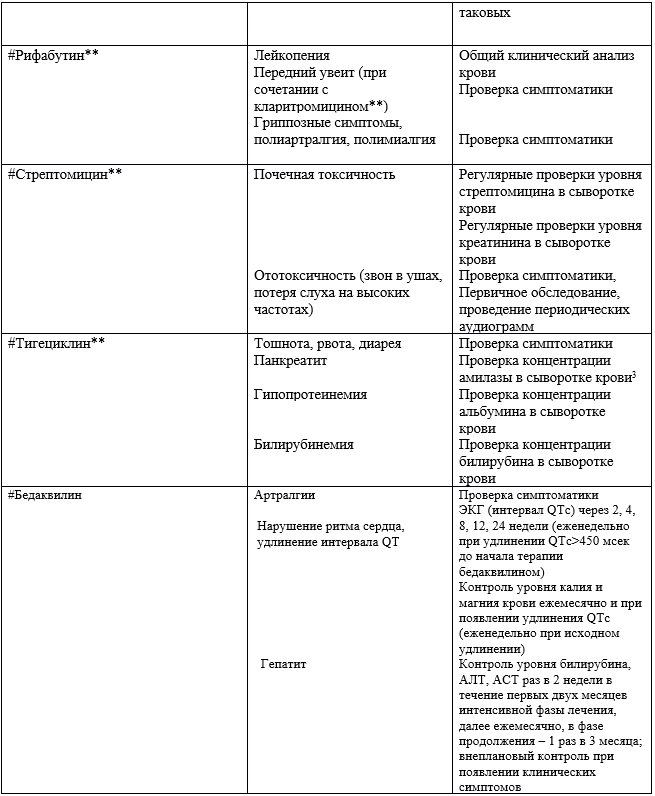
1 - Для получения максимального уровня в 20-30 µг/мл и минимального уровня <5-10 µг/мл.
2 - При приеме 25 мг/кг/день необходимо проходить ежемесячные осмотры (Прием (осмотр, консультация) врача-офтальмолога первичный и Прием (осмотр, консультация) врача-офтальмолога повторный).
3 - У лиц с почечной достаточностью.
- Рекомендуется при назначении лечения пациентам с микобактериозом применять персонализированный подход с учетом:- теста на лекарственную чувствительность НТМБ (Определение чувствительности к антимикробным препаратам микроорганизмов, выделенных из бронхоальвеолярной лаважной жидкости/Определение чувствительности к антибактериальным препаратам микроорганизмов, выделенных из мокроты);- массивности и длительности бактериовыделения;- сопутствующих заболеваний, являющихся противопоказанием к назначению определенных групп АБП;- выраженности клинических проявлений (лихорадка, кашель с мокротой, одышка, кровохарканье и др.);- рентгенологических изменений (очаги, инфильтративные изменения, полости распада легочной ткани);- переносимости АБПс целью прекращения размножения микобактерий и предотвращения развития лекарственной устойчивости, рассасывания очаговых и инфильтративных изменений, закрытия полостей распада в легких; а также восстановления функциональных возможностей организма [224,230,447,448,450,451,452,453,454].
(УУР – С, УДД – 5).
Комментарии: антибактериальные препараты системного действия назначают в максимальных терапевтических дозах, соответствующих возрасту и массе тела ребенка.
Лечение проводится в 2 фазы:
интенсивная фаза – направлена на ликвидацию клинических проявлений заболевания, максимальное воздействие на популяцию НТМБ с целью прекращения размножения микобактерий и предотвращения развития лекарственной устойчивости, рассасывание очаговых и инфильтративных изменений, закрытие полостей распада в легких;
фаза продолжения – направлена на подавление сохраняющейся микобактериальной популяции, обеспечивает дальнейшее уменьшение воспалительных изменений, а также восстановление функциональных возможностей организма.
- Рекомендуется критериями эффективного лечения микобактериоза и завершения интенсивной фазы считать: исчезновение клинических проявлений заболевания и/или выраженную рентгенологическую динамику через 3 месяца (рассасывание инфильтративных изменений и очагов, закрытие каверн); прекращение бактериовыделения по данным микроскопии и/или культурального исследования диагностического материала (мокрота, смыв с ротоглотки) на НТМБ [447,448,452,453].
(УУР – С, УДД – 5).
- Не рекомендуется считать критерием неэффективного лечения микобактериоза обнаружение КУМ, ДНК НТМБ, выявление роста культуры НТМБ в образцах диагностического материала (мокрота, смыв с ротоглотки) при проведении динамического микробиологического мониторинга, если отсутствуют клинические проявления и отмечена положительная рентгенологическая динамика воспалительного процесса в легких [222,447].
(УУР – С, УДД – 5).
- Рекомендуется в фазу продолжения лечения микробиологическое исследование диагностического материала проводить с интервалом 2 мес. до окончания лечения [224].
(УУР – C, УДД – 5).
Комментарии: продолжительность лечения микобактериоза определяется индивидуально. Общий срок химиотерапии не менее 6 мес., критерии завершения: отсутствие клинических проявлений, стабильная рентгенологическая картина при динамическом наблюдении с интервалом 3 мес. [447,452,453].
- После завершения лечения микобактериоза рекомендуется постоянное наблюдение за состоянием пациента и регулярное, не реже чем 1 раз в 6 месяцев микробиологическое исследование на наличие или отсутствие НТМБ в диагностическом материале [224,84].
(УУР – C, УДД – 5).
Комментарии: в случае рецидива микобактериоза рекомендуется повторное проведение лечения. Рецидив микобактериоза – появление клинических и/или рентгенологических проявлений заболевания в сочетании с положительными результатами микробиологического исследования диагностического материала на НТМБ.
- Не рекомендуется считать рецидивом микобактериоза – обнаружение в диагностическом материале НТМБ, при отсутствии клинических и/или рентгенологических проявлений заболевания с целью избегания нерациональной терапии [447,452,453].
(УУР – C, УДД – 5).
Комментарии: принятие решения о лечении остается трудным, существует значительная неопределенность в отношении потенциальной пользы терапии и рисков развития побочных реакций от проведения длительной антимикробной терапии [447,452,453,455].
Противомикробные препараты, применяемые у пациентов с микобактериозом, вызванным Micobacterium avium complex (MAC) и Mycobacterium abscessus complex (MABSC) представлены в таблице 17 [222,446,456,457].
3.1.3.7.1 Антибактериальная терапия микобактериоза, вызванного M. abscessus
- Рекомендовано пациентам с МВ и микобактериозом, вызванным представителями M.abscessus complex проводить двухфазное лечение – фаза интенсивного лечения должна сменяться фазой поддерживающего лечения с целью эрадикации данного возбудителя (табл.17,19) [222,223,224,230,446,447,457].
(УУР – C, УДД – 5).
Таблица 19. Фазы лечения при микобактериозах, вызванных M. аbscessus complex (дозы см. в таблице 17)
ФАЗЫ ЛЕЧЕНИЯ* |
|---|
ИНТЕНСИВНАЯ | ПРОДОЛЖЕНИЯ |
#Азитромицин** внутрь #Амикацин** внутривенно #Тигециклин** внутривенно [#имипенем+циластатин**] внутривенно [#цефокситин] внутривенно [#бедаквилин]** внутрь | #Азитромицин** внутрь #Амикацин** в ингаляциях #Миноциклин внутрь [#моксифлоксацин]** внутрь [#линезолид**] внутрь |
#Азитромицин** внутрь #Амикацин** внутривенно #Тигециклин** внутривенно [#имипенем + циластатин**] внутривенно [#цефокситин] внутривенно [#бедаквилин]** внутрь | #Азитромицин** внутрь #Амикацин** в ингаляциях #Миноциклин внутрь [#моксифлоксацин]** внутрь [#линезолид**] внутрь |
|
* длительность каждой фазы и количество АБП в схеме определяются индивидуально с учетом клинической, рентгенологической и микробиологической динамики заболевания;
в квадратных скобках указаны препараты, которые можно использовать в случае резистентности НТМБ к #азитромицину**, #амикацину**, #тигециклину**, #миноциклину.
Комментарии: - интенсивная фаза должна включать ежедневный пероральный прием минимум трех АБП, что определяется результатами тестов на чувствительность НТМБ к антибиотикам,
- фаза продолжения лечения должна включать ежедневный прием минимум двух АБП,
- при необходимости продления назначения амикацина более трех месяцев, возможно назначение его в ингаляциях (лекарственная форма для инъекций) [174].
- Категорически не рекомендуется применение монотерапии любым противомикробным средством системного действия при лечении микобактериоза, с целью предотвращения развития резистентности НТМБ [222,223,224,448,450,452].
(УУР – C, УДД – 5).
Комментарии: длительность фазы продолжения зависит от клинической и рентгенологической динамики (стабилизация рентгенологической картины при сравнении результатов через 3 месяца лечения).
3.1.3.7.2 Антибактериальная терапия микобактериозов, вызванных MAC (Mycobacterium avium complex)
- Рекомендовано пациентам с микобактериозом, вызванным МАС (Mycobacterium avium complex) проводить двухфазное лечение – фаза интенсивного лечения должна сменяться фазой продолжения лечения с целью прекращения размножения микобактерий и предотвращения развития лекарственной устойчивости, рассасывания очаговых и инфильтративных изменений, закрытия полостей распада в легких; а также восстановления функциональных возможностей организма [222,452,458] (табл. 20,17).
Таблица 20. Фазы лечения при микобактериозах, вызванных МАС (дозы см. в табл. 17)
ФАЗЫ ЛЕЧЕНИЯ* |
|---|
ИНТЕНСИВНАЯ | ПРОДОЛЖЕНИЯ |
#азитромицин** внутрь #амикацин** ингаляции #рифампицин** внутрь #этамбутол** внутрь [#моксифлоксацин]** внутрь [#бедаквилин]** внутрь | #азитромицин** внутрь #амикацин** ингаляции #рифампицин** внутрь #этамбутол** внутрь [#моксифлоксацин]** внутрь |
- * длительность каждой фазы и количество АБП в схеме определяются индивидуально с учетом клинической, рентгенологической и микробиологической динамики заболевания;
- в квадратных скобках указан препарат, который можно использовать в случае резистентности НТМБ к вышеперечисленным препаратам;
- В случае с чувствительной к #кларитромицину** формой поражения нетуберкулезными микобактериями легких (НТМБ) группы MAC рекомендовано применять лекарственную схему лечения на основе ежедневного перорального приема макролида (предпочтительно #азитромицина**), #рифампицина** и #этамбутола** (табл. 17) [222,230,452,453,458].
(УУР –С; УДД – 5).
Комментарии: интенсивная фаза должна включать ежедневный пероральный прием макролида (предпочтительно #азитромицина**) в сочетании с #амикацином внутривенно/внутримышечно на протяжении 3-12 недель, а также одного или нескольких из следующих препаратов: #рифампицин**, #этамбутол**, #моксифлоксацин**, #бедаквилин**.
- Категорически не рекомендуется применение монотерапии любым противомикробным средством системного действия при лечении микобактериозов группы MAC пациентов с МВ с целью профилактики развития резистентности [222,223,224,230,452,453].
(УУР – С; УДД – 5).
Комментарий: длительность фазы продолжения зависит от клинической и рентгенологической динамики (стабилизация рентгенологической картины при сравнении результатов через 3 месяца лечения) [447].
3.1.4 Терапия поражений легких, вызванных грибами рода Aspergillus
Результаты проведенного в НИИ медицинской микологии им. П.Н. Кашкина в 2014-2017 гг. исследования свидетельствуют, что колонизация дыхательных путей Aspergillus spp. возникает у 22% пациентов с МВ, а различные варианты аспергиллеза - 9,2% [242].
Наиболее частый вариант аспергиллеза у пациентов с МВ - аллергический бронхолегочный аспергиллез (АБЛА). Частота АБЛА у подростков и взрослых пациентов с МВ – 10-15%, реже у детей младшего возраста [39,40].
ХАЛ развивается у 2-5% пациентов с МВ. Инвазивный аспергиллез легких у пациентов с МВ возникает редко (0,5-1%) [242].
Грибы рода Aspergillus могут колонизировать дыхательные пути пациентов с МВ или вызывать, в зависимости от состояния иммунной системы пациента, аллергический бронхолегочный аспергиллез (АБЛА), хронический аспергиллез легких (ХАЛ) и инвазивный аспергиллез (ИА) [16,38,85,86].
- Рекомендовано применение противогрибковых препаратов системного действия как этиотропной терапии при АБЛА и ХАЛ (табл. 21) [16,38,85,86].
(УУР – С, УДД – 5).
Таблица 21 Противогрибковые препараты системного действия, применяемые при АБЛА и ХАЛ [16,38,85,86]
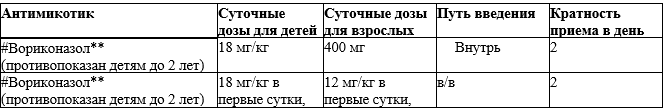

Примечания: # - Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия пациента, родителей (законных представителей) или ребенка в возрасте старше 15 лет.
1 - В дальнейшем при хорошей переносимости прием препарата разрешен в амбулаторных условиях.
2 - Ингаляции #Амфотерицина В [липосомального] или #Амфотерицина В [Липидного комплекса] могут быть альтернативой или дополнительной противогрибковой терапией в лечении AБЛA и ХАЛ при недостаточной эффективности терапии противогрибковыми препаратами системного действия, непереносимости производных триазола (азольных противогрибковых препаратов) или потенциально опасных лекарственных взаимодействиях [175,243,244], а также колонизации дыхательных путей грибами Aspergillus spp. в случае высокого риска развития аспергиллеза.
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и пункт 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14.01.2019 №4н). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
При использовании #вориконазола** и других средств группы триазолов всегда следует учитывать возможность лекарственных взаимодействий. Например, при назначении #вориконазола** следует отменить рифампицин** или другие индукторы ферментов цитохрома Р-450 (ингибиторы протонной помпы, карбамазепин**, фенитоин**), поскольку в этих случаях терапевтическая концентрация #вориконазола** в плазме и тканях обычно не достигается.
У пациентов, получающих длительную терапию #вориконазолом**, могут развиться кожные реакции фоточувствительности. Во время лечения пациентам рекомендуется избегать интенсивного или длительного облучения прямым солнечным светом.
Терапия АБЛА
- При АБЛА рекомендовано применение кортикостероидов системного действия и противогрибковых препаратов системного действия подгруппы «производные триазола и тетразола» (#вориконазол** и #итраконазол) (табл.21) с терапевтической целью [38,85,245,246].
(УУР – C, УДД – 5).
Комментарий: #позаконазол** применяют при непереносимости или невозможности применения #вориконазола** или #итраконазола.
Использование кортикостероидов системного действия рекомендовано при выраженном бронхообструктивном синдроме (БОС), наличии эозинофильных инфильтратов в легких или неэффективности применения противогрибковых лекарственных средств группы триазолов [38,85,245].
Для купирования бронхообструктивного синдрома и эозинофильных инфильтратов в легких назначают преднизолон** по 0,5–1,0 мг/кг/сут. или другой кортикостероид системного действия в эквивалентной дозе (например, метилпреднизолон**) в течение 14 дней в зависимости от степени бронхообструктивного синдрома. Последующее снижение дозы (от 5 до 10 мг каждые две недели) в течение 1-3-5 месяцев. Продолжительность лечения зависит от активности и тяжести заболевания. Низкая поддерживающая доза (от 5,0 до 7,5 мг/сут.) может потребоваться в течение длительного времени для контроля заболевания и предотвращения рецидивов у некоторых пациентов [247,248].
Критериями эффективности служат купирование клинических признаков, исчезновение эозинофильных инфильтратов в легких и снижение уровня общего IgE в сыворотке крови. После достижения эффекта постепенно снижают дозу препарата вплоть до отмены в течение 3-4 недель.
Во время ремиссии пациенты в специфической терапии не нуждаются.
При рецидиве АБЛА вновь применяют #вориконазол** или #итраконазол (табл.21) в течение 2–4 мес., при выраженном БОС – преднизолон** или метилпреднизолон**.
Кроме рецидива АБЛА показаниями к назначению триазолов является зависимость от кортикостероидов для системного применения, их недостаточная эффективность и выраженные нежелательные эффекты.
Применение противогрибковых препаратов системного действия подгруппы «производные триазола и тетразола» у пациентов АБЛА позволяет достоверно уменьшить применение кортикостероидов для системного применения, приводит к улучшению функции внешнего дыхания и уменьшению частоты рецидивов АБЛА.
Терапия ХАЛ
- Рекомендовано в качестве лечения ХАЛ у пациентов с МВ использовать длительный курс противогрибковых лекарственных средств, лечение «фонового» заболевания и уменьшение ятрогенной иммуносупрессии, а также хирургического удаления очагов поражения. [14,16,17].
(УУР – C, УДД – 5).
Комментарий: пациенты с ХАЛ нуждаются в длительном наблюдении для контроля заболевания и своевременного лечения рецидива. Основу антимикотической терапии составляет применение пероральных #вориконазола** или #итраконазола (табл.21)). #Позаконазол** применяют при непереносимости или невозможности применения #вориконазола** или #итраконазола. #Каспофунгин** (табл.21), а также #амфотерицин В [липосомальный] или #амфотерицин В [Липидный комплекс] или обычный (табл. 21) назначают в/в при неэффективности пероральных противогрибковых лекарственных средств группы триазолов.
Альтернативный метод лечения – #внутриполостное введение амфотерицина В** [459,460]. Общая доза #амфотерицина B**, необходимая для излечения неясна: сообщается о 50 мг ежедневно в течение 10 дней, 50 мг ежедневно в течение как минимум 15 дней [461,462,463]. Общая доза амфотерицина B** может варьировать от 250 мг до 1085 мг [464], введение по 5 мг/сут. #амфотерицина B** с постепенным повышением дозы до 50 мг/сут. в 20 или 5 мл 5% декстрозы (всего 3 г #амфотерицина B** в течение 60 дней), возникающий кашель возможно купировать введением 1% #лидокаина** 2-4 мл перед введением #амфотерицина B**.
Важной составляющей лечения ХАЛ у больных МВ является улучшение экспекторации мокроты.
Коррекция иммунного дефекта обычно достигается успешным лечением основного заболевания и снижением дозы кортикостероидов для системного применения.
Хирургическое вмешательство – важный компонент комплексного лечения ХАЛ. Однозначным показанием является высокий риск или развитие легочного кровотечения. Чтобы уменьшить вероятность инфицирования тканей и развития специфической эмпиемы плевры, до и после оперативного лечения применяют #вориконазол** или #итраконазол (хирургическому лечению могут препятствовать распространенность поражения, тяжесть состояния пациента и выраженная дыхательная недостаточность, а также множественные аспергилломы. Частота осложнений (кровотечение и пр.) при оперативном лечении может достигать 5–20%.
3.1.5 Терапия внешнесекреторной недостаточности поджелудочной железы
- Заместительную терапию панкреатином**, (в виде минимикросфер, с рН-чувствительным покрытием без применения метакриловой кислоты [249,250,251,252,253] с или без желатиновой капсулы) рекомендовано назначать всем пациентам, включая новорождённых с МВ, имеющим клинические проявления кишечного синдрома или низкую концентрацию панкреатической эластазы-1 в кале (<200 мкг/г) при отсутствии противопоказаний. Цель вмешательства – коррекция внешнесекреторной панкреатической недостаточности (по клиническим показателям и отсутствие нейтрального жира в копрограмме) [2,18,251,252,253,254].
(УУР – B, УДД – 3).
Комментарий: при проведении заместительной терапии необходимо контролировать:
- показатели копрограммы, в первую очередь количество нейтрального жира;
- частоту и характер стула;
- ежемесячную прибавку массы тела и динамику роста пациента.
Для восстановления адекватной ассимиляции жира следует применять высокоэффективные ферментные препараты в виде минимикросфер, что в большинстве случаев позволяет компенсировать стеаторею и уменьшить дефицит массы тела.
Показания: все пациенты с признаками недостаточности экзокринной функции поджелудочной железы (стеаторея (нейтральный жир в копрограмме), снижение панкреатической эластазы-1 менее 200 мкг/г).
Противопоказания: индивидуальная непереносимость.
Выбор пути введения: внутрь до и во время каждого приема пищи. Панкреатические ферменты не следует назначать после еды. Капсулы, содержащие минимикросферы, можно вскрывать и принимать их содержимое одновременно с небольшим количеством пищи, или принимать целиком, не вскрывая, если ребенок уже достаточно большой и может проглотить капсулу.
Оценка эффективности лечения: к клиническим показателям адекватной дозировки панкреатических ферментов следует отнести: улучшение прибавки веса детей, уменьшение объема стула, его частоты, уменьшение зловонного запаха, исчезновение болей в животе. Лабораторные показатели – уменьшение степени стеатореи.
Оценка безопасности лечения - по клиническим признакам.
Дополнительные замечания:
Подбор доз панкреатических ферментов проводится эмпирически.
o Доза панкреатина** индивидуальна для каждого пациента.
o У большинства пациентов доза должна оставаться меньше или не превышать 10 000 ЕД по липазе на 1 кг массы тела в сутки или 4000 ЕД на 1 г потребленного жира.
o Подбор дозы можно начать в зависимости от массы тела, что составляет в начале лечения 1000 ЕД/кг по липазе на каждый прием пищи для детей младше четырех лет и 500 ЕД/кг по липазе во время приема пищи для детей старше четырех лет и взрослых. В дальнейшем доза может постепенно повышаться до нормализации симптомов стеатореи. Дозу следует определять также в зависимости от выраженности кишечного синдрома, результатов контроля за стеатореей и поддержания адекватного нутритивного статуса.
o Новорожденным на каждые 120 мл питания (смесь или женское молоко) стартовая доза рассчитывается как 2500-3333 ЕД липазы (1/4-1/3 капсулы препарата с активностью 10 000 ЕД липазы в капсуле) [11,12,37]. В настоящее время рекомендуется подсчет панкреатических ферментов по потребляемому жиру с расчетом коэффициента на 1 г жира. Доза рассчитывается индивидуально. Допустимые значения коэффициента от 500 до 4000 ЕД на 1 г жира, в среднем 1800 ЕД липазы на 1 г жира [255 ].
o У ряда пациентов, особенно при белково–энергетической недостаточности, гиперацидности и других состояниях, может понадобиться повышенная доза панкреатина более 10 000 ЕД по липазе на 1 кг массы тела в сутки или 4000 ЕД на 1 г потребленного жира [256,257,258,259,260,261,262,263,264].
o Не следует повышать дозу ферментов до очень высокой (>18000-20000 Eд липазы/кг в сутки). В дальнейшем доза подвергается коррекции на основе клинических симптомов и лабораторных данных. Следует помнить, что примерно у 10% пациентов недостаточность поджелудочной железы не поддается полной коррекции [18].
o Эффективность терапии панкреатическими ферментами иногда можно повысить при одновременном применении эзомепразола** (пеллеты - противопоказаны по инструкции детям до 1 года, таблетки противопоказаны детям до 12 лет. Данные препараты могут быть назначены в случае потребности значительного увеличения доз панкреатических ферментов и/или при отсутствии их лечебного эффекта, что может быть обусловлено повышенной кислотностью желудочного сока и недостаточным ощелачиванием химуса в 12-перстной кишке [21,89].
- Не рекомендуется рутинное использование ингибиторов протонного насоса (ИПН) с целью повышения эффективности ферментов [465,466].
(УУР – C, УДД – 5).
Комментарии: исследование у детей и взрослых с МВ показало, что длительное применение ингибиторов протонного насоса может повышать риск легочной инфекции, не улучшая при этом нутритивный статус [466].
3.1.6 Терапия эндокринной недостаточности поджелудочной железы (МАСД)
Лечение диабета при МВ (МАСД) в целом должно соответствовать стандартам помощи всем пациентам с диабетом; но имеются особые требования к лечению пациентов с муковисцидозом [49,91].
- Рекомендовано лечение пациентов с МАСД у специалистов многопрофильной команды, имеющей опыт работы с МАСД, и при этом поддерживать контакт и консультироваться со специалистами по муковисцидозу с целью эффективного ведения пациентов с учетом особенностей основного заболевания [49,91].
(УУР – C, УДД – 5).
- При лечении МАСД рекомендуется обучение самостоятельному уходу при диабете, инсулинотерапия и аэробная нагрузка не менее 150 мин в неделю с целью адекватного контроля МАСД и предотвращения осложнений [49,91].
(УУР – C, УДД – 5).
- Рекомендовано соблюдение рекомендаций по питанию пациентов с муковисцидозом для пациентов с МАСД. Изменение потребления калорий, жиров, белков, углеводов или соли в результате диагностики диабета не допускается. Рекомендуется равномерное распределение углеводов в течение суток и замена рафинированных на защищенные с целью поддержания нутритивного статуса [49,91].
(УУР – C, УДД – 5).
- Рекомендуется лечить МАСД у пациентов с МВ инсулинами (АТХ Инсулины и их аналоги), а не препаратами группы «Гипогликемические препараты, кроме инсулинов» с целью оптимального контроля уровня глюкозы в крови [49,91,265,266].
(УУР – C, УДД – 5).
Комментарий: эффективность препаратов группы «Гипогликемические препараты, кроме инсулинов» для терапии МАСД не доказана. При лечении МАСД рекомендуется применять болюсную схему приема инсулинов и их аналогов. Может применяться стандартный режим базально-болюсного введения инсулинов, включая комбинацию базального (Инсулины и аналоги длительного действия) и быстродействующего (Инсулины и аналоги быстрого действия) инсулина путем многократных ежедневных подкожных инъекций или быстродействующего инсулина (Инсулины и аналоги быстрого действия) путем непрерывной подкожной инфузии (инсулиновая помпа). Пациентов следует научить устанавливать дозу инсулинов в соответствии с содержанием углеводов в их пище.
Есть очень ограниченные данные об использовании препаратов группы «Гипогликемические препараты, кроме инсулинов» при МАСД. Из данной группы, зарегистрированных на территории Российской Федерации изучены производные сульфонилмочевины, метформин**, прочие противогликемические препараты (репаглинид**) и тиазолидиндионы. Эффект не доказан.
Аналоги глюкагоноподобного пептида-1(инкретины или инкретинмиметические агенты) могут играть важную роль, но пока требуется провести дополнительные исследования, чтобы вынести доказательные рекомендации.
- Во время обострений легочного процесса рекомендуется чаще проверять уровень гликемии (до 3-6 раз в день), которая повышается на фоне воспаления и увеличить дозу инсулина, как болюсного, так и базисного с целью оптимального контроля уровня глюкозы в крови и своевременной коррекции дозы инсулинов [49,91].
(УУР – C, УДД – 5).
Комментарий: пациентам с муковисцидозом при нарушении толерантности к глюкозе (НТГ), особенно во время обострения заболевания также может потребоваться инсулиновая терапия.
- Рекомендуется проведение мониторинга осложнений МАСД согласно мониторингу других форм диабета для организации профилактических мероприятий [49,91].
(УУР – C, УДД – 5).
3.1.7 Терапия поражения печени
- Рекомендуется назначение препаратов урсодезоксихолевой кислоты** (УДХК) (противопоказание до 3 лет для капсул, нет противопоказаний для суспензии для приема внутрь) пациентам с МВ с целью терапии имеющихся поражений печени, при наличии ЖКБ или угрозы ее развития при отсутствии медицинских противопоказаний [1,2,21,267,268,467].
(УУР – C, УДД – 5).
Комментарий: противопоказания: индивидуальная непереносимость, острые воспалительные заболевания желчного пузыря.
Выбор лекарственных форм: препараты, выпускаемые в виде капсул и сиропа (для детей с массой до 34 кг), дозировка 15-30 мг/кг в сутки.
Оценка эффективности лечения: клинически и по данным УЗИ и фиброэластографии (1 раз в 12 месяцев) (см. Раздел 2. «Диагностика»).
Оценка безопасности лечения: необходим периодический (2 раза в год) контроль активности аланинаминотрансферазы, аспартатаминторансферазы, щелочной фосфатазы в крови (см. Раздел 2. Диагностика).
В настоящее время, убедительных доказательных данных о предотвращении развития фиброза и цирроза на фоне приема УДХК нет [269].
Пациентам с МВ рекомендуется минимизировать применение гепатотоксичных лекарственных средств, исключение алкоголя [2,268].
- Рекомендовано при развитии хронической печеночной энцефалопатии, асцита, варикозно-расширенных вен пищевода и желудка 3-4 степени и кровотечения из них проводить терапию согласно соответствующим клиническим рекомендациям [2,268,270].
(УУР – С, УДД – 5).
Комментарии: формирование таких осложнений встречаются нечасто, но, тем не менее, требуют экстренных мер лечения. Ряду пациентов может понадобиться трансплантация печени (см.раздел 3.4 «Хирургическое лечение»), в настоящее время в Российской Федерации проведено 22 трансплантации.
3.1.8 Терапия остеопороза у пациентов с МВ
Задачами лечения остеопороза являются: предотвращение переломов костей, повышение качества жизни, замедление или прекращение потери костной массы, у детей - обеспечение нормального роста.
- Рекомендовано лечение основного заболевания при вторичном остеопорозе у пациентов с МВ [35,96,125,271].
(УУР – С, УДД – 5).
- Колекальциферол**, в том числе, в виде капель для приема внутрь, рекомендован всем пациентам с МВ в качестве терапии недостаточности витамина D в виде приема один раз в день ежедневно или один раз в неделю (в эквивалентных дозах) для поддержания концентрации 25(ОН)D сыворотки не менее 30 нг/мл (75 нмоль/л) (табл. 22) [96,272,273,274].
(УУР – С, УДД –5).
Комментарии:
Таблица 22. Профилактические дозы колекальциферола** (витамина D3) и рекомендации по лечению дефицита витамина D у детей и взрослых с МВ (ЕД)
Возраст, годы | Профилактическая доза, МЕ | Максимальная лечебная доза, МЕ |
|---|
0-3 | 1500-2000 | 2000 |
4-10 | 2000-3000 | 4000 |
11-18 | 2000-4000 | 10000* |
>18 | 2000-4000 | 10000* |
Примечание: * - при низких значениях 25(OH)D дозы могут быть увеличены.
- Рекомендовано терапию остеопороза при МВ проводить согласно клиническим рекомендациям по остеопорозу [35,125,271].
(УУР – С, УДД –5).
Комментарий: вопрос о применении бифосфонатов решается в индивидуальном порядке с учетом минеральной плотности костной ткани, малотравматичных переломов в анамнезе и трансплантационного статуса.
При лечении бифосфонатами у пациентов с МВ получены доказательства увеличения МПК, однако малое число наблюдений не позволило выявить снижение риска переломов при длительности лечения 2 года [275].
Длительность лечения бифосфонатами определяется индивидуально. Назначаются бифосфонаты в детской практике решением консилиума врачей или при разрешении Этического комитета и подписании информированного добровольного согласия родителями ребенка [276].
3.1.9 Терапия хронического риносинусита и назального полипоза
- Рекомендуется ирригационная терапия при наличии ХРС [122,277].
(УУР – A, УДД – 1).
Комментарии: промывания полости носа проводятся изотоническими (0,9%) или гипертоническими (3%) солевыми растворами 2 раза в сутки (или чаще по показаниям) ежедневно перед проведением ингаляций в полость носа.
- Рекомендуется терапия кортикостероидами в виде назального спрея при наличии назального полипоза [96,278,279].
(УУР – А, УДД – 1).
Комментарии: доказана эффективность в отношении уменьшения размера полипов; предпочтение следует отдавать кортикостероидам в виде назального спрея с наименьшей степенью системной абсорбции (мометазона фуроат в дозе 400 мкг в сутки у взрослых, 200 мкг в сутки у детей с 2-х лет, длительными курсами от 2 до 12 месяцев, в некоторых случаях – дольше), в т.ч. после ринохирургического лечения.
Терапия хронического полипозного риносинусита дорназой альфа** - см. раздел 3.1.2 «Муколитическая терапия».
3.1.10 Консервативная терапия легочного кровотечения и кровохарканья
Легочное кровотечение встречается ежегодно у 2,0% взрослых пациентов (регистр 2023 г.), кровохарканье разной интенсивности встречается чаще. Причина развития этих осложнений заключается в ремоделировании легочной ткани и развитии патологически извитых и увеличенных бронхиальных артерий. В ряде случаев ангиографически не подтверждается развитие патологических бронхиальных артерий и причиной кровохарканья является эрозивное поражение слизистой бронхоэктазов. Лечебные мероприятия включают в себя снижение активности гнойного воспаления в бронхах, гемостатическую терапию и хирургическое пособие.
- Рекомендовано в качестве гемостатической терапии пациентам с кровохарканьем применять этамзилат** (внутривенно или внутрь) и/или антифибринолитические средства: аминокапроновая кислота** и транексамовая кислота**. При неэффективности вышеперечисленных препаратов рекомендовано применение препаратов крови: свежезамороженная плазма, Фактор свертывания крови VIII**, факторы свертывания крови (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**, Эптаког альфа (активированный)**) [280,282,283,284].
(УУР – C, УДД – 5).
Комментарии: гемостатическая терапия назначается на несколько дней до купирования кровохарканья. На высоте легочного кровотечения дополнительный эффект может оказать обкладывание грудной клетки льдом.
- Рекомендовано при возникновении кровохарканья у пациентов с МВ на фоне манифестации обострения бронхолегочного процесса обязательное назначение противомикробных препаратов системного действия [280,283].
(УУР – C, УДД – 5).
Комментарии: необходимо помнить, что кровохарканье может быть следствием или усугубляться передозировкой гепарина натрия**, использующегося для промывания периферических венозных катетеров.
- Рекомендовано проведение бронхоскопии пациентам с кровохарканьем на фоне МВ по показаниям во время кровотечения/кровохарканья с целью выяснения источника кровотечения, как этап подготовки к дальнейшему хирургическому пособию, непосредственного купирования кровохарканья проведением бронхоблокации, санации трахеобронхиального дерева от сгустков крови при проведении искусственной вентиляции легких [280,283].
(УУР – C, УДД – 5).
Комментарии: в данной ситуации может потребоваться ригидная трахеобронхоскопия.
- При неэффективности консервативных методов, нарастании эпизодов кровохарканья и развитии легочных кровотечений пациентам с МВ рекомендовано хирургическое пособие [280,283].
(УУР – C, УДД – 5).
Комментарий: см. раздел 3.4 «Хирургическое лечение».
3.1.11 Терапия дыхательной недостаточности
Дыхательная недостаточность — это патологический синдром, при котором парциальное напряжение кислорода в артериальной крови меньше 80 мм рт.ст. (SpO2 95%) и/или парциальное напряжение углекислого газа больше 45 мм рт.ст.
По времени развития различают острую (нарастание симптомов в течение часов или дней) и хроническую (в течение недель или месяцев) ДН. С клинической точки зрения целесообразно еще выделять острую дыхательную недостаточность на фоне хронической (ОДН на фоне ХДН).
Причина развития хронической ДН у пациентов с МВ - структурные изменения легких, которые развиваются вследствие хронического бронхолегочного процесса и приводящие к снижению абсолютной площади газообмена. Причиной развития ОДН – обострение хронического гнойного бронхолегочного процесса в легких, легочное кровотечение, пневмоторакс. Причиной для развития ОДН могут быть и общими, в частности развитие вирусной пневмонии в разгар эпидемии гриппа.
Другим, важным компонентом в развитии ДН у пациентов с МВ является слабость и утомление дыхательной мускулатуры, очень часто сопровождающие тяжелое течение заболевания.
- Рекомендовано проведение оксигенотерапии при PaO2 <55 мм рт.ст. в покое, или при PaO2 <60 мм рт.ст. в покое, но при наличии отеков, полицитемии, легочной гипертензии [128,129].
(УУР – C, УДД – 5).
Комментарии: «золотой» стандарт диагностики нарушений газообмена Исследование кислотно-основного состояния и газов крови (путем забора крови из лучевой артерии - Взятие крови из артерии).
- Оксигенотерапия рекомендована не менее 15-24 часов в день.
- Целевой уровень: SpO2 90-92%.
- Рекомендована неинвазивная искусственная вентиляция легких (НИВЛ) при гиперкапнической дыхательной недостаточности у пациентов с МВ [285,286,287]. Цель проведения НИВЛ - нормализация или улучшение газообмена. К положительным эффектам НИВЛ также можно отнести эффект улучшения дренажа мокроты за счет значительного улучшения коллатеральной вентиляции [280,281].
(УУР – C, УДД – 5).
Комментарии: показания к НИВЛ при ОДН (при соблюдении трех условий):
- Тяжелая одышка, участие в дыхании вспомогательных мышц и парадоксальное дыхание.
- Частота дыхания>25 в минуту.
- Респираторный ацидоз (pH<7,35) и гиперкапния (PaCO2>45 мм рт.ст.)
- Выраженная гипоксемия (PaO2/FiO2)<200 мм рт.ст.
Показания для НИВЛ при ХДН:
- PaCO2>55 мм рт.ст.
- PaCO2 50-54 мм рт.ст. и эпизоды ночной гипоксемии.
- PaCO2 50-54 мм рт.ст. и частые госпитализации вследствие повторных обращений.
Подбор режима и параметров НИВЛ очень индивидуально и во много зависит от исходного состояния пациента.
Хроническая дыхательная недостаточность – является показанием для рассмотрения направления пациента на трансплантацию легких (см. раздел 3.4 «Хирургическое лечение»).
3.1.12 Консервативная терапия мекониевого илеуса
Формы мекониевого илеуса:
Неосложненная форма - плотный меконий формируется внутриутробно и забивает дистальные отделы тонкой кишки, вызывая дилатацию проксимальных, утолщение кишечной стенки и кишечную непроходимость.
При неосложненном мекониевом илеусе возможна консервативная терапия.
Осложненная форма обструкции кишки приводит к сегментарному завороту, атрезии, некрозу или перфорации кишки, мекониевому перитониту или происходит образование гигантской мекониевой псевдокисты.
Осложненный мекониевый илеус всегда требует экстренного хирургического лечения [21,288].
- Консервативная терапия мекониевого илеуса для ликвидации непроходимости кишечника у пациентов с МВ может быть рекомендована при соблюдении необходимых условий:
o Отсутствие рентгенологических признаков хирургических осложнений;
o Отсутствие патологического отделяемого из желудка;
o Отсутствие болевого синдрома;
o Компенсированный метаболический и волемический статус [123,289,290].
(УУР – C, УДД – 5).
Комментарии: консервативные мероприятия:
o Пероральное введение водорастворимого контрастного вещества с рентгенконтролем пассажа по ЖКТ (A06.17.002 Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке);
o Перорально муколитики (#ацетилцистеин** в разведении 1:5 в дозе 1,0 мл/кг);
o Высокая очистительная клизма с муколитиками - #ацетилцистеин** в разведении 3 мл на 200,0 мл раствора (0,9%) натрия хлорида** под ультразвуковым контролем заполнения кишечника или без такового максимально щадящим способом выверенным объемом жидкости;
o Повторное тугое контрастирование толстой кишки контрастным средством (водорастворимым) с созданием коло-илеального рефлюкса [289];
o При необходимости – вводятся препараты крови /плазма крови (В05А/В05АА).
3.1.13 Консервативная терапия синдрома дистальной интестинальной обструкции
- Терапия синдрома дистальной интестинальной обструкции (СДИО) у пациентов с муковисцидозом с целью восстановления пассажа кишечника – рекомендуется при отсутствии признаков кишечной непроходимости применение больших доз #ацетилцистеина** 600-1200 мг\сутки, лактулозы** от 5 до 45 мл в сутки в 3 приема в зависимости от возраста, обильное питье, гиперосмолярные растворы, нормализация режима и дозировки приема панкреатических ферментов [1,2,291,292].
(УУР – C, УДД – 5).
Комментарий: при неэффективности проводимой консервативной терапии, признаках кишечной непроходимости – оперативное лечение в соответствии с рекомендациями по кишечной непроходимости.
В настоящее время отсутствуют доказательства высокого уровня о преимуществе того или иного терапевтического вмешательства при СДИО ввиду небольшого числа исследований и редкости СДИО с кишечной непроходимостью у пациентов с МВ [293].
3.1.14 Терапия псевдо - Барттер синдрома
- Лечение развившегося ПБС у пациентов с МВ рекомендовано проводить препаратами калия хлорида**, калийсберегающими диуретиками для профилактики электролитных нарушений [1,2,89,90].
(УУР – C, УДД – 5).
Комментарии: пероральное введение хлорида калия** возможно при снижении калия от 3,5 до 3,0 ммоль/л, отсутствии изменений на ЭКГ. Внутривенная терапия - при снижении калия ниже 2,5 ммоль/л, при наличии изменений на ЭКГ, при длительном нарушении состояния ребенка.
Профилактика гипокалиемии: 1-2 ммоль/кг массы тела 7% раствора калия хлорида**, терапевтическая доза вводится внутривенно из расчета 2-4 ммоль/кг и более в зависимости от уровня калия в крови.
В комплексной терапии используются калийсберегающие диуретики – спиронолактон** (противопоказан детям до 3 лет) из расчета 1-3 мг/кг.
Отмена терапии проводится постепенно, после полной стойкой нормализации уровня электролитов в крови, при стабильных прибавках веса и под контролем концентрации электролитов в венозной крови.
3.1.15 Патогенетическая терапия (ивакафтор + лумакафтор**, ивакафтор + тезакафтор + элексакафтор и ивакафтор)
3.1.15.1 Патогенетическая терапия (ивакафтор + лумакафтор**)
- Рекомендуется применение комбинации ивакафтор + лумакафтор** (ивакафтор (потенциатор белка CFTR) + лумакафтор (корректор белка CFTR)) у пациентов с муковисцидозом гомозиготных по мутации F508del в гене CFTR с целью патогенетического лечения, повышения количества активного белка CFTR на поверхности клеток экзокринных желёз, повышения лёгочной функции, снижения частоты лёгочных обострений и замедления прогрессирования заболевания [117,294,295].
(УУР – A, УДД – 1).
Комментарии: комбинация ивакафтор + лумакафтор** показана для лечения муковисцидоза у пациентов в возрасте 2 лет и старше, гомозиготных по мутации F508del в гене CFTR (эффективность и безопасность комбинации ивакафтор + лумакафтор** установлена только у пациентов с муковисцидозом, гомозиготных по мутации F508del в гене CFTR). При отсутствии данных о гетерозиготном носительстве мутации F508del у родителей, рекомендуется дополнительное обследование (см. Раздел: «лабораторные диагностические исследования»).
Рекомендуемые дозировки ивакафтор + лумакафтор** представлены в таблице 23.
Таблица 23. Рекомендуемая дозировка препарата ивакафтор + лумакафтор** у пациентов в возрасте 2 лет и старше1.
Возраст | Доза | Общая суточная доза |
|---|
детский возраст 2-5 лет и масса тела менее 14 кг | одно саше ивакафтор + лумакафтор ивакафтор 125 мг/ лумакафтор 100 мг каждые 12 часов | Ивакафтор 250 мг/ лумакафтор 200 мг |
детский возраст 2-5 лет и масса тела 14 кг и более | одно саше ивакафтор + лумакафтор ивакафтор 188 мг/ лумакафтор 150 мг каждые 12 часов | Ивакафтор 376 мг/ лумакафтор 300 мг |
детский возраст 6-11 лет | 2 таблетки ивакафтор + лумакафтор** Ивакафтор 125мг/ Лумакафтор 100 мг каждые 12 ч | Ивакафтор 500 мг/ лумакафтор 400 мг |
детский возраст с 12 лет и старше, а также взрослые пациенты | 2 таблетки ивакафтор + лумакафтор** Ивакафтор 125 мг/ Лумакафтор 200 мг каждые 12 ч | Ивакафтор 500 мг/ лумакафтор 800 мг |
Примечание: 1 - Препарат следует принимать с жиросодержащей пищей
Детский возраст до 2 лет для лекарственной формы в гранулах;
Детский возраст до 6 лет для лекарственной формы в таблетках.
Применять с осторожностью
- В случаях выраженной бронхиальной обструкции (ОФВ1 менее 40% от должного) рекомендуется в течение первых 1 – 2 недель назначать половинную дозу препарата. Отмечено, что в этом случае имеет место уменьшение числа нежелательных реакций (НР) или сокращение их длительности [296].
- При циррозе печени и пациентам после трансплантации печени.
- Во время приема препарата ивакафтор + лумакафтор** необходимо контролироватьo Определение активности аланинаминотрансферазы в крови и определение активности аспартатаминотрансферазы в крови и Исследование уровня общего билирубина в крови, Исследование уровня свободного и связанного билирубина в крови перед началом лечения препаратом ивакафтор + лумакафтор**, далее ежемесячно в течение 6 мес., далее каждые 3 месяца (табл.26).o При назначении ивакафтор + лумакафтор** необходимо проводить исходное и последующие обследования органа зрения на предмет катаракты (Прием (осмотр, консультация) врача-офтальмолога с проведением офтальмоскопии, визометрии, биомикроскопии глаза), затем через 6 мес., 12 мес. и каждый год.
- Эффективность терапии следует оценивать через 6 месяцев по снижению числа обострений, потребности в АБТ, функциональным тестам (потовая проба, метод ОРКП – при отсутствии снижения показателей потовой пробы), показателям Исследование неспровоцированных дыхательных объемов и потоков (спирометрии), ИМТ [117].
- При отсутствии эффекта через 6 месяцев терапии препаратом ивакафтор + лумакафтор** необходимо:дополнительное обследование на носительство комплексных аллелей - Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови (секвенирование всего гена CFTR) для выявления носительства комплексных аллей, которые могут обуславливать устойчивость к таргетной терапии (см. раздел «лабораторные диагностические исследования») (в тех случаях, когда секвенирование не было выполнено перед началом терапии). При этом минимальным необходимым объемом исследования в данном случае будет анализ варианта L467F (NM_000492.3:c.1399C>T; NP_000483.3:p.(Leu467Phe)), доказанно приводящего к резистентности к терапии [105], любым доступным методом исследования;проведение метода ОРКП (см. раздел «Методы подбора патогенетической терапии»).
- Лечение пациентов следует прекратить при повышении активности АЛТ или АСТ >5 верхних границ нормы (ВГН) или при повышении активности АЛТ или АСТ >3 ВГН в сочетании с уровнем общего билирубина >2 ВГН.
- Следует помнить о возможных лекарственных взаимодействиях (согласно инструкции к препарату), в т.ч., с противогрибковыми препаратами системного действия - производными триазола, рифампицином** и зверобоем продырявленным [115].
- Применение ивакафтора и лумакафтора** может снижать экспозицию субстратов изоферментов CYP2C19 (ингибиторов протонного насоса, индометацина, которые являются ингибиторами CYP2C19 вследствие индукции лумакафтором изоферментов CYP3A/2С19), ибупрофена** вследствие индукции лумакафтором изоферментов CYP3A/2C8/2C9 [https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=ff37d270-1afb-45ca-bbc7-521ff7e0ac41, https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=bf582a60-1e93-441e-9062-e4bffc15d4d1].
- Следует продолжить прием ингибиторов протонного насоса в минимально эффективной дозе, и увеличивать их дозу только в том случае, если у пациентов наблюдается увеличение симптомов изжоги/гастроэзофагеальной рефлюксной болезни [505].
3.1.15.2 Патогенетическая терапия ивакафтор + тезакафтор + элексакафтор и ивакафтор
- Рекомендуется применение препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор с целью патогенетического лечения, повышения количества активного белка CFTR на поверхности клеток экзокринных желёз, повышения лёгочной функции, снижения частоты лёгочных обострений и замедления прогрессирования заболевания у пациентов с муковисцидозом, отвечающих следующим условиям:
Наличие в генотипе хотя бы одной мутации F508del или хотя бы одного из патогенных вариантов гена CFTR, который реагирует на лечение препаратом ивакафтор + тезакафтор + элексакафтор и ивакафтор (Приложение А3.5). FDA расширила список патогенных вариантов, чувствительных к терапии ивакафтор + тезакафтор + элексакафтор и ивакафтор, за счет дополнительных 94 мутаций
(https://www.cff.org/sites/default/files/2022-02/Trikafta-Approved-Mutations.pdf) в декабре 2024 г. Общее число генетических вариантов составило 271.
Возраст 6 лет и старше в соответствующей возрасту и весу дозировке (таблица 24) [297,298,299,300].
(УУР – A, УДД – 2).
Комментарии: элексакафтор и тезакафтор действуют как корректоры CFTR, восстанавливая процессинг F508del, связываясь с белком CFTR, чтобы увеличить доступность белка CFTR на клеточной поверхности. Они работают, изменяя форму белка CFTR для его расположения на поверхности клетки. Сочетание повышенного содержания белка CFTR в правильном положении на клеточной поверхности с потенцированием ивакафтором открытия хлоридных каналов приводит к усилению транспорта хлоридов и разжижению секреции слизи.
Таблица 24. Рекомендуемая дозировка препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор для взрослых пациентов и детей в возрасте от 6 лет и старше
Возраст | Масса | Утренняя доза | Вечерняя доза |
|---|
От 6 до 12 лет | менее 30 кг | Две таблетки, каждая из которых содержит 37,5 мг ивакафтора + 25 мг тезакафтора + 50 мг элексакафтора | Одна таблетка, содержащая 75 мг ивакафтора |
30 кг и более | Две таблетки, каждая из которых содержит 75 мг ивакафтора + 50 мг тезакафтора + 100 мг элексакафтора | Одна таблетка, содержащая 150 мг ивакафтора |
12 лет и старше | — | Две таблетки, каждая из которых содержит 75 мг ивакафтора + 50 мг тезакафтора + 100 мг элексакафтора | Одна таблетка, содержащая 150 мг ивакафтора |
Препарат следует принимать с жиросодержащей пищей
Противопоказания
- Гиперчувствительность к действующим веществам (ивакафтору, тезакафтору, элексакафтору) или к любому из вспомогательных веществ;
- Нарушения функции печени тяжелой степени (класс С по классификации Чайлд-Пью);
- Детский возраст до 6 лет;
- Прием сильных индукторов изофермента цитохрома Р450 3A4 (CYP3A4).
Применять с осторожностью
- тяжелая почечная недостаточность клиренс креатинина (КК) ≤ 30 мл/мин или терминальная стадия заболевания почек;
- прогрессирующие заболевания печени, особенно при печеночной недостаточности;
- в случаях сниженной легочной функции (менее ОФВ1 40%) следует в первые дни начать с половинной дозы для оценки переносимости;
- пациентам после трансплантации печени;
- период грудного вскармливания;
- беременность;
- прием ивакафтора может вызвать головокружение. Требуется осторожность при вождении машины, использовании различных механизмов, инструментов;
- потребуется коррекция дозы для получения эффекта - при применении препаратов - ингибиторов CYP3A (см. раздел «Взаимодействие с другими препаратами»).
Особенности приема: Следует принимать во время еды, с жиросодержащими продуктами.
Прием ивакафтор + тезакафтор + элексакафтор и ивакафтор каждые 12 часов помогает поддерживать достаточное количество препарата в организме.
Если пропущена доза приема препарата и прошло менее 6 часов от срока приема – следует принять пропущенную дозу. Если пропущено время приема и прошло более 6 часов, то следующая доза принимается в стандартной дозировке в обычное время. Прием двойной дозы недопустим.
Применение ивакафтор + тезакафтор + элексакафтор и ивакафтор у пациентов с печеночной недостаточностью
Класс A по шкале Чайлд-Пью - для пациентов с легкой степенью печеночной недостаточности коррекции дозы ивакафтор + тезакафтор + элексакафтор и ивакафтор не требуется.
Класс В по шкале Чайлд-Пью - пациентам с умеренной печеночной недостаточностью не рекомендуется использование ивакафтор + тезакафтор + элексакафтор и ивакафтор, если выгода не превышает риск. Если принято решение использовать ивакафтор + тезакафтор + элексакафтор и ивакафтор у пациентов с умеренной печеночной недостаточностью ивакафтор + тезакафтор + элексакафтор и ивакафтор следует использовать с осторожностью и в соответствии с инструкцией.
Рекомендованные дозы препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор у пациентов с нарушением функции печени:
Легкая степень (класс А по классификации Чайлд-Пью) | Нарушения средней степени тяжести (класс В по классификации Чайлд-Пью) | Тяжелая степень (класс С по классификации Чайлд-Пью) |
Коррекция дозы не проводится | Применение препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор целесообразно, только если существует явная медицинская необходимость, а ожидаемая польза превышает риски. При назначении препарат ивакафтор + тезакафтор + элексакафтор и ивакафтор следует принимать с осторожностью в уменьшенной дозе следующим образом: - День 1: необходимо принять две таблетки, содержащие ивакафтор + тезакафтор + элексакафтор утром
- День 2: необходимо принять одну таблетку, содержащую ивакафтор + тезакафтор + элексакафтор утром
- Следует продолжать чередовать схему приема в день 1 и день 2.
- Не следует принимать вечернюю дозу таблетки, содержащую ивакафтор.
| Применение противопоказано |
Применение ивакафтор + тезакафтор + элексакафтор и ивакафтор у пациентов с почечной недостаточностью
У пациентов с легкой и умеренной почечной недостаточностью (скорость клубочковой фильтрации от 60 до <90 мл/мин./1,73 м²) или умеренная (от 30 до 60 мл/мин./1,73 м²) коррекции дозы не требуется; для пациентов с тяжелой почечной недостаточностью (скорость клубочковой фильтрации менее или равен 30 мл/мин) или терминальной стадией заболевания почек рекомендуется ивакафтор использовать с осторожностью.
Применение ивакафтор + тезакафтор + элексакафтор и ивакафтор у пациентов, перенесших трансплантацию органов.
- Рекомендован персонализированный подход для применения таргетной терапии пациентам с МВ после проведения трансплантации солидных органов с лечебной целью с учетом текущего статуса пациента [315,470,511,512].
(УУР – С, УДД – 4).
Комментарий: в настоящее время данная проблема продолжает изучаться [468,469,470,471].
- Рекомендуется пациентам с МВ, получающим таргетную терапию ивакафтор + тезакафтор + элексакафтор и ивакафтор и такролимус** после трансплантации органов проведение:- контроля определения активности аспартатаминотрансферазы в крови, определения активности аланинаминотрансферазы в крови, определения активности гамма-глютамилтрансферазы в крови, определения активности щелочной фосфатазы в крови чаще чем в декретированные сроки (по потребности) у пациентов с трансплантированными органами,- частого контроля (по потребности) концентрации такролимуса** (исследование уровня лекарственных препаратов в крови) с коррекцией дозы такролимуса** для достижения целевого диапазона такролимуса**[468,469].
(УУР – В, УДД – 3).
Комментарии: прием ивакафтор + тезакафтор + элексакафтор и ивакафтор может увеличить системную экспозицию такролимуса**, который является чувствительным субстратом P-гликопротеина, что может усилить или увеличить продолжительность его терапевтического эффекта и возникновение нежелательных реакций.
Такролимус** активно метаболизируется в печени, главным образом, при участии изофермента CYP3A4.
- Рекомендовано при токсическом воздействии такролимуса**- снижение дозы ивакафтор + тезакафтор + элексакафтор и ивакафторили- временная отмена ивакафтор + тезакафтор + элексакафтор и ивакафтор и возобновление терапии со сниженной дозы с целью нивелирования токсических эффектов такролимуса** [468,469].
(УУР – B, УДД – 3).
Взаимодействие ивакафтор + тезакафтор + элексакафтор и ивакафтор с другими лекарственными препаратами
1. Одновременное применение с индукторами CYP3A не рекомендуется
Воздействие ивакафтора значительно снижается, и ожидается, что воздействие элексакафтора и тезакафтора уменьшится при одновременном применении сильных индукторов CYP3A, что может снизить терапевтическую эффективность элексакафтора, тезакафтора и ивакафтора. Таким образом, совместное применение с сильными индукторами CYP3A не рекомендуется. Например, применение ивакафтор + тезакафтор + элексакафтор и ивакафтор с сильными индукторами CYP3A (например, или рифабутин**, зверобоем продырявленным (Hypericum perforatum), противосудорожными препаратами (фенобарбитал**, карбамазепин** или фенитоин**) не показано.
2. Одновременное применение с ингибиторами CYP3A с осторожностью
Воздействие ивакафтор + тезакафтор + элексакафтор и ивакафтор увеличивается при совместном применении с сильными или умеренными ингибиторами CYP3A. Поэтому дозу элексакафтора, тезакафтора и ивакафтора следует уменьшить при одновременном применении с умеренными или сильными ингибиторами CYP3A.
А. При совместном применении с умеренными ингибиторами CYP3A, такими как флуконазол**, эритромицин**, рекомендуется снижение дозы до двух таблеток элексакафтора + тезакафтора + ивакафтора и одной таблетки ивакафтора, принимаемых через день. Рекомендовано не принимать вечернюю дозу ивакафтора.
В. При совместном применении с сильными ингибиторами CYP3A, такими как кетоконазол, итраконазол, позаконазол**, вориконазол**, телитромицин и кларитромицин** необходимо снижение дозы до двух таблеток элексакафтора + тезакафтора + ивакафтора два раза в неделю с интервалом примерно 3–4 дня. Не следует принимать вечернюю дозу ивакафтора (таблица 25).
Таблица 25. Изменение дозировки при одновременном использовании ивакафтор + тезакафтор + элексакафтор и ивакафтор с умеренными и сильными ингибиторами CYP3A
А. Умеренные ингибиторы CYP3A |
|---|
| День 1 | День 2 | День 3 | День 4 * |
Утренняя доза | Две таблетки, содержащие ивакафтор + тезакафтор + элексакафтор | Одна таблетка, содержащая ивакафтор | Две таблетки, содержащие ивакафтор + тезакафтор + элексакафтор | Одна таблетка, содержащая ивакафтор |
Вечерняя доза ^ | Нет приема |
* Следует продолжать чередовать прием двух таблеток, содержащих ивакафтор + тезакафтор + элексакафтор, и одной таблетки, содержащей ивакафтор, в разные дни. |
В. Сильные ингибиторы CYP3A |
| День 1 | День 2 | День 3 | День 4 # |
Утренняя доза | Две таблетки, содержащие ивакафтор + тезакафтор + элексакафтор | Нет приема | Нет приема | Две таблетки, содержащие ивакафтор + тезакафтор + элексакафтор |
Вечерняя доза ^ | Нет приема |
* - Следует продолжать принимать по две таблетки, содержащих ивакафтор + тезакафтор + элексакафтор, два раза в неделю с интервалом примерно в 3–4 дня. ^ - Не следует принимать вечернюю дозу ивакафтор |
Совместное применение ивакафтор + тезакафтор + элексакафтор и ивакафтор с соком грейпфрута, который содержит один или несколько компонентов, которые умеренно ингибируют CYP3A, может повышать экспозицию ивакафтор + тезакафтор + элексакафтор и ивакафтор. Следует избегать приёма пищи или напитков, содержащих грейпфрут во время лечения препаратом ивакафтор + тезакафтор + элексакафтор и ивакафтор.
Ципрофлоксацин** не оказывал клинически значимого влияния на экспозицию тезакафтора или ивакафтора и, как ожидается, не влияет на экспозицию элексакафтора. Таким образом, нет необходимости корректировать дозу при одновременном приеме ивакафтор + тезакафтор + элексакафтор и ивакафтор с ципрофлоксацином**.
1. Влияние ивакафтор + тезакафтор + элексакафтор и ивакафтор на другие лекарственные средства
А. Ивакафтор может ингибировать CYP2C9, рекомендуется проводить мониторинг уровня международного нормализованного отношения (МНО) (Определение международного нормализованного отношения (МНО)) во время совместного приёма препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор с варфарином**.
Экспозиция глимепирида и глипизида может повышаться на фоне приёма препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор. Глимепирид и глипизид следует использовать с осторожностью.
В. Совместный приём ивакафтора или тезакафтора с дигоксином**, субстратом P-gp, увеличивало AUC дигоксина** в 1,3 раза. Приём препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор может повышать экспозицию лекарственных средств, которые являются субстратами P-gp.
Следует соблюдать осторожность при одновременном применении препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор с дигоксином** или другими субстратами P-gp с узким терапевтическим индексом, такими как циклоспорин**, эверолимус**, сиролимус и такролимус**.
Элексакафтор M23-ELX ингибируют OATP1B1 и OATP1B3 in vitro. Совместный приём препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор может увеличивать экспозицию лекарственных препаратов, являющихся субстратами этих переносчиков, таких как статины, натеглинид и репаглинид**. Билирубин также является субстратом OATP1B1 и OATP1B3.
Следует соблюдать осторожность при одновременном приёме ивакафтор + тезакафтор + элексакафтор и ивакафтор с субстратами OATP1B1 или OATP1B3 [115,301].
Критерии эффективности и отмены ивакафтор + тезакафтор + элексакафтор и ивакафтор
Эффективность терапии следует оценивать через 12 месяцев по снижению числа обострений, потребности в АБТ, показателям исследования неспровоцированных дыхательных объемов и потоков (спирометрии), ИМТ, функциональным тестам (потовая проба, метод ОРКП – при отсутствии снижения показателей потовой пробы) [303].
При отсутствии эффекта через 12 месяцев терапии препаратом ивакафтор + тезакафтор + элексакафтор и ивакафтор необходимо:
1. Дополнительное обследование на носительство комплексных аллелей - молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови (секвенирование всего гена CFTR) для выявления носительства комплексных аллей, которые могут обуславливать устойчивость к таргетной терапии (в тех случаях, когда секвенирование не было выполнено перед началом терапии). При этом минимальным необходимым объемом исследования в данном случае будет анализ варианта L467F (NM_000492.3:c.1399C>T; NP_000483.3:p.(Leu467Phe)), доказано приводящего к резистентности к терапии [107,304].
2. Проведение метода ОРКП [111,112,113,114,115,116,117].
Показания для прекращения терапии
Решение об отмене таргетного препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор при неэффективности терапии и отсутствии возможности замены на другой препарат принимается консилиумом специалистов через 12 мес. от начала терапии.
Основанием для отмены препарата являются:
1. Отсутствие положительной динамики клинических, лабораторных и инструментальных показателей, включая потовую пробу.
2. Наличие комплексных аллелей в результате дополнительного молекулярно – генетического обследования (Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови) [428,472]. Носительство комплексных аллелей:
- [S466X;R1070Q] -0,46% в регистре 2022 г.,
- [L467F;508del] в гетерозиготном состоянии с вариантами I класса,
- [L467F;F508del]/ [S466X;R1070Q] [428,472].
3. Отрицательный результат форсколинового теста на кишечных органоидах.
4. Отрицательный результат восстановления функции CFTR канала по данным метода ОРКП.
5. Стойкое повышение активности АЛТ или АСТ >5 ВГН или при повышении активности АЛТ или АСТ >3 ВГН в сочетании с уровнем общего билирубина >2 ВГН.
6. НР, угрожающие жизни пациента или его социальной адаптации.
3.1.15.3 Нежелательные реакции на фоне таргетной терапии и стратегия оказания медицинской помощи при возможных НР на фоне таргетной терапии
Группы риска развития НР
ОФВ1 <40%.
Наличие трансплантированных органов.
Цирроз печени.
Возможные нежелательные реакции (НР):
1. Серьезные нежелательные реакции
При применении таргетной терапии возможно повышение трансаминаз (определение активности аланинаминотрансферазы и аспартатаминотрансферазы в крови должно быть проведено до начала приема и контролироваться ежемесячно в течение 3 месяцев после старта терапии, далее каждые три месяца в течение всего периода наблюдения). У больных с повышенной активностью аланинаминотрансферазы и аспартатаминотрансферазы в крови в анамнезе необходим более частый мониторинг функции печени. Пациенты, у которых в ходе лечения отмечено повышение уровня трансаминаз, должны тщательно контролироваться пока аномалия не будет устранена. Прием должен быть прерван у больных с показателями АЛТ или АСТ в 5 раз превышающими верхние границы нормы (ВГН), либо АЛТ и АСТ выше 3-х ВГН в сочетании с повышением билирубина выше 2-х ВГН согласно инструкции.
a. После разрешения НР в виде повышения уровня трансаминаз следует рассмотреть преимущества и риски возобновления приема
Повреждение печени и ухудшение ее функции у людей с тяжелым заболеванием печени, которые могут быть серьезными и могут потребовать трансплантации. Повреждение печени также случалось у людей без заболеваний печени. Признаки повреждения печени - боль или дискомфорт в верхней правой части брюшной области, желтушность кожных покровов и склер, потеря аппетита, тошнота или рвота, моча темного, янтарного цвета.
b. Катаракта: у детей, получавших ивакафтор, были зарегистрированы неврожденные помутнения хрусталика / катаракта. Следует проводить регулярно прием (осмотр, консультацию) врача-офтальмолога первичный/повторный до начала таргетной терапии и далее 1 раз в 6/12мес.
2. Наиболее распространенными нежелательными реакциями, поражающими более 5% пациентов, являются головная боль, инфекция верхних дыхательных путей, боль в животе, диарея, сыпь, заложенность носа, повышение уровня креатинфосфокиназы в крови, ринорея, ринит, грипп, синусит [302].
Могут возникать некоторые побочные эффекты, которые обычно не требуют медицинской помощи. Эти побочные эффекты могут исчезнуть с течением времени без отмены препарата. Чаще это - боли в теле, озноб, кашель, диарея, затрудненное дыхание, заложенность уха, высокая температура, зуд кожи или сыпь, потеря голоса, чихание, больное горло, заложенность носа или насморк.
3. Реже бывают боль в мочевом пузыре, затрудненное, болезненное мочеиспускание, частые позывы к мочеиспусканию, гематурия или мутная моча, сыпь пятнистая, прыщи, покраснение кожи, ухудшение зрения (затуманенное), сухие или зудящие глаза, боль, отек глаза, века или внутренней оболочки века, чрезмерное слезотечение, холодный пот, кома, бледная кожа, судороги, депрессия, головокружение, повышенное газообразование, сердцебиение, кровотечение, чувство голода, боль в пояснице или боку, беспокойство, нервозность, кошмары, припадки, дрожь, невнятная речь.
Прием должен быть прерван при стойком нарушении самочувствия и угрозе состояния и жизни.
После разрешения НР следует рассмотреть преимущества и риски возобновления приема.
Возобновить прием после купирования НР рекомендуется с половинной дозы.
Стратегия оказания медицинской помощи при возможных НР на фоне таргетной терапии представлена в Приложении А3.6
Показания для временного прекращения таргетной терапии (при нормализации - возобновление терапии)
Повышение активности АЛТ или АСТ >5 ВГН или при повышении активности АЛТ или АСТ >3 ВГН в сочетании с уровнем общего билирубина >2 ВГН.
Другие выраженные НР, усугубляющие состояние пациента.
Тактика при выявлении катаракты:
Распространенность диагностированной катаракты среди пациентов с МВ, включенных в программу на 31 августа 2012 года, составила 4,8% против 2,8% у людей без МВ. Частота в когорте МВ была выше, чем в группе людей без хронических заболеваний, и увеличивалась с возрастом в обеих когортах. Скорректированный IRR при сравнении когорт CF и GP составил 1,5 (95% ДИ: 1,2-1,8). Выводы: Исследование предполагает, что риск развития катаракты был выше среди пациентов с МВ, чем среди пациентов без МВ [305].
Основными стратегиями лечения нежелательных реакций на фоне приема этих препаратов со стороны органа зрения являются коррекция рефракции, лечение амблиопии и хирургия катаракты. Офтальмологическое обследование детей, получающих таргетную терапию, должно включать проверку остроты зрения в соответствии с возрастом, биомикроскопию (стандартная или портативная щелевая лампа) и полное обследование сетчатки (офтальмоскопия, биомикроскопия глаза, визометрия (с и без коррекции)). Могут наблюдаться катаракты диаметром менее 3 мм или частичной плотности. У детей старшего возраста врачи-офтальмологи должны рассмотреть возможность хирургического лечения катаракты при любом помутнении, приводящем к снижению качества жизни. После операции по удалению катаракты (Дисцизия, экстракция вторичной катаракты) врачи-офтальмологи должны начать оптическую реабилитацию и лечение амблиопии [306,307].
3.1.15.4 Критерии мониторинга безопасности таргетной терапии (табл. 26)
- Рекомендовано проведение пациентвм с МВ, получающим таргетную терапию, проведение мониторинга безопасности с целью оценки возможности продолжения лечения, своевременной фиксации НР и принятия соответствующих выявленным изменениям мер (табл.26) [315, https://grls.minzdrav.gov.ru].
(УУР – C, УДД – 5).
Комментарии:
Таблица 26. Критерии мониторинга безопасности таргетной терапии
Показатель | Единицы измерения | Частота | Пороговое значение |
|---|
Определение активности аланинаминотрансферазы в крови (АЛТ) | Ед/л | 14 дней или 1 месяц, затем 1раз в месяц в течении первых 6 месяцев Далее каждые 3 месяца | ≤ 5 ВГН или ≤ 3 ВГН при одновременном повышении билирубина ≤ 2 ВГН |
Определение активности аспартатаминотрансферазы в крови (АСТ) | Ед/л | 14 дней или 1 месяц, затем 1раз в месяц в течении первых 6 месяцев Далее каждые 3 месяца | ≤ 5 ВГН или ≤ 3 ВГН при одновременном повышении билирубина ≤ 2ВГН |
Исследование уровня общего билирубина в крови (билирубин общий), Исследование уровня билирубина свободного (неконъюгированного) в крови | мкмоль/л | 14 дней или 1 месяц, затем 1раз в месяц в течении первых 6 месяцев Далее каждые 3 месяца | ≤ 2ВГН при одновременном повышении АЛТ, АСТ ≤ 3ВГН |
Наличие катаракты (прием (осмотр, консультация) врача-офтальмолога первичный/повторные) | Да/нет | 6 месяцев 12 месяцев Далее 1 раз в год | Нет |
Уровень артериального давления на периферических артериях Для детей старше 12 лет | мм рт. ст. | 14 дней или 1 месяц 3 месяца 6 месяцев 9 месяцев 12 месяцев Далее каждые 3 месяца | Повышение выше значений для возраста и роста |
Серьезные нежелательные реакции | Да/нет | 14 дней или 1 месяц 3 месяца 6 месяцев 9 месяцев 12 месяцев Далее каждые 3 месяца | Нет |
Состояние психоэмоциональной сферы: опросник по состоянию здоровья (Приложение Г4), оценка уровня тревоги (Приложение Г5). По результатам – всем - (Прием (тестирование консультация) медицинского психолога первичный и повторный/ Прием (осмотр, консультация) врача-психиатра первичный и повторный – до и после начала таргетной терапии* | Оценить тревогу и депрессию | 1 месяц 3 месяца, затем по показаниям | |
Примечания: * - См. подраздел «Мониторинг тревоги и депрессии на фоне таргетной терапии».
При повышении уровня билирубина (Исследование уровня общего билирубина в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови) во время терапии препаратом ивакафтор + тезакафтор + элексакафтор и ивакафтор рекомендовано проведение молекулярно-генетического исследования в гене UTG1A1 для подтверждения синдрома Жильбера и контроль уровня билирубина (Исследование уровня общего билирубина в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови) с целью определения необходимости коррекции дозы препарата [502,503].
(УУР – B, УДД – 4).
Комментарии: в российской и зарубежной практике описаны случаи впервые выявленного синдрома Жильбера у пациентов с муковисцидозом, получающих таргетную терапию [502,503].
- При повышении уровня АЛТ, АСТ во время терапии препаратами ивакафтор + лумакафтор** и ивакафтор + тезакафтор + элексакафтор и ивакафтор рекомендовано, при возможности, определение генотипа - медленного метаболизатора лекарственных средств с помощью молекулярно-генетической диагностики в генах ферментов биотрансформации ксенобиотиков (CYP2C9, CYP2C19, CYP2D6, CYP3A4) [504].
(УУР – B, УДД – 4).
- Рекомендовано младенцам, рожденным от матерей с МВ, получавших во время беременности патогенетическую (таргетную) терапию ((ивакафтор + лумакафтор**, ивакафтор + тезакафтор + элексакафтор и ивакафтор и т.п.)), проводить особое наблюдение, включая мониторинг печеночной функции (определение активности аспартатаминотрансферазы в крови (АСТ), определение активности аланинаминотрансферазы в крови (АЛТ), определение активности гамма-глютамилтрансферазы в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови) и прием (осмотр, консультация) врача офтальмолога первичные и повторные в связи с тем, что данный вид лечения, проводимый беременной пациентке с МВ может помочь предотвратить или замедлить прогрессирование повреждения поджелудочной железы внутриутробно у ребенка с МВ и приводить к ложноотрицательным результатам неонатального скрининга, при этом у ребенка могут развиваться НР на таргетную терапию, получаемую матерью (Приложение А3.10) [515,516].
(УУР – C, УДД – 5).
Комментарий: алгоритм принятия решений по проведению грудного вскармливания у детей, рожденных от матерей с МВ, получавших/получающих патогенетическую (таргетную) терапию представлен в Приложении Б2.
3.1.15.5 Дополнительные критерии по назначению препаратов ивакафтор + лумакафтор** или ивакафтор + тезакафтор + элексакафтор и ивакафтор при муковисцидозе
- Рекомендовано назначать таргетную терапию (ивакафтор + лумакафтор** или ивакафтор + тезакафтор + элексакафтор и ивакафтор)
В случае обнаружения в генотипе пациента патогенного варианта гена CFTR, не указанного в инструкции по применению препарата, при наличии положительного результата форсколинового теста на кишечных органоидах. В такой ситуации возможность назначения таргетной терапии распространяется на всех пациентов с таким же патогенным вариантом в генотипе [315](Приложение А3.7).
В случае наличия в генотипе пациента двух патогенных вариантов гена CFTR, не указанных в инструкции по применению препарата, при положительном эффекте применения таргетной терапии (ивакафтор+лумакафтор** или ивакафтор + тезакафтор + элексакафтор и ивакафтор), подтвержденном в динамике результатами потовой пробы и/или теста определения разности кишечных потенциалов на биоптатах прямой кишки пациента [315].
(УУР – С, УДД – 5).
3.1.15.6 Cмена препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор в рамках МНН
С учетом достигнутого эффекта на препарате препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор и высокой функции внешнего дыхания риск развития НР при переводе в рамках МНН – низкий.
Появление мокроты/увеличение количества мокроты, появление кашля/усиление кашля может свидетельствовать об увеличении эффективности терапии по сравнению с предыдущим препаратом.
НР при терапии препаратом ивакафтор + элексакафтор + тезакафтор и ивакафтор наблюдались у 50% детей и подростков.
Оценка состояния при смене препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор в рамках единого МНН для детей в возрасте 2-18 лет представлена в табл. 27.
Таблица 27. Оценка состояния при смене препарата ивакафтор + тезакафтор + элексакафтор и ивакафтор в рамках единого МНН для детей в возрасте 2-18 лет
Следует проводить мониторирование состояния пациента [https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=c7eab980-0718-4265-a421-d75ea2e14001, письмо Минздрава России от 30.01.2025 № 15-1/4/2-1467]
| Сроки оценки состояния здоровья |
|---|
Критерий | Старт (до начала терапии) | 14 дней или 1 месяц | 3 месяца | 6 месяцев | 9 месяцев | 12 месяцев |
Исследование неспровоцированных дыхательных объемов и потоков (ОФВ1 (л,%)‡) | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ |
Исследование неспровоцированных дыхательных объемов и потоков (ФЖЕЛ (л,%)‡) | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ |
Измерение массы тела (Масса тела, кг) | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ |
Измерение роста (Рост, см) | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ |
ИМТ кг/м2 | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ |
Потовая проба | | V | | V‡‡‡ | | ˅ |
Определение активности панкреатической эластазы-1 в кале (Панкреатическая эластаза 1 кала, мкг/㇇) | | | | ˅ | | ˅ |
Количество госпитализаций | ˅ Оценка за год до старта терапии | | | | | ˅ Оценка за год терапии |
Количество дней внутривенной антибактериальной терапии | ˅ Оценка за год до старта терапии | | | | | ˅ Оценка за год терапии |
Количество дней пероральной антибактериальной терапии | ˅ Оценка за год до старта терапии | | | | | ˅ Оценка за год терапии |
Примечание: ‡ - для детей старше 5 лет
‡‡ - для детей до 10 лет
‡‡‡ - при необходимости
3.1.16 Мониторинг тревоги и депрессии
Пациенты с муковисцидозом и лица, осуществляющие уход, подвержены высокому риску развития депрессии и тревоги, которые значительно влияют на приверженность лечению, уменьшают продолжительность жизни и снижают ее качество. Новые методы лечения муковисцидоза (таргетная терапия) открывают большие перспективы для улучшения физического здоровья, но есть вероятность их влияния на психическое здоровье пациентов и развития депрессии и тревоги [309,310]. Раннее выявление депрессии и тревоги способствует своевременной терапии указанных состояний и предотвращает их неблагоприятное влияние на эффективность лечения и качество жизни пациентов и лиц, осуществляющих уход.
- Рекомендован скрининг на депрессию и тревогу для всех лиц с МВ, начиная с 12-летнего возраста, с использованием шкал PHQ-9 (Приложение Г4) и GAD-7 (Приложение Г5), при инициации таргетной терапии и динамическом наблюдении с целью своевременного выявления и лечения данных состояний [311,312,313,314,473].
(УУР – A, УДД – 2).
Комментарий: скрининг должен проводиться перед началом/сменой таргетной терапии и при выявлении жалоб/симптомов депрессии, но не позже 3 мес. от начала таргетной терапии, далее – в среднем, не реже 1 раза в год, при необходимости - чаще. Изменение психического состояния на фоне лечения CFTR-модуляторами развивается, как правило, в течение первых трех месяцев от начала терапии [315].
На проведение анкетирования с использованием указанных шкал отдельного информированного согласия не требуется.
- Рекомендован прием (осмотр, консультация) врача-психиатра пациентам с МВ с повышенными баллами по результатам скрининга на депрессию и тревогу с целью уточнения диагноза и терапии [316,317].
(УУР – С, УДД – 5).
- Рекомендован прием (осмотр, консультация) врача-психиатра для пациентов с муковисцидозом при инициации/смене таргетной терапии и при динамическом наблюдении с целью своевременной диагностики депрессии и/или тревоги в случае, если лицо, осуществляющее уход, и/или пациент, и/или медицинский специалист сообщают о возможных симптомах депрессии или тревоги [315,316].
(УУР – C, УДД – 5).
Комментарии: инструменты скрининга (опросники), позволяют определить риск развития депрессии и тревоги, однако в части случаев для назначения приема (осмотра, консультации) врача-психиатра необходимо ориентироваться на информацию об изменении поведения, характерного для нарушений настроения, от пациента или окружающих его лиц: осуществляющих уход и медицинских специалистов. Рекомендация применима также в отношении пациентов до 12 лет, для которых отсутствуют эффективные инструменты скрининга депрессии и тревоги в силу объективных психофизиологических и когнитивных возрастных особенностей. Для своевременного выявления депрессии и тревоги важно принимать во внимание информацию, поступившую непосредственно от ребенка и лиц, осуществляющих уход или медицинских специалистов, об изменении психологического состояния, настроения, поведения, психосоматических проявлениях (нарушения сна, аппетита и др.), а также о других симптомов, характерных для депрессии и тревоги у детей, в целях своевременного назначения приема (осмотра, консультации) врача-психиатра.
- Рекомендовано для пациентов с МВ на таргетной терапии с диагностированной депрессией и/или тревогой, с целью лечения депрессии и/или тревоги, динамическое наблюдение врача-психиатра и терапия диагностированных состояний в соответствии с клиническими рекомендациями по ведению пациентов с депрессией/тревогой [311,318,319,316].
(УУР – C, УДД – 5).
Комментарий: решение о коррекци таргетной терапии на фоне лечения в рамках психиатрической помощи, принимается совместно лечащим врачом и врачом-психиатром.
3.1.17 Терапия препаратами других групп и/или по особым показаниям
Для терапии МВ применяется ряд лекарственных препаратов других фармакотерапевтических групп.
- Рекомендуется рассмотреть назначение кортикостероидов системного действия при:
o тяжелом течении, обусловленном частыми обострениями с явлениями выраженной дыхательной недостаточности;
o длительном воспалительном процессе, осложненном образованием ателектатических изменений в легких;
o выраженном и стойком обструктивном синдроме, рефрактерном к действию β2- агонистов;
o аллергическом бронхолегочном аспергиллезе (АБЛА) [1,2,21].
(УУР – C, УДД – 5).
Комментарий: кортикостероиды системного действия в малых дозах помогают не только стабилизировать состояние пациента, но и улучшить функциональные и клинические показатели. Чаще всего для поддерживающей терапии назначают преднизолон** по 0,3–0,5 мг/кг массы тела пациента в сутки альтернирующим курсом. Его следует принимать внутрь через сутки (постоянно). При использовании кортикостероидов (для ингаляционного применения, группа АТХ R03BA) медленнее и в меньшем количестве развиваются побочные эффекты, хотя оценка их эффективности требует проведения исследований [1,2,320].
- Рекомендовано назначение макролидов (#Кларитромицин**, #Азитромицин**) пациентам с МВ и хронической синегнойной инфекцией в качестве противовоспалительных ЛС с целью замедления прогрессирования снижения легочной функции [1,2,5,21,176,321,322,323,324]:
o #Азитромицин** в дозе 250 мг (пациентам с весом менее 40 кг) и 500 мг (пациентам с весом 40 кг и более) через два дня на третий между приемами пищи. Длительность терапии индивидуальна у каждого больного [2,176,321,322,323].
(УУР – С, УДД – 5).
o #Кларитромицин** в дозе 125 мг (пациентам с весом менее 40 кг) или 250 мг (пациентам с весом 40 кг и более) через день независимо от приема пищи [2,176,324].
(УУР – C, УДД – 4).
- Нестероидные противовоспалительные и противоревматические препараты (НПВП) в настоящее время могут рассматриваться как альтернатива кортикостероидам системного действия с противовоспалительной целью. Однако это касается только #ибупрофена**. Методика назначения: #ибупрофен** назначается в дозе 20-30 мг на 1 кг массы тела дважды в день детям в возрасте от 6 лет. Максимальная суточная доза для взрослых составляет 1,2 г. Максимальная суточная доза для детей и подростков в возрасте от 12 до 17 лет – 1 г [1,2,21,325,326,329].
(УУР – A, УДД – 1).
Комментарии: НПВП оказывают достаточно выраженный противовоспалительный эффект, но при их длительном применении высок риск нежелательных реакций. Обсуждается возможность длительного применения препаратов, селективно ингибирующих циклооксигеназу-2 (нестероидные противовоспалительные и противоревматические препараты), однако их противовоспалительная активность ниже, чем у более ранних аналогов.
Парацетамол** метаболизируется в печени и обладает гепатотоксическим эффектом, что крайне нежелательно у пациентов с муковисцидозом, при котором поражения печени являются одним из проявлений данного заболевания.
Длительность терапии определяется индивидуально. Следует одновременно назначить ингибитор протонного насоса.
Использование селективных ингибиторов циклооксигеназы-2 (ЦОГ-2) (Коксибы) не рекомендовано из-за риска нежелательных явлений на сердечно-сосудистую систему при длительных курсах лечения [327].
Применение нимесулида (противопоказан до 12 лет) при МВ не выявило положительной динамики маркеров воспаления и показателей функции легких [328], препарат не рекомендован к применению.
- Рекомендуется #ацетилцистеин** в дозе 1200 мг в сутки у пациентов старше 12 лет и 600 мг в сутки у детей младше 12 лет в 2 приёма внутрь непрерывно с первого дня применения #амикацина** в течение всего курса применения и 7 дней после его окончания (минимум 6 недель) для снижения ототоксичности. Препарат имеет отчетливый кохлеопротективный эффект при аминогликозид-связанной потере слуха, понижает риск ототоксичности на 80% и предупреждает развитие антибиотикорезистентности, является антиоксидантом [2].
(УУР – C, УДД – 5).
3.1.18 Лечение пациентов – носителей патогенных вариантов, связанных с CFTR
- Рекомендовано селективное применение таргетной терапии (#ивакафтор + лумакафтор**/#ивакафтор + тезакафтор + элексакафтор и ивакафтор) для лечения тяжелых и сложных респираторных инфекций у носителей патогенных вариантов гена CFTR с целью достижения наилучших результатов терапии [422].
(УУР – C, УДД – 5).
Комментарий: дозировки – согласно Инструкциям. В отличие от пациентов с МВ, носителям МВ такое лечение может потребоваться только в течение относительно коротких периодов времени для усиления антимикробной терапии, например, при тяжелых проявлениях инфекции, вызванной нетуберкулезными микобактериями [406,420].
- Рекомендовано селективное применение таргетной терапии (#ивакафтор + лумакафтор**/#ивакафтор + тезакафтор + элексакафтор и ивакафтор) у пациентов – носителей патогенных вариантов, связанных с CFTR-ассоциированным панкреатитом для предупреждения обострения панкреатита в дозировках согласно Инструкциям [474,475,476,477,478,479,480,481,482,483,484,485,486,487,488,489,490].
(УУР – C, УДД – 4).
3.2 Кинезитерапия
- Всем пациентам с муковисцидозом в обязательном порядке рекомендовано проведение кинезитерапии (КНТ) по индивидуальной программе (методика дренирования бронхиального дерева и лечебная физкультура (дыхательные упражнения дренирующие, Лечебная физкультура при заболеваниях бронхолегочной системы)) с целью улучшения эвакуации мокроты [1,2,21,191,287].
(УУР – C, УДД – 5).
Комментарий: кинезитерапия - один из важных компонентов комплексного лечения МВ. Главная цель проведения кинезитерапии — очищение бронхиального дерева от вязкой мокроты, которая блокирует бронхи, создавая условия для развития инфекции в бронхолёгочной системе, а также поддержание легких в максимально функциональном состоянии [1,2,5,191]. Основными методиками КНТ являются:
o постуральный дренаж;
o перкуссионный массаж грудной клетки;
o активный цикл дыхания;
o дренажные положения;
o аутогенный дренаж;
o терапия, с помощью дыхательных тренажеров, создающих положительное давление на выдохе, в том числе, с контролем и регулированием этого давления (специальные маски, системы, Тренажер дыхательный с переменным положительным давлением на выдохе, (флаттер) и др.);
Дыхательный тренажер, создающий положительное давление на выдохе. В комплекте: верхняя секция; нижняя часть; муфта-регулятор сопротивления; мундштук без клапана выдоха; носовой зажим. Наличие возможности проведения термической, химической обработки, автоклавирования всех частей тренажера.
Терапия с помощью специальных аппаратов назначается совместо врачом-пульмонологом или врачом-педиатром, врачом-терапевтом специализировнного отделения (центра) или врачом паллиативной помощи совместно с врачом по лечебной физкультуре ( и др.) по показаниям:
o дренаж с помощью специальных приборов по показаниям, методами:
- Аппарат для помощи удаления выделений из дыхательных путей с принадлежностями;
- IPV (интрапульмональная перкуссионная вентиляция). аппаратом для интрапульмональной перкуссионной вентиляции легких;
- IPP (интрапульмональная перкуссия) приборами: инсуффлятор-аспиратор механический и Инсуффлятор-аспиратор с принадлежностями. Приборы предназначены для пациентов, которые не могут кашлять или эффективно очищать дыхательные пути из-за ухудшения пиковой скорости при кашле. Устройство стимулирует естественный кашель, быстро меняя положительное давление на отрицательное. Инсуффляторы-аспираторы механические следует использовать по назначению врача или после консультации с медицинским специалистом/посещения лечебно-профилактического учреждения с осмотром у медицинского специалиста;
-.HFCWO (Высокочастотная осцилляция грудной клетки) - при помощи приборов: (система очищения дыхательных путей от секрета методом высокочастотной осцилляции грудной клетки или системы очистки дыхательных путей) и др.
Кинезитерапия назначается всем пациентам с момента постановки диагноза, в любом возрасте. У грудных детей обычно применяют пассивную технику кинезитерапии, включающую:
o специальные дренажные положения, в которых улучшается эвакуация слизи из лёгких;
o контактное дыхание;
o массаж с лёгкой вибрацией и поглаживанием;
o клопфмассаж (постукивание в 8-ми точках грудной клетки);
o занятия на гимнастическом мяче;
o дыхание с помощью маски, создающей положительное давление на выдохе;
o дренаж с помощью специального вибрационного жилета: у пациентов с муковисцидозом в любом возрасте (от новорожденного до взрослого).
Эффективность тех или иных методов КНТ варьирует в зависимости от индивидуальных особенностей пациентов с МВ. Чем младше ребёнок, тем более пассивные методики дренирования следует использовать. Новорождённым выполняют только перкуссию и компрессию грудной клетки. По мере роста ребёнка следует постепенно вводить более активные методики, обучая пациентов технике контролируемого откашливания.
Услуги по приказу Минздрава России от 13.10.2017 г. № 804н «Об утверждении номенклатуры медицинских услуг»:
o Массаж при хронических неспецифических заболеваниях легких;
o Общий массаж и гимнастика у детей раннего возраста;
o Массаж грудной клетки медицинский.
- Рекомендуются пациентам с муковисцидозом регулярные занятия лечебной физкультурой (Лечебная физкультура при заболеваниях бронхолегочной системы, Индивидуальное занятие лечебной физкультурой при заболеваниях бронхолегочной системы, Механотерапия при заболеваниях бронхолегочной системы, Механотерапия на простейших механотерапевтических аппаратах при заболеваниях бронхолегочной системы, Лечебная физкультура с использованием аппаратов и тренажеров при заболеваниях бронхолегочной системы) с целью улучшения эвакуации мокроты, укрепления дыхательной мускулатуры, повышения эмоционального тонуса пациента [1,2,21,191].
(УУР – C, УДД – 5).
Комментарии: с раннего детства (начиная с 3-х лет) необходимо стимулировать пациентов заниматься динамическими видами спорта, связанными с нагрузками средней интенсивности, особенно сопряжёнными с пребыванием на свежем воздухе. Физические упражнения облегчают очищение бронхов от вязкой мокроты и развивают дыхательную и общую мускулатуру. Некоторые упражнения укрепляют грудную клетку и исправляют осанку.
Разрешены аэробные виды спорта: аэробика, плавание, бег, велосипед, гимнастика йоги и УШУ, бадминтон, большой и малый теннис, волейбол, гольф, туризм и т.п.
В редких случаях тяжесть состояния пациента полностью исключает возможность занятия физическими упражнениями. Поэтому вопросы спортивной активности (выбор вида спорта и нагрузки) должен решать лечащий врач.
Пациентам с МВ не следует заниматься особенно травматичными видами спорта (тяжёлая атлетика, футбол, хоккей, прыжки в воду, мотоспорт, бокс, регби, дзюдо и т.п.), поскольку длительное ограничение физической активности, связанное с восстановлением после травмы, неблагоприятно сказывается на дренажной функции лёгких. Запрещены анаэробные виды спорта: тяжелая атлетика, бодибилдинг и т.п.
Пациенты с муковисцидозом относятся к специальным, III и IV группам здоровья:
III группа здоровья - пациенты с муковисцидозом в стадии стойкой клинико-лабораторной ремиссии.
- Детям, отнесенным к этой группе, разрешаются занятия физкультурой в образовательных учреждениях по индивидуальной программе, под руководством учителя физической культуры или инструктора лечебной физкультуры.
- Дети этой группы, имеющие хорошее функциональное состояние и соответствующую возрасту физическую подготовленность, не отстающие от сверстников в физическом развитии и физической подготовленности, допускаются до занятий в полном объеме по учебной программе физического воспитания, подготовки и сдачи тестовых программ, требующих определенной физической подготовленности, такой как – Готов к Труду и Обороне (ГТО) и участием в спортивных соревнованиях и турнирах, спартакиадах, спортивных праздниках и фестивалях, днях “Спорта”.
- К спортивным занятиям и участию в спортивных соревнованиях они допускаются после сдачи норм ГТО.
IV группа здоровья - пациенты с муковисцидозом в стадии не полной клинико-лабораторной ремиссии или в стадии обострении заболевания. Детям, отнесенным к этой группе здоровья, рекомендуются в обязательном порядке домашние занятия лечебной физкультурой и кинезитерапией, прогулки на воздухе. К спортивным занятиям и участию в спортивных соревнованиях они не допускаются.
Комментарий: переход пациента с муковисцидозом из III группы здоровья в IV, или из IV в III, определяется его лечащим врачом по клинико-функциональному состоянию на данный момент [330,331,332,333,334].
Услуги по приказу Минздрава России от 13.10.2017 г. № 804н «Об утверждении номенклатуры медицинских услуг»:
o Лечебная физкультура при заболеваниях бронхолегочной системы;
o Механотерапия при заболеваниях бронхолегочной системы;
o Лечебная физкультура с использованием аппаратов и тренажеров при заболеваниях бронхолегочной системы;
o Дыхательные упражнения дренирующие;
o Лечебная физкультура с биологической обратной связью при заболеваниях бронхолегочной системы (принцип биологической обратной связи заключается в непрерывном мониторинге определённых электрофизиологических показателей и «подкреплением» с помощью мультимедийных, игровых и других приёмов заданной области значений).
3.3 Диетотерапия и витаминотерапия
3.3.1 Общие принципы диетотерапии у пациентов с МВ без таргетной терапии
Диетотерапия составляет важную часть комплексной терапии при МВ [1,2,21]. Смеси для лечебного и дополнительного питания для пациентов с муковисцидозом предтавлены в Приложении А3.8.
- Рекомендуется всем пациентам с муковисцидозом увеличение суточного потребления калорий до 120-150% по сравнению с нормами по возрасту, пропорциональное увеличение потребления высококачественного белка (20% от суточного калоража) и жира (35-40% от суточного калоража) с целью поддержания адекватного нутритивного статуса [62].
(УУР – C, УДД – 5).
Комментарий: пациентам с МВ необходима ранняя нутритивная поддержка. Установлена непосредственная связь между состоянием питания и функцией легких. Существует прямая корреляция между показателем индекса массы тела, функцией легких и продолжительностью жизни.
Индекс массы тела (ИМТ) = масса тела (кг) / квадрат роста (м2).
Для оценки нутритивного статуса используются следующие критерии:
Для детей: недостаточный вес: Z-score вес /возраст <-2 SD или ИМТ <5-го перцентиля, <-2 SD (= 2-го перцентиля) медианного референтного значения по возрасту и полу;
задержка роста: Z-score рост/возраст < –2 SD среднего референcного значения по возрасту и полу;
для взрослых: ИМТ <18,5 кг/м2;
Для определения избыточного веса/ожирения:
для детей от двух лет и старше:
избыточный вес– ИМТ между 85–94,9 перцентилем или z-скор ИМТ >1 SD (~84-й перцентиль) медианного референтного значения повозрасту и полу;
ожирение – ИМТ ≥95-го перцентиля ожирения или z-скор ИМТ >2 SD (~98-й перцентиль) медианного референтного значения повозрасту и полу;
для взрослых:
избыточный вес - ИМТ 25–29,9 кг/м2 для избыточного веса;
ожирение - ИМТ ≥30 кг/м2.
Целевые показатели:
ИМТ >50 перцентиля ( 0 SD) (при ИМТ = 21 – 22 кг/м2 у взрослых зарегистрировано существенное улучшение показателя ОФВ1) [424].
Высокий перцентиль показателя вес/возраст ассоциируется с лучшими показателями ОФВ1, линейного роста, снижением сроков госпитализации, снижением количества бронхолегочных обострений, а также увеличением продолжительности жизни.
Белки
Пациенты с МВ нуждаются в повышенном количестве белка из-за его потерь (мальабсорбции) и в дополнительном поступлении его в период катаболизма при легочных обострениях. Источниками полноценного белка являются натуральные продукты (мясо, птица, рыба, морепродукты, молоко, кисломолочные продукты, творог, сыры, яйца). Детям старше года рекомендуется включать в рацион высокобелковые продукты (яйца, рыба, творог, сыр) не реже 3 раз в день, молоко и кисломолочные продукты не менее 500 – 800 мл в день.
Взрослым пациентам с муковисцидозом рекомендовано употреблять в день 2 – 3 порции продуктов, содержащих белок высокой биологической ценности (мясо, птица, рыба, яйца, творог, сыр).
В качестве дополнительного источника белка рекомендуется использование лечебных смесей для энтерального и дополнительного питания. Дополнительное питание назначают по 150 - 200 – 250 мл 1 – 3 раза в день (например, на второй завтрак, на полдник или перед сном, возможно в сочетании с фруктовым пюре, печеньем, хлопьями и т.п.). К использованию рекомендуются смеси на основе цельного молочного белка (стандартные специализированные продукты энтерального питания) с нормальным или повышенным содержанием белка. В случае недостаточной эффективности стандартных продуктов используются смеси на основе гидролизованного молочного белка (специализированные продуты энерального питания на основе гидролизованного белка молочной сыворотки) с нормальным или повышенным количеством калорий.
Объем дополнительного питания определяется степенью нутритивной недостаточности и аппетитом.
У взрослых пациентов при расчете объема дополнительного питания необходимо учитывать тяжесть дыхательной недостаточности. Соблюдение принципа «много, не значит хорошо» у пациентов с тяжелой дыхательной недостаточностью – профилактика усиления синдрома гиперкатаболизма при перегрузке питательными субстратами.
Особенности диетотерапии на фоне таргетной терапии:
В эру таргетной терапии меняется концепция питания от гиперкалорийной высокожировой диеты для всех пациентов до "здорового питания" как основной рекомендации [424].
Комментарии: при достижении 50 центиля и стабильном сохранении в течение 6 месяцев меняется концепция от гиперкалорийной высокожировой диеты для всех пациентов до физиологической нормы [424].
Прием препаратов таргетной терапии следует осуществлять в основные приемы пищи или с молочными продуктами (в среднем, 4-5 г жиров на каждую дозу).
Отмечается увеличение веса от 13 до 15% в первые 16-24 нед. таргетной терапии с последующей стабилизацией. С момента старта таргетной терапии в США число взрослых пациентов с избыточным весом увеличилось на 26,7% [335].
В связи с этим, существует обеспокоенность по поводу возрастных, метаболических нарушений, которые, как известно, связаны с диетой с высоким содержанием жиров и увеличением веса. Текущие рекомендации по энергетической ценности и потреблению жира в рационе могу быть избыточными в этом случае. Следует применять индивидуальный подход и назначение рациона питания, согласно рекомендациям при ожирении и метаболическом синдроме [336].
Для объективной оценки необходим динамический контроль не только ИМТ, но и состава тела методом биоипедансометрии (Определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра) [424] (см. раздел 2.4).
Жиры
Чрезвычайно важно сохранение высокого потребления жиров пациентами с МВ (до 40 % от энергетической ценности). Жиры являются наиболее энергетически «плотным» энергоносителем (9 ккал/г); увеличение квоты жира в энергообеспечении снижает образование CO2, минимизирует его задержку в организме, положительно влияет на газообмен в легких. Возможность высокого потребления жира обеспечивается адекватной заместительной ферментной терапией.
Хотя количество жира в диете пациентов с МВ не ограничивается, важное значение приобретает его качественный состав. В связи с нарушениями в гепатобилиарной сфере, количество насыщенных и трансжиров (животные жиры, содержащиеся в жареных продуктах, колбасных изделиях, коже птицы, кулинарные жиры, маргарин) необходимо ограничивать, отдавая предпочтение жирам, богатым полиненасыщенными жирными кислотами (ПНЖК): омега-6 (кукурузное, подсолнечное масло) и омега-3 (льняное масло, жир морских рыб) жирными кислотами, природным витамином Е. Такие масла как – кукурузное подсолнечное, рапсовое следует использовать в качестве базовых продуктов для приготовления пищи. А такие масла, как льняное, тыквенное, сафлоровое, масло грецких орехов, виноградных косточек и др. в качестве дополнительной, биологически активной добавки к пище, в небольшом объеме, без термической обработки, добавляя в готовые блюда.
Растительное кокосовое масло - содержит в своем составе среднецепочечные триглицериды (СЦТ).Триглицериды со средней длиной углеродной цепи (С6-С12) являются легко доступным источником энергии, так как не нуждаются в эмульгации желчными солями и гидролизе панкреатической липазой и легко всасываются, минуя лимфатическую систему, непосредственно в кровеносные сосуды системы воротной вены. Однако, следует знать, что СЦТ относятся к насыщенным жирам, обладают кетогенным эффектом, в связи с этим следует избегать избыточного употребления их в рационе.
Ряд смесей для лечебного питания содержат в своём составе СЦТ. Содержание их варьирует в пределах 20-70% жирового компонента, остальные жиры представлены липидами с высоким содержанием эссенциальных (полиненасыщенных) жирных кислот. Модульные жировые смеси (эмульсии) имеют в своем составе только СЦТ. Показанием к использованию таких продуктов, смесей является невозможность увеличить калорийность рациона и компенсировать стеаторею с помощью адекватных доз микросферических ферментов, выраженная степень нутритивной недостаточности.
Углеводы
Энергетический дефицит восполняется также за счет углеводов, доля которых в рационе должна составлять 35-40 % от суточной калорийности. Дисахариды, в том числе сахар, в большинстве случаев переносятся хорошо, простые сахара (моно- и дисахариды) усваиваются без панкреатических ферментов, за счет пристеночного пищеварения. В рационе питания простые углеводы не ограничиваются (сахар, фрукты, сладкие напитки, мед, варенье, конфеты и др.), однако, в связи с возрастающим риском возникновения ассоциированного с МВ сахарного диабета, их рекомендуется употреблять только после основных приемов пищи, во избежание резких колебаний уровня гликемии.
Необходимо помнить, что у 91% пациентов отмечается кариозное поражение зубов, что требует тщательной гигиены полости рта и регулярного наблюдения врача-стоматолога.
У пациентов, сохраняющих жалобы на диарею, вздутие живота, боли в животе и повышенное газообразование при употреблении молочных продуктов, необходимо исключить лактазную недостаточность. Снижение лактазной активности в биоптатах слизистой оболочки тонкой кишки 103 детей с МВ и тяжелой панкреатической недостаточностью было обнаружено в 58% (тяжелая гиполактазия в 31% и умеренная в 28% случаев)[338].
Особую группу составляют дети, оперированные по поводу мекониевого илеуса, а также пациенты, оперированные по поводу СДИО, которые могут иметь лактазную недостаточность в той или иной степени, в зависимости от длины резецированного участка тонкой кишки (пострезекционный синдром/синдром короткой кишки).
Детям на грудном вскармливании, при наличии лактазной недостаточности, используют биологически активные добавки, содержащие лактазу (лактазар, лактаза–беби и др.), при смешанном или искусственном вскармливании - низколактозные заменители грудного молока, а также безлактозные смеси на основе глубокого гидролиза белка. Детям старше года при сохраняющихся симтомах лактазной недостаточности, кишечной дисфункции показаны полуэлементные смеси для энтерального питания.
В дигестии полимеров глюкозы – мальтодекстринов с небольшим числом глюкозных остатков (5-8) в большей степени принимает участие глюкоамилаза и мальтаза (ферменты кишечного пристеночного пищеварения), чем панкреатическая амилаза. Мальтодекстрины имеют более низкую осмолярность, чем моно- и дисахариды, поэтому их использование в составе специализированных смесей для энтерального и дополнительного питания позволяет существенно увеличить калорийность без увеличения осмотической нагрузки на кишку.
Расщепление крахмала зависит от панкреатической амилазы, поэтому он усваивается хуже, чем ди- и моносахариды. Амилорея, также как креаторея и стеаторея, нуждается в коррекции панкреатином**. Излишки нерасщепленного крахмала, поступая в толстую кишку, гидролизируются кишечной микрофлорой, что приводит к повышенному газообразованию, вздутию и болям в животе.
Пациентам с МВ не ограничиваются продукты и блюда, богатые растворимыми пищевыми волокнами (пектины, камеди), которые способствуют профилактике запоров и синдрома дистальной интестинальной обструкции (СДИО). Однако, при сохранении диспептических явлений не рекомендуется в больших количествах пища, богатая грубой клетчаткой и волокнами (бобовые, каши из цельного зерна, цельнозерновой и ржаной хлеб, отруби, косточки, кожица от фруктов и овощей, сухофрукты, низкосортное мясо с большим содержанием соединительной ткани), которые увеличивают объем каловых масс и усиливают метеоризм.
- Для обеспечения повышенных энергетических потребностей калорийность суточного рациона пациентам с муковисцидозом рекомендуется рассчитывать не на фактический, а на долженствующий вес с учетом катаболических процессов при хроническом воспалении и исходя из дефицита массы тела [2,62].
(УУР – C, УДД – 5).
Комментарий: потребность в энергии у детей и взрослых с МВ без таргетной терапии, по данным различных источников, должна быть повышена до 120-150%, по сравнению с теоретическими расчетами на фактический вес, в зависимости от возраста и нутритивного статуса пациента (таблица 28). 35-40% всей энергетической потребности должно обеспечиваться жирами, 20% белками и 60-65% - углеводами.
При тяжелой дыхательной недостаточности 50 – 60% небелковых калорий должно приходиться на жиры (имеют наименьший дыхательный коэффициент – 0,7) [339].
Существуют довольно сложные формулы для расчета необходимых дополнительных калорий, однако в повседневной практике можно пользоваться следующими ориентирами:
o 1-2 года - 200 ккал,
o 3-5 лет - 400 ккал,
o 6-11 лет - 600 ккал,
o старше 12 лет и для взрослых - 800 ккал в сутки [1].
Таблица 28. Рекомендуемые величины потребления белка и энергии
Возраст | Белок, г/кг/сут. | Энергия, ккал/кг/сут. |
|---|
| | Минимальная | Максимальная |
0 - 1 год | 3 - 4 (до 6) | 130 | 200 |
1 - 3 года | 4 – 3 | 90 – 100 | 150 |
3 - 10 лет | 3 – 2,5 | 70 – 80 | 100 |
11-14 лет | 2,5 - 1,5 | 45 – 70 | 90 |
Взрослые | 2-2,5 | 35 | 50 |
- Недостаточность питания рекомендуется диагностировать, если процент соответствия массы по росту и полу или массо-ростовой индекс (МРИ), фактическая масса/идеальная масса по росту и полу х 100% меньше 90% у пациентов детского возраста, а у подростков и взрослых - если ИМТ составляет менее 18,5кг/м2. Ведение пациентов с МВ осуществляют в зависимости от их физического статуса (табл.29). При показаниях Z-score по ИМТ от -1 до -2 следует диагностировать среднетяжелую недостаточность питания, а при>-2 – тяжелую недостаточность питания [340].
(УУР – C, УДД – 5).
- У взрослых тяжесть недостаточности питания рекомендуется оценивать по показателям ИМТ: ИМТ – 17 - 15 кг/м2 - соответствует недостаточности питания средней степени тяжести, ИМТ – менее 15 кг/м2 - тяжелой степени недостаточности питания [339].
(УУР – C, УДД – 5).
Комментарий:
Таблица 29. Диетологические рекомендации по ведению пациентов с МВ в зависимости от физического статуса [62]
Дети ≤ 2-х лет | Дети 2-18 лет | Взрослые | Состояние питания |
|---|
Вес и длина ³ 50 перцентиль | ИМТ ³ 50 перцентиль | ИМТ = 18,5 – 22,0 кг/м2 для женщин, 18,5 – 23,0 кг/м2 для мужчин | Нормальное состояние питания: Профилактическое консультирование по вопросам питания |
Вес и длина ˂50 ≥ 10 перцентиль | ИМТ <50 ≥ 10 перцентиль Потеря или отсутствие прибавки веса в предыдущие 2-4 мес. | ИМТ ˂ 18,5 кг/м2, или снижение массы тела на 5% менее, чем за 2 месяца | Нарушение нутритивного статуса: коррекция диеты и добавление продуктов энтерального питания |
Вес и длина < 10 перцентиль | ИМТ< 10 перцентиль Потеря ³ 2 перцентилей веса и задержка роста с момента последнего посещения | ИМТ стойко ˂18,5 кг/м2, или снижение ИМТ более, чем на 5% за 2 прошедших месяца | Нарушение нутритивного статуса тяжелой степени: Зондовое питание |
- Рекомендованная цель нутритивной поддержки при МВ - обеспечить физическое развитие пациента согласно возрастным нормам (достижение показателей физического развития в границе 25-75 перцентиль после коррекции нутритивного статуса, рекомендуемая цель - 50 перцентиль или 0 SD), Для взрослых - целевой ИМТ = 21 кг/м2 у женщин и 22 кг/м2 у мужчин и прирост % мышечной массы [62].
(УУР – C, УДД – 5).
Комментарий: критерии для оценки состояния питания представлены в таблице 30.
Таблица 30 Систематический подход к оценке питания при МВ
Возраст | |
Дети и взрослые | Мониторинг массы тела, роста, ИМТ каждые 3 месяца |
Мониторинг питания |
Дети и взрослые | - Маркеры состояния питания – клинический, биохимический анализы крови, жирорастворимые витамины сыворотки - Мониториг заместительной терапии ферментными препаратами (панкреатин**) – через 3-6 месяцев после начала терапии или изменения дозы - Эластаза-1 в стуле ежегодно при нормальной функции поджелудочной железы - ПГТТ ежегодно с 10 лет |
Диетологическое консультирование |
Дети и взрослые | Дети – каждые три месяца, взрослые – каждые 6 месяцев |
3.3.2 Дети первого года жизни
Грудное вскармливание
Идеальным для новорожденных и детей первого года жизни является непастеризованное грудное материнское молоко, так как оно содержит широкий спектр защитных факторов и биологически активных веществ. Важную роль играет активность термолабильной липазы в нативном (непастеризованном) женском молоке. Для детей с МВ показана защитная роль естественного вскармливания: младенцы, получающие грудное молоко, имеют лучшие показатели легочных функций и низкую частоту инфекционных эпизодов, по сравнению с детьми на искусственном вскармливании. Новорожденные и дети первых месяцев жизни, которые не могут самостоятельно высасывать необходимый объем молока из груди ввиду тяжести состояния (общая слабость, одышка, сердечно-легочная недостаточность) должны получать сцеженное непастеризованное материнское молоко из бутылочки или через назогастральный зонд.
В некоторых случаях требуется дополнительное поступление энергии с помощью обогащения грудного молока. Так, при недостаточной прибавке в весе молоко можно обогащать добавлением на каждые 100 мл приблизительно 5 г (1 мерная ложка) сухой смеси на основе гидролизата белка с СЦТ.
- Детям грудного возраста с МВ и панкреатической недостаточностью рекомендуется назначать ферментную заместительную терапию препаратами панкреатина** (в виде минимикросфер) в каждое кормление с целью коррекции панкреатической недостаточности [2,62].
(УУР – C, УДД – 5).
Комментарий: с момента введения неонатального скрининга на МВ в России (2006 г.) появилась возможность раннего начала лечения, однако вопрос, когда и кому начинать заместительную терапию панкреатическими ферментами, не всегда ясен. Уровень панкреатической эластазы-1 в стуле в течение первого года жизни может существенно варьировать и однократного его измерения не всегда достаточно. Следует ориентироваться на темпы прибавки в массе и показатели копрограммы (наличие стеатореи) [62].
Смешанное/искусственное вскармливание
У детей, сохраняющих удовлетворительные темпы физического развития, могут использоваться обычные адаптированные молочные смеси.
При смешанном/искусственном вскармливании большинство младенцев, при своевременной диагностике панкреатической недостаточности и ее коррекции панкреатическими ферментами, хорошо растут и развиваются при использовании обычных адаптированных молочных смесей с преобладанием сывороточных белков в составе белкового компонента (60:40) [62].
- У детей первого года жизни с муковисцидозом не рекомендуется использовать заменители молока с низким содержанием белка (1,1 – 1,3 г/100 мл) и жира (менее 3,5 г/100 мл), так как они не обеспечивают нутритивные потребности пациентов с МВ [341].
(УУР – C, УДД – 5).
- При недостаточной прибавке в весе у пациентов с муковисцидозом рекомендуется отдавать предпочтение высококалорийным смесям, имеющим в качестве жирового компонента СЦТ и растительные жиры в эмульгированной форме, что позволяет улучшить утилизацию жира и снизить дозу панкреатических ферментов [342].
(УУР – C, УДД – 5).
Комментарии: этим требованиям отвечают отдельные смеси для недоношенных и маловесных детей.
Могут применяться: Антирефлюксная смесь, Жидкая специальная молочная смесь для вскармливания недоношенных и маловесных детей, Специализированный продукт детского диетического лечебного питания для детей раннего возраста, смесь специализированная сухая безлактозная (мелкий сухой порошок), Сухая специализированная смесь без лактозы, Сухая специальная молочная смесь для вскармливания недоношенных и маловесных детей и другие.
При смешанном/искусственном вскармливании большинство младенцев, при своевременной диагностике панкреатической недостаточности и ее коррекции панкреатическими ферментами, хорошо растут и развиваются при использовании обычных адаптированных молочных смесей с преобладанием сывороточных белков в составе белкового компонента (60:40).
- Рекомендовано назначение смесей на основе гидролизатов молочного белка при аллергии к белкам коровьего молока и временно – после оперативного вмешательства по-поводу мекониевого илеуса или СДИО или других оперативных вмешательствах на кишечнике с лечебной целью [341].
(УУР – C, УДД – 5).
- Пациентам, получающим массивную антибактериальную терапию, а также повторные курсы противомикробных препаратов системного действия, рекомендовано ввести адаптированную кисломолочную смесь или смесь, обогащенную пробиотиками, в количестве до 1/3 суточного объема кормления для поддержания нормальной микрофлоры кишечника [341].
(УУР – C, УДД – 5).
- Прикорм рекомендуется вводить в 4–5 мес. (как и в популяции здоровых детей), а некоторым детям, при низкой прибавке в массе - раньше с целью коррекции данных нарушений (табл. 31) [341].
(УУР – C, УДД – 5).
Комментарий: первыми блюдами прикорма служат энергетически плотные блюда: каши на сцеженном молоке или молочной смеси со сливочным маслом, детский творог 4,5-5% жирности, далее вводят овощное пюре с мясным пюре и растительным маслом, желток.
Следует использовать высококалорийные продукты прикорма, обогащенные витаминно-минеральным комплексом: детские молочные каши промышленного производства с добавлением сливочного масла, овощные пюре с добавлением растительного масла, мяса.
Возможно введение мясного пюре в качестве первого прикорма детям на естественном вскармливании, как хороший источник железа и цинка.
Коровье и козье молоко можно использовать только для приготовления блюд с 8–9 месяцев. В эти же сроки можно вводить неадаптированные кисломолочные продукты (кефир, натуральный йогурт), обогащенные живыми бифидо- и лактобактериями. Блюда прикорма, в отличие от здоровых детей, подсаливают. Дополнительное количество поваренной соли в день ориентировочно составляет 1/8 чайной ложки (0,6 – 0,7 г) для ребенка первого полугодия и ¼ ч. л. (1,25 г) для ребенка 6-12 месяцев [341].
Таблица 31. Особенности введения прикорма детям первого года жизни с МВ
Продукты и блюда | Возраст (мес.) |
|---|
Фруктовое пюре | 7 |
Творог | 4 - 5 |
Желток | 5 - 6 |
Овощное пюре | 5 - 6 |
Растительное масло | 4 - 5 |
Каша | 4 (на сцеженном грудном молоке, молочной смеси или гидролизате) |
Сливочное масло | 4-5 |
Мясное пюре | 4,5 – 5,5 |
Неадаптированные кисломолочные напитки (кефир, йогурт) | 8 – 9 |
Сухари, хлеб | 7 – 8 |
Рыба | 8 - 9 |
3.3.3 Питание дошкольников, школьников и взрослых
Стандартные принципы питания одинаковы для детей, подростков и взрослых.
Основной принцип - «активный» подход к питанию пациента с МВ в любом возрасте:
o Питание ребенка должно быть регулярным (6 раз в день даже для школьников, а также для взрослых, формула 3+3): 3 основных приема пищи (завтрак, обед, ужин) и 3 дополнительных перекуса (2-й завтрак, полдник, на ночь);
o Питание должно быть «плотным»: в каждый основной прием пищи должны включаться блюда, содержащие качественные животные белки, цинк (мясо, субпродукты, рыба, яйца или молочные продукты – сыр, творог), качественные жиры (растительное, сливочное масло, сметана, сливки), сложные (крупы, хлеб, овощи) и в меньшей степени простые (фрукты, сладости, варенье, мед) углеводы;
o Дополнительные приемы пищи (перекусы: 2-й завтрак, полдник, перед сном) обязательны при дефиците массы тела; они состоят, как правило, из кисломолочных продуктов, творога, фруктов, выпечки и умеренного количества сладостей.
При муковисцидозе до 10% пациентов к подростковому возрасту формируют фиброз и цирроз печени, ассоциированный с МВ; до 13% пациентов к 20-летнему возрасту и до 50% к 30 годам формируют МВ - ассоциированный сахарный диабет. Поэтому, несмотря на то что при МВ, при отсутствии аллергических реакций, в международных рекомендациях разрешены любые продукты, некоторые блюда не рекомендуется употреблять постоянно и в больших количествах:
o продукты и блюда, осложняющие работу печени и желчевыводящих путей - тугоплавкие и транс-жиры (см. выше), крепкие бульоны, острые, кислые блюда и пряности;
o продукты промышленного производства, содержащие большое количество стабилизаторов, искусственных красителей и консервантов, майонез промышленного производства;
o т.н. «мусорную пищу», готовые сухие полуфабрикаты, фаст-фуд;
o сладкие газированные напитки и неразбавленные фруктовые напитки промышленного производства;
o в большом количестве и отдельно от других приемов пищи – рафинированные простые углеводы (сахар, конфеты) с целью не допускать резкого подъема уровня гликемии;
o при диспепсических явлениях – большие объемы продуктов, усиливающих газообразование в кишечнике: цельнозерновой и отрубной хлеб, свежую и кислую белокочанную, краснокочанную капусту, бобовые, свеклу, кожицу и семечки от фруктов, орехи, грибы.
- При бронхолегочных обострениях, значительном отставании в весе для увеличения поступления энергии, высококачественного белка, витаминов и минеральных веществ в качестве перекусов рекомендуется использовать специализированные высокоэнергетические коктейли или смеси для энтерального питания [2,62].
(УУР – C, УДД – 5).
- Рекомендовано обогащение рациона полиненасыщенными жирными кислотами, кальцием, пробиотиками для восполнения повышенных нутритивных потребностей пациентов с МВ (см. раздел 3.3.1 «Общие принципы диетотерапии у пациентов с МВ», жиры). С целью обогащения рациона омега-3 жирными кислотами рекомендовано использовать слабосоленую (не копченую) жирную морскую рыбу: сельдь, семгу, форель и др. лососевые, икру 3-4 раза в неделю в качестве закуски [62].
(УУР – C, УДД – 5).
- Растительное масло (льняное, тыквенное, кедровое, масло грецкого ореха, соевое, рапсовое, подсолнечное, кукурузное, оливковое) рекомендуется использовать в нерафинированном виде без термической обработки, добавляя в салаты и готовые овощные блюда, для приготовления домашнего майонеза с целью обогащения рациона полиненасыщенными жирными кислотами и биологически активными веществами [2,62].
(УУР – C, УДД – 5).
- Пациентам с МВ рекомендуется ежедневно употреблять, как основной источник кальция и высококачественного белка - необезжиренные молоко, творог, сыр, кисломолочные продукты, обогащенные живыми штаммами пробиотиков (бифидобактерий и лактобактерий) – йогурты короткого срока хранения, биокефир и т.п. [2,62].
(УУР – C, УДД – 5).
- При формировании сахарного диабета, ассоциированного с муковисцидозом (МАСД), рекомендуется калорийность рациона и содержание жиров сохранять повышенным для восполнения повышенных нутритивных потребностей пациентов с МВ [2,49,62,91] (см. раздел 3.1.6 «Терапия эндокринной недостаточности поджелудочной железы (МАСД)»).
(УУР – C, УДД – 5).
3.3.4 Микронутриенты и витамины
- Всем детям с МВ рекомендовано подсаливание пищи с целью коррекции баланса хлора и натрия (табл.32,33) [2,62].
(УУР – C, УДД – 5).
Таблица 32. Суточные потребности в соли (NaCl) у детей с МВ [2,62]
Вес ребенка/ температура окружающей среды | < 5 кг | 5 – 10 кг | > 10 кг |
|---|
20 ºС | 0,8 г/день | 0,5 г/день | Минимум + 0,8 г/день/10 кг |
25 ºС | 1,5 г/день | 2 г/день | Минимум 2 г/день + 1 г/день/10 кг |
30 ºС | 2,8 г/день | 4 г/день | Минимум 4 г/день + 2 г/день/10 кг |
Примечание: старшие дети, как правило, сами регулируют количество соли в своих блюдах по принципу «солонка на столе».
Таблица 33. Профилактические дозы натрия для пациентов с МВ [62]
Возраст | Дотация натрия | Примечания |
|---|
Дети 0-6 мес. | 1–2 ммоль/кг/дн. | Для детей с риском соледефицита – соль, разведенная в воде или фруктовом соке небольшими порциями в течение дня |
Детям по показаниям (см. примечания) | до 4 ммоль/кг/дн. | У грудных детей, проживающих в жарком климате или при повышенных потерях жидкости (рвота, повышенная температура тела, диарея, тахипноэ, или при наличии кишечной стомы у грудного ребенка) |
Дети после 6 мес. и взрослые | Соленая пища или соль | Применять в стрессовых ситуациях с избыточной потливостью (лихорадка, физические нагрузки, жаркая погода) |
Примечания: 1/5-1/6 чайной ложки примерно соответствует 15 ммоль NaCl солевых растворов, предназначенных для пероральной регидратации [2];
Для перевода ммоль в мг натрия, хлора или натрия хлорида необходимо умножить количество ммоль на 23, 35 или 58 (молекулярную массу натрия, хлора или натрия хлорида) соответственно [62].
- Всем пациентам с МВ рекомендовано дополнительное введение препаратов кальция: с целью профилактики недостаточности кальция в организме и остеопенических состояний [2,62].
(УУР – C, УДД – 5).
Комментарии: применяются препараты кальция (кальция глюконат**, кальция глицерофосфат) и комбинированные препараты (Кальция карбонат + Колекальциферол).
- Всем пациентам с МВ рекомендовано назначение жирорастворимых витаминов с целью восполнения дефицита их поступления с пищей на фоне мальдигестии и мальабсорбции [2,62,96,342].
(УУР – C, УДД – 5).
Комментарий: вследствие мальабсорбции жира у пациентов с МВ нарушается всасывание жирорастворимых витаминов.
У пациентов с МВ хорошо известно о недостаточности витамина D и нарушениях фосфорно-кальциевого обмена. Лечебный эффект высоких доз витаминов А и D нуждается в дальнейшем изучении. Однако хорошо известно, что все пациенты с МВ с панкреатической недостаточностью ежедневно должны получать дополнительно жирорастворимые витамины (А, D, Е и К) и бета-каротин, оптимально в водорастворимой форме. Пациенты с сохранной функцией поджелудочной железы обязательно должны получать дополнительно витамин Е (Другие витаминные препараты, A11HA03 Токоферол (витамин E) и Витамин D и его аналоги. Водорастворимые витамины назначаются пациентам с МВ в обычных профилактических дозировках, рекомендуемых здоровым лицам соответствующего возраста, за исключением витамина С, потребность в котором у пациентов повышена, и витамина В12 случаях резекции подвздошной кишки.
В таблице 34 приведены рекомендуемые профилактические дозировки для дополнительного введения жирорастворимых витаминов, и терапевтические дозы витамина D для пациентов с МВ.
Таблица 34. Рекомендуемые профилактические дозы жирорастворимых витаминов и бетакаротена для пациентов с МВ [2,62,96,274,343,282,283].
Витамины | Дозировка (МЕ/сут) | Форма выпуска для РФ |
|---|
#Колекальциферол** Сывороточный 25 (ОН) D минимум– более 30 нг/мл | Дети 1 года жизни 1-3 года 4-10 лет > 11 лет | 1000-1500 МЕ/сут. 1500-2000 МЕ/сут. 2000-3000 МЕ/сут., от 2000 (лето, осень) до 4000 (зима, весна) МЕ/сут. Доза зависит от сывороточного уровня и должна регулярно корректироваться | 1 капля = 500 МЕ (12,5 мкг) |
#Альфа-Токоферола ацетат или Витамин Е Уровень соотношения ɑ-токоферол:холестерин > 5,4 Мониторинг по показаниям, после изменения дозы | 0-6 мес. 6-12 мес. 1-4 года 4-10 лет Старше 10 лет | 25 МЕ (18,4 мг) 50 МЕ (36,8 мг) 100 МЕ (73,5 мг) 100-200 МЕ (73,5 – 147,1 мг) 200-400 МЕ (147,1 – 294,1 мг) | 30% масляный р-р: 1капля = 6,5 МЕ (4,8 мг) 10% масляный р-р: 1 капля = 2 МЕ (1,47 мг) Масляный раствор в капсулах 100 МЕ (73,5 мг), 200 МЕ (147,1 мг), 400 МЕ (294,2 мг) |
#Менадиона натрия бисульфит (таблетки противопоказаны до 3 лет, раствор для внутримышечного введения – без возрастных ограничений) Протормбиновое время, уровень витамина К в крови | 0 – 1 год: 0,3 – 1 мг/сут. Старше 1 года: 1 – 10 мг/сут. При патологии печени: 10 – 15 мг/сут. | 1 таблетка 15 мг |
Ретинол** Нормы определяются лабораторией, проводящей анализ Мониторинг по показаниям, после изменения дозы Тест при планировании беременности | Начинать с низких доз. Подбирать по уровню в сыворотке крови (ежегодный контроль) | 1 капля 3,44% р-ра = 5000 МЕ (1,5 мг) 1 драже = 3300 МЕ (1 мг) 1 капсула = 12000 МЕ (3,6 мг) |
0-1 год 1-6 лет 7 лет и старше | 1650 МЕ (0,5 мг) 3300 МЕ (1 мг) 5000 МЕ (1,5 мг) |
#Бетакаротен | Начать с 1 мг/кг/сут. – 12 недель, далее поддерживающая доза – 10 мг/сут. | 1 капля = 1 мг |
Примечания: * - терапевтические дозы витамина D указаны в таблице 22 (терапия остеопороза).
Могут применяться комбинированные препараты, например, Витамин Е + Ретинол.
Особенности витаминотерапии на фоне таргетной терапии
- Рекомендуется при возможности проводить мониторинг уровня жирорастворимых витаминов (A, исследование уровня 25-ОН витамина Д в крови E, K) в крови 2 раза в год с решением вопроса о целесообразности их применения в связи с возможностью гипервитаминоза [344,345].
(УУР – C, УДД – 4).
Комментарии: накапливаются данные о том, что таргетная терапия, вероятно, повышает всасываемость и биодоступность жирорастворимых витаминов, увеличивая вероятность более частых проявлений токсического эффекта. Отмечается повышение концентрации витаминов А и D через 1 и более месяцев от старта таргетной терапии, уровень витиамина Е не менялся [491].
Особую настороженность вызывают случаи гипервитаминоза витамина А. Одним из самых частых, из описываемых в публикациях, симптомов гипервитаминоза вит. А является - отек диска зрительного нерва, на фоне повышения внутричерепного давления, выявлемый при офтальмологическом обследовании. При этом концентрация вит. А в крови у этих пациентов варьировалась от нормы до повышенных значений. Описан случай фульминантного повышения внутричерепного давления с отеком диска зрительного нерва у 11-летней девочки (E193X / N1303K) через 8 мес. от старта таргетной терапии [492].
3.3.5 Агрессивные методы нутритивной поддержки у пациентов с МВ
К «агрессивным» методам нутритивной поддержки у пациентов с МВ относятся:
1. Зондовое энтеральное питание в виде ночной гипералиментации, через назогастральный зонд или через перкутанную низкопрофильную гастростому (трубки питательные гастростомические и еюнальные MIC, MIC-KEY с принадлежностями).
Показаниями к установке гастростомы служит ИМТ <10 перцентиля (услуги: гастростомия (Гастростомия открытым доступом/ Гастростомия лапароскопическим доступом/Гастростомия эндоскопическим доступом/Гастростомия чрескожным доступом), закрытие гастростомы).
Следует проводить замену гастростомической трубки в среднем, 1раз/6 мес. Гастростомию выполняет хирург, в условиях хирургическое отделения. С помощью ночной гипералиментации, при адекватном контроле панкреатическими заменителями, можно дополнительно обеспечить от 30 до 50% рассчитанной энергопотребности [9].
2. Парентеральное питание
o Полное (центральный венозный катетер); показаниями являются:
- состояния после операции на кишечнике;
- синдром короткой кишки;
- острый панкреатит.
o Частичное (с целью дополнительного питания), используется периферическая вена:
- жировые эмульсии;
- глюкозо-аминокислотные смеси, витамины.
- Рекомендовано применение «агрессивных» методов нутритивной поддержки при:o отсутствии прибавки в весе или снижении веса в течение 6 месяцев;o фактической массе тела ниже 3 перцентиля;o фактической массе тела ниже должного значения на 15% или менее 25 перцентиля на фоне дополнительного питания специальными смесями [2,21,62].
(УУР – C, УДД – 5).
Комментарий: «агрессивные» методы нутритивной поддержки показали весьма высокую эффективность, в особенности у пациентов с МВ с выраженными нарушениями нутритивного статуса. Однако, оптимальные методики, схемы применения, виды и способы введения питательных смесей, способы заместительной ферментной терапии при проведении зондовой гипералиментации нуждаются в дальнейшей отработке в практике отечественной пульмонологии и педиатрии.
Показано, что только применение энтерального зондового питания через гастростому достоверно приводит к улучшению нутритивного статуса пациентов с МВ.
3.3.6 Программы ЭВМ для подбора диеты и ферментной терапии для врачей и пациентов
Разработаны программы для ЭВМ, которые направлены на оптимизацию комплексной терапии муковисцидоза и применяются в ряде регионов РФ [346]. Программа ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе» (Государственная регистрация № 2016 660762 от 21.09.16 г.) позволяет сократить трудозатраты врача при расчетах индивидуальной диеты и дозы заместительной ферментной терапии. Мобильная версия программы ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе. Мобильная версия» (Государственная регистрация № 2017 661283 от 09.10.17 г.) помогает пациентам самостоятельно подбирать дозу ферментов на каждый прием пищи; в режиме онлайн передавать данные (в деперсонифицированном виде) о физическом развитии, рационе питания, дозах панкреатина для консультации с лечащим врачом, обучает контролю над своим заболеванием. Использование данных программ показало свою эффективность в клинической практике [260,346,347,348].
3.4 Хирургическое лечение
Хирургическое лечение эпизодов кровохарканья и легочных кровотечений.
При неэффективности консервативных методов, нарастании эпизодов кровохарканья и развитии легочных кровотечений пациентам с МВ рекомендовано хирургическое пособие с целью остановки кровотечения [280,282,283,284].
(УУР – C, УДД – 5).
Комментарий: методикой выбора является эмболизация бронхиальных артерий (Эндоваскулярная эмболизация сосудов), достаточная простая процедура, заключающаяся в эндоваскулярной эмболизации кровоточащего сосуда инертными материалами. Эмболизация позволяет купировать эпизоды кровохарканья или значительно отсрочить следующие в 2/3 случаев. Также может проводиться эндоскопическая клапанная бронхоблокация (Эндоскопическая клапанная бронхоблокация). Резекция кровоточащего сегмента, доли или целого легкого может проводиться только в чрезвычайных случаях по витальным показаниям.
Нарастание легочных кровотечений и невозможность их контролировать эмболизацией – показание для рассмотрения пациента как кандидата на трансплантацию легких.
Хирургическое лечение пневмоторакса
- Лечение пневмоторакса у пациентов с МВ рекомендуется проводить согласно клиническим рекомендациям по пневмотораксу с целью выбора оптимальной тактики ведения пациента [280,281,335].
(УУР – C, УДД – 5).
Комментарии: пневмоторакс, по данным Национального Регистра, в Российской Федерации встречается ежегодно у 1,5% взрослых пациентов с муковисцидозом, что намного чаще чем у детей (0,2%), и является следствием разрыва субплевральных булл. При рецидивах его рассматривается необходимость применения плевродеза (Облитерация плевральной полости). В таком случае манипуляцией выбора является локальный химический плевродез (Облитерация плевральной полости) или плеврэктомия. К таким операциям, как резекция субплевральных булл, необходимо относится с осторожностью, учитывая возникновение дополнительного спаечного процесса, что может затруднять в дальнейшем трансплантацию легких.
Хирургическое лечение хронического риносинусита
- Рекомендуется эндоскопическое хирургическое лечение хронического риносинусита (ХРС) (Полисинусотомия с использованием видеоэндоскопических технологий) на фоне муковисцидоза при выраженном затруднении носового дыхания за счет назального полипоза и/или медиализации латеральной стенки полости носа; некупируемом консервативными методами обострении инфекционно-воспалительного процесса в ОНП, который рассматривается в качестве важной причины контаминации бронхолегочной системы; развитии синусогенных орбитальных и/или внутричерепных осложнений; необходимости санации полости носа и ОНП перед трансплантацией легких [349,350,351,352].
(УУР – В, УДД – 3).
Комментарий: для детей и взрослых пациентов оптимальным методом хирургического лечения ХРС во всем мире признана расширенная эндоскопическая функциональная риносинусохирургия (FESS-Functional Endoscopic Sinus Surgery) – малоинвазивный, органосохраняющий, физиологичный метод хирургического лечения заболеваний носа и околоносовых пазух. По классификации P. J. Wormald (Австралия, 2012), расширенная FESS включает в себя полипотомию в сочетании с полисинусотомией (максимально широким вскрытием всех пораженных полипозом пазух, расширением соустий верхнечелюстных пазух до 7 мм и более, вскрытием клеток решетчатого лабиринта с обнажением основания черепа). Показаниями к хирургическому лечению являются: выраженное затруднение носового дыхания за счет назального полипоза и/или медиализации латеральной стенки полости носа; некупируемое консервативными методами обострение инфекционно-воспалительного процесса в ОНП, который рассматривается в качестве важной причины контаминации бронхолегочной системы; развитие синусогенных орбитальных и/или внутричерепных осложнений; санация полости носа и ОНП перед трансплантацией легких. Изолированная оценка результатов КТ ОНП не может служить показанием к хиругическому лечению. На данный момент есть убедительные доказательства снижения степени контаминации нижних дыхательных путей после ринохирургического лечения. Тем не менее, пациенты и/или родители/законные представители должны быть информированы, что хирургическое лечение не является средством излечения от ХРС и назального полипоза и о высокой вероятности рецидивов и потребности в повторных вмешательствах.
Трансплантация печени
- Рекомендовано направить пациента с муковисцидозом и выраженной портальной гипертензией (даже при относительно сохранной функции печени и до наступления терминальной стадии цирроза печени)к врачу-трансплантологу для оценки возможности и сроков проведения трансплантации печени [1,2,21,509].
(УУР – C, УДД – 5).
Комментарий: радикальный метод лечения. Первая операция в РФ проведена только в 2009 г.
Раннее рассмотрение вопроса о трансплантации печени может снизить риски осложнений и улучшить долгосрочный прогноз.
- На основании критериев Чайлд–Пью и оценки степени портальной гипертензии (включая данные инструментальных исследований, таких как эластометрия печени и отношение уровня АСТ к тромбоцитам [APRI]) рекомендовано более раннее рассмотрение вопроса о трансплантации печени у пациентов, находящихся на стадии В или имеющих выраженные признаки портальной гипертензии даже при сохранной функции печени, а не только у пациентов стадии С для снижения рисков осложнений и улучшения долгосрочного прогноза [508,509].
(УУР – C, УДД – 5).
Хирургическое лечение мекониевого илеуса
- Пациентам с МВ и мекониевым илеусом при отсутствии возможности консервативного лечения или при его неэффективности рекомендуется проведение оперативного лечения с целью разрешения кишечной непроходимости и предотвращения осложнений [123,290,353].
(УУР – C, УДД – 4).
Комментарии:
Оперативное лечение
Диагностическая лапароскопия → лапаротомия (преимущественно правосторонним нижнепоперечным доступом, удобным для выведения илеостомы).
Интестинотомия на границе расширенной и суженной кишки.
Опорожнение отводящего отдела кишечника.
Биопсия тонкой кишки оперативная, биопсия ободочной кишки оперативная (Поэтажная биопсия кишки).
Выведение кишечной стомы на границе расширенной и суженной кишки (операция выбора).
Наложение межкишечного анастомоза (при достаточном опыте оперирующего хирурга и отсутствии сомнений в патологии толстой кишки, желательно с проведением интраоперационной биопсии).
Послеоперационное ведение:
По восстановлении пассажа по кишечнику энтеральная нагрузка не ранее 3 послеоперационных суток.
Расширение объема кормления при адекватной толерантности объему кормления.
Приоритетно грудное молоко, необходимо строгое соблюдение матерью щадящей диеты.
При подозрении на муковисцидоз назначение панкреатина** из расчета начальной дозы 600-800 ед. липазы на 1 грамм жира в смеси или в грудном молоке [21,290]. Допустимые значения коэффициента от 500 до 4000 ЕД, в среднем 1800 ед. липазы на 1 г жира [255].
При больших потерях по кишечной стоме переход на лечебные смеси с частичным или полным гидролизом белка.
Уход за отводящим отделом кишечника.
Верификация причин возникновения:
- Морфология биоптата (Патологоанатомическое исследование биопсийного (операционного) материала тонкой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала ободочной кишки).
- Генетическое исследование (Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови, Комплекс исследований для диагностики муковисцидоза).
- Определение активности панкреатической эластазы-1 в кале Консультация специалиста по муковисцидозу (Прием (осмотр, консультация) врача-пульмонолога первичный и Прием (осмотр, консультация) врача-пульмонолога повторный) и/или Прием (осмотр, консультация) врача-педиатра первичный/Прием (осмотр, консультация) врача-педиатра повторный.
- Верификация внутриутробной инфекции (согласно соответствующим клиническим рекомендациям).
Осложнения кишечной стомы
- Эвагинация кишки.
- Перистомальный дерматит.
- Парастомальная грыжа.
- Мальабсорбция на фоне кишечной стомы.
- Отсутствие прибавки в весе.
Радикальный этап хирургической коррекции
1. Плановая через 2-3 месяца после первичной операции при:
- Стабилизации состояния пациента;
- Адекватной прибавки в весе;
- Смене внутрибольничной флоры на «домашнюю».
2. Срочная - через 2-3 недели после первичной операции:
- Отсутствие возможности достичь возрастного объема кормления;
- Некорригируемые потери по стоме;
- Сохраняющаяся зависимость от инфузионной терапии;
- Клинически значимые очаги инфекции в отключенном отделе кишки;
- Осложнения кишечной стомы, создающих угрозу жизни пациента.
3. Обязательное предоперационное обследование:
- Результаты микроскопического обследования (Микроскопическое исследование мокроты на микобактерии (Mycobacterium spp.));
- Исследование микробиологического пейзажа (Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы, Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы);
- Антеградная рентгенконтрастная ирригоскопия;
- Получение результатов нормальной морфологии биоптата стенки кишки.
Оперативное лечение радикального этапа хирургической коррекции
Закрытие кишечной стомы с наложением межкишечного анастомоза.
Примечание:
- Любой вариант врожденной низкой кишечной непроходимости у новорожденного требует проведения дообследования у ребенка на муковисцидоз, а наличие внутриутробного псевдокистозного перитонита у новорожденного позволяет максимально рано заподозрить смешанную форму муковисцидоза и начать лечение уже с периода новорожденности (см. раздел «Клиническая картина заболевания или состояния (группы заболеваний или состояний)») [353].
- Необходимо стремиться к как можно более раннему закрытию кишечной стомы.
Хирургическое лечение микобактериозов у пациентов с МВ
- Рекомендуется пациентам с МВ и микобактериозом выполнить оперативный этап лечения при неэффективности антимикробной терапии: прогрессирование воспаления с образованием полостей распада, развитие осложнений микобактериоза (кровохарканье, рецидивирующие инфекции респираторного тракта, присоединение аспергиллеза и т.д.) [222,450,458].
(УУР – С, УДД – 5).
Комментарии: противопоказаниями к проведению операции служат: большая распространенность процесса (двустороннее поражение легких), наличие тяжелой сопутствующей патологии, выраженных дыхательных нарушений) [222,450,458].
Вопрос о возможности и сроках проведения хирургического вмешательства решается ВК с участием врача-хирурга/врача-детского хирурга и врача-анестезиолога-реаниматолога (с согласия родителей/ законного представителя).
Трансплантация легких
- Рекомендовано направить пациента с муковисцидозом тяжелого течения, торпидного к терапии, частыми обострениями и осложнениями к врачу-трансплантологу для решения вопроса о проведении трансплантации легких [354].
(УУР – C, УДД – 5).
Комментарии: в мировой практике трансплантация лёгких (ТЛ) является общепризнанным методом лечения пациентов в терминальной стадии заболеваний лёгких различной этиологии. Среди показаний к ТЛ у пациентов старше 18 лет муковисцидоз (МВ) занимает 3 позицию, уступая ХОБЛ и лёгочному фиброзу, и занимает первое место у пациентов детского возраста от 6 до 17 лет. ТЛ при тщательном отборе пациентов достоверно улучшает показатели выживаемости и качество жизни. Медиана продолжительности жизни пациентов после ТЛ по поводу МВ характеризуется наилучшими показателями при сравнении с другими заболеваниями и составляет более 11 лет.
Основанием для направления пациента с МВ в Центр трансплантации (ЦТ) является:
1. ОФВ1 ≤30% или прогрессивное снижение показателя ОФВ1, несмотря на максимально возможную терапию;
2. Дистанция в тесте 6-минутной ходьбы менее 400 м;
3. Развитие лёгочной гипертензии в отсутствие гипоксемической дыхательной недостаточности;
4. Прогрессивное ухудшение состояния пациента, приводящее к частым госпитализациям вследствие:
a. Развития и нарастания дыхательной недостаточности с потребностью в проведении НИВЛ;
b. Повышения антибиотикорезистентности, ухудшения клинического восстановления при обострениях, роста частоты обострений и госпитализаций;
c. Ухудшения нутритивного статуса, несмотря на дополнительное энтеральное питание;
d. Рецидивирующих пневмотораксов;
e. Лёгочных кровотечений и кровохарканий, резистентных к эмболизации бронхиальных артерий.
Целью обращению в ЦТ является установление показаний и исключение противопоказаний к трансплантации лёгких.
Показания к трансплантации лёгких:
Хроническая дыхательная недостаточность (гипоксемическая форма PaO2<60 мм рт.ст.; гиперкапническая форма PaCO2 >50 мм рт.ст.);
Длительная неинвазивная вентиляция лёгких;
Лёгочная гипертензия (СДЛА>35 мм рт.ст при ЭХО-КГ, или СДЛА> 25 мм.рт.ст. по результатам катетеризации сердца);
Частые обострения заболевания, требующие стационарного лечения;
Прогрессивное снижение показателей функции внешнего дыхания;
4 функциональный класс по NYHA.
Противопоказания к трансплантации лёгких делятся на абсолютные и относительные. Вклад последних в принятие решения о постановке в лист ожидания определяется на основании локальных протоколов и собственного опыта ЦТ.
Абсолютные противопоказания к трансплантации легких:
Наличие в анамнезе злокачественных онкологических заболеваний со сроками ремиссии после соответствующей терапии менее 5 лет (исключение – рак кожи T1-2N0M0, после радикального лечения, с ремиссией более 2 лет);
Тяжелая дисфункция или заболевание других органов и/или систем при отсутствии возможности симультантной коррекции;
Тяжелое состояние пациента, характеризующееся нарушением витальных функций организма (острое нарушение мозгового кровообращения, отсрый инфаркт миокарда и т.д.);
Некоррегируемые нарушения гемостаза;
Хроническая персистирующая неконтролируемая микробная инфекция, туберкулёз;
Выраженная деформация грудной клетки и позвоночника;
ИМТ ≥35 кг/м2;
Психические нарушения с потерей дееспособности, адекватного контакта, зависимости от психоактивных веществ, алкоголя и/или табака;
Отсутствие комплаентности и надлежащей социальной поддержки.
Относительные противопоказания к трансплантации легких:
Возраст старше 65 лет;
Ожирение 1 степени (ИМТ 30,0–34,9 кг/м2);
Прогрессирующее или тяжелое истощение (ИМТ менее 15 кг/м2);
Тяжелый остеопороз с наличием патологических переломов или болевого синдрома;
Предшествующие операции на грудной клетке с резекцией легких и/или проведением плевродеза;
Искусственная вентиляция легких и/или наличие у реципиента вспомогательного кровообращения и/или экстракорпоральной мембранной оксигенации;
Внелегочная колонизация или инфицирование высокорезистентными или высоковирулентными бактериями или грибами;
Наличие хронического вирусного гепатита В и/или С, ВИЧ-инфекции и/или СПИДа;
Хроническое инфицирование дыхательных путей такими микроорганизмами, как Burkholderia cepacia, Mycobacterium abscessus;
Другие заболевания или состояния без клинических признаков терминального поражения органов-мишеней.
Показания к направлению в ЦТ и постановке в лист ожидания пациента детского возраста в целом не отличаются от таковых у пациентов старше 18 лет. Однако в каждом конкретном случае взвешенное решение принимается консилиумом в составе хирургов-трансплантологов, анестезиологов, педиатров, пульмонологов и специалистов по муковисцидозу.
Пациентам с необратимой дисфункцией печени и лёгких, при отсутствии тяжёлой коморбидности и наличии возможности выполнения комбинированной трансплантации, следует рассмотреть проведение одновременной трансплантации лёгких и печени. С точки зрения технического исполнения, оптимальной тактикой признан подход «liver first» (пересадка печени первым этапом операции). Такие операции следует выполнять в крупных центрах, где функционируют обе программы: пересадки печени и лёгких [509,510].
3.5. Репродуктивное здоровье мужчин с муковисцидозом
Диагностику состояния репродуктивной системы мужчин с МВ см. в разделе 2 «Диагностика».
- Рекомендуется пациентам мужского пола с муковисцидозом, имеющим азооспермию/криптозооспермию, проведение биопсии тестикул (биопсия яичка) (с 18-летнего возраста). При получении сперматозоидов, пригодных для оплодотворения, возможно их использование в процедурах ЭКО/ICSI (и криоконсервация при возможности и необходимости), при отсутствии сперматозоидов – рекомендовано использование донорских гамет в программах ВРТ для сохранения возможности деторождения [101,104,130].
(УУР – C, УДД – 5).
- Рекомендуется пациентам мужского пола в возрасте с 15 лет с муковисцидозом без азооспермии/криптозооспермии криоконсервация сперматозоидов (по возможности ранняя) (Криоконсервация гамет (ооцитов, сперматозоидов)) для последующего их использования в программах ЭКО/ICSI для возможности деторождения, в частности у носителей патогенного варианта 3849 + 10kbC>T в гене CFTR [99,355].
(УУР – C, УДД – 4).
3.6 Беременность при муковисцидозе
Планирование беременности у женщин с любым тяжелым экстрагенитальным заболеванием является важным фактором профилактики осложненного течения беременности и залогом успешного её завершения.
Подготовка к беременности должна проводится по трем направлениям:
- Генетическое консультирование с целью уточнения риска рождения ребенка с муковисцидозом (Прием (осмотр, консультация) врача-генетика первичный и Прием (осмотр, консультация) врача-генетика повторный).
- Оценка клинического и функционального состояния пациентки:- весоростовые характеристики,- показатели респираторной функции,- инфекция дыхательных путей,
- Социальная адаптация (помощь в понимании последствий принятого решения).
Пациентка должна быть осведомлена о возможном взаимном влиянии муковисцидоза и беременности, риске рождения ребенка с муковисцидозом. Принимая во внимание наличие тяжелого недуга у матери, следует уточнить, кто при необходимости, будет оказывать помощь в уходе за ребенком. Существенным моментом при тяжелом течении заболевания является планирование будущего для ребенка.
Во время беременности дыхательная система женщины претерпевает значительные анатомические и функциональные изменения:
Подъем диафрагмы до 4 см;
Снижение ОЕЛ, ФОЕ, ОО;
Увеличение минутной вентиляции;
Рост потребления кислорода;
Гиперсекреция и отек слизистой дыхательных путей (преимущественно в третьем триместре).
Снижение легочных объемов в сочетании с бронхиальной обструкцией (ОФВ1<50%) вызывает закрытие мелких дыхательных путей (<2 мм) во время спокойного выдоха, до достижения легочной системой точки равновесия (т.е. достижения ФОЕ). Ранний экспираторный коллапс приводит к затруднению отхождения мокроты у пациентов с муковисцидозом. В случае выраженных обструктивных нарушений высока опасность развития мукостаза, обострения инфекционного процесса, а также изменения диффузионно-перфузионных отношений и развития артериальной гипоксемии.
Энергетические затраты организма матери и плода, возросшие во время беременности, требуют дополнительного усвоения 300 ккал/сутки. Внешнесекреторная недостаточность поджелудочной железы, приводящая к мальдигестии и мальабсорбции, требует особенного внимания к вопросам питания и заместительной терапии у пациенток с муковисцидозом во время беременности.
Во время беременности увеличивается объем циркулирующей плазмы, что приводит к увеличению частоты сердечных сокращений и ударного объема. Механическое сдавление растущим плодом нижней полой вены вызывает дополнительное увеличение преднагрузки. У пациенток, страдающих тяжелой легочной патологией, это может привести к развитию легочной гипертензии, перегрузке правых отделов сердца, развитием сердечной недостаточности [356,357].
Факторы риска жизнеугрожающих осложнений
Наиболее значимым фактором, снижающим показатели выживаемости у родивших женщин, является инфицирование дыхательных путей Burkholderia cepacia complex.
Другими факторами, определяющими неблагоприятный прогноз при беременности у пациентки с муковисцидозом, являются:
Снижение ОФВ1 менее 50% от должного.
Низкий нутритивный статус пациентки, прибавление беременной в весе менее 4,5 кг.
Легочная гипертензия.
Инфицирование дыхательных путей Burkholderia cepacia complex.
Сахарный диабет [358].
- Для определения риска рождения ребенка с муковисцидозом, рекомендовано провести генетическое исследование (Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови) будущего отца ребенка, так как в случае выявления у него мутации в гене CFTR, риск рождения больного ребенка составит 50% [356].
(УУР – C, УДД – 5).
Комментарий: следует также сообщить пациентке, что даже если результат анализа по выявлению наиболее частых мутаций отрицательный, остается риск носительства вторым родителем ребенка неизвестной мутации. В этом случае необходимо дальнейшее генетическое исследование гена МВТР. Если второй родитель не является носителем мутации муковисцидоза, то ребенок будет облигатным носителем одной из мутаций матери, фенотипически здоровым.
- Пациенток с МВ, планирующих беременность, рекомендовано вести мультидисциплинарной командой специалистов в связи с тем, что беременность является дополнительной нагрузкой при имеющемся хроническом заболевании, кроме того, необходимо тщательно подбирать лекарственные препараты для терапии МВ с учетом их эффективности для женщины и безопасности для плода [356].
(УУР – С, УДД – 5).
Комментарий: наряду с наблюдением и лечением у врача-пульмонолога самое пристальное внимание следует уделить оценке нутритивного статуса. Обязателен прием (осмотр, консультация) врача-диетолога. При необходимости назначается лечебное питание.
Оптимизации состояния здоровья (подавление хронической инфекции, улучшение функции внешнего дыхания, компенсация сахарного диабета, адекватное питание и нормализация процессов пищеварения) повышает шансы на скорое наступление беременности и является профилактикой обострения болезни, что позволяет снизить медикаментозную нагрузку в первом триместре, в период органогенеза.
Лечение муковисцидоза во время беременности
- Рекомендовано адекватное (в полном объеме) лечение муковисцидоза у пациенток с беременностью, что является основным методом профилактики осложненного течения беременности и лечения фетоплацентарной недостаточности [356].
(УУР – С, УДД – 5).
Комментарии: особенности физиологической адаптации к беременности, увеличивающие нагрузку на системы дыхания, кровообращения, требующие увеличения энергетических затрат организма матери, определяют необходимость значительного расширения программы лечения этой группы пациенток [356].
Необходимо максимально увеличить калораж суточного рациона беременных, используя высококалорийные пищевые добавки, продолжать заместительную ферментную терапию и при необходимости антацидную терапию. В связи с высокой степенью проникновения блокаторов Н2-рецепторов через плацентарный барьер, рекомендовано заменить их игибиторами протонной помпы.
- Рекомендовано при необходимсти назначения лекарственной терапии беременным пациенткам с МВ осуществлять выбор ЛС в соответствии с классификацией фармакологических препаратов по степени возможного риска для плода с целью предупреждения фетотоксических эффектов [356,359].
(УУР – С, УДД – 5).
Комментарии: классификация лекарственного ущерба для плода:
Категория А - Риск мало вероятен;
Категория В - В испытаниях на животных препарат безвреден; клинические испытания не проводились;
Категория С - В испытаниях на животных доказан потенциальный риск для плода; клинические испытания не проводились;
Категория D - Доказан потенциальный риск для плода; клинический эффект препарата превышает потенциальный риск для плода;
Категория X - Риск для плода доказан и превышает лечебное действие препарата.
Из перечисленных групп только препараты группы Х полностью исключаются во время беременности.
Накапливается положительный опыт применения таргетной терапии при беременности [360]. Тем не менее, исследования на настоящее время еще продолжаются [361,362]. В Инструкциях к зарегистрированным в России препаратам для таргетной терапии беременность не является противопоказанием.
Для лечения хронического инфицирования дыхательных путей золотистым стафилококком и неферментирующей Грам-отрицательной палочкой (преимущественно синегнойная инфекция) во время беременности, необходимо активно продолжать таблетированную, внутривенную и ингаляционную антибактериальную терапию.
К противомикробным препаратам системного действия категории В относятся все препараты из группы пенициллинов и цефалоспоринов, а также меропенем**, азитромицин**, эритромицин, азтреонам (противопоказания: гиперчувствительность)
К противомикробным препаратам системного действия категории С относятся все препараты из группы фторхинолонов, сульфаниламидов, а также имипенем/циластин**, кларитромицин**, гентамицин**, ванкомицин**, линезолид** (противопоказания: гиперчувствительность).
К противомикробным препаратам системного действия категории D относятся все препараты из группы тетрациклинов, аминогликозидов, кроме гентамицина**, а также сульфаниламиды в поздние сроки беременности.
Ингаляционная форма терапии приобретает особенное значение во время беременности, так как позволяет доставлять препараты в бронхиальное дерево, в меньшей степени повышая пороговую концентрацию в крови.
Женщины, инфицированные неферментирующей Грам-отрицательной флорой, нуждаются в проведении нескольких курсов внутривенной антибактериальной терапии за время беременности с учетом возможного риска для плода. Чаще всего применяются цефтазидим**, цефепим**, меропенем** (противопоказания: гиперчувствительность) [356,359].
Кинезитерапия пациенток с муковисцидозом во время беременности
- При беременности пациенткам с МВ рекомендовано максимально интенсифицировать применение муколитических препаратов и кинезитерапии (дыхательные упражнения дренирующие, лечебная физкультура при заболеваниях бронхолегочной системы) для сохранения дренажных функций бронхиального дерева [356,359].
(УУР – С, УДД – 5).
Комментарии: ежедневные занятия кинезитерапией следует продолжать и во время беременности. Дыхательные упражнения не должны вызывать утомления или одышки, порядок их выполнения следует приспосабливать к индивидуальным особенностям пациентки. Необходимо обеспечить возможность выполнения дыхательных упражнений при различных положениях тела (сидя или лежа). Этим требованиям соответствуют такие техники кинезитерапии, как цикл активного дыхания и аутогенный дренаж. Терапия, с помощью дыхательных тренажеров, создающих вибрации бронхиальной стенки и/или положительное давление на выдохе, в том числе, с контролем и регулированием этого давления (специальные маски, Тренажер дыхательный с переменным положительным давлением на выдохе (флаттер) и др.); позволяет увеличить дренажный эффект выполняемых дыхательных упражнений.
Ежедневные физические упражнения также улучшают дренаж бронхиального дерева, однако физическая нагрузка не должна быть максимальной, так как на фоне понижения ФОЕ и повышения потребления кислорода существует опасность развития кислородного голодания для плода. В качестве динамических упражнений можно рекомендовать плавание, гимнастику. В комплекс гимнастики необходимо включить упражнения по укреплению мышц тазового дна [363].
Роды
- Беременным с МВ рекомендовано плановое родоразрешение (программированные роды) вследствие наличия тяжелого экстрагенитального заболевания, обуславливающего риск развития осложнений и возникновения необходимости экстренного оказания акушерских пособий [356,359,364].
(УУР – С, УДД – 5).
Комментарии: роды следует вести через естественные родовые пути с мониторным контролем за состоянием роженицы, сердцебиением плода и характером родовой деятельности. При тяжелом течении болезни необходимо ограничить длительные и сильные потуги. С этой целью рекомендована эпизио- или перинеотомия.
Проведение кесарева сечения у пациенток с муковисцидозом связано с высоким риском инфекционных осложнений, нарушения бронхиального дренажа и усиления бронхиальной обструкции. Ограничение физической активности в раннем послеоперационном периоде и болевые ощущения, провоцируемые кашлем, затрудняют отхождение мокроты. Терапевтическими показаниями для проведения кесарева сечения являются наличие спонтанного пневмоторакса в анамнезе, дыхательная недостаточность со снижением сатурации ниже 92%, показатели функции внешнего дыхания менее 50% от должных величин.
Акушерские показания для абдоминального родоразрешения: декомпенсированная фето-плацентарная недостаточность, острая гипоксия плода, упорная слабость родовой деятельности.
Предпочтительный метод обезболивания родов и кесарева сечения - эпидуральная анестезия.
Послеродовый период
- После рождения ребенка рекомендовано не снижать интенсивность проводимой терапии, так как заботы о новорожденном потребуют от пациентки больших физических сил [356,359].
(УУР – С, УДД – 5).
Комментарий: нарушение режима сна, питания, постоянная занятость заставляют пациенток пренебрегать регулярной киензитерапией, пропускать курсы антибактериального лечения, что приводит к снижению веса, ухудшению респираторной функции.
К лактации и грудному вскармливанию у родильниц с муковисцидозом следует подходить индивидуально. Большинству таких родильниц лактация не противопоказана. Однако при тяжелом течении заболевания и развитии акушерских осложнений, потребовавших досрочного родоразрешения, возникают показания к выключению лактации.
Обсуждая с пациенткой с муковисцидозом ее желание стать матерью, необходимо уточнить, в какой степени члены семьи готовы помочь в уходе за ребенком, так как заботы о новорожденном потребуют больших физических сил.
3.7 Паллиативная помощь
Палллиативная помощь пациентам с муковисцидозом оказывается на основании соответствующих нормативных документов (см. Приложение А3).
Паллиативная помощь — подход, целью которого является улучшение качества жизни пациентов и членов их семей, оказавшихся перед лицом угрожающего жизни заболевания. Эта цель достигается путем предупреждения и облегчения страданий, благодаря раннему выявлению, тщательной оценке и купированию боли и других тягостных физических симптомов, а также оказанию психосоциальной и духовной поддержки [493].
Главная задача паллиативной помощи — достижение, поддержка, сохранение и повышение, насколько это возможно, качества жизни пациента. Однако определить, что такое «качество жизни», может только сам пациент, нуждающийся в паллиативной помощи [494]. Важно не противопоставлять активное (интервенционное) лечение паллиативной помощи, а взаимно их дополнять.
- Рекомендуется оказание доступной паллиативной медицинской помощи детям с кистозным фиброзом (муковисцидозом), комплексно осуществляемой (согласно установленным врачебной комиссией медицинской организации медицинским показаниям) сотрудниками медицинских организаций и их подразделений, оказывающих паллиативную специализированную медицинскую помощь детям (Прием (осмотр, консультация) врача по паллиативной медицинской помощи первичный/ Прием (осмотр, консультация) врача по паллиативной медицинской помощи повторный и др.), в регулярном взаимодействии с семьей для обеспечения потребностей детей и его законных представителей на различных этапах заболевания [437,495,496,497].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется всем детям с муковисцидозом, нуждающимся в оказании паллиативной медицинской помощи, проводить патронаж выездной патронажной бригадой отделения выездной патронажной паллиативной медицинской помощи детям с целью оказания паллиативной специализированной медицинской помощи детям в амбулаторной форме [497].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется включение плановой оценки боли согласно шкалам, соответствующим возрасту и уровню нервно-психического развития ребенка, детям с кистозным фиброзом (муковисцидозом) для подбора обезболивания [498].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
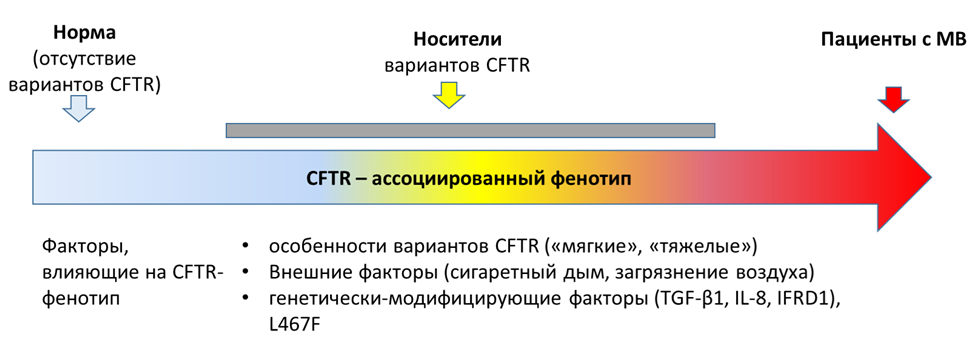 Рисунок 1. Факторы, потенциально модифицирующие фенотипы носителей гена CFTR [420]
Рисунок 1. Факторы, потенциально модифицирующие фенотипы носителей гена CFTR [420] 





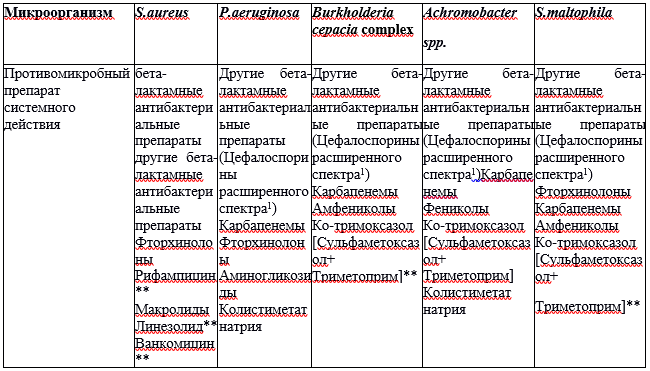
 Алгоритм обследования и тактика решения вопроса репродукции, который зависит от трех составляющих: результатов генетического обследования, результатов спермиологического исследования и статуса фертильности супруги.
Алгоритм обследования и тактика решения вопроса репродукции, который зависит от трех составляющих: результатов генетического обследования, результатов спермиологического исследования и статуса фертильности супруги.
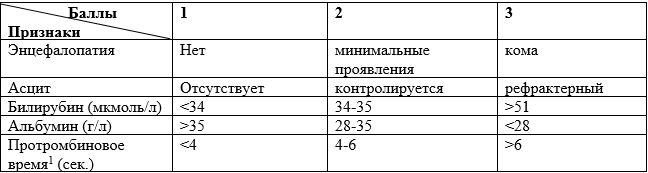
 Ключ:
Ключ: Ключ:
Ключ: