- АД – артериальное давление
- АЛТ – аланинаминотрансфераза
- АМГ – антимюллеров гормон
- АСТ – аспартатаминотрансфераза
- ВА – вагинальная атрофия
- ВВА – вульвовагинальная атрофия
- ВМС-ЛНГ – внутриматочная система, высвобождающая левоноргестрел
- ВОЗ – Всемирная организация здравоохранения
- ВТЭ – венозная тромбоэмболия
- ВТЭО – венозные тромбоэмболические осложнения
- ГГТ – гамма-глютамилтранспептидаза
- ГУМС – генитоуринарный менопаузальный синдром
- ДЭРА – двухэнергетическая рентгеновская абсорбциометрия
- Е2 – эстрадиол
- ЖКБ – желчнокаменная болезнь
- ЗГТ – заместительная гормональная терапия
- ИБС – ишемическая болезнь сердца
- ИМТ – индекс массы тела
- КОК – комбинированные оральные контрацептивы (по АТХ – Гормональные пероральные контрацептивы)
- КЭЭ – конъюгированные эквин-эстрогены
- ЛПВП-ХС – холестерин липопротеинов высокой плотности
- ЛПНП-ХС – холестерин липопротеинов низкой плотности
- МГТ – менопаузальная гормональная терапия
- МПА – Медроксипрогестерон**
- МПК – минеральная плотность кости
- МЗ РФ – Министерство здравоохранения Российской Федерации
- НТГ – нарушение толерантности к глюкозе
- П – прогестаген (по АТХ – Прогестагены)
- ПНЯ – преждевременная недостаточность яичников
- ПЦР – полимеразная цепная реакция
- РКИ – рандомизированное контролируемое исследование
- РМЖ – рак молочной железы
- РФ – Российская Федерация
- СД – сахарный диабет
- СИОЗС – селективные ингибиторы обратного захвата серотонина
- СИОЗСН – селективные ингибиторы обратного захвата серотонина и норадреналина
- ТТГ – тиреотропный гормон
- УЗИ – ультразвуковое исследование
- ФСГ – фолликулостимулирующий гормон
- ХС – холестерин
- Э – эстроген
- ACR – American College of Radiology
- BI-RADS – Breast Imaging Reporting and Data System
- FRAX – алгоритм оценки индивидуальной 10-летней вероятности переломов
- NAMS (North American Menopause Society) – Североамериканское общество по менопаузе
- STRAW (Stages of Reproductive Ageing Workshop) – классификация стадий репродуктивного старения
- WHI (Women’s Health Initiative) – рандомизированное контролируемое клиническое исследование «Во имя здоровья женщин»
Менопауза и климактерическое состояние у женщины
Список сокращений
Термины и определения
Этапы репродуктивного старения женщин – клинико-гормональная характеристика этапов старения репродуктивной системы (Stages of Reproductive Aging Workshop – STRAW) разработаны в 2001 г. и пересмотрены в 2011 г. (STRAW+10) [1].
Вазомоторные нарушения – проявление всех форм нарушений вегетативной регуляции (приливы жара, ночная потливость, ознобы и т.д.).
Приливы жара – резкий приток тепла к лицу и к верхней половине тела (шея, руки, грудь), который может сопровождаться потоотделением, ознобом.
Психоэмоциональные менопаузальные расстройства включают лабильность настроения, нарушения сна, депрессивное состояние, тревожность, плаксивость, повышенную возбудимость, агрессию, панические атаки.
Генитоуринарный менопаузальный синдром (ГУМС) – симптомокомплекс, ассоциированный со снижением уровней эстрогенов и других половых стероидов, включающий в себя изменения наружных половых органов, промежности, влагалища, уретры и мочевого пузыря.
Вульвовагинальная атрофия (ВВА) часто сопровождает ГУМС. Наиболее распространенными симптомами ВВА является сухость влагалища, диспареуния, жжение и зуд.
Недержание мочи – непроизвольное выделение мочи, являющееся социальной или гигиенической проблемой, при наличии объективных проявлений неконтролируемого мочеиспускания.
Постменопаузальный остеопороз – метаболическое заболевание скелета, сопровождающееся снижением косной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами при минимальной травме.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Менопауза определяется как последняя самостоятельная менструация [2].
Естественная менопауза отражает окончательное прекращение менструальных циклов вследствие снижения функции яичников [3]; является ретроспективным клиническим диагнозом, устанавливается после 12 последовательных месяцев отсутствия менструаций (аменореи).
Климактерический синдром – комплекс вегетативно-сосудистых, психических и обменно-эндокринных нарушений, возникающих у женщин на фоне угасания (или резкой потери) гормональной функции яичников и общего старения организма [4].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Период менопаузального перехода сопровождается колебаниями уровней половых гормонов, развитием овуляторной дисфункции, снижением секреции прогестерона и, как следствие, изменением характеристик менструального цикла [4].
Перименопауза характеризуется постепенным снижением, а затем и «выключением» функции яичников, развитием дефицита эстрогенов. Развившееся в результате этого состояние гипергонадотропного гипогонадизма характеризуется изменением функции лимбической системы, нарушением секреции нейрогормонов, развитием инволютивных и атрофических процессов в репродуктивных и нерепродуктивных органах-мишенях и развитием специфических симптомов [5].
В постменопаузе синтез эстрогенов продолжается, но в значительно более низких концентрациях, чем в репродуктивном периоде. Синтез эстрогенов происходит в основном за счет превращения андростендиона в эстрон (в большей степени) и тестостерона в эстрадиол под воздействием ароматазы [6], [7]. Ожирение наряду с увеличением активности ароматазы может быть связано с более высокими концентрациями эстрогенов и тестостерона в сыворотке крови женщин в постменопаузе [8], [9]. Выработка тестостерона яичниками снижается по мере увеличения возраста женщины и на уровень тестостерона не влияет факт наступления менопаузы [10], [11], при этом тека-клетки яичников в постменопаузе продолжают синтезировать тестостерон в ответ на повышенный уровень гонадотропинов [12].
На фоне снижения уровней эстрогенов у некоторых женщин возможно развитие абдоминального ожирения и повышение рисков метаболических нарушений, сердечно-сосудистых осложнений, а также относительной гиперандрогении, которая сопровождается появлением поздних акне, алопеции, гирсутизма [13], [14].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Средний возраст наступления менопаузы во всем мире составляет 48,8 лет (95% ДИ 48,3-49,2) со значительными колебаниями этого показателя в зависимости от географического региона проживания женщин [15], в РФ он колеблется от 49 до 51 года [4].
Около 75% женщин в возрасте от 45 до 55 лет предъявляют жалобы на приливы, при этом в 28,5% случаев – средней или тяжелой степени выраженности [16]; продолжительность симптомов может составлять 3-15 лет [17].
Вазомоторные симптомы чаще возникают в поздней фазе менопаузального перехода и особенно выражены в первые годы постменопаузы [18]. Распространенность нарушений сна у женщин в перименопаузе колеблется от 39% до 47%, у женщин в постменопаузе – от 35% до 60% [19].
Среди лиц в возрасте 50 лет и старше в РФ остеопороз выявляется у 34% женщин, а частота остеопении составляет 43% [20].
У 15% женщин в перименопаузе и до 80% женщин в постменопаузе отмечаются симптомы ГУМС или ВВА [21], [22], [23]. У 41% женщин в возрасте 50-79 лет есть хотя бы один из симптомов ВВА. Распространенность нарушений мочеиспускания (внезапное и непреодолимое желание помочиться, которое невозможно отсрочить, недержание мочи) у женщин зависит от длительности постменопаузы и увеличивается с 15,5% при длительности постменопаузы до 5 лет и до 41,4% при длительности менопаузы более 20 лет [24].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
N95 Нарушения менопаузы и другие нарушения в околоменопаузном периоде:
N95.1 – Менопауза и климактерическое состояние у женщины
N95.2 – Постменопаузальный атрофический вагинит
N95.3 – Состояние, связанное с искусственно вызванной менопаузой
N95.8 – Другие уточненные нарушения менопаузного и перименопаузного периода
N95.9 – Менопаузные и перименопаузные нарушения неуточненные
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Выделяют следующие типы менопаузы:
По причине наступления:
– самопроизвольная (естественная) менопауза;
– менопауза, наступившая в результате двухсторонней овариоэктомии (хирургическая менопауза) или химио-/лучевой терапии.
По времени наступления:
– преждевременная (преждевременная недостаточность яичников) (до 40 лет);
– ранняя (40-44 года);
– своевременная (45-55 лет);
– поздняя (старше 55 лет).
В 2001 г. впервые была разработана клинико-гормональная характеристика этапов старения репродуктивной системы (Stages of Reproductive Aging Workshop – STRAW), пересмотренная в 2011 г. с учетом результатов крупных когортных исследований, проведенных в течение последующих 10 лет (STRAW+10) (Приложение А3, рис. 1) [1].
Период менопаузального перехода характеризуется вариабельностью циклов, начинается в 40-45 лет и заканчивается с наступлением менопаузы. Отмечаются различные уровни фолликулостимулирующего гормона (ФСГ), эстрадиола (Е2), а также снижение ингибина В и антимюллерова гормона (АМГ). На фоне задержек менструаций могут появляться вазомоторные, психологические, урогенитальные симптомы, ассоциированные со снижением уровня эстрогенов, а также отмечается высокая частота аномальных маточных кровотечений, связанных с овуляторной дисфункцией [5]. Эта фаза репродуктивного старения может длиться до 4-8 лет. Различают ранний (вариабельные уровни ФСГ и длительность менструального цикла) и поздний период менопаузального перехода (наступает за 1-3 года до последней менструации, стойкое повышение ФСГ ≥25 МЕ/л, отсутствие менструаций ≥60 дней) [25] [26].
Пременопауза. Термин «пременопауза» не рекомендуется использовать для обозначения последних нескольких лет перед менопаузой. В настоящее время этот термин рекомендуется использовать в значении всего репродуктивного периода и периода менопаузального перехода – то есть, от менархе до последней менструации [27].
Менопауза – стойкое прекращение менструаций, это последняя самостоятельная менструация, обусловленная возрастным снижением гормональной и «выключением» репродуктивной функции яичников. Дата наступления менопаузы оценивается ретроспективно: спустя 12 мес. отсутствия менструации.
Перименопауза включает период менопаузального перехода +12 мес. после последней самостоятельной менструации.
Постменопауза – период после наступления менопаузы.
Различают фазы раннего постменопаузального периода: +1а, +1b, +1c. Характерно прогрессирующее повышение уровней ФСГ, снижение Е2, АМГ и ингибина В. Эта фаза продолжается 5-8 лет, чаще персистируют симптомы климактерического синдрома.
Поздняя постменопаузальная фаза (+2) – Вазомоторные симптомы менее выражены, но могут персистировать в 15% случаев длительное время. На первый план выходит соматическое старение. (см. приложение А3)
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические признаки, возникающие в период пери- и постменопаузы ввиду недостатка эстрогенов, характеризуют первые проявления климактерического (менопаузального) синдрома. Установлена четкая взаимосвязь дефицита эстрогенов и вазомоторных симптомов, нарушений сна/бессонницы, сухости влагалища, диспареунии, лабильности настроения, депрессии, а также расстройства когнитивной функции [19], [28], развития висцерального (абдоминального) ожирения, колебаний артериального давления [29], [30].
Существующие данные о связи сексуальной дисфункции с дефицитом эстрогенов в настоящее время неоднозначны.
Вазомоторные симптомы (приливы жара, потливость, ознобы) являются наиболее частыми и ранними проявлениями периода пери- и ранней постменопаузы. Средняя продолжительность приливов составляет 7,4 года, однако в последнее время появляется все больше данных проспективных исследований о том, что у значительного числа женщин они могут продолжаться ≥10 лет [3]. Согласно документу IMS (2024г.) приливы считаются самостоятельным фактором риска сердечно-сосудистых заболеваний у женщин [31].
Наиболее типичная жалоба пациенток с нарушениями сна – частые пробуждения (фрагментация сна). Другими проявлениями являются бессонница, трудности засыпания и ранние пробуждения. Нередко нарушения сна сочетаются с вазомоторными симптомами, а также с повышенной тревожностью, лабильность настроения. В возникновении нарушений сна в период пери- и постменопаузы немаловажную роль играют психосоциальные факторы, стресс и сопутствующие заболевания [32].
Сухость влагалища, зуд и диспареуния (болезненность при половом акте) являются симптомами, связанными с ВВА. В основе развития ВВА лежит дефицит половых гормонов (в первую очередь эстрогенов), вызывающий ряд инволютивных (атрофических) процессов в урогенитальном тракте и сопровождается изменением состава микробиоты. Симптомы ВВА нередко сочетаются с расстройствами мочеиспускания (поллакиурией, ноктурией, цисталгией, императивными позывами к мочеиспусканию). Симптомокомплекс, возникающий у женщин на фоне дефицита эстрогенов, включающий физиологические и анатомические изменения во влагалище, уретре, мочевом пузыре и наружных половых органах получил название генитоуринарный менопаузальный синдром (ГУМС) [23].
Возникновение депрессии в период пери- и постменопаузы связано с недостатком эстрогенов в организме женщины, часто сочетается с вазомоторными симптомами и ночной потливостью, что ведет к нарушению сна и бессоннице, и является результатом нарушения регуляции норадренергической и серотонинергической систем [19]. Эти же процессы имеют отношение к нарушениям когнитивной функции (как правило, снижение концентрации внимания и памяти), которые в большей степени наблюдаются у пациенток в период перименопаузы, однако связь когнитивных нарушений и дефицита эстрогенов носят более сложный характер [33]. Следует отметить, что данные проявления нередко коррелируют с вазомоторными симптомами, депрессией и тревожными состояниями у женщин в пери- и постменопаузе [34].
Увеличение абдоминального/висцерального жира и уменьшение мышечной массы более выражены в постменопаузе и связано с повышенным риском смертности даже среди лиц с нормальным ИМТ [35].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
В диагностике менопаузы и определении стадии репродуктивного старения важным является сбор анамнестических данных, включающий информацию о менструации, наличии менопаузальных симптомов. Данные лабораторных и инструментальных обследований необходимы в случае затруднений при установлении диагноза, а также для выявления ассоциированных с менопаузой состояний.
Критерии установления диагноза/состояния на основании патогномоничных данных:
1) анамнестических данных
2) физикального обследования
3) лабораторных исследований
4) инструментального обследования [4].
2.1 Жалобы и анамнез
- Рекомендуется при опросе пациентки обращать внимание на наличие следующих жалоб и признаков для диагностики климактерических симптомов [3], [4], [19], [21], [23], [31], [33], [35], [36], [37], [38], [39]. - вазомоторные – приливы, повышенная ночная потливость, ознобы;- психоэмоциональные – депрессия, раздражительность, возбудимость, расстройство сна, слабость, снижение памяти и концентрации внимания;- урогенитальные и сексуальные – зуд, жжение, сухость во влагалище, диспареуния, дизурия;- скелетно-мышечные – миалгии, артралгии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3).
Комментарии: Следует подчеркнуть большую индивидуальную вариабельность менопаузальных симптомов среди пациенток как по времени их появления, так и по длительности и интенсивности.
- Рекомендуется всем пациенткам на этапе постановки диагноза использовать терминологию и систему критериев STRAW +10 для определения стадии репродуктивного старения [21], [42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Терминология и система критериев STRAW +10 применимы у большинства женщин, поскольку процесс старения репродуктивной системы универсален. Классификация стадии репродуктивного старения по STRAW +10 неприменима у пациенток с синдромом поликистозных яичников, преждевременной недостаточностью яичинков, после гистерэктомии, абляции эндометрия, или использующих в настоящее время ВМС-ЛНГ, КОК (по АТХ – Гормональные пероральные контрацептивы). У этих групп пациенток необходимо обращать внимание на возникновение вазомоторных и психоэмоциональных симптомов как ранних признаков приближающейся менопаузы.
- Рекомендуется пациенткам с наличием менопаузальных симптомов проводить анкетирование (Шкала Грина) (приложение Г) для определения степени их тяжести [29].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам проводить тщательный сбор анамнестических данных для выявления факторов риска онкологических заболеваний органов репродуктивной системы и молочной железы, сердечно-сосудистых заболеваний, остеопороза и других коморбидных состояний для определения плана обследования и лечения [19], [27], [43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: сбор анамнеза подразумевает опрос пациентки относительно жалоб, наследственной патологии (наличие онкологических заболеваний: рак молочной железы, эндометрия, яичников, кишечника; тромбоэмболические события; сахарный диабет; сердечно-сосудистые заболевания – инсульты, инфаркты до 50 лет [29]; остеопороз, включая переломы), акушерского анамнеза (гестационный сахарный диабет, преэклампсия, артериальная гипертензия), вредных привычек, сопутствующих соматических, эндокринных и системных заболеваний, хирургических вмешательств, гинекологической патологии, текущей или проводимой ранее лекарственной терапии. При выявлении коморбидных состояний показана консультация профильных специалистов.
2.2 Физикальное обследование
- Рекомендуется всем пациенткам проведение визуального осмотра наружных половых органов и бимануального влагалищного исследования для диагностики патологии вульвы, влагалища, шейки матки и органов малого таза [43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам визуальное исследование и пальпация молочных желез для диагностики патологии молочной железы [42], [44]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам измерение окружности талии (ОТ), как ключевого показателя абдоминального/висцерального ожирения [26], [44], [47], [48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам определение массы тела, роста и вычисление индекса массы тела (ИМТ) для диагностики избыточной массы тела и ожирения [3], [26], [45], [46], [48], [49], [50].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
2.3 Лабораторные диагностические исследования
- Рекомендуется проводить гормональное обследование пациенткам в случае наличия затруднений при определении стадии репродуктивного старения [27], [42], [43], [45], [49], [50], [51], [52], [53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется исследование уровня ФСГ в сыворотке крови у женщин до 45 лет с менопаузальными симптомами, включая аменорею или нерегулярные менструации [51], у женщин до 45 лет с синдромом поликистозных яичников, абляцией эндометрия или у женщин, нуждающихся в дифференциальной диагностике аменореи; у женщин до 45 лет после гистерэктомии без придатков;
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: исследование уровня ФСГ в сыворотке крови проводится дважды на 2-5 день менструального цикла в двух последующих менструальных циклах при наличии менструаций, в случае аменореи – в любой день дважды с перерывом 4-6 недель.
- Рекомендуется исследование уровня тиреотропного гормона (ТТГ) в крови для дифференциальной диагностики причин олигоменореи/аменореи, атипичных вазомоторных симптомов, нарушений сна, быстрой утомляемости, колебаний веса [52], [54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5);
- Рекомендуется исследование уровня пролактина в крови у женщин для дифференциальной диагностики причин олигоменореи/аменореи, галактореи [52], [54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется определение концентрации водородных ионов (рН) отделяемого слизистой оболочки влагалища женщинам в пери- и постменопаузе с симптомами ВВА [52, 54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: тест-полоски для определения pH вагинального секрета.
- Рекомендуется при наличии жалоб и клинических признаков ГУМС женщинам в пери- и постменопаузе проводить молекулярно-биологическое исследование влагалищного отделяемого на микроорганизмы-маркеры бактериального вагиноза или микробиологическое (культуральное) исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы для оценки микробиоты влагалища [31], [47], [55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется при наличии факторов риска остеопороза, низкоэнергетических переломов в анамнезе, а также при ожирении женщинам в пери- и постменопаузе исследование уровня 25-ОН витамина D крови для выявления недостаточности/дефицита [53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам проводить цитологическое исследование микропрепарата шейки матки (ПАП-тест) и определение ДНК вирусов папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР, количественное исследование для скрининга поражений шейки матки [54], [56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Цервикальный скрининг следует проводить согласно приказу МЗ РФ № 1130н от 2020г [43].
2.4 Инструментальные диагностические исследования
- Рекомендуется женщинам в постменопаузе (старше 40 лет) проводить оценку индивидуальной 10-летней вероятности переломов (с использованием алгоритма FRAX) [57], [58], [59].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Оценка индивидуальной 10-летней вероятности переломов проводится с использованием алгоритма FRAX в качестве скринингового метода. Наиболее информативным методом оценки минеральной плотности кости и диагностики остеопороза является двухэнергетическая рентгеновская абсорбциометрия (ДЭРА) (по НМУ – рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости) [60].
- Рекомендуется при наличии низкоэнергетических переломов в анамнезе или факторов риска остеопороза или выявленного среднего (промежуточного) индивидуального 10-летнего риска остеопоротического перелома (по алгоритму FRAX) женщинам в пери- и постменопаузе проведение двухэнергетической рентгеновской абсорбциометрии (ДЭРА) поясничного отдела позвоночника и проксимального отдела бедренной кости (по НМУ – рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости) с целью оценки минеральной плотности кости (МПК) [20], [61], [62], [63].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Для оценки МПК используются критерии ВОЗ по интерпретации результатов ДЭРА у женщин [61]:
- норма – показатели Т-критерия ≥-1 стандартных отклонений от пиковой костной массы;
- остеопения – показатели Т-критерия от -1 до -2,5 стандартных отклонений;
- остеопороз – показатели Т-критерия -2,5 стандартных отклонений и ниже;
- тяжелый остеопороз – показатели Т-критерия -2,5 стандартных отклонений и ниже с наличием в анамнезе одного и более переломов.
- Рекомендуется всем женщинам с диагнозом ПНЯ базовое проведение двухэнергетической рентгеновской абсорбциометрии (ДЭРА) поясничного отдела позвоночника и проксимального отдела бедренной кости (по НМУ – рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости) с целью оценки МПК [64], [65].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Женщины с диагнозом ПНЯ имеют как общеизвестные факторы риска развития остеопороза, так и специфические (такие как выключение функции яичников до накопления пиковой костной массы, отсутствие лечения более 1 года из-за задержки постановки диагноза, неадекватная терапия и несоблюдение рекомендаций). Рекомендуется интерпретировать результаты ДЭРА у женщин с ПНЯ [64], [65].
– МПК в пределах возрастной нормы – показатели Z-критерия >-2 стандартных отклонений;
– низкая МПК – показатели Z-критерия ≤-2 стандартных отклонений;
– остеопороз – показатели Т-критерия <-2,5 стандартных отклонений и ниже и/или наличие низкоэнергетического перелома (особенно вертебрального)
2.5 Иные диагностические исследования
- Рекомендуется проведение комплексного обследования женщинам в пери- и постменопаузе перед назначением МГТ для выявления противопоказаний и/или риска возможных нежелательных явлений [4], [21], [27], [49], [65], [66], [67], [68]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Обязательное обследование перед назначением МГТ включает:
- ультразвуковое исследование органов малого таза с целью исключения органической патологии органов малого таза; при толщине эндометрия ≤4 мм у женщин в пери- и постменопаузе МГТ не противопоказана; >4 мм – в фазе менопаузального перехода назначаются прогестагены в течение 10 дней и проводится контрольное ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное) на 5-7й день менструальноподобного кровотечения или на фоне его отсутствия через 7-14 дней после окончания приема гестагенов; >4 мм в постменопаузе – рекомендовано проводить гистероскопию и раздельное диагностическое выскабливание полости матки и цервикального канала или аспирационную биопсию эндометрия (по НМУ – биопсия тканей матки) для уточнения состояния эндометрия [69].
- обследование молочных желез: визуальный осмотр, пальпация, маммография в двух проекциях, начиная с возраста 40 лет, и УЗИ молочных желез в возрасте до 40 лет с оценкой по шкале BI-RADS и классификацией маммографической плотности по ACR с целью исключения патологии молочных желез [66], [68]. Высокая маммографическая плотность молочных желез (тип строения C или D по ACR) является фактором высокого риска рака молочной железы (РМЖ) и требует дополнительного обследования – УЗИ молочных желез [66], [68]. Высокая маммографическая плотность может снижать чувствительность маммографии до 48%, что требует дополнительных методов обследования в дополнение к маммографии (УЗИ молочных желез, МРТ молочных желез с контрастированием) [66]. При наличии узловых образований молочных желез, и/ или категории по шкале BI-RADS, отличной от 1 или 2 и/или высокой маммографической плотности (ACR: С или D) и/или других значимых факторов риска РМЖ рекомендована консультация врача-онколога (врача-маммолога) для определения наличия или отсутствия противопоказаний для приема МГТ (ЗГТ половыми стероидами) со стороны молочных желез.
- Цитологическое исследование микропрепарата шейки матки – ПАП-тест [56]. При наличии данных проведенного обследования по результатам прохождения диспансеризации, дополнительно данное обследование не проводится. При отсутствии результатов диспансеризации, необходимо назначить пациентке указанный метод обследования.
- Измерение артериального давления на периферических артериях
- общий (клинический) анализ крови
- анализ крови биохимический общетерапевтический (исследование уровня глюкозы в крови/гликированного гемоглобина в крови натощак, общего белка в крови, общего и прямого билирубина в крови, креатинина в крови) и анализ крови для оценки нарушений липидного обмена биохимический (исследование уровня холестерина крови, холестерина липопротеинов низкой плотности, уровня холестерина липопротеинов высокой плотности в крови, уровня триглицеридов в крови) [4]; при подозрении на наличие метаболического синдрома или нарушений углеводного обмена (НГТ, СД 2 типа) рекомендуется проведение перорального 2-часового глюкозотолерантного теста, как надежного индикатора нарушения толерантности к глюкозе.
- Рекомендуется проведение ряда дополнительных обследований перед назначением МГТ женщинам при соответствующих данных анамнеза и показаниях [4], [26], [40], [48], [64], [65], [68], [69].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: при соответствующих данных анамнеза и показаниях проводится ультразвуковое исследование органов брюшной полости (комплексное) и анализ крови биохимический общетерапевтический (определение активности АЛТ, АСТ, ГГТ в крови); коагулограмма (ориентировочное исследование системы гемостаза); определение полиморфизма G20210A протромбина в гене фактора II свертывания крови; молекулярно-генетическое исследование мутации G1691A в гене фактора V (мутация Лейдена в V факторе свертывания), колоноскопия.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
3.1.1. Системная менопаузальная гормонотерапия
- Рекомендовано использовать индивидуальный подход к каждой пациентке, что является приоритетным при выборе тактики лечения климактерического синдрома [27], [29], [43], [75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Менопаузальная гормонотерапия (МГТ) позволяет эффективно купировать симптомы климактерического синдрома, а также уменьшить/отсрочить развитие отдаленных последствий дефицита эстрогенов.
Врач при выборе терапии должен соблюдать принципы современной концепции персонализации менопаузальной гормональной терапии.
Начало системной МГТ необходимо рассматривать у женщин в возрасте менее 60 лет и с длительностью постменопаузы менее 10 лет. Оптимальное время для старта МГТ – период пери- и ранней постменопаузы. Отсутствуют возрастные ограничения при назначении локальной терапии эстрогенами (эстриолом) симптомов ГУМС.
Терапевтическая цель должна заключаться в использовании наиболее подходящей минимальной эффективной дозы МГТ в соответствии с целями лечения.
Индивидуализация МГТ (выбор дозы, лекарственной формы препарата, его состава, режима использования) проводится с учетом возраста пациентки, стадии репродуктивного старения, гинекологических заболеваний, коморбидных состояний, предпочтений женщины.
Наличие показаний к назначению МГТ и отсутствие противопоказаний.
Применение МГТ требует периодической коррекции дозировок в зависимости от стадии репродуктивного старения, возраста, эффективности и переносимости лечения. По мере увеличения возраста пациентки и длительности постменопаузы целесообразно снижать дозу МГТ.
Мониторинг лечения и регулярная (не реже 1 раз в год) переоценка польза/риск. Длительность терапии определяется целью терапии и балансом польза/ риск.
При выборе МГТ учитывается профиль безопасности составляющих компонентов.
Назначение, коррекция или отмена МГТ, а также динамический контроль за эффективностью и переносимостью лечения лежит в зоне ответственности врача акушера-гинеколога.
- Рекомендуется назначение менопаузальной гормональной терапии (МГТ) женщинам в перименопаузе и постменопаузе для лечения:- Вазомоторных симптомов умеренной и тяжелой степени, существенно снижающих качество жизни,- Симптомов ГУМС, сексуальной дисфункции[4], [33], [40], [21], [45], [46], [47], [49], [50], [52], [63], [64], [72], [74], [75], [76], [77], [78], [79], [80], [81], [82], [83].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Цель МГТ у женщин в перименопаузе и постменопаузе – частично восполнить дефицит половых гормонов, используя минимальные (оптимальные) дозы гормональных препаратов, способные улучшить общее состояние пациенток, купировать климактерические симптомы, обеспечить профилактику поздних обменных нарушений. При наличии других клинических симптомов, указывающих на дефицит эстрогенов (включая артралгии, мышечные боли, снижение памяти, нарушения сна и психо-эмоциональные нарушения), существенно снижающих качество жизни, возможно назначение МГТ после дообследовании у профильных специалистов и исключении других причин для данных симптомов [21], [83], [84].
По данным когортных и плацебо контролируемых исследований своевременный старт МГТ в перименопаузе или в первые 5 лет постменопаузы снижает риск развития субклинического атеросклероза, ИБС и когнитивных нарушений (при условии нормальной когнитивной функции на момент начала МГТ) [85], [86], [87].
- Рекомендуется назначение менопаузальной гормональной терапии (МГТ) женщинам в перименопаузе и постменопаузе для профилактики постменопаузального остеопороза [4], [20], [21], [47], [49], [52], [62], [65], [78], [79], [82], [88].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Пациенткам в постменопаузе (старше 40 лет) показан скрининг для оценки 10-летнего риска основных остеопоротических переломов с использованием алгоритма FRAX. При выявлении среднего (промежуточного) риска (см. Приложение Д) или в случае наличия низкоэнергетических переломов в анамнезе или других факторов риска остеопороза – показано проведение ДЭРА.
МГТ является эффективным методом предотвращения потери костной массы, которая наиболее выражена в первые 3-5 лет постменопаузы, а также способствует сохранению качества кости и межпозвонковых дисков у женщин в постменопаузе. Эффективность МГТ доказана в отношении снижения риска перелома в популяции постменопаузальных женщин.
Снижение риска остеопоротических переломов зависит от длительности приема и возраста начала МГТ, защитный эффект прекращается после отмены терапии.
Имеются доказательные данные о предотвращении потери МПК при пероральном и трансдермальном применении стандартных и низких доз эстрадиола в составе МГТ (по АТХ – Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание)), а также о предотвращении переломов позвонков и других локализаций при применении тиболона (по АТХ – другие эстрогены).
Мониторинг эффективности терапии осуществляется с помощью ДЭРА – 1 раз в 1-2 года.
- Рекомендуется назначение менопаузальной/заместительной гормональной терапии (МГТ/ЗГТ) женщинам для восполнения дефицита эстрогенов при преждевременной недостаточности яичников и ранней менопаузе, в т.ч. после химио-/лучевой терапии, двусторонней овариоэктомии [49], [50], [65], [66], [79], [82], [89].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Показаниями к назначению ЗГТ половыми стероидами являются лечение симптомов эстрогендефицита, а также первичная профилактика остеопороза. Начинать заместительную гормональную терапию следует как можно раньше после постановки диагноза ПНЯ при отсутствии противопоказаний.
- Рекомендуется врачу-акушеру-гинекологу учитывать наличие относительных противопоказаний к МГТ с целью оценки рисков лечения для решения вопроса о возможности ее назначения, а также для индивидуального подбора типа, режима, дозы и пути введения МГТ [29]:
- Длительность постменопаузы (более 10 лет на момент старта МГТ); курение; ИМТ ≥30 кг/м2;
- отягощенный семейный анамнез по венозным тромбоэмболиям (ВТЭ); повышенный риск рака молочной железы; отягощенный акушерский анамнез (наличие артериальной гипертензии, преэклампсии, гестационного диабета, преждевременная отслойка нормально расположенной плаценты);
- мигрень; неконтролируемая артериальная гипертензия; коллагенозы; эпилепсия, наличие миомы матки, эндометриоза [82], [90].
Уровень убедительности рекомендаций А уровень достоверности доказательств – 1).
Комментарии: назначение МГТ возможно при наличии миомы матки небольших размеров (с межмышечным или субсерозным расположением) при условии проведения ультразвукового исследования матки и придатков не реже 1 раза в 6 месяцев на фоне МГТ. При обнаружении роста/увеличения количества или изменения структуры миоматозных узлов МГТ необходимо отменить [90] [91].
Пациенткам с эндометриозом/аденомиозом в анамнезе в качестве МГТ показана комбинированная эстроген-гестагенная терапия или тиболон, в том числе после гистерэктомии [92].
Отягощенный семейный анамнез по раку молочной железы не является противопоказанием для МГТ и требует дополнительной оценки других факторов риска.
При выявленном носительстве мутаций BRCA1/2 (при отсутствии РМЖ в анамнезе) при назначении МГТ рекомендована консультация врача-онколога и проведение селективного скрининга [75], [93].
- Не рекомендуется назначение МГТ пациенткам при наличии у них следующих заболеваний/состояний (абсолютные противопоказания):Кровотечение из половых путей неясного генеза (требуют дообследования и лечения, определение противопоказаний к МГТ или их отсутствие); рак молочной железы (диагностированный, подозреваемый или в анамнезе); диагностированные или подозреваемые эстрогензависимые злокачественные новообразования (эндометрия, яичников, матки); острые и хронические заболевания печени в настоящее время или в анамнезе (до нормализации функциональных проб печени), в том числе злокачественные опухоли печени; тромбозы (артериальные и венозные) и тромбоэмболии в настоящее время или в анамнезе (в том числе тромбоз глубоких вен; тромбоэмболия легочной артерии, инфаркт миокарда, ишемические или геморрагические цереброваскулярные нарушения); генетические тромбофилии высокого риска (дефицит антитромбина III, дефицит протеина С, дефицит протеина S), антифосфолипидный синдром, наличие миомы матки с субмукозным расположением узла; наличие полипа эндометрия; аллергия к компонентам МГТ; кожная порфирия; прогестагензависимые новообразования (например, менингиома) (для гестагенов) [4], [29], [21], [49], [50], [51], [52], [63], [64], [72], [74], [81], [93], [94], [95].
Уровень убедительности рекомендаций А, уровень достоверности доказательств – 1).
Комментарии: При наличии у пациентки миомы матки с субмукозным расположением узла или при наличии полипа эндометрия рекомендовано оперативное лечение (в случае миомы матки с субмукозным расположением узла – гистероскопическая миомэктомия; в случае полипа эндометрия – гистероскопия, раздельное диагностическое выскабливанием или гистерорезектоскопия (полипэктомия)). После получения результатов патологоанатомического исследования рассмотреть вопрос о назначении МГТ.
3.1.1 Режимы и характеристики МГТ
- Рекомендуется индивидуальный подбор режима и пути введения препаратов МГТ пациенткам с учетом выраженности симптомов, персонального и семейного анамнеза, стадии репродуктивного старения (по STRAW+10), результатов соответствующих исследований, наличия коморбидных состояний, предпочтений и ожиданий женщины для обеспечения высокой эффективности, безопасности терапии и приверженности к ней [1], [3], [4], [37], [21], [45], [47], [49], [50], [52], [65], [69], [70], [79], [82], [96], [97], [98].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Препараты МГТ, зарегистрированные в Российской Федерации, имеют широкий спектр лекарственных форм, путей и способов их введения, а также обладают благоприятным профилем безопасности и эффективности, в том числе в отношении рисков сердечно-сосудистых событий и ВТЭО [29].
При инициации МГТ целесообразно подбирать минимальную эффективную дозу препарата. По мере увеличения возраста женщины и длительности постменопаузы рекомендуется рассмотреть возможность снижения дозировки.
В перименопаузе используются стандартные и низкие дозы эстрогенов (по АТХ – Эстрогены) в составе МГТ. В постменопаузе используются низкие и ультранизкие дозы эстрогенов в составе МГТ.
У женщин в постменопаузе старше 45 лет низкодозированные и ультранизкодозированные пероральные эстрогены в составе комбинированной монофазной МГТ эффективны для лечения вазомоторных симптомов, при этом имеют более благоприятный профиль безопасности и переносимости в сравнении со стандартными дозами эстрогенов.
В РФ зарегистрированы пероральные препараты МГТ с включением стандартных (2 мг), низких (1 мг) и ультранизких (0,5 мг) доз эстрадиола (по АТХ – Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание).
В РФ зарегистрированы трансдермальные формы эстрогенов для МГТ – эстрадиол (по АТХ – Эстрадиол) 0,06% – накожный гель с включением максимальной суточной дозы 3 мг эстрадиола (5,0 г геля), стандартной суточной дозы 1,5 мг эстрадиола (2,5 г геля), низкой суточной дозы #0,75 мг эстрадиола (1,25 г геля); Эстрадиол (по АТХ – Эстрадиол) 0,1% накожный гель с включением максимальной суточной дозы 1,5 мг эстрадиола (1,5 г геля), стандартной суточной дозы 1 мг эстрадиола (1,0 г геля), низкой суточной дозы 0,5 мг эстрадиола (0,5 г геля).
Трансдермальные формы эстрогенов вследствие отсутствия первичной стадии печеночного метаболизма имеют благоприятный профиль безопасности при высоких рисках ВТЭО и ЖКБ [71], [99], [100], [101].
Основная функция гестагена в составе МГТ: защитное действие на эндометрий. Важно учитывать свойства прогестагена в составе МГТ. Микронизированный прогестерон** (МНН: Прогестерон**), дидрогестерон** и ряд других прогестагенов (по АТХ – Гестагены), кроме защитного влияния на эндометрий могут обладать и другими эффектами. Например, дроспиренон в составе комбинации с эстрадиолом (по АТХ – Прогестагены и эстрогены) обладает антиминералокортикоидным и антиандрогенным эффектом, способностью препятствовать задержке жидкости, улучшать ряд метаболических параметров [97], [98]. Микронизированный прогестерон** (МНН: Прогестерон**) и дидрогестерон** в наименьшей степени ассоциированы с повышением риска РМЖ в сравнении с другими гестагенами в составе МГТ [104], [105], [106]. Современная низкодозированная и ультранизкодозированная комбинированная пероральная МГТ с эстрадиолом, который используется в составе МГТ, и гестагенами (дидрогестерон** [71] [107] [108] [109] [99] [110] [111], микронизированный прогестерон** (МНН: Прогестерон**) [71], [101], [107], [108], [109], дроспиренон [112], левоноргестрел и др.) представляется достаточно безопасной в отношении тромботических осложнений [29]. Однако оценка пользы и риска назначения МГТ, выбор лекарственного препарата, его состава, и пути введения должны проводиться индивидуально, с учетом особенностей клинической картины и наличия факторов риска ВТЭО.
В качестве МГТ у женщин в постменопаузе в ряде стран (в том числе в РФ) также используется синтетический стероид тиболон (по АТХ – другие эстрогены). При пероральном приеме препарат метаболизируется с образованием трех активных метаболитов, из которых два обладают эстрогеноподобной активностью, в то время как третий метаболит обладает слабой гестагеноподобной и андрогеноподобной активностью. Эффективность его применения для купирования климактерических симптомов сопоставима с эстрадиолом в составе МГТ (2,5 мг тиболона эквивалентно по действию 1-1,5 мг эстрадиола). Препарат используется для лечения симптомов эстрогенной недостаточности у женщин в постменопаузе (но не ранее чем через 12 месяцев после последней менструации) или сразу после двусторонней овариэктомии, для профилактики и лечения остеопороза при непереносимости или противопоказаниях к применению других лекарственных средств, используемых для профилактики остеопороза, а также может благоприятно влиять на сексуальную функцию у женщин в постменопаузе. Тиболон не оказывает пролиферативной активности в отношении эндометрия и молочных желез, значимого влияния на рост миоматозных узлов [40], [96].
- Рекомендуется назначение монотерапии эстрогенами (по АТХ – Эстрогены) в непрерывном режиме женщинам с удаленной маткой, вне зависимости от фазы климактерия, для лечения климактерических симптомов и/или профилактики остеопороза [4], [39], [62], [111]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: необходимо учитывать показания к гистерэктомии и объем операции (тотальная или субтотальная). Монотерапия эстрогенами показана только при тотальной гистерэктомии. В случае надвлагалищной ампутации матки, а также пациенткам после гистерэктомии по поводу аденомиоза, с распространенным наружным генитальным эндометриозом в анамнезе, показано назначение комбинированной эстроген-гестагенной терапии или тиболона [21], [92], [115]
Используются препараты, содержащие эстрадиол. Пути введения: пероральный (таблетки) и парентеральный (накожный – гели) в непрерывном режиме.
- Рекомендуется назначение монотерапии прогестагенами (по АТХ – Гестагены) женщинам в периоде менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла [4], [5], [49], [114].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарий: используется микронизированный прогестерон** (МНН: Прогестерон**) в дозе 200-400 мг в сутки; #дидрогестерон** 10-20 мг в сутки [117]. Прогестерон и его производные назначаются на срок не менее 10-15 дней.
#Левоноргестрел в дозе 52 мг в форме внутриматочной терапевтической системы (по АТХ – Пластиковые спирали с гестагенами) имеет показание к использованию в качестве гестагенного компонента МГТ. Применение #левоноргестрела в форме внутриматочной терапевтической системы (по АТХ – Пластиковые спирали с гестагенами) в период менопаузального перехода возможно у женщин, нуждающихся в контрацепции, а также при наличии обильных маточных кровотечений, не связанных с органической патологией матки [69].
- Рекомендуется назначение комбинированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание)) в циклическом режиме женщинам с интактной маткой в перименопаузе, через 6 месяцев после последней менструации, для лечения климактерических симптомов и профилактики постменопаузального остеопороза [31], [36], [39], [48], [49], [50], [51], [65], [83], [119], [120].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: По согласованию с врачом-акушером-гинекологом возможно назначение МГТ не ранее чем через 3 месяца после последней менструации.
Следует информировать женщину о том, что препараты МГТ не обладают контрацептивным эффектом.
В перименопаузе используются стандартные и низкие дозы эстрогенов в составе МГТ.
В РФ зарегистрированы комбинированные формы пероральных препаратов, содержащие стандартную дозу (2 мг) и низкую дозу (1 мг) эстрадиола в сочетании с гестагеном, а также препарат перорального эстрадиола (2 мг).
Для трансдермальной МГТ используется стандартная доза – 1,5 мг эстрадиола 0,06% накожного геля (2,5 г геля); 1,0 мг эстрадиола 0,1% накожного геля (1,0 г геля) (применяется согласно инструкции к препарату).
При назначении трансдермального пути введения эстрогенов в качестве гестагенного компонента используются микронизированный прогестерон** (МНН: Прогестерон**) (по АТХ – Гестагены) (перорально или вагинально) в дозе 200-300 мг в сутки; дидрогестерон** (по АТХ – Гестагены) перорально 10-20 мг в сутки в зависимости от ИМТ. Прогестерон и его производные назначаются на срок не менее 10-14 дней.
- Рекомендуется назначение комбинированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание)) в циклическом режиме женщинам с ПНЯ (спонтанной или хирургической, вследствие химио- или лучевой терапии) с интактной маткой для лечения климактерических симптомов и профилактики остеопороза [3], [41], [50], [65], [78], [120], [121], [122], [123], [124].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: При назначении терапии пациенткам с ПНЯ учитывают предпочтения пациентки относительно пути и способа введения препарата, а также необходимость контрацепции. Рекомендуется назначение эстроген-гестагенной терапии в циклическом режиме женщинам с ПНЯ для лечения климактерических симптомов, улучшения качества жизни, профилактики остеопороза и других возраст-ассоциированных заболеваний как минимум до возраста естественной менопаузы – 50-51 года. При длительном применении ЗГТ при ПНЯ есть возможность перехода на непрерывную монофазную терапию при необходимости.
При ПНЯ в качестве эстрогенного компонента заместительной терапии препаратами половых гормонов возможно назначать трансдермальные или пероральные формы эстрогенов в стандартных или, при необходимости (недостаточное купирование симптомов), высоких дозах [27], [123].
Трансдермальные формы эстрогенов (по АТХ – Эстрадиол) включают 0,06% накожный гель в суточной дозе 1,5-2,25 мг эстрадиола (эстрадиола гемигидрата), максимально до 3,0 мг (2,5-3,75 г геля, максимально до 5,0 г в сутки) или 0,1% накожный гель в суточной дозе 1,0-1,5 мг эстрадиола (эстрадиола гемигидрата) (1,0-1,5 г геля).
Пероральные формы эстрогенов включают эстрадиол в суточной дозе 2 мг (по АТХ – Прогестагены и эстрогены в комбинации); Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание).
В качестве гестагенного компонента возможно использовать (микронизированный) #прогестерон** (МНН – прогестерон**) (по АТХ – Гестагены) в дозе 200-400 мг/сут (перорально или вагинально) или #дидрогестерон** перорально в дозе 10-20 мг/сут на срок 12-14 дней во вторую фазу менструального цикла для профилактики гиперпластических процессов эндометрия [41, 69, 75, 83].
Возможно использование пероральных фиксированных сочетаний прогестагенов и эстрогенов (по АТХ – Прогестагены и эстрогены в комбинации); Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированое сочетание)): 2 мг эстрадиола с 10 мг дидрогестерона** или 2 мг эстрадиола с 150 мкг левоноргестрела в сутки в циклическом режиме [65], [78].
- Рекомендуется назначение монофазной комбинированной низкодозированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание)) в непрерывном режиме женщинам с интактной маткой в постменопаузе для лечения климактерических симптомов и профилактики постменопаузального остеопороза [4], [40], [44], [48], [49], [47], [51], [64], [83], [123], [124].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Непрерывный монофазный режим МГТ назначается не ранее чем через 12 месяцев после последней менструации. Для пероральной МГТ используется низкая доза эстрогена – 1 мг эстрадиола. В РФ зарегистрированы следующие комбинированные формы пероральных препаратов: эстрадиол 1 мг/дидрогестерон 5 мг; эстрадиола 1 мг/дроспиренон 2 мг.
Для трансдермальной МГТ в ранней постменопаузе используется доза – 1,5 мг эстрадиола 0,06% накожного геля (2,5 г геля); 1 мг эстрадиола 0,1% накожного геля (1 г геля), с последующим снижением дозы через 3-5 лет применения [69], [98].
По согласованию с врачом-акушером-гинекологом возможно назначение МГТ, начиная с 0,75 мг эстрадиола 0,06% накожного геля (1,25 г геля) или 0,5 мг эстрадиола 0,1% накожного геля (0,5 г геля) с индивидуальной коррекцией дозы (при необходимости).
При назначении трансдермального пути введения эстрогенов в качестве гестагенного компонента дополнительно используются микронизированный прогестерон** (МНН: Прогестерон**) (перорально или вагинально) в дозе 100 мг в сутки (при повышении дозы эстрогенов – 200 мг в сутки); дидрогестерон** 10 мг в сутки (при повышении дозы эстрогенов – 20 мг в сутки); внутриматочная система с левоноргестрелом (ВМС-ЛНГ) 52 мг (по АТХ – Пластиковые спирали с гестагенами); прогестерон** (гель вагинальный) – 90 мг (1 аппликатор) 2 раза в неделю.
Переход на монофазный комбинированный режим МГТ при применении циклической комбинированной МГТ возможен в следующих случаях:
- Через 1-2 года приема низкодозированной МГТ в циклическом режиме при возрасте женщины на момент начала терапии старше 50 лет.
- По достижении пациенткой среднего возраста менопаузы (51-52 года), при начале использования МГТ до 50 лет.
- При изменении характера менструальноподобной реакции: скудные мажущие выделения/полное отсутствие в течение более 2-х последовательных циклов.
- При желании пациентки прекратить менструальноподобную реакцию после приема низкодозированной циклической МГТ в течение не менее 12 месяцев (во избежание прорывных кровотечений) [115].
- Рекомендуется назначение монофазной комбинированной ультранизкодозированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированное сочетание)) в непрерывном режиме женщинам с интактной маткой в постменопаузе для лечения климактерических симптомов [4], [40], [44], [48], [49], [51].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Для пероральной МГТ женщинам в постменопаузе возможно использовать ультранизкую дозу эстрогена – 0,5 мг эстрадиола в составе препарата. В РФ зарегистрированы следующие комбинированные формы пероральных препаратов: эстрадиол 0,5 мг/дидрогестерон 2,5 мг; эстрадиола 0,5мг/дроспиренон 0,25мг.
- Рекомендуется при назначении МГТ пациенткам с сердечно-сосудистыми и метаболическими заболеваниями пользоваться Российскими критериями приемлемости с целью минимизации рисков и определения категории безопасности МГТ, а также выбора режима и дозы препаратов [29] (см. приложение В)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: МГТ (как пероральная, так и трансдермальная) может быть назначена при варикозном расширении вен нижних конечностей, при курении (с учетом совокупности всех факторов риска), а также при условии контроля АД с помощью антигипертензивных препаратов. МГТ положительно влияет на липидный профиль у женщин в пери- и постменопаузе. Своевременно начатая МГТ может снизить риск развития СД 2 типа на 30%.
При выявлении/подозрении на наличие факторов сердечно-сосудистого риска, сердечно-сосудистых и метаболических заболеваний пациентке должна быть рекомендована консультация врача терапевтического профиля.
- Рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами при наличии заболеваний желудочно-кишечного тракта, связанных с нарушением всасываемости [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Не рекомендуется назначать препараты тестостерона (по АТХ – Производные 3-оксоандростена) для лечения женщин с когнитивными, сердечно-сосудистыми и метаболическими нарушениями [4], [21], [128].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: В РФ препараты тестостерона для лечения климактерических симптомов не зарегистрированы. Согласно данным систематического обзора и мета-анализа РКИ 2019 года препараты тестостерона могут быть эффективны для лечения женщин в постменопаузе, у которых после биопсихосоциальной оценки диагностировано снижение сексуального влечения. Эффективность в отношении улучшения общего самочувствия, скелетно-мышечного и когнитивного здоровья, а также показатели безопасности требуют дальнейшего изучения [128].
- Не рекомендуется накладывать произвольные ограничения на длительность МГТ при наличии показаний и отсутствии противопоказаний к ее применению [3], [4], [40], [44], [48], [75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Решение о продолжении МГТ принимается совместно пациенткой (хорошо информированной) и ее врачом, с учетом конкретных целей лечения и объективной оценки текущих индивидуальных преимуществ и рисков терапии.
Нет никаких причин накладывать жесткие ограничения на продолжительность МГТ. Данные наиболее важных РКИ свидетельствуют в поддержку безопасности терапии, по крайней мере, в течение 5 лет у здоровых женщин, начавших ее до возраста 60 лет [105].
Эксперты NAMS в 2015 г. (и 2022г) опубликовали заявление о возможном продолжении использования МГТ в минимальной эффективной дозе у женщин в возрасте ˃65 лет для лечения персистирующих приливов при условии, что пациентка получила подробную информацию о возможных рисках и находится под тщательным врачебным наблюдением [75].
Нет окончательного решения, каким образом лучше прекращать прием МГТ: постепенно или резко. У некоторых женщин ультранизкая доза гормонального препарата способна поддерживать общее благополучие и адекватное купирование симптомов, поэтому они предпочитают получать такое лечение до момента их полного завершения.
3.1.2 Локальная гормональная терапия
В РФ для вагинального применения зарегистрированы препараты эстриола (по АТХ Природные и олусинтетические эстрогены (G03CA)) в форме свечей, крема или геля в различных дозах: стандартной 0,5 мг, низкой 0,2 мг и ультранизкой 0,05 и 0,03 мг. Препараты с содержанием низкой и ультранизкой дозы эстриола представлены как в виде монотерапии, так и в сочетании с лактобактериями (по АТХ – Другие антисептики и противомикробные препараты для лечения гинекологических заболеваний (G01AX)).
- Рекомендовано назначение локальной гормонотерапии, содержащей стандартную дозу эстриола (по АТХ – Природные и полусинтетические эстрогены (G03CA)) 0,5 мг, женщинам в перименопаузе и постменопаузе для купирования проявлений генитоуринарного менопаузального синдрома [129], [130], [131], [132], [133], [134], [135].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1a).
Комментарий: Локальная (вагинальная) терапия эстриолом предпочтительна для женщин с жалобами на сухость влагалища, диспареунию или дискомфорт при половой жизни, связанный с этим состоянием. Эффективность локального эстриола 0.5 мг в лечении ГУМС/ВВА доказана в ходе РКИ и систематических обзоров [127], [128], [129]. В начале лечения препараты назначают ежедневно в терапевтической дозе 0.5 мг в течение 2-4 недель (терапия насыщения), по мере улучшения – 2 раза в неделю длительно (поддерживающая терапия) (см. таблицу 4 приложения А3). Лечение ГУМС рассматривается как долговременная терапия, так как ограничений для перерывов и возобновления приема этих препаратов нет. Симптомы ГУМС и выраженность атрофических изменений мочеполового тракта имеют прогрессирующее течение и возобновляются через 1-3 месяца после прекращения гормональной терапии. Эстриол интравагинально не имеет возрастных ограничений и может быть назначен женщинам старше 60 лет. В зависимости от тяжести симптомов гормональные препараты могут использоваться совместно с лубрикантами. Следует учесть для пациенток, принимающих системную МГТ, что она может быть недостаточно эффективна для купирования симптомов ГУМС, и это может потребовать дополнительного назначения локальной терапии эстрогенами. Длительные когортные исследования со сроком наблюдения от 7 до 18 лет, данные РКИ при сроке наблюдения до 52 недель показывают отсутствие влияния локальных эстрогенов на эндометрий, поэтому не требуется дополнительного использования прогестагенов [129].
Локальная гормональная терапия эстрогенами эффективна для профилактики рецидивирующих инфекций мочевыводящих путей, возникающих в постменопаузе на фоне атрофических изменений урогенитального тракта [131], [132]. Применение локальных эстрогенов может давать положительный эффект в отношении симптомов гиперактивного мочевого пузыря [133].
- Рекомендовано назначение локальной гормонотерапии, содержащей низкую дозу эстриола 0,2 мг в комбинации с лиофилизированной культурой лактобактерий и 2,0 мг прогестерона (по АТХ – Прочие препараты, применяемые в гинекологии); содержащей ультранизкую дозу эстриола 0,05 мг (по АТХ – Эстриол); ультранизкую дозу эстриола 0,03 мг в комбинации с лиофилизированной культурой лактобактерий (по АТХ – Прочие препараты, применяемые в гинекологии), женщинам при эстрогендефицитных состояниях/постменопаузе для купирования симптомов вульвовагинальной атрофии [136], [137], [138], [139], [140], [141], [142], [143], [144], [145] [146].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2a).
Комментарий: Плацебо – контролируемые и сравнительные исследования показали эффективность локальных препаратов, содержащих низкую и ультранизкую дозы эстриола (в комбинации с лиофилизированной культурой лактобактерий или без нее) для коррекции симптомов вульвовагинальной атрофии и поддержания здоровой экосистемы влагалища.
3.2 Негормональное лечение
3.2.1. К негормональным медикаментозным методам лечения менопаузальных симптомов относятся:
СИОЗС, СИОЗСН, препараты цимицифуги (МНН: Цимицифуги кистевидной корневищ с корнями экстракт), бета-аланина, полипептидов эпифиза (МНН: Полипептиды шишковидной железы [эпифиза] крупного рогатого скота) [2], [4], [21], [44], [48], [49], [70], [117], [145], [146], [147], [148], [149], [150], [151], [153], [154], [155], [156], [157], [158], [159], [160], [161], [162], [163], [164], [167], [168], [169], [170].
- Рекомендуется применение селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) женщинам с климактерическим синдромом, имеющих противопоказания к МГТ, в том числе пациенткам с гормонозависимыми злокачественными новообразованиями, или не желающих использовать МГТ, с целью купирования вазомоторных и психоэмоциональных симптомов и улучшения сна [2], [117], [146], [147], [150], [151], [152], [153], [155], [156], [157], [158], [159].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: к препаратам, которые достоверно облегчают вазомоторные симптомы и улучшают сон, относятся СИОЗС и СИОЗСН. Однако, В РФ СИОЗС и СИОЗСН не имеют зарегистрированных показаний к применению при климактерическом синдроме.
К СИОЗС относятся препараты #пароксетин** (используемые дозы 10-20 мг/сут) [150], [156, 195], #циталопрам (используемые дозы 10-20 мг/сут) [148], [170, 195], #эсциталопрам (используемые дозы 10-20 мг/сут) [149] и #флуоксетин** (используемые дозы 20 мг/сут [170, 195]). К СИОЗСН – #венлафаксин (используемые дозы 75 (37,5-150) мг/сут) [157],[158, 195].
У женщин, перенесших рак молочной железы и получающих тамоксифен**, следует отдавать предпочтение #венлафаксину, #эсциталопраму или #циталопраму [148], [149], [158] и избегать применения #пароксетина, #флуоксетина и #сертралина** из-за влияния на метаболизм тамоксифена** [195].
СИОЗС не влияют на активность ингибиторов ароматазы и могут безопасно использоваться у женщин, получающих данные препараты.
Длительность терапии СИОЗС и СИОЗСН составляет 3-6 месяцев. Вопрос о продолжении терапии решается индивидуально.
С целью минимизации побочных эффектов СИОЗС и СИОЗСН лечение начинают с минимальных доз с постепенным увеличением. Отмена препарата также должна проводиться с постепенным снижением дозы в течение не менее чем 2 недель во избежание появления симптомов отмены [160].
- Рекомендуется применение лекарственных препаратов цимицифуги кистевидной корневищ с корнями экстракт (по АТХ – Прочие препараты, применяемые в гинекологии) женщинам при наличии у них противопоказаний к МГТ или иных факторов, препятствующих ее назначению, для терапии вазомоторных симптомов легкой и средней степени тяжести [2], [171], [172].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Цимицифуги (МНН: Цимицифуги кистевидной корневищ с корнями экстракт) кистевидной корневищ экстракт не является фитоэстрогеном в классическом его понимании и действует через рецепторы серотонина, дофамина и норадреналина в головном мозге [2], [172].
Согласно данным систематического обзора и мета-анализа экстракт корневищ цимицифуги (МНН: Цимицифуги кистевидной корневищ с корнями экстракт) более эффективен в лечении вазомоторных симптомов, чем плацебо, хотя эффект менее выражен, чем у МГТ [2, 171].
- Рекомендуется назначение лекарственных препаратов бета-аланина (по АТХ – Прочие препараты, применяемые в гинекологии) женщинам при наличии у них противопоказаний к МГТ или иных факторов, препятствующих назначению МГТ для терапии вазомоторных симптомов легкой и средней степени тяжести [173], [174], [175], [176]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется женщинам, имеющим противопоказания к применению МГТ или отказе от ее проведения, назначение полипептидов эпифиза [шишковидной железы] крупного рогатого скота (по АТХ – Прочие препараты, применяемые в гинекологии) для лечения климактерических симптомов [168], [169], [177].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: Полипептиды эпифиза [шишковидной железы] крупного рогатого скота стимулируют продукцию пептидов, блокирующих структуры гипоталамуса, участвующих в возникновении вазомоторных симптомов. Препарат не оказывает влияния на уровень эстрадиола, уровни гонадотропинов в плазме крови и толщину эндометрия у женщин в период постменопаузы. Препарат противопоказан при предраковых или злокачественных заболеваниях, в т.ч. эстрогензависимых опухолях половых органов и молочной железы [168], [169], [177].
3.2.2. К негормональным немедикаментозным методам коррекции менопаузальных симптомов относятся: фитоэстрогены, увлажнители и лубриканты, модификация образа жизни.
- Рекомендуется применение альтернативных негормональных методов коррекции менопаузальных симптомов у женщин, имеющих противопоказания к МГТ или не желающих использовать МГТ [2], [3], [4], [23], [21], [80], [119], [128], [159], [161], [162], [163], [164], [165], [166], [167], [168], [169], [178], [179], [180], [181], [182], [183], [184], [185], [186], [187], [188], [189], [190], [191], [192], [193], [194].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Снижение массы тела ассоциировано со снижением степени тяжести и количества вазомоторных симптомов [178].
Использование фитоэстрогенов: транс–ресвератрола, изофлавонов сои, красного клевера способствует снижению количества и тяжести приливов жара [190], [191], [192], [193], [194], [195].
Использование когнитивно-поведенческой терапии, [179], [180], [181], [182], клинического гипноза [183], [189], акупунктуры [184] снижает частоту и степень тяжести вазомоторных симптомов, могут улучшить сон и настроение.
- Рекомендуется использование негормональных лубрикантов, регулярное использование увлажнителей пролонгированного действия, а также тренировка мышц тазового дна женщинам для терапии симптомов ГУМС [23], [49], [50], [72], [80], [118], [196], [197], [198], [199], [200].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Неприменимо
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфических профилактических мероприятий в отношении пациенток в пери- и постменопаузе не разработано. Неспецифическая профилактика подразумевает физическую активность, правильное питание и ведение здорового образа жизни.
- Рекомендуются регулярные физические упражнения женщинам в пери- и постменопаузе для улучшения качества жизни, снижения смертности от сердечно-сосудистых заболеваний и общей смертности [201], [202].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Оптимальные физические нагрузки составляют как минимум 150 минут аэробных упражнений средней интенсивности или 75 минут высокой интенсивности в неделю, возможно сочетание упражнение средней и высокой интенсивности. При выборе интенсивности аэробной активности необходимо учитывать физическое состояние и возраст женщины. Кроме того, рекомендовано прохождение не менее 10 000 шагов в сутки. У физически активных лиц улучшается метаболический профиль, сохраняются мышечная масса (профилактика саркопении) и сила, когнитивные способности и качество жизни. Заболевания сердца, инсульт, переломы и некоторые онкологические заболевания, например, рак молочной железы и рак толстой кишки, встречаются гораздо реже [201], [203].
- Рекомендуется снижение массы тела женщинам в пери- и постменопаузе при наличии избыточной массы тела или ожирения для снижения смертности от сердечно-сосудистых заболеваний и общей смертности [201], [202], [203], [204].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: у женщин вазомоторные симптомы увеличиваются по частоте и интенсивности параллельно повышению ИМТ. Снижение массы тела приводит к облегчению вазомоторных симптомов. У женщин, начиная с периода менопаузального перехода, происходит прибавка массы тела и перераспределение жировой ткани с преимущественным накоплением висцерального жира, что приводит к возникновению инсулинорезистентности и развитию метаболического синдрома. Снижение массы тела лишь на 5-10% достаточно для коррекции многих нарушений, ассоциированных с нарушениями углеводного обмена (НТГ, СД 2 типа). При неэффективности применяемых стратегий необходимо вести пациентку согласно клиническим рекомендациям «Ожирение».
- Рекомендуется следовать принципам здорового питания женщинам в пери- и постменопаузе для снижения смертности от сердечно-сосудистых заболеваний и общей смертности [201], [200], [204], [205].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Основные компоненты здорового питания: несколько порций в день фруктов и овощей, цельных злаков, рыба дважды в неделю и низкое общее потребление жиров, рекомендуется отдавать предпочтение оливковому маслу. Потребление соли должно быть ограничено, а дневное количество алкоголя не должно превышать 20 г.
- Рекомендуется отказаться от курения женщинам в пери- и постменопаузе для снижения смертности от сердечно-сосудистых заболеваний и общей смертности [201], [206].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Доказано более раннее наступление менопаузы у курящих женщин. Результаты крупномасштабных исследований показывают, что даже незначительное/умеренное, но длительное курение, значимо коррелирует с внезапной кардиальной смертью у женщин (в 2 раза выше по сравнению с некурящими сверстницами); риск внезапной кардиальной смерти возрастает на 8% в течение каждых 5-ти лет курения).
- Рекомендуется женщинам в пери- и постменопаузе следовать принципам, способствующим сохранению когнитивной функции в старшем возрасте [207], [208].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Существует три главных подхода для сохранения когнитивной функции: - улучшение состояния головного мозга за счет профилактики и лечения артериальной гипертензии, сахарного диабета 2 типа, дислипидемии, ожирения и отказа от курения; - повышение когнитивного резерва с помощью различных видов досуга, стимулирующих познавательную деятельность, и высокой социальной активности; - профилактика патологических изменений, характерных для болезни Альцгеймера, которая включает регулярные физические занятия, применение методик по формированию стрессоустойчивости.
МГТ, начатая в среднем возрасте, способствует снижению риска болезни Альцгеймера и деменции. Необходим новый стиль взаимоотношений врач – пациент, при котором врач становится советчиком, а пациентка должна взять ответственность за свое собственное здоровье.
- Рекомендуется мониторирование эффективности лечения и выявление нежелательных эффектов женщинам в пери- и постменопаузе, принимающим МГТ, через 1-2 месяца после начала лечения. Далее каждые 6 месяцев в течение первого года терапии, затем 1 раз в год [3], [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Наблюдение за пациентками, принимающими системную МГТ, включает: ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное) (не реже 1 раза в год; для пациенток с миомой матки не реже 1 раза в 6 месяцев); маммографию в двух проекциях с оценкой по шкале BI-RADS и ACR в возрасте после 40 лет и УЗИ молочных желез в возрасте до 40 лет с оценкой по шкале BI-RADS ежегодно; анализ крови биохимический общетерапевтический: (исследование уровня глюкозы в крови/гликированного гемоглобина в крови натощак, общего белка в крови, общего и прямого билирубина в крови, креатинина в крови) и анализ крови для оценки нарушений липидного обмена биохимический (исследование уровня холестерина крови, холестерина липопротеинов низкой плотности в крови, уровня холестерина липопротеинов высокой плотности в крови, триглицеридов в крови); общий (клинический) анализ крови; исследование уровня тиреотропного гормона (ТТГ) в крови (по показаниям); коагулограмму (ориентировочное исследование системы гемостаза – по показаниям); исследование уровня 25-ОН витамина D в крови (по показаниям); определение полиморфизма G20210A протромбина в гене фактора II свертывания крови и молекулярно-генетическое исследование мутации G1691A в гене фактора V (мутация Лейдена в V факторе свертывания) (по показаниям); рентгеноденситометрию поясничного отдела позвоночника и проксимального отдела бедренной кости с использованием двухэнергетической рентгеновской абсорбциометрии (ДЭРА) (по показаниям).
- Пациентки, принимающие только локальную гормонотерапию, проходят обследование согласно Приказу Министерства здравоохранения Российской Федерации от 20.10.2020 № 1130н "Об утверждении Порядка оказания медицинской помощи по профилю ‘акушерство и гинекология,’
- Рекомендуется женщинам, принимающим МГТ, ежегодно оценивать соотношение польза/риск для решения вопроса о продолжении МГТ [21], [82], [209], [210].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Потенциальная связь между использованием МГТ и раком молочной железы является спорной. Данные, полученные в исследовании WHI (Women’s Health Initiative) не показали повышения риска РМЖ у женщин, впервые применяющих МГТ в течение 5-7 лет после начала терапии. Согласно результатам WHI, повышенный риск РМЖ существует в случае применении определенной комбинации эстрогенов с синтетическим прогестагеном (КЭЭ и МПА) более 5 лет. При этом скорректированный относительный риск (на другие факторы риска) не является статистически значимым. Фактический риск РМЖ на фоне МГТ низок и оценивается как в менее чем 0,1% в год или <1 случая на 1000 женщин-лет среди пользователей МГТ, что ниже, чем риск, связанный с эндогенными факторами, такими как повышенная плотность молочных желез или таких факторов, как ожирение, гиподинамия и потребление алкоголя. Согласно данным ряда исследований, МГТ, содержащее микронизированный прогестерон (МНН: Прогестерон**) или дидрогестерон** не повышает риски РМЖ [21], [104], [105], [106], [211].
Результаты клинических исследований указывают, что риск развития рака молочной железы зависит от продолжительности МГТ, ее состава, возраста начала терапии, наличия сопутствующих факторов риска (избыточный вес и ожирение, курение, прием алкоголя и т.д.) [104], [105], [210], [212], [213], [214], [215], [216], [217]. При этом по данным РКИ применение МГТ не сопровождается повышением смертности от рака молочной железы [218].
6. Организация оказания медицинской помощи
Стационарное лечение не предусмотрено.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Не применимо
Критерии оценки качества медицинской помощи
№
| Критерии качества | Оценка выполнения |
1. | Определен уровень ФСГ, ТТГ, пролактина в крови у женщин до 45 лет с менопаузальными симптомами при наличии затруднений при определении стадии репродуктивного старения, а также при аменорее или нерегулярных менструациях | Да/Нет |
2. | Произведено ультразвуковое исследование матки и придатков | Да/Нет |
3. | Произведена рентгеновская маммография в 2 проекциях с оценкой по системе BI-RADS и ACR женщинам в возрасте 40 лет или старше, а также по показаниям – УЗИ молочных желез; женщинам до 40 лет – УЗИ молочных желез | Да/Нет |
4. | Выполнено цитологическое исследование микропрепарата шейки матки (ПАП-тест) и определение ДНК вирусов папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР, количественное исследование для скрининга поражений шейки матки | Да/Нет |
5. | Выполнено определение МПК при помощи рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости с использованием ДЭРА при наличии переломов в анамнезе/наличии факторов риска остеопороза/среднего (промежуточного) риска остеопоротических переломов по FRAX | Да/Нет |
6. | Произведено дополнительное обследование перед назначением МГТ: измерение АД, общий (клинический) анализ крови; анализ крови биохимический общетерапевтический (исследование уровня глюкозы в крови/гликированного гемоглобина в крови натощак, общего белка в крови, общего и прямого билирубина в крови, креатинина в крови) и анализ крови для оценки нарушений липидного обмена биохимический (исследование уровня холестерина крови, холестерина липопротеинов низкой плотности в крови, уровня холестерина липопротеинов высокой плотности в крови, триглицеридов в крови) | Да/Нет |
7. | Определены четкие показания/противопоказания к назначению МГТ, подбор минимально-эффективной дозы МГТ. С пациенткой проведена беседа о пользе и потенциальных рисках МГТ | Да/Нет |
8. | При наличии противопоказаний к приему МГТ пациентке предложены альтернативные методы коррекции климактерических расстройств и симптомов ГУМС | Да/Нет |
9. | Произведено мониторирование эффективности лечения и выявление нежелательных эффектов на фоне МГТ через 1-2 месяца после начала лечения, каждые 6 месяцев в течение первого года терапии и 1 раз в год в последующем | Да/Нет |
Список литературы
[1] S. D. Harlow et al., “Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging.,” J. Clin. Endocrinol. Metab., vol. 97, no. 4, pp. 1159–68, Apr. 2012, doi: 10.1210/jc.2011-3362.
[2] J. Drewe, K. A. Bucher, and C. Zahner, “A systematic review of non-hormonal treatments of vasomotor symptoms in climacteric and cancer patients,” pp. 1–29, 2015, doi: 10.1186/s40064-015-0808-y.
[3] P. F. Schnatz, A. Romegialli, J. Abrantes, K. Marakovits, D. Cunningham, and D. M. O’Sullivan, “The North American Menopause Society: From abstract to publication,” Menopause, vol. 15, no. 5, pp. 996–1001, 2008, doi: 10.1097/gme.0b013e318166f026.
[4] Сухих Г.Т., Сметник В.П., Андреева Е.Н., Балан В.Е., Гависова А.А., Григорян О.Р., Ермакова Е.И., Зайдиева Я.З., Ильина Л.М., Касян В.Н., Марченко Л.А., Подзолкова Н.М., Роговская С.И., Сметник А.А., Чернуха Г.Е., Юренева С.В. Менопаузальная гормонотерапия и сохранение здоровья женщин в зрелом возрасте. Клинические рекомендации. 2015, pp. 8–9.
[5] M. G. Munro et al., “The FIGO Ovulatory Disorders Classification System†.,” Hum. Reprod., vol. 37, no. 10, pp. 2446–2464, Sep. 2022, doi: 10.1093/humrep/deac180.
[6] C. K. Welt, Y. Jimenez, P. M. Sluss, P. C. Smith, and J. E. Hall, “Control of estradiol secretion in reproductive ageing.,” Hum. Reprod., vol. 21, no. 8, pp. 2189–93, Aug. 2006, doi: 10.1093/humrep/del136.
[7] N. D. Shaw et al., “Compensatory Increase in Ovarian Aromatase in Older Regularly Cycling Women.,” J. Clin. Endocrinol. Metab., vol. 100, no. 9, pp. 3539–47, Sep. 2015, doi: 10.1210/JC.2015-2191.
[8] E. K. Ofori et al., “Thigh and abdominal adipose tissue depot associations with testosterone levels in postmenopausal females.,” Clin. Endocrinol. (Oxf)., vol. 90, no. 3, pp. 433–439, Mar. 2019, doi: 10.1111/cen.13921.
[9] C. M. Rariy et al., “Higher serum free testosterone concentration in older women is associated with greater bone mineral density, lean body mass, and total fat mass: the cardiovascular health study.,” J. Clin. Endocrinol. Metab., vol. 96, no. 4, pp. 989–96, Apr. 2011, doi: 10.1210/jc.2010-0926.
[10] M. E. Wierman et al., “Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline.,” J. Clin. Endocrinol. Metab., vol. 99, no. 10, pp. 3489–510, Oct. 2014, doi: 10.1210/jc.2014-2260.
[11] S. L. Davison, R. Bell, S. Donath, J. G. Montalto, and S. R. Davis, “Androgen levels in adult females: changes with age, menopause, and oophorectomy.,” J. Clin. Endocrinol. Metab., vol. 90, no. 7, pp. 3847–53, Jul. 2005, doi: 10.1210/jc.2005-0212.
[12] A. R. Cappola et al., “Hormones and Aging: An Endocrine Society Scientific Statement.,” J. Clin. Endocrinol. Metab., vol. 108, no. 8, pp. 1835–1874, Jul. 2023, doi: 10.1210/clinem/dgad225.
[13] S. R. Davis, “Testosterone and the heart: friend or foe?,” Climacteric, vol. 27, no. 1, pp. 53–59, Jan. 2024, doi: 10.1080/13697137.2023.2250252.
[14] C. C. Zouboulis et al., “Skin, hair and beyond: the impact of menopause,” Climacteric, vol. 25, no. 5, pp. 434–442, Sep. 2022, doi: 10.1080/13697137.2022.2050206.
[15] D. A. Schoenaker, C. A. Jackson, J. V Rowlands, and G. D. Mishra, “Socioeconomic position, lifestyle factors and age at natural menopause: a systematic review and meta-analyses of studies across six continents,” Int. J. Epidemiol., vol. 43, no. 5, pp. 1542–1562, Oct. 2014, doi: 10.1093/ije/dyu094.
[16] E. W. Freeman, M. D. Sammel, and R. J. Sanders, “Risk of long-term hot flashes after natural menopause: evidence from the Penn Ovarian Aging Study cohort,” Menopause, vol. 21, no. 9, pp. 924–932, Sep. 2014, doi: 10.1097/GME.0000000000000196.
[17] Улумбекова Г.Э., Худова И.Ю. “Оценка демографического,социального и экономического эффекта при приеме менопаузальной гормональной терапии,” ОРГЗДРАВ: новости, мнения .Вестник ВШОУЗ., vol. 6, no. 4, pp. 23–53, 2020.
[18] C. Costanian, S. Zangiabadi, S. A. Bahous, R. Deonandan, and H. Tamim, “Reviewing the evidence on vasomotor symptoms: the role of traditional and non-traditional factors,” Climacteric, vol. 23, no. 3, pp. 213–223, May 2020, doi: 10.1080/13697137.2019.1711051.
[19] N. Santoro, C. N. Epperson, and S. B. Mathews, “Menopausal Symptoms and Their Management,” Endocrinol. Metab. Clin. North Am., vol. 44, no. 3, pp. 497–515, 2015, doi: 10.1016/j.ecl.2015.05.001.
[20] G. A. Mel’Nichenko et al., “Russian federal clinical guidelines on the diagnostics, treatment, and prevention of osteoporosis,” Probl. Endokrinol. (Mosk)., vol. 63, no. 6, pp. 392–426, 2017, doi: 10.14341/probl2017636392-426.
[21] R. J. Baber, N. Panay, A. Fenton, and IMS Writing Group, “2016 IMS Recommendations on women’s midlife health and menopause hormone therapy.,” Climacteric, vol. 19, no. 2, pp. 109–50, Apr. 2016, doi: 10.3109/13697137.2015.1129166.
[22] F. Palma, A. Volpe, P. Villa, and A. Cagnacci, “Vaginal atrophy of women in postmenopause. Results from a multicentric observational study: The AGATA study,” Maturitas, vol. 83, pp. 40–44, Jan. 2016, doi: 10.1016/j.maturitas.2015.09.001.
[23] S. V. Yureneva, E. I. Ermakova, and A. V. Glazunova, “Genitourinary syndrome of menopause in peri- and postmenopausal patients: Diagnosis and therapy (short clinical guideline),” Akush. Ginekol. (Sofiia)., vol. 5_2016, pp. 138–144, May 2016, doi: 10.18565/aig.2016.5.138-144.
[24] L. N. Wood and J. T. Anger, “Urinary incontinence in women,” BMJ Br. Med. J., vol. 349, p. g4531, Sep. 2014, doi: 10.1136/bmj.g4531.
[25] L. Verrilli and S. L. Berga, “What Every Gynecologist Should Know About Perimenopause,” Clin. Obstet. Gynecol., vol. 63, no. 4, pp. 720–734, Dec. 2020, doi: 10.1097/GRF.0000000000000578.
[26] P. Paramsothy et al., “Duration of the menopausal transition is longer in women with young age at onset: the multiethnic Study of Women’s Health Across the Nation.,” Menopause, vol. 24, no. 2, pp. 142–149, Feb. 2017, doi: 10.1097/GME.0000000000000736.
[27] E. Armeni et al., “Maintaining postreproductive health: A care pathway from the European Menopause and Andropause Society (EMAS).,” Maturitas, vol. 89, pp. 63–72, Jul. 2016, doi: 10.1016/j.maturitas.2016.04.013.
[28] W. H. Natcher, “NIH State-of-the-Science Conference on Management of Menopause-Related Symptoms Sponsored by : National Institutes of Health,” Heal. (San Fr., vol. 3, p. 118(suppl 2):1–172, 2005.
[29] E V Shlyakhto, G T Sukhikh, V N Serov, I I Dedov, G P Arutyunov, I A Suchkov, Ya A Orlova, E N Andreeva, S V Yureneva, I S Yavelov, M I Yarmolinskaya, S V Villevalde, O R Grigoryan, E N Dudinskaya, E A Ilyukhin, N A Koziolova, I V Sergienko, A A Smetnik, N I Tapilskaya “Russian eligibility criteria prescribing menopausal hormonal hormones therapy for patients with cardiovascular and metabolic diseases. Consensus document of the Russian Cardiological Society, Russian Society of Obstetricians and Gynecologists, Russian Ass,” Probl. Endocrinol., vol. 69, no. 5, pp. 115–136, Nov. 2023, doi: 10.14341/probl13394.
[30] A. L. Hirschberg, “Hyperandrogenism and Cardiometabolic Risk in Pre- and Postmenopausal Women-What Is the Evidence?,” J. Clin. Endocrinol. Metab., vol. 109, no. 5, pp. 1202–1213, Apr. 2024, doi: 10.1210/clinem/dgad590.
[31] C. A. Stuenkel, “Reproductive milestones across the lifespan and cardiovascular disease risk in women,” Climacteric, vol. 27, no. 1, pp. 5–15, Jan. 2024, doi: 10.1080/13697137.2023.2259793.
[32] P. Monteleone, G. Mascagni, A. Giannini, A. R. Genazzani, and T. Simoncini, “Symptoms of menopause — global prevalence, physiology and implications,” Nat. Rev. Endocrinol., vol. 14, no. 4, pp. 199–215, 2018, doi: 10.1038/nrendo.2017.180.
[33] P. M. Maki et al., “Guidelines for the evaluation and treatment of perimenopausal depression: Summary and recommendations,” J. Women’s Heal., vol. 28, no. 2, pp. 117–134, 2019, doi: 10.1089/jwh.2018.27099.mensocrec.
[34] E. S. Mitchell and N. F. Woods, “Cognitive symptoms during the menopausal transition and early postmenopause,” Climacteric, vol. 14, no. 2, pp. 252–261, Apr. 2011, doi: 10.3109/13697137.2010.516848.
[35] S. R. El Khoudary et al., “Menopause Transition and Cardiovascular Disease Risk: Implications for Timing of Early Prevention: A Scientific Statement From the American Heart Association.,” Circulation, vol. 142, no. 25, pp. e506–e532, Dec. 2020, doi: 10.1161/CIR.0000000000000912.
[36] H. M. Kravitz and H. Joffe, “Sleep During the Perimenopause: A SWAN Story,” Obstetrics and Gynecology Clinics of North America, vol. 38, no. 3. Elsevier, pp. 567–586, Sep. 2011. doi: 10.1016/j.ogc.2011.06.002.
[37] S. M. Mallhi TH, Khan YH, Khan AH, Mahmood Q, Khalid SH, “Managing Hot Flushes in Menopausal Women: A Review,” J Coll Physicians Surg Pak., vol. Jun;28(6), pp. 460–465, 2018, doi: doi: 10.29271/jcpsp.2018.06.460.
[38] M. R. Islam, P. Gartoulla, R. J. Bell, P. Fradkin, and S. R. Davis, “Prevalence of menopausal symptoms in Asian midlife women: a systematic review,” Climacteric, vol. 18, no. 2, pp. 157–176, Mar. 2015, doi: 10.3109/13697137.2014.937689.
[39] S. Chaikittisilpa, K. Soimongkol, and U. Jaisamrarn, “Efficacy of oral estrogen plus testosterone gel to improve sexual function in postmenopausal women,” Climacteric, vol. 22, no. 5, pp. 460–465, Sep. 2019, doi: 10.1080/13697137.2019.1577378.
[40] G. Sarri, H. Pedder, S. Dias, Y. Guo, and M. A. Lumsden, “Vasomotor symptoms resulting from natural menopause: a systematic review and network meta-analysis of treatment effects from the National Institute for Health and Care Excellence guideline on menopause,” BJOG An Int. J. Obstet. Gynaecol., vol. 124, no. 10, pp. 1514–1523, Sep. 2017, doi: https://doi.org/10.1111/1471-0528.14619.
[41] ESHRE, ASRM, CREWHIRL and IMS Guideline Group on POI, Panay N, Anderson RA, et al. Evidence-based guideline: premature ovarian insufficiency. Climacteric. 2024;27(6):510-520. doi:10.1080/13697137.2024.2423213.
[42] D. Harlow, P. Maki, R. W. Rebar, and E. Director, “President, International Menopause Society (South Africa),” Climacteric, vol. 15, no. 2, pp. 105–114, 2012, doi: 10.3109/13697137.2011.650656.
[43] “Приказ Министерства здравоохранения Российской Федерации от 20.10.2020 № 1130н ‘Об утверждении Порядка оказания медицинской помощи по профилю ’акушерство и гинекология"”.
[44] “Доброкачественная дисплазия молочной железы. Клинические рекомендации. Министерство здравоохранения Российской Федерации.,” p. 77, 2020.
[45] M. A. Lumsden, “The NICE Guideline – Menopause: diagnosis and management,” Climacteric, vol. 19, no. 5, pp. 426–429, Sep. 2016, doi: 10.1080/13697137.2016.1222483.
[46] Юренева С.В., Ермакова Е.И., Павлович С.В., Корнеева И.Е., Смольникова В.Ю., Мишиева Н.Г. Ведение женщин с менопаузальными расстройствами. Учебное пособие. М.: ГЭОТАР-Медиа. 2016;23-26.
[47] С. В. Ермакова, Е.И, Юренева, “Менопауза и климактерическое состояние у женщины,” Акушерство и гинекология., vol. 7, pp. 17–21, 2018.
[48] S. V. Yureneva, V. I. Komedina, and S. Y. Kuznetsov, “Weight gain in perimenopausal women: methods for assessing the body composition and maintenance tactics,” Akush. Ginekol. (Sofiia)., vol. 2_2020, pp. 56–61, Mar. 2020, doi: 10.18565/aig.2020.2.56-61.
[49] O. Ortmann, M. Beckermann, E. Inwald, T. Strowitzki, E. Windler, and C. Tempfer, “Peri- and postmenopause—diagnosis and interventions interdisciplinary S3 guideline of the association of the scientific medical societies in Germany (AWMF 015/062): short version,” Arch. Gynecol. Obstet., vol. 302, Jul. 2020, doi: 10.1007/s00404-020-05682-4.
[50] National Collaborating Centre for Women’s and Children's Health (UK). Menopause: Full Guideline. London: National Institute for Health and Care Excellence. London, 2015.
[51] M. G. Munro, H. O. D. Critchley, I. S. Fraser, and FIGO Menstrual Disorders Committee, “The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions.,” Int. J. Gynaecol. Obstet., vol. 143, no. 3, pp. 393–408, Dec. 2018, doi: 10.1002/ijgo.12666.
[52] Menopause Practice (5th Edition) : A Clinician’s Guide.The North American Menopause Society. 2014.
[53] E. A. Pigarova et al., “Russian Association of Endocrinologists recommendations for diagnosis, treatment and prevention of vitamin D deficiency in adults,” Probl. Endocrinol., vol. 62, no. 4, pp. 60–84, Jul. 2016, doi: 10.14341/probl201662460-84.
[54] J. Wang, “Analysis of the application values of different combination schemes of liquid-based cytology and high-risk human papilloma virus test in the screening of high-grade cervical lesions.,” Brazilian J. Med. Biol. Res. = Rev. Bras. Pesqui. medicas e Biol., vol. 52, no. 1, p. e7517, Nov. 2018, doi: 10.1590/1414-431X20187517.
[55] D. J. Portman, M. L. S. Gass, and on behalf of the V. A. T. C. C. Panel, “Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and The North American Menopause Society,” Menopause, vol. 21, no. 10, 2014.
[56] A. Meggiolaro, B. Unim, L. Semyonov, S. Miccoli, E. Maffongelli, and G. La Torre, “The role of Pap test screening against cervical cancer: a systematic review and meta-analysis.,” Clin. Ter., vol. 167, no. 4, pp. 124–139, 2016, doi: 10.7417/CT.2016.1942.
[57] L. Shepstone et al., “Screening in the community to reduce fractures in older women (SCOOP): a randomised controlled trial.,” Lancet (London, England), vol. 391, no. 10122, pp. 741–747, Feb. 2018, doi: 10.1016/S0140-6736(17)32640-5.
[58] X. Jiang et al., “Diagnostic accuracy of FRAX in predicting the 10-year risk of osteoporotic fractures using the USA treatment thresholds: A systematic review and meta-analysis,” Bone, vol. 99, pp. 20–25, Jun. 2017, doi: 10.1016/j.bone.2017.02.008.
[59] “FRAX ®Инструмент оценки риска перелома.” [Online]. Available: https://frax.shef.ac.uk/FRAX/tool.aspx?lang=rs
[60] Остеопороз. Клинические рекомендации (актуальные).
[61] J. A. Kanis, C. Cooper, & R. Rizzoli, and J.-Y. Reginster, “European guidance for the diagnosis and management of osteoporosis in postmenopausal women”, doi: 10.1007/s00198-018-4704-5.
[62] W. D. Leslie, S. Morin, L. M. Lix, and H. Johansson, “Fracture risk assessment without bone density measurement in routine clinical practice,” 2011, doi: 10.1007/s00198-011-1747-2.
[63] W. D. Leslie et al., “High fracture probability with FRAX® usually indicates densitometric osteoporosis: implications for clinical practice,” Osteoporos. Int., vol. 23, no. 1, pp. 391–397, 2012, doi: 10.1007/s00198-011-1592-3.
[64] “‘International Society for Clinical Densitometry position statement 2019.’ https://www.iscd.org/official-positions/2019-iscd-official-positions-adult.”
[65] N. Panay et al., “Premature ovarian insufficiency: an International Menopause Society White Paper.,” Climacteric, vol. 23, no. 5, pp. 426–446, Oct. 2020, doi: 10.1080/13697137.2020.1804547.
[66] T. B. Bevers et al., “NCCN Guidelines® Insights: Breast Cancer Screening and Diagnosis, Version 1.2023.,” J. Natl. Compr. Canc. Netw., vol. 21, no. 9, pp. 900–909, Sep. 2023, doi: 10.6004/jnccn.2023.0046.
[67] S. G. Vitale et al., “Endometrial biopsy: Indications, techniques and recommendations. An evidence-based guideline for clinical practice.,” J. Gynecol. Obstet. Hum. Reprod., vol. 52, no. 6, p. 102588, Jun. 2023, doi: 10.1016/j.jogoh.2023.102588.
[68] “Методические рекомендации по использованию системы BI-RADS при маммографическом обследовании / Методические рекомендации под редакцией д.м.н., профессора, член-корреспондента РАН, Заслуженного деятеля науки РФ, А. Ю. Васильева. — Москва. — 2017”.
[69] BMS joint guideline, “Management of unscheduled bleeding on hormone replacement therapy (HRT),” 2024.
[70] S. R. Salpeter, J. M. E. Walsh, T. M. Ormiston, E. Greyber, N. S. Buckley, and E. E. Salpeter, “Meta-analysis: effect of hormone-replacement therapy on components of the metabolic syndrome in postmenopausal women.,” Diabetes. Obes. Metab., vol. 8, no. 5, pp. 538–554, Sep. 2006, doi: 10.1111/j.1463-1326.2005.00545.x.
[71] M. Canonico, G. Plu-Bureau, G. D. O. Lowe, and P.-Y. Scarabin, “Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis.,” BMJ, vol. 336, no. 7655, pp. 1227–1231, May 2008, doi: 10.1136/bmj.39555.441944.BE.
[72] C. A. Stuenkel et al., “Treatment of Symptoms of the Menopause: An Endocrine Society Clinical Practice Guideline,” J. Clin. Endocrinol. Metab., vol. 100, no. 11, pp. 3975–4011, Nov. 2015, doi: 10.1210/jc.2015-2236.
[73] G. Casanova, R. Bossardi Ramos, P. Ziegelmann, and P. M. Spritzer, “Effects of Low-Dose Versus Placebo or Conventional-Dose Postmenopausal Hormone Therapy on Variables Related to Cardiovascular Risk: A Systematic Review and Meta-Analyses of Randomized Clinical Trials,” J. Clin. Endocrinol. Metab., vol. 100, no. 3, pp. 1028–1037, Mar. 2015, doi: 10.1210/jc.2014-3301.
[74] H. Okano et al., “Japan Society of Obstetrics and Gynecology and Japan Society for Menopause and Women’s Health 2017 guidelines for hormone replacement therapy,” J. Obstet. Gynaecol. Res., vol. 44, no. 8, pp. 1355–1368, Aug. 2018, doi: https://doi.org/10.1111/jog.13684.
[75] “The 2022 Hormone Therapy Position Statement of The North American Menopause Society” Advisory Panel, “The 2022 hormone therapy position statement of The North American Menopause Society.,” Menopause, vol. 29, no. 7, pp. 767–794, Jul. 2022, doi: 10.1097/GME.0000000000002028.
[76] Menopause Practice: A Clinician’s Guide 5-th Edition. The American Menopause Society. 2014.
[77] “The 2017 hormone therapy position statement of The North American Menopause Society.,” Menopause, vol. 24, no. 7, pp. 728–753, Jul. 2017, doi: 10.1097/GME.0000000000000921.
[78] L. Webber et al., “ESHRE Guideline: management of women with premature ovarian insufficiency.,” Hum. Reprod., vol. 31, no. 5, pp. 926–937, May 2016, doi: 10.1093/humrep/dew027.
[79] C. Biehl, O. Plotsker, and S. Mirkin, “A systematic review of the efficacy and safety of vaginal estrogen products for the treatment of genitourinary syndrome of menopause.,” Menopause, vol. 26, no. 4, pp. 431–453, Apr. 2019, doi: 10.1097/GME.0000000000001221.
[80] “The 2020 genitourinary syndrome of menopause position statement of The North American Menopause Society,” Menopause, vol. 27, no. 9, pp. 976–992, 2020, doi: DOI: 10.1097/GME.0000000000001609.
[81] R. H. Cobin and N. F. Goodman, “American Association of Clinical Endocrinologists and American College of Endocrinology Position Statement on Menopause–2017 Update,” Endocr. Pract., vol. 23, no. 7, pp. 869–881, Jul. 2017, doi: 10.4158/EP171828.PS.
[82] Marjoribanks J. et al. Long term hormone therapy for perimenopausal and postmenopausal women //Cochrane Database of Systematic Reviews. – 2012. – №. 7.
[83] I. Lambrinoudaki, E. Armeni, D. Goulis, S. Bretz, Iuliana Ceausu, F. Durmusoglu, R. Erkkola, I. Fistonic, M. Gambacciani, M. Geukes, H. Hamoda, C. Hartley, A. Lindén Hirschberg, B. Meczekalski, N. Mendoza, A. Mueck, A. Smetnik, P. Stute, M. van Trotsenburg, M. Rees. “Menopause, wellbeing and health: A care pathway from the European Menopause and Andropause Society.,” Maturitas, vol. 163, pp. 1–14, Sep. 2022, doi: 10.1016/j.maturitas.2022.04.008.
[84] R. Kagan, G. Constantine, A. M. Kaunitz, B. Bernick, and S. Mirkin, “Improvement in sleep outcomes with a 17 b -estradiol–progesterone oral capsule (TX-001HR) for postmenopausal women,” vol. 26, no. 6, pp. 622–628, 2019, doi: 10.1097/GME.0000000000001278.
[85] V. M. Miller et al., “The Kronos Early Estrogen Prevention Study (KEEPS): what have we learned?,” Menopause, vol. 26, no. 9, pp. 1071–1084, Sep. 2019, doi: 10.1097/GME.0000000000001326.
[86] H. N. Hodis et al., “Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol.,” N. Engl. J. Med., vol. 374, no. 13, pp. 1221–31, Mar. 2016, doi: 10.1056/NEJMoa1505241.
[87] H. Shao et al., “Hormone therapy and Alzheimer disease dementia,” Neurology, vol. 79, no. 18, pp. 1846–1852, Oct. 2012, doi: 10.1212/WNL.0b013e318271f823.
[88] D. Sanchez-Rodriguez et al., “The Belgian Bone Club 2020 guidelines for the management of osteoporosis in postmenopausal women,” Maturitas, vol. 139, no. May, pp. 69–89, 2020, doi: 10.1016/j.maturitas.2020.05.006.
[89] S. Gordhandas, B. M. Norquist, K. P. Pennington, R. L. Yung, M. B. Laya, and E. M. Swisher, “Hormone replacement therapy after risk reducing salpingo-oophorectomy in patients with BRCA1 or BRCA2 mutations; a systematic review of risks and benefits.,” Gynecol. Oncol., vol. 153, no. 1, pp. 192–200, Apr. 2019, doi: 10.1016/j.ygyno.2018.12.014.
[90] M. Ulin, M. Ali, Z. T. Chaudhry, A. Al-Hendy, and Q. Yang, “Uterine fibroids in menopause and perimenopause,” Menopause, vol. 27, no. 2, pp. 238–242, 2020, doi: 10.1097/GME.0000000000001438.
[91] E. Moro et al., “The impact of hormonal replacement treatment in postmenopausal women with uterine fibroids: A state-of-the-art review of the literature,” Med., vol. 55, no. 9, 2019, doi: 10.3390/medicina55090549.
[92] Sukhikh G.T., Serov V.N., Adamyan L.V., Baranov I.I., Bezhenar V.F., Gabidullina R.I., Dubrovina S.O., Kozachenko A.V., Podzolkova N.M., Smetnik A.A., Tapilskaya N.I., Uvarova E.V., Shikh E.V., Yarmolinskaya M.I. “Algorithms for the management of patients with endometriosis: an agreed position of experts from the Russian Society of Obstetricians and Gynecologists,” Akush. Ginekol. (Sofiia)., vol. 5_2023, pp. 159–176, May 2023, doi: 10.18565/aig.2023.132.
[93] C. Oliver-Williams et al., “The route of administration, timing, duration and dose of postmenopausal hormone therapy and cardiovascular outcomes in women: a systematic review.,” Hum. Reprod. Update, vol. 25, no. 2, pp. 257–271, Mar. 2019, doi: 10.1093/humupd/dmy039.
[94] N. Biglia, A. Gadducci, R. Ponzone, R. Roagna, and P. Sismondi, “Hormone replacement therapy in cancer survivors.,” Maturitas, vol. 48, no. 4, pp. 333–346, Aug. 2004, doi: 10.1016/j.maturitas.2003.09.031.
[95] S. Kim, Y. Ko, H. J. Lee, and J.-E. Lim, “Menopausal hormone therapy and the risk of breast cancer by histological type and race: a meta-analysis of randomized controlled trials and cohort studies.,” Breast Cancer Res. Treat., vol. 170, no. 3, pp. 667–675, Aug. 2018, doi: 10.1007/s10549-018-4782-2.
[96] G. Formoso et al., “Short-term and long-term effects of tibolone in postmenopausal women.,” Cochrane database Syst. Rev., vol. 10, no. 10, p. CD008536, Oct. 2016, doi: 10.1002/14651858.CD008536.pub3.
[97] S. Tsiligiannis, B. C. Wick-Urban, J. van der Stam, and J. C. Stevenson, “Efficacy and safety of a low-dose continuous combined hormone replacement therapy with 0.5 mg 17β-estradiol and 2.5 mg dydrogesterone in subgroups of postmenopausal women with vasomotor symptoms,” Maturitas, vol. 139, pp. 20–26, Sep. 2020, doi: 10.1016/j.maturitas.2020.05.002.
[98] D. F. Archer, J. H. Pickar, D. C. MacAllister, and M. P. Warren, “Transdermal estradiol gel for the treatment of symptomatic postmenopausal women,” Menopause, vol. 19, no. 6, pp. 622–629, 2012, doi: 10.1097/gme.0b013e31823b8867.
[99] Y. Vinogradova, C. Coupland, and J. Hippisley-Cox, “Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases.,” BMJ, vol. 364, p. k4810, Jan. 2019, doi: 10.1136/bmj.k4810.
[100] M. Canonico et al., “Postmenopausal hormone therapy and risk of stroke: Impact of the route of estrogen administration and type of progestogen,” Stroke, vol. 47, no. 7, pp. 1734–1741, 2016, doi: 10.1161/STROKEAHA.116.013052.
[101] M. Canonico, “Hormone therapy and risk of venous thromboembolism among postmenopausal women.,” Maturitas, vol. 82, no. 3, pp. 304–307, Nov. 2015, doi: 10.1016/j.maturitas.2015.06.040.
[102] M. R. Rizzo, S. Leo, P. De Franciscis, N. Colacurci, and G. Paolisso, “Short-term effects of low-dose estrogen/drospirenone vs low-dose estrogen/dydrogesterone on glycemic fluctuations in postmenopausal women with metabolic syndrome,” Age (Omaha)., vol. 36, no. 1, pp. 265–274, 2014, doi: 10.1007/s11357-013-9554-7.
[103] W. B. White, V. Hanes, M. Mallareddy, and V. Chauhan, “Effects of the hormone therapy, drospirenone and 17-beta estradiol, on early morning blood pressure in postmenopausal women with hypertension.,” J. Am. Soc. Hypertens., vol. 2, no. 1, pp. 20–27, 2008, doi: 10.1016/j.jash.2007.08.004.
[104] A. Fournier, F. Berrino, and F. Clavel-Chapelon, “Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study.,” Breast Cancer Res. Treat., vol. 107, no. 1, pp. 103–111, Jan. 2008, doi: 10.1007/s10549-007-9523-x.
[105] Y. Vinogradova, C. Coupland, and J. Hippisley-Cox, “Use of hormone replacement therapy and risk of breast cancer: nested case-control studies using the QResearch and CPRD databases.,” BMJ, vol. 371, p. m3873, Oct. 2020, doi: 10.1136/bmj.m3873.
[106] H. Lyytinen, E. Pukkala, and O. Ylikorkala, “Breast cancer risk in postmenopausal women using estradiol-progestogen therapy.,” Obstet. Gynecol., vol. 113, no. 1, pp. 65–73, Jan. 2009, doi: 10.1097/AOG.0b013e31818e8cd6.
[107] P.-Y. Scarabin, E. Oger, G. Plu-Bureau, and EStrogen and THromboEmbolism Risk Study Group, “Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk.,” Lancet (London, England), vol. 362, no. 9382, pp. 428–32, Aug. 2003, doi: 10.1016/S0140-6736(03)14066-4.
[108] M. Canonico et al., “Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study.,” Circulation, vol. 115, no. 7, pp. 840–5, Feb. 2007, doi: 10.1161/CIRCULATIONAHA.106.642280.
[109] M. Canonico et al., “Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study.,” Arterioscler. Thromb. Vasc. Biol., vol. 30, no. 2, pp. 340–5, Feb. 2010, doi: 10.1161/ATVBAHA.109.196022.
[110] M. Š. Goldštajn et al., “Effects of transdermal versus oral hormone replacement therapy in postmenopause: a systematic review,” Arch. Gynecol. Obstet., vol. 307, no. 6, pp. 1727–1745, Jun. 2022, doi: 10.1007/s00404-022-06647-5.
[111] C. Schneider, S. S. Jick, and C. R. Meier, “Risk of cardiovascular outcomes in users of estradiol/dydrogesterone or other HRT preparations,” Climacteric, vol. 12, no. 5, pp. 445–453, Jan. 2009, doi: 10.1080/13697130902780853.
[112] J. Dinger, K. Bardenheuer, and K. Heinemann, “Drospirenone plus estradiol and the risk of serious cardiovascular events in postmenopausal women,” Climacteric, vol. 19, no. 4, pp. 349–356, Jul. 2016, doi: 10.1080/13697137.2016.1183624.
[113] V. Beral, K. Gaitskell, C. Hermon, K. Moser, G. Reeves, and R. Peto, “Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies.,” Lancet (London, England), vol. 385, no. 9980, pp. 1835–1842, May 2015, doi: 10.1016/S0140-6736(14)61687-1.
[114] C. Castelo-Branco et al., “Long-term compliance with estrogen replacement therapy in surgical postmenopausal women: benefits to bone and analysis of factors associated with discontinuation,” Menopause, vol. 6, no. 4, pp. 307–311, 1999, doi: 10.1097/00042192-199906040-00006.
[115] Л.А. Ашрафян, В.Е. Балан, И.И. Баранов, Ж.Е. Белая, С.А. Бобров, А.В. Воронцова, С.О. Дубровина, И.Е. Зазерская, И.А. Иловайская, Л.Ю. Карахалис, О.М. Лесняк, М.И. Мазитова, Н.М. Подзолкова, А.Э. Протасова, В.Н. Серов, А.А. Сметник, Л.С. Сотникова, Е.А. Ульрих, Г.Е. Чернуха, С.В. Юренева. Совместная позиция экспертов РОАГ, РАМ, АГЭ, РАОП / под ред. В.Н. Серова и С.В. Юреневой, “Алгоритмы применения менопаузальной гормональной терапии у женщин в период пери- и постменопаузы.,” Акушерство и гинекология., vol. 3: 210–221, 2021, doi: https://dx.doi.org/10.18565/aig.2021.3.210-221.
[116] P. Stute, J. Neulen, and L. Wildt, “The impact of micronized progesterone on the endometrium: a systematic review.,” Climacteric, vol. 19, no. 4, pp. 316–328, Aug. 2016, doi: 10.1080/13697137.2016.1187123.
[117] M. Bińkowska and J. Woroń, “Progestogens in menopausal hormone therapy.,” Prz. menopauzalny = Menopause Rev., vol. 14, no. 2, pp. 134–143, Jun. 2015, doi: 10.5114/pm.2015.52154.
[118] P. Briggs, “Genitourinary syndrome of menopause,” Post Reprod. Heal., vol. 26, no. 2, pp. 111–114, 2020, doi: 10.1177/2053369119884144.
[119] M. Rees et al., “European Menopause and Andropause Society (EMAS) and International Gynecologic Cancer Society (IGCS) position statement on managing the menopause after gynecological cancer: focus on menopausal symptoms and osteoporosis.,” Maturitas, vol. 134, pp. 56–61, Apr. 2020, doi: 10.1016/j.maturitas.2020.01.005.
[120] S. Tsiligiannis, N. Panay, and J. C. Stevenson, “Premature Ovarian Insufficiency and Long-Term Health Consequences.,” Curr. Vasc. Pharmacol., vol. 17, no. 6, pp. 604–609, 2019, doi: 10.2174/1570161117666190122101611.
[121] “Committee Opinion No. 698: Hormone Therapy in Primary Ovarian Insufficiency.,” Obstet. Gynecol., vol. 129, no. 5, pp. e134–e141, May 2017, doi: 10.1097/AOG.0000000000002044.
[122] B. Cartwright, J. Robinson, P. T. Seed, I. Fogelman, and J. Rymer, “Hormone Replacement Therapy Versus the Combined Oral Contraceptive Pill in Premature Ovarian Failure: A Randomized Controlled Trial of the Effects on Bone Mineral Density,” J. Clin. Endocrinol. Metab., vol. 101, no. 9, pp. 3497–3505, Sep. 2016, doi: 10.1210/jc.2015-4063.
[123] J. P. Langrish et al., “Cardiovascular effects of physiological and standard sex steroid replacement regimens in premature ovarian failure.,” Hypertens. (Dallas, Tex. 1979), vol. 53, no. 5, pp. 805–811, May 2009, doi: 10.1161/HYPERTENSIONAHA.108.126516.
[124] T. R. Rebbeck et al., “Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group.,” J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol., vol. 23, no. 31, pp. 7804–7810, Nov. 2005, doi: 10.1200/JCO.2004.00.8151.
[125] A. R. Genazzani, T. Schmelter, M. Schaefers, C. Gerlinger, and K. Gude, “One-year randomized study of the endometrial safety and bleeding pattern of 0.25 mg drospirenone/0.5 mg 17β-estradiol in postmenopausal women.,” Climacteric, vol. 16, no. 4, pp. 490–498, Aug. 2013, doi: 10.3109/13697137.2013.783797.
[126] E. Hirvonen, B. Cacciatore, T. Wahlström, H. Rita, and G. Wilén-Rosenqvist, “Effects of transdermal oestrogen therapy in postmenopausal women: a comparative study of an oestradiol gel and an oestradiol delivering patch.,” Br. J. Obstet. Gynaecol., vol. 104 Suppl , pp. 26–31, Nov. 1997, doi: 10.1111/j.1471-0528.1997.tb11564.x.
[127] J. C. Stevenson, G. Durand, E. Kahler, and T. Pertyński, “Oral ultra-low dose continuous combined hormone replacement therapy with 0.5 mg 17β-oestradiol and 2.5 mg dydrogesterone for the treatment of vasomotor symptoms: results from a double-blind, controlled study.,” Maturitas, vol. 67, no. 3, pp. 227–232, Nov. 2010, doi: 10.1016/j.maturitas.2010.07.002.
[128] R. M. Islam, R. J. Bell, S. Green, M. J. Page, and S. R. Davis, “Safety and efficacy of testosterone for women: a systematic review and meta-analysis of randomised controlled trial data.,” lancet. Diabetes Endocrinol., vol. 7, no. 10, pp. 754–766, Oct. 2019, doi: 10.1016/S2213-8587(19)30189-5.
[129] A. Lethaby, R. O. Ayeleke, and H. Roberts, “Local oestrogen for vaginal atrophy in postmenopausal women,” Cochrane Database Syst. Rev., vol. 2016, no. 11, Aug. 2016, doi: 10.1002/14651858.CD001500.pub3.
[130] C. Rueda, A. M. Osorio, A. C. Avellaneda, C. E. Pinzón, and O. I. Restrepo, “The efficacy and safety of estriol to treat vulvovaginal atrophy in postmenopausal women: a systematic literature review,” Climacteric, vol. 20, no. 4, pp. 321–330, Jul. 2017, doi: 10.1080/13697137.2017.1329291.
[131] A. L. Hirschberg et al., “Topical estrogens and non-hormonal preparations for postmenopausal vulvovaginal atrophy: An EMAS clinical guide.,” Maturitas, vol. 148, pp. 55–61, Jun. 2021, doi: 10.1016/j.maturitas.2021.04.005.
[132] C. J. Crandall, A. Diamant, and N. Santoro, “Safety of vaginal estrogens: a systematic review.,” Menopause, vol. 27, no. 3, pp. 339–360, Mar. 2020, doi: 10.1097/GME.0000000000001468.
[133] C. Perrotta, M. Aznar, R. Mejia, X. Albert, and C. W. Ng, “Oestrogens for preventing recurrent urinary tract infection in postmenopausal women,” Cochrane Database Syst. Rev., Apr. 2008, doi: 10.1002/14651858.CD005131.pub2.
[134] Y.-Y. Chen, T.-H. Su, and H.-H. Lau, “Estrogen for the prevention of recurrent urinary tract infections in postmenopausal women: a meta-analysis of randomized controlled trials,” Int. Urogynecol. J., vol. 32, no. 1, pp. 17–25, Jan. 2021, doi: 10.1007/s00192-020-04397-z.
[135] E. Russo et al., “Management of urinary incontinence in postmenopausal women: An EMAS clinical guide.,” Maturitas, vol. 143, pp. 223–230, Jan. 2021, doi: 10.1016/j.maturitas.2020.09.005.
[136] G. D. Constantine et al., “Endometrial safety of low-dose vaginal estrogens in menopausal women: a systematic evidence review.,” Menopause, vol. 26, no. 7, pp. 800–807, Jul. 2019, doi: 10.1097/GME.0000000000001315.
[137] S. V. Yureneva, A. V. Glazunova, E. G. Eprikyan, A. E. Donnikov A, and L. S. Ezhova, “Therapy for vulvovaginal atrophy in postmenopausal women: Clinical and pathogenetic aspects,” Akush. Ginekol. (Sofiia)., vol. 6_2017, pp. 143–150, Jul. 2017, doi: 10.18565/aig.2017.6.143-50.
[138] D. Y. Pushkar and M. Y. Gvozdev, “Dynamics of symptoms of genitourinary menopausal syndrome and the frequency of recurrence of lower urinary tract infection in women in periand postmenopausal patients with combined therapy with Trioginal®,” Gynecology, vol. 20, no. 6, pp. 67–72, Dec. 2018, doi: 10.26442/20795696.2018.6.180119.
[139] V. K. Kuzmenko, V. K. Kuzmenko, and A. G. Gyaurgiev, “Experience of application of hormonal and probiotic therapy in the complex treatment of women in peri- and postmenopausal with chronic recurrent bacterial cystitis in the background of vulvovaginal atrophy,” Urologiia, vol. 3_2019, pp. 66–71, Jul. 2019, doi: 10.18565/urology.2019.3.66-71.
[140] P. Villa et al., “Local ultra-low-dose estriol gel treatment of vulvo-vaginal atrophy: efficacy and safety of long-term treatment.,” Gynecol. Endocrinol., vol. 36, no. 6, pp. 535–539, Jun. 2020, doi: 10.1080/09513590.2019.1702016.
[141] A. Cano et al., “The therapeutic effect of a new ultra low concentration estriol gel formulation (0.005% estriol vaginal gel) on symptoms and signs of postmenopausal vaginal atrophy: results from a pivotal phase III study.,” Menopause, vol. 19, no. 10, pp. 1130–9, Oct. 2012, doi: 10.1097/gme.0b013e3182518e9a.
[142] G. B. Dikke et al., “Efficacy and safety of ultra-low dose vaginal estriol in the therapy of genitourinary syndrome of menopause: a phase III multicenter randomized controlled trial,” Akush. Ginekol. (Sofiia)., vol. 12_2022, pp. 146–156, Dec. 2022, doi: 10.18565/aig.2022.303.
[143] A. O. Mueck, X. Ruan, V. Prasauskas, P. Grob, and O. Ortmann, “Treatment of vaginal atrophy with estriol and lactobacilli combination: a clinical review,” Climacteric, vol. 21, no. 2, pp. 140–147, Mar. 2018, doi: 10.1080/13697137.2017.1421923.
[144] G. Capobianco, J. M. Wenger, G. B. Meloni, M. Dessole, P. L. Cherchi, and S. Dessole, “Triple therapy with Lactobacilli acidophili, estriol plus pelvic floor rehabilitation for symptoms of urogenital aging in postmenopausal women.,” Arch. Gynecol. Obstet., vol. 289, no. 3, pp. 601–8, Mar. 2014, doi: 10.1007/s00404-013-3030-6.
[145] U. Jaisamrarn, S. Triratanachat, S. Chaikittisilpa, P. Grob, V. Prasauskas, and N. Taechakraichana, “Ultra-low-dose estriol and lactobacilli in the local treatment of postmenopausal vaginal atrophy,” Climacteric, vol. 16, no. 3, pp. 347–355, Jun. 2013, doi: 10.3109/13697137.2013.769097.
[146] B. Kanne and J. Jenny, “[Local administration of low-dose estriol and vital Lactobacillus acidophilus in postmenopause].,” Gynakol. Rundsch., vol. 31, no. 1, pp. 7–13, 1991, [Online]. Available: http://www.ncbi.nlm.nih.gov/pubmed/1906830
[147] C. L. Loprinzi et al., “Newer Antidepressants and Gabapentin for Hot Flashes: An Individual Patient Pooled Analysis,” J. Clin. Oncol., vol. 27, no. 17, pp. 2831–2837, Mar. 2009, doi: 10.1200/JCO.2008.19.6253.
[148] A. E. Kalay, B. Demir, A. Haberal, M. Kalay, and O. Kandemir, “Efficacy of citalopram on climacteric symptoms.,” Menopause, vol. 14, no. 2, pp. 223–229, 2007, doi: 10.1097/01.gme.0000243571.55699.4a.
[149] K. E. Ensrud et al., “Effect of escitalopram on insomnia symptoms and subjective sleep quality in healthy perimenopausal and postmenopausal women with hot flashes: a randomized controlled trial.,” Menopause, vol. 19, no. 8, pp. 848–855, Aug. 2012, doi: 10.1097/gme.0b013e3182476099.
[150] J. A. Simon et al., “Low-dose paroxetine 7.5 mg for menopausal vasomotor symptoms: two randomized controlled trials.,” Menopause, vol. 20, no. 10, pp. 1027–1035, Oct. 2013, doi: 10.1097/GME.0b013e3182a66aa7.
[151] H. Joffe et al., “Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial.,” JAMA Intern. Med., vol. 174, no. 7, pp. 1058–1066, Jul. 2014, doi: 10.1001/jamainternmed.2014.1891.
[152] T. Shams et al., “SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials.,” J. Gen. Intern. Med., vol. 29, no. 1, pp. 204–213, Jan. 2014, doi: 10.1007/s11606-013-2535-9.
[153] Z. Sun, Y. Hao, and M. Zhang, “Efficacy and safety of desvenlafaxine treatment for hot flashes associated with menopause: a meta-analysis of randomized controlled trials.,” Gynecol. Obstet. Invest., vol. 75, no. 4, pp. 255–262, 2013, doi: 10.1159/000348564.
[154] D. Grady, B. Cohen, J. Tice, M. Kristof, A. Olyaie, and G. F. Sawaya, “Ineffectiveness of sertraline for treatment of menopausal hot flushes: a randomized controlled trial.,” Obstet. Gynecol., vol. 109, no. 4, pp. 823–830, Apr. 2007, doi: 10.1097/01.AOG.0000258278.73505.fa.
[155] E. W. Freeman et al., “Efficacy of escitalopram for hot flashes in healthy menopausal women: a randomized controlled trial.,” JAMA, vol. 305, no. 3, pp. 267–274, Jan. 2011, doi: 10.1001/jama.2010.2016.
[156] V. Stearns et al., “Paroxetine is an effective treatment for hot flashes: results from a prospective randomized clinical trial.,” J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol., vol. 23, no. 28, pp. 6919–6930, Oct. 2005, doi: 10.1200/JCO.2005.10.081.
[157] J. S. Carpenter et al., “Randomized, double-blind, placebo-controlled crossover trials of venlafaxine for hot flashes after breast cancer.,” Oncologist, vol. 12, no. 1, pp. 124–135, Jan. 2007, doi: 10.1634/theoncologist.12-1-124.
[158] L. Speroff, M. Gass, G. Constantine, and S. Olivier, “Efficacy and tolerability of desvenlafaxine succinate treatment for menopausal vasomotor symptoms: a randomized controlled trial.,” Obstet. Gynecol., vol. 111, no. 1, pp. 77–87, Jan. 2008, doi: 10.1097/01.AOG.0000297371.89129.b3.
[159] Y.-S. Cheng, C.-K. Sun, P.-Y. Yeh, M.-K. Wu, K.-C. Hung, and H.-J. Chiu, “Serotonergic antidepressants for sleep disturbances in perimenopausal and postmenopausal women: a systematic review and meta-analysis.,” Menopause, vol. 28, no. 2, pp. 207–216, Sep. 2020, doi: 10.1097/GME.0000000000001647.
[160] O. V. Shabalova, S. V. Yureneva, S. V. Khokhlova, Z. R. Gardanova, and E. I. Ermakova, “Managing menopausal symptoms in patients with hormone receptor-positive gynecologic cancers,” J. Mod. Oncol., vol. 22, no. 3, pp. 154–159, Nov. 2020, doi: 10.26442/18151434.2020.3.200104.
[161] “Nonhormonal management of menopause-associated vasomotor symptoms: 2015 position statement of The North American Menopause Society.,” Menopause, vol. 22, no. 11, pp. 1154–1155, Nov. 2015, doi: 10.1097/GME.0000000000000546.
[162] G. Mintziori et al., “EMAS position statement: Non-hormonal management of menopausal vasomotor symptoms.,” Maturitas, vol. 81, no. 3, pp. 410–413, Jul. 2015, doi: 10.1016/j.maturitas.2015.04.009.
[163] T. R. Moore, R. B. Franks, and C. Fox, “Review of Efficacy of Complementary and Alternative Medicine Treatments for Menopausal Symptoms.,” J. Midwifery Womens. Health, vol. 62, no. 3, pp. 286–297, May 2017, doi: 10.1111/jmwh.12628.
[164] C. L. Loprinzi et al., “Venlafaxine in management of hot flashes in survivors of breast cancer: a randomised controlled trial.,” Lancet (London, England), vol. 356, no. 9247, pp. 2059–2063, Dec. 2000, doi: 10.1016/S0140-6736(00)03403-6.
[165] P. Stute et al., “A model of care for healthy menopause and ageing: EMAS position statement,” Maturitas, vol. 92, pp. 1–6, 2016, doi: 10.1016/j.maturitas.2016.06.018.
[166] HD Nelson, KK Vesco, E Haney, R Fu, A Nedrow, J Miller, C Nicolaidis, M Walker, “Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis,” Database Abstr. Rev. Eff. Qual. Rev. [Internet]., 2006.
[167] A. Bardia, P. Novotny, J. Sloan, D. Barton, and C. Loprinzi, “Efficacy of nonestrogenic hot flash therapies among women stratified by breast cancer history and tamoxifen use: a pooled analysis,” Menopause, vol. 16, no. 3, pp. 477–483, 2009, doi: 10.1097/gme.0b013e31818c91ca.
[168] Ярмолинская М.И., Татарова Н.А., Касян В.Н., Петросян А.С. Эффективность негормональной терапии в лечении женщин с климактерическим синдромом. Российский вестник акушера-гинеколога. 2021;21(2):91‑101.
[169] S. V. Yureneva, T. Y. Ivanets, E. I. Ermakova, and V. G. Averkova, “The results of an open-label comparative randomized controlled clinical trial of the use of combined treatment including Pineamin in postmenopausal women,” Ross. Vestn. akushera-ginekologa, vol. 20, no. 2, p. 86, 2020, doi: 10.17116/rosakush20202002186.
[170] Suvanto-Luukkonen E. et al. Citalopram and fluoxetine in the treatment of postmenopausal symptoms: a prospective, randomized, 9-month, placebo-controlled, double-blind study //Menopause. – 2005. – Т. 12. – №. 1. – С. 18-26.
[171] C. Castelo-Branco et al., “Review & meta-analysis: isopropanolic black cohosh extract iCR for menopausal symptoms - an update on the evidence.,” Climacteric, vol. 24, no. 2, pp. 109–119, Apr. 2021, doi: 10.1080/13697137.2020.1820477.
[172] Рафаэлян И.В., Балан В.Е., Ковалева Л.А. “Эффективность и безопасность применения экстракта цимицифуги рацемозы в терапии климактерического синдрома в течение года (результаты собственного исследования),” Медицинский совет, vol. 7, pp. 54–57, 2014, doi: https://doi.org/10.21518/2079-701X-2014-7-54-57.
[173] Delaroix P., “Abufen 400 mg. Double blind plasebocontroled trial. Laboratories Adrian- Marinier.,” data file, 1978.
[174] Roueche J. et al., “Clinical trial report of double bind study of beta-alanin versus placebo in the treatment of hot flushes caused by climacteric syndrome and by the menopause. Laboratories DOMS-Adrian.,” data file, 1991.
[175] E. Andreeva and B. Tkeshelashvili, “Women dealing with hot flushes: The role of β-alanine,” Eur. Rev. Med. Pharmacol. Sci., vol. 24, no. 9, pp. 5148–5154, 2020, doi: 10.26355/eurrev_202005_21209.
[176] Овсянникова Т. В., Макаров И. О., Куликов И. А. “Клиническая эффективность негормональных методов терапии у женщин в перименопаузе.,” Акушерство, Гинекология и Репродукция., vol. 7(3), pp. 26–29, 2013.
[177] В. Н. Прилепская et al., “Новое в профилактике и терапии климактерического синдрома,” Гинекология, vol. 18, no. 1, pp. 1–8, 2016.
[178] C. H. Kroenke et al., “Effects of a dietary intervention and weight change on vasomotor symptoms in the Women’s Health Initiative Candyce,” Menopause, vol. 19, no. 9, pp. 980–988, 2013, doi: 10.1097/gme.0b013e31824f606e.Effects.
[179] S. Norton, J. Chilcot, and M. S. Hunter, “Cognitive-behavior therapy for menopausal symptoms (hot flushes and night sweats): moderators and mediators of treatment effects.,” Menopause, vol. 21, no. 6, pp. 574–578, Jun. 2014, doi: 10.1097/GME.0000000000000095.
[180] E. Mann, M. Smith, J. Hellier, and M. S. Hunter, “A randomised controlled trial of a cognitive behavioural intervention for women who have menopausal symptoms following breast cancer treatment (MENOS 1): trial protocol.,” BMC Cancer, vol. 11, p. 44, Jan. 2011, doi: 10.1186/1471-2407-11-44.
[181] B. Ayers, M. Smith, J. Hellier, E. Mann, and M. S. Hunter, “Effectiveness of group and self-help cognitive behavior therapy in reducing problematic menopausal hot flushes and night sweats (MENOS 2): a randomized controlled trial.,” Menopause, vol. 19, no. 7, pp. 749–759, Jul. 2012, doi: 10.1097/gme.0b013e31823fe835.
[182] Q. Zhang, F. Li, H. Zhang, X. Yu, and Y. Cong, “Effects of nurse-led home-based exercise & cognitive behavioral therapy on reducing cancer-related fatigue in patients with ovarian cancer during and after chemotherapy: A randomized controlled trial.,” Int. J. Nurs. Stud., vol. 78, pp. 52–60, Feb. 2018, doi: 10.1016/j.ijnurstu.2017.08.010.
[183] G. R. Elkins, W. I. Fisher, A. K. Johnson, J. S. Carpenter, and T. Z. Keith, “Clinical hypnosis in the treatment of postmenopausal hot flashes: a randomized controlled trial.,” Menopause, vol. 20, no. 3, pp. 291–298, Mar. 2013, doi: 10.1097/gme.0b013e31826ce3ed.
[184] H.-Y. Chiu, C.-H. Pan, Y.-K. Shyu, B.-C. Han, and P.-S. Tsai, “Effects of acupuncture on menopause-related symptoms and quality of life in women in natural menopause: a meta-analysis of randomized controlled trials.,” Menopause, vol. 22, no. 2, pp. 234–244, Feb. 2015, doi: 10.1097/GME.0000000000000260.
[185] M. S. Lee, J.-I. Kim, J. Y. Ha, K. Boddy, and E. Ernst, “Yoga for menopausal symptoms: a systematic review.,” Menopause, vol. 16, no. 3, pp. 602–608, 2009, doi: 10.1097/gme.0b013e31818ffe39.
[186] K. M. Newton et al., “Efficacy of yoga for vasomotor symptoms: a randomized controlled trial.,” Menopause, vol. 21, no. 4, pp. 339–346, Apr. 2014, doi: 10.1097/GME.0b013e31829e4baa.
[187] D. Anderson, C. Seib, and L. Rasmussen, “Can physical activity prevent physical and cognitive decline in postmenopausal women?: A systematic review of the literature,” Maturitas, vol. 79, no. 1, pp. 14–33, Sep. 2014, doi: 10.1016/j.maturitas.2014.06.010.
[188] A. Daley, H. Stokes-Lampard, A. Thomas, and C. MacArthur, “Exercise for vasomotor menopausal symptoms.,” Cochrane database Syst. Rev., no. 11, p. CD006108, Nov. 2014, doi: 10.1002/14651858.CD006108.pub4.
[189] G. Elkins et al., “Randomized trial of a hypnosis intervention for treatment of hot flashes among breast cancer survivors.,” J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol., vol. 26, no. 31, pp. 5022–5026, Nov. 2008, doi: 10.1200/JCO.2008.16.6389.
[190] S. Asgary, R. Karimi, S. Momtaz, R. Naseri, and M. H. Farzaei, “Effect of resveratrol on metabolic syndrome components: A systematic review and meta-analysis.,” Rev. Endocr. Metab. Disord., vol. 20, no. 2, pp. 173–186, Jun. 2019, doi: 10.1007/s11154-019-09494-z.
[191] R. Milia, “Improvement of climacteric symptoms with a novel sublingual product containing trans-resveratrol,” Prog. Nutr., vol. 17, pp. 68–72, 2015.
[192] L. Leo et al., “[Preliminary data on the effectiveness of resveratrol in a new formulation in treatment of hot flushes].,” Minerva Ginecol., vol. 67, no. 5, pp. 475–83, Oct. 2015, [Online]. Available: http://www.ncbi.nlm.nih.gov/pubmed/26491826
[193] L.-R. Chen, N.-Y. Ko, and K.-H. Chen, “Isoflavone Supplements for Menopausal Women: A Systematic Review.,” Nutrients, vol. 11, no. 11, Nov. 2019, doi: 10.3390/nu11112649.
[194] S. L. Crawford, E. A. Jackson, L. Churchill, J. W. Lampe, K. Leung, and J. K. Ockene, “Impact of dose, frequency of administration, and equol production on efficacy of isoflavones for menopausal hot flashes: a pilot randomized trial.,” Menopause, vol. 20, no. 9, pp. 936–45, Sep. 2013, doi: 10.1097/GME.0b013e3182829413.
[195] V. Djapardy and N. Panay, “Alternative and non-hormonal treatments to symptoms of menopause,” Best Pract. Res. Clin. Obstet. Gynaecol., vol. 81, pp. 45–60, May 2022, doi: 10.1016/j.bpobgyn.2021.09.012.
[196] S. S. Faubion, R. Sood, and E. Kapoor, “Genitourinary Syndrome of Menopause: Management Strategies for the Clinician.,” Mayo Clin. Proc., vol. 92, no. 12, pp. 1842–1849, Dec. 2017, doi: 10.1016/j.mayocp.2017.08.019.
[197] R. Kagan, S. Kellogg-Spadt, and S. J. Parish, “Practical Treatment Considerations in the Management of Genitourinary Syndrome of Menopause.,” Drugs Aging, vol. 36, no. 10, pp. 897–908, Oct. 2019, doi: 10.1007/s40266-019-00700-w.
[198] S. S. Faubion et al., “Management of genitourinary syndrome of menopause in women with or at high risk for breast cancer: consensus recommendations from The North American Menopause Society and The International Society for the Study of Women’s Sexual Health,” vol. 25, no. 6, pp. 596–608, 2018, doi: 10.1097/GME.0000000000001121.
[199] M. Hickey, J. L. Marino, S. Braat, and S. Wong, “A randomized, double-blind, crossover trial comparing a silicone- versus water-based lubricant for sexual discomfort after breast cancer.,” Breast Cancer Res. Treat., vol. 158, no. 1, pp. 79–90, Jul. 2016, doi: 10.1007/s10549-016-3865-1.
[200] E. Pitsouni, T. Grigoriadis, A. Douskos, M. Kyriakidou, M. E. Falagas, and S. Athanasiou, “Efficacy of vaginal therapies alternative to vaginal estrogens on sexual function and orgasm of menopausal women: A systematic review and meta-analysis of randomized controlled trials.,” Eur. J. Obstet. Gynecol. Reprod. Biol., vol. 229, pp. 45–56, Oct. 2018, doi: 10.1016/j.ejogrb.2018.08.008.
[201] V. Colpani et al., “Lifestyle factors, cardiovascular disease and all-cause mortality in middle-aged and elderly women: a systematic review and meta-analysis.,” Eur. J. Epidemiol., vol. 33, no. 9, pp. 831–845, Sep. 2018, doi: 10.1007/s10654-018-0374-z.
[202] E. Kapoor, M. L. Collazo-Clavell, and S. S. Faubion, “Weight Gain in Women at Midlife: A Concise Review of the Pathophysiology and Strategies for Management.,” Mayo Clin. Proc., vol. 92, no. 10, pp. 1552–1558, Oct. 2017, doi: 10.1016/j.mayocp.2017.08.004.
[203] I. I. Dedov et al., “Interdisciplinary Clinical Practice Guidelines ‘Management of Obesity and Its Comorbidities,’” Obe. Metab., vol. 18, no. 1, pp. 5–99, 2021, doi: 10.14341/omet12714.
[204] S. Khandelwal, “Obesity in midlife: lifestyle and dietary strategies.,” Climacteric, vol. 23, no. 2, pp. 140–147, Apr. 2020, doi: 10.1080/13697137.2019.1660638.
[205] I. Lambrinoudaki et al., “EMAS position statement: Diet and health in midlife and beyond.,” Maturitas, vol. 74, no. 1, pp. 99–104, Jan. 2013, doi: 10.1016/j.maturitas.2012.10.019.
[206] J. T. Chang, G. M. Anic, B. L. Rostron, M. Tanwar, and C. M. Chang, “Cigarette Smoking Reduction and Health Risks: A Systematic Review and Meta-analysis.,” Nicotine Tob. Res. Off. J. Soc. Res. Nicotine Tob., vol. 23, no. 4, pp. 635–642, Mar. 2021, doi: 10.1093/ntr/ntaa156.
[207] T. Ngandu et al., “A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial.,” Lancet (London, England), vol. 385, no. 9984, pp. 2255–2263, Jun. 2015, doi: 10.1016/S0140-6736(15)60461-5.
[208] M. Kivipelto, F. Mangialasche, and T. Ngandu, “Lifestyle interventions to prevent cognitive impairment, dementia and Alzheimer disease.,” Nat. Rev. Neurol., vol. 14, no. 11, pp. 653–666, Nov. 2018, doi: 10.1038/s41582-018-0070-3.
[209] R. Nelson, “HRT Update Regarding Breast Cancer Risk Advised in EU,” Medscape Medical News.
[210] Collaborative Group on Hormonal Factors in Breast Cancer, “Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence,” Lancet (London, England), vol. 394, no. 10204, pp. 1159–1168, Sep. 2019, doi: 10.1016/S0140-6736(19)31709-X.
[211] E. Cordina-Duverger et al., “Risk of breast cancer by type of menopausal hormone therapy: a case-control study among post-menopausal women in France.,” PLoS One, vol. 8, no. 11, p. e78016, 2013, doi: 10.1371/journal.pone.0078016.
[212] R. T. Chlebowski and J. E. Manson, “Menopausal Hormone Therapy and Breast Cancer,” Cancer J., vol. 28, no. 3, pp. 169–175, May 2022, doi: 10.1097/PPO.0000000000000601.
[213] R. T. Chlebowski and A. K. Aragaki, “The Women’s Health Initiative randomized trials of menopausal hormone therapy and breast cancer: findings in context,” Menopause, vol. 30, no. 4, pp. 454–461, Apr. 2023, doi: 10.1097/GME.0000000000002154.
[214] J. Yuk, “Relationship between menopausal hormone therapy and breast cancer: A nationwide population‐based cohort study,” Int. J. Gynecol. Obstet., Mar. 2024, doi: 10.1002/ijgo.15461.
[215] C. Schneider, S. S. Jick, and C. R. Meier, “Risk of gynecological cancers in users of estradiol/dydrogesterone or other HRT preparations,” Climacteric, vol. 12, no. 6, pp. 514–524, Dec. 2009, doi: 10.3109/13697130903075352.
[216] Z. Yang, Y. Hu, J. Zhang, L. Xu, R. Zeng, and D. Kang, “Estradiol therapy and breast cancer risk in perimenopausal and postmenopausal women: a systematic review and meta-analysis.,” Gynecol. Endocrinol., vol. 33, no. 2, pp. 87–92, Feb. 2017, doi: 10.1080/09513590.2016.1248932.
[217] H. Hamoda et al., “BMS, IMS, EMAS, RCOG and AMS joint statement on menopausal hormone therapy and breast cancer risk in response to EMA Pharmacovigilance Risk Assessment Committee recommendations in May 2020,” Post Reprod. Heal., vol. 27, no. 1, pp. 49–55, Mar. 2021, doi: 10.1177/2053369120983154.
[218] R. T. Chlebowski et al., “Association of Menopausal Hormone Therapy With Breast Cancer Incidence and Mortality During Long-term Follow-up of the Women’s Health Initiative Randomized Clinical Trials,” JAMA, vol. 324, no. 4, p. 369, Jul. 2020, doi: 10.1001/jama.2020.9482.
[219] J. G. Greene, “Constructing a standard climacteric scale.,” Maturitas, vol. 29, no. 1, pp. 25–31, May 1998, doi: 10.1016/s0378-5122(98)00025-5.
[220] “Порог вмешательства на основании определения 10-летнего абсолютного риска основных остеопоротических переломов”, [Online]. Available: https://osteoporosis-russia.ru/frax/
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Адамян Лейла Владимировна – Академик РАН, доктор медицинских наук, профессор, заместитель директора ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, Заслуженный деятель науки России, заведующая кафедрой репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, главный специалист Минздрава России по гинекологии, является Президентом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, членом Российского общества акушеров-гинекологов.
Андреева Елена Николаевна – доктор медицинских наук, профессор, заместитель директора – директор Института репродуктивной медицины, зав. отделением эндокринной гинекологии, профессор кафедры эндокринологии ГНЦ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, профессор кафедры Акушерства, гинекологии и репродуктивной медицины Российского Университета медицины, Президент Международной ассоциации акушеров, гинекологов и эндокринологов, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров-гинекологов, Российского общества специалистов по гинекологической эндокринологии и менопаузе.
Аполихина Инна Анатольевна – д.м.н., профессор, руководитель отделения эстетической гинекологии и реабилитации ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова" Минздрава России, профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ИПО ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России, профессор кафедры акушерства и гинекологии департамента профессионального образования ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Артымук Наталья Владимировна – д.м.н., профессор, заведующая кафедрой акушерства и гинекологии имени профессора Г.А. Ушаковой ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в Сибирском федеральном округе (г. Кемерово), является членом президиума правления Российского общества акушеров-гинекологов, президент Кемеровской региональной общественной организации «Ассоциация акушеров-гинекологов».
Ашрафян Лев Андреевич – академик РАН, д.м.н., профессор, директор института онкогинекологии и маммологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, президент Российского общества специалистов по профилактике и лечению опухолей репродуктивной системы.
Балан Вера Ефимовна – д.м.н., проф., руководитель поликлинического отделения ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии».
Ермакова Елена Ивановна – к.м.н., старший научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, вице-президент Российского общества специалистов по гинекологической эндокринологии и менопаузе.
Кузнецов Сергей Юрьевич – к.м.н., врач-рентгенолог, врач акушер-гинеколог отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Родионов Валерий Витальевич – заведующий отделением патологии молочной железы института онкогинекологии и маммологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации, д.м.н., является членом Российского общества маммологов, Российского общества специалистов по профилактике и лечению опухолей репродуктивной системы, член правления Российского общества специалистов по гинекологической эндокринологии и менопаузе.
Сметник Антонина Александровна – заведующая отделением гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации, к.м.н., доцент, президент Российского общества специалистов по гинекологической эндокринологии и менопаузе, советник Европейского общества по менопаузе и андропаузе, является членом Российского общества акушеров-гинекологов.
Филиппов Олег Семенович – д.м.н., профессор, заместитель директора Департамента медицинской помощи детям и службы родовспоможения Министерства здравоохранения Российской Федерации, профессор кафедры акушерства и гинекологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России (г. Москва).
Чернуха Галина Евгеньевна – д.м.н., профессор, главный научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, является президентом Межрегиональной ассоциации гинекологов – эндокринологов, членом Российского общества акушеров-гинекологов.
Юренева Светлана Владимировна – заместитель директора по научной работе института онкогинекологии и маммологии, профессор кафедры акушерства и гинекологии ДПО ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации, вице-президент МОО Ассоциации гинекологов-эндокринологов, д.м.н., профессор
Ярмолинская Мария Игоревна – руководитель отдела гинекологии и эндокринологии ФГБНУ «НИИ АГиР им.Д.О.Отта», заведующий отделением гинекологии №2, руководитель центра «Диагностики и лечение эндометриоза», профессор кафедры акушерства и гинекологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, профессор РАН, д.м.н., профессор, член Российского общества акушеров-гинекологов, член правления Российского общества специалистов по гинекологической эндокринологии и менопаузе.
Якушевская Оксана Владимировна – к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Конфликт интересов: отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Клинические рекомендации по оказанию медицинской помощи пациенткам в периоды пери- и постменопаузы, а также пациенткам с раннее и преждевременной менопаузой составлены в соответствии с требованиями о разработке клинических рекомендаций медицинскими профессиональными некоммерческими организациями, часть 2 статьи 76 Федерального закона от 21.11.2011г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», приказом Министерства здравоохранения Российской Федерации №103н от 28.02.2019г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
Целевая аудитория данных клинических рекомендаций:
врачи акушеры-гинекологи
врачи-эндокринологи
врачи-урологи
врачи-терапевты
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД | Расшифровка |
1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
4 | Несравнительные исследования, описание клинического случая |
5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД | Расшифровка |
1 | Систематический обзор РКИ с применением мета-анализа |
2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР | Расшифровка |
A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
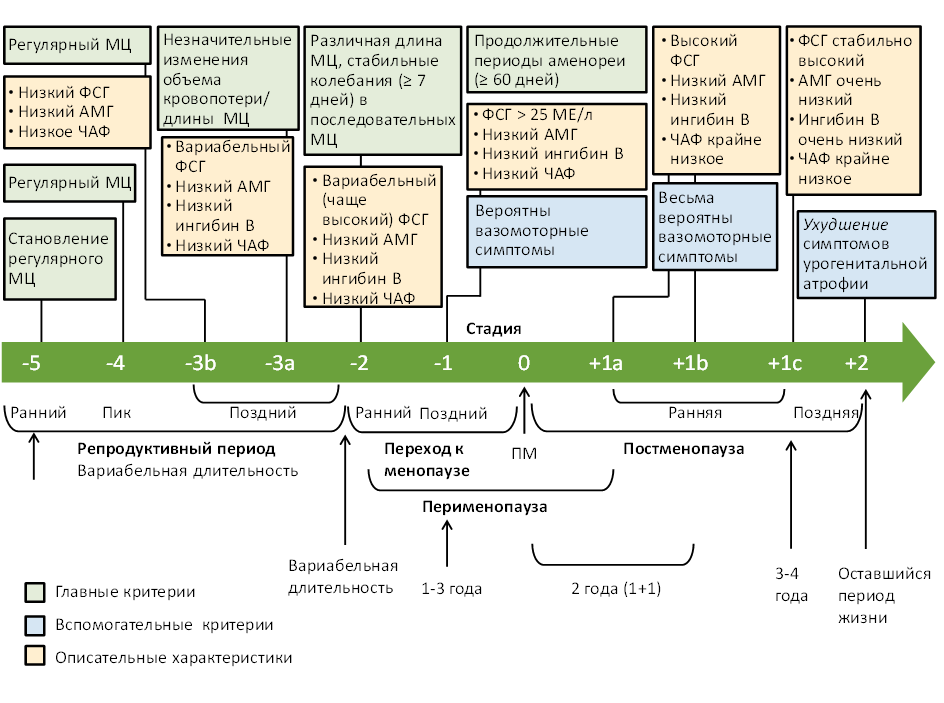
Рисунок 1. STRAW+10: стадии старения репродуктивной системы женщин [1].
Заключение по системе BI-RADS:
0 категория – неуточненное и требует дообследования
1 категория – результат отрицательный (без изменений)
2 категория – доброкачественные изменения
3 категория – вероятно доброкачественные изменения
4, 5 категории – высокая вероятность малигнизации
6 категория – малигнизация, подтвержденная морфологически с помощью биопсии.
Маршрутизация пациенток в зависимости от заключения по системе BI-RADS:
0 категория – направляется на консультацию врача-онколога для дальнейшего обследования
1, 2 категория – наблюдение врачом акушером-гинекологом
3 – направляется в онкологический диспансер для верификации диагноза
4, 5, 6 категории – наблюдение врачом онкологом
1. Монотерапия эстрогенами
Проводится в непрерывном режиме женщинам с удаленной маткой (за исключением надвлагалищной ампутации матки или после гистерэктомии по поводу распространенного наружного генитального эндометриоза и/или аденомиоза) вне зависимости от фазы климактерия, для лечения климактерических симптомов и/или профилактики остеопороза. Терапия локальной/системной МГТ у женщин для купирования проявлений ГУМС.
Таблица 4 Схемы лечения эстрогенами
Наименование ЛС | Дозы и кратность назначения ЛС | Длительность применения |
Эстрадиола валерат 2 мг, драже | По 1 драже в день | В течение 1 года, далее длительность терапии определяется индивидуально |
Эстрадиол 0,06%, гель трансдермальный | максимальная суточная доза 3 мг эстрадиола (5,0 г геля), стандартная суточная доза 1,5 мг эстрадиола (2,5 г геля), низкая суточная доза #0,75 мг эстрадиола (1,25 г геля) в непрерывном режиме [65, 69, 98] | В течение 1 года, далее длительность терапии определяется индивидуально |
Эстрадиол 0,1%, гель трансдермальный | максимальная суточная доза 1,5 мг эстрадиола (1,5 г геля), стандартная суточная доза 1 мг эстрадиола (1,0 г геля), низкая суточная доза 0,5 мг эстрадиола (0,5 г геля); В непрерывном режиме | В течение 1 года, далее длительность терапии определяется индивидуально |
Эстриол 2 мг, таблетированный препарат | В непрерывном режиме | В течение 1 года, далее длительность терапии определяется индивидуально |
Эстриол (суппозитории вагинальные) – 0,5 мг. эстриол (крем вагинальный) – 1 мг/г. | В начале лечения ежедневно в течение 2 недель (максимально до 4 недель), по мере улучшения 2 раза в неделю длительно | В течение 1 года, далее длительность терапии определяется индивидуально |
Лактобактерии + 2,0 мг Прогестерон + 0,2 мг Эстриол (МНН: Лактобактерии + Прогестерон + Эстриол) | По 2 капсулы 1 раз в сутки вагинально в течение 20 дней до облегчения симптомов (терапия насыщения), затем по 1 капсуле в сутки 2 раза в неделю (поддерживающая терапия). | При необходимости возможно повторение курсов терапии. |
Лактобактерии ацидофильные + эстриол | По 1 вагинальной таблетке ежедневно на протяжении 6-12 дней, далее поддерживающая доза составляет 1 вагинальную таблетку 1-2 раза в неделю. | При необходимости возможно повторение курсов терапии. |
2. Терапия гестагенами
Проводится женщинам в период менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла, а также в пери- и постменопаузе в составе МГТ.
Таблица 5 Схемы лечения гестагенами
Наименование ЛС | Дозы и кратность назначения ЛС | Длительность применения |
Дидрогестерон** | 10-20 мг на срок 10-15 дней циклически; В составе МГТ: 10-20 мг внутрь в течение 14 дней в рамках 28-дневного цикла. | в течение 1 года, в дальнейшем по показаниям |
Прогестерон (микронизированный)** (МНН: Прогестерон**) | 200-400 мг в течение 10-14 дней во вторую фазу цикла. В составе МГТ в перименопаузе: 200 мг в течение 12-14 дней В составе МГТ в постменопаузе: 100-200 мг ежедневно. | в течение 1 года, в дальнейшем по показаниям |
Внутриматочная система, высвобождающая левоноргестрел (52 мг) (МНН: Левоноргестрел система внутриматочная терапевтическая) | Т-образный стержень с контейнером, содержащим 52 мг левоноргестрела; поддерживает выделение левоноргестрела в полость матки на уровне 20 мкг/сут; ввести в полость матки однократно; | устанавливается на 5 лет, по показаниям возможно установить повторно |
3. Комбинированная эстроген-гестагенная терапия
Проводится женщинам с интактной маткой в перименопаузе и в постменопаузе для лечения климактерических симптомов и профилактики остеопороза в циклическом и непрерывном режимах. При надвлагалищной ампутации матки или после гистерэктомии по поводу эндометриоза проводится комбинированная эстроген-гестагенная терапия в непрерывном режиме.
Таблица 6 Схемы лечения комбинированными эстроген-гестагенными препаратами.
Наименование ЛС | Дозы и кратность назначения ЛС | Длительность применения |
Комбинированная эстроген-гестагенная терапия в циклическом режиме | ||
эстрадиол 2 мг/дидрогестерон 10 мг (МНН: Дидрогестерон + Эстрадиол и Эстрадиол [набор]) | по 1 таблетке в день в течение 28 дней | в течение 1 года, в дальнейшем по показаниям |
эстрадиол 2 мг/левоноргестрел 150 мкг (МНН: Эстрадиол и Левоноргестрел + Эстрадиол) | по 1 таблетке в день в течение 21 дня с последующим 7-дневным перерывом | в течение 1 года, в дальнейшем по показаниям |
эстрадиола валерат 2 мг/норгестрел 500 мкг (МНН: Норгестрел + Эстрадиола валерат; Эстрадиола валерат [набор]) | по 1 таблетке в день в течение 21 дня с последующим 7-дневным перерывом | в течение 1 года, в дальнейшем по показаниям |
эстрадиол 2 мг/ципротерон 1 мг (МНН: Ципротерон + Эстрадиол) | по 1 таблетке в день в течение 21 дня с последующим 7-дневным перерывом | в течение 1 года, в дальнейшем по показаниям |
эстрадиол 1 мг/дидрогестерон 10 мг (МНН: Дидрогестерон + Эстрадиол и Эстрадиол [набор]) | по 1 таблетке в день в течение 28 дней | в течение 1 года, в дальнейшем по показаниям |
эстрадиол 0,06% гель трансдермальный/Эстрадиол 0,1% гель трансдермальный + микронизированный прогестерон (перорально или вагинально)/дидрогестерон** перорально (МНН: Прогестерон**) | Трансдермальные формы эстрогенов назначаются в максимальной, стандартной или низкой дозе. Микронизированный прогестерон (перорально или вагинально) в дозе 200-300 мг в сутки в зависимости от ИМТ и дозы эстрогенов; дидрогестерон** перорально 10-20 мг в сутки на срок не менее 12-14 дней. | в течение 1 года, в дальнейшем по показаниям |
Комбинированная эстроген-гестагенная терапия в непрерывном режиме (в постменопаузе) | ||
Эстрадиол 1 мг/дидрогестерон 5 мг (МНН: Дидрогестерон + Эстрадиол) | по 1 таблетке в день в течение 28 дней непрерывно | в течение 1 года, в дальнейшем по показаниям |
Эстрадиол 1 мг/дроспиренон 2 мг (МНН: Дроспиренон + Эстрадиол). | по 1 таблетке в день в течение 28 дней непрерывно | в течение 1 года, в дальнейшем по показаниям |
Эстрадиола 0,06% гель трансдермальный/Эстрадиола 0,1% гель трансдермальный/Эстрадиола гель трансдермальный + микронизированный прогестерон (МНН: Прогестерон**) (перорально или вагинально)/ дидрогестерон** перорально | Трансдермальные формы эстрогенов назначаются в стандартной или низкой дозе. Прогестерон** используется перорально или вагинально в дозе 100 мг в сутки/ гель вагинальный в дозе 90 мг 2 раза в неделю; дидрогестерон** в дозе 10 мг непрерывно ежедневно, может использоваться левоноргестрел система внутриматочная терапевтическая (ВМС-ЛНГ) 52 мг. | в течение 1 года, в дальнейшем по показаниям |
Таблица 7 Негормональные методы терапии вазомоторных симптомов
Наименование ЛС | Дозы и кратность назначения ЛС | Длительность применения |
Негормональные методы терапии вазомоторных симптомов | ||
цимицифуги кистевидной корневищ экстракт 20 мг (МНН: Цимицифуги кистевидной корневищ с корнями экстракт) | Внутрь по 1 табл. 2 раза в сутки | по показаниям |
цимицифуги кистевидной корневищ экстракт 12 г в 100г (МНН: Цимицифуги кистевидной корневищ с корнями экстракт) | Внутрь по 30 капель 2 раза в сутки | по показаниям |
бета-аланин, 400 мг | Внутрь по 1-2 таблетки в сутки, доза может быть увеличена до 3-х таблеток в сутки | От 5-10 дней до исчезновения «приливов». При возобновлении симптомов следует провести повторный курс лечения. |
полипептиды эпифиза крупного рогатого скота 10 мг (МНН: Полипептиды шишковидной железы [эпифиза] крупного рогатого скота) | в/м 10 мг/сут. | 10 дней |
#венлафаксин [195] | 75 мг 1 раз в сутки | 3-6 месяцев, более продолжительный прием по показаниям |
#эсциталопрам [195] | 10-20 мг 1 раз в сутки | 3-6 месяцев, более продолжительный прием по показаниям |
#пароксетин** [195] | 10-20 мг 1 раз в сутки | 3-6 месяцев, более продолжительный прием по показаниям |
#флуоксетин**[195] | 20 мг 1 раз в сутки | 3-6 месяцев, более продолжительный прием по показаниям |
#циталопрам [195] | 10-20 мг 1 раз в сутки | 3-6 месяцев, более продолжительный прием по показаниям |
Приложение Б. Алгоритмы действий врача
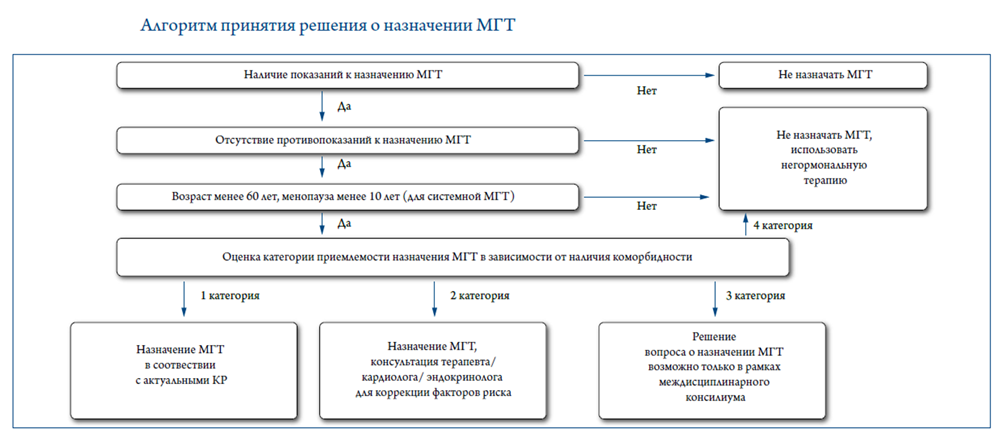
Рисунок 2. Алгоритм принятия решения о назначении МГТ [29]
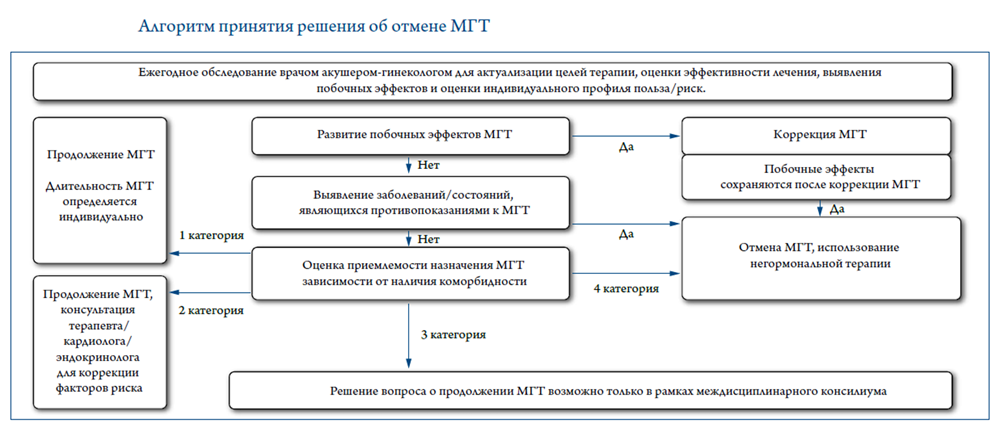
Рисунок 3. Алгоритм принятия решения об отмене МГТ [29]

Рисунок 4. Факторы, влияющие на ведение пациенток с менопаузальными симптомами
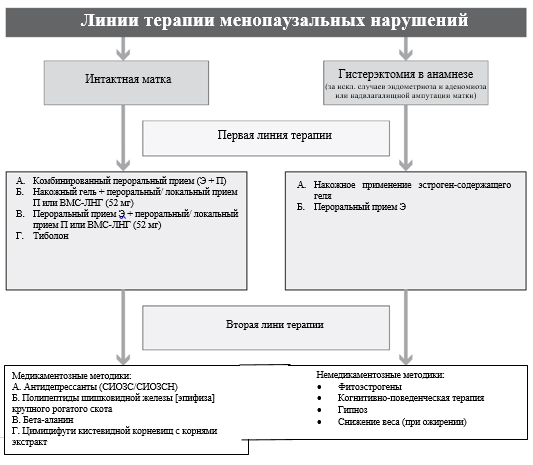
Рисунок 5. Линии терапии менопаузальных нарушений
Дозирование МГТ [65], [69] |
Эстроген
| Ультранизкая доза | Низкая доза | Стандартная доза | Высокая доза |
Эстрадиол | 0,5 мг/сут | 1,0 мг/сут | 2 мг/сут | 3-4 мг |
Эстрадиола валерат | - | - | 2 мг/сут | 3-4 мг/сут |
Гель эстрадиола 0,1% | - | 0,5 мг/сут | 1,0 мг/сут | 1,5 мг/сут |
Гель эстрадиола 0,06% | - | 0,75 мг/ сут | 1,5 мг/сут | 3 мг/ сут |
Последовательное назначение прогестагена – суточная доза в течение 14 дней в месяц – наиболее низкая «безопасная доза»:
Гестаген | Низкая доза Э | От средней до высокой дозы Э |
Дидрогестерон** | 10 мг | 10-20 мг |
Микронизированный прогестерон (МНН: Прогестерон**) | 100 мг | 200-400 мг |
Левоноргестрел |
| 0,15 мг |
Ципротерона ацетат (МНН: Ципротерон**) |
| 1 мг |
Норгестрел (МНН: Норгестрел + Эстрадиола валерат; Эстрадиола валерат [набор]) |
| 0,5 мг |
Непрерывный прием прогестагенов – суточная доза – наиболее низкая «безопасная доза»:
| Ультранизкая/Низкая доза Э | От средней до высокой дозы Э |
Дидрогестерон** | 2,5/5 мг | 5-10 мг |
Дроспиренон (МНН: Дроспиренон + Эстрадиол) | 0,25/2 мг | – |
Микронизированный прогестерон (МНН: Прогестерон**) | 100 мг | 200-300 мг |
ВМС-ЛНГ (52 мг) | Система с высвобождением левоноргестрела 20 мкг/24 ч | Система с высвобождением левоноргестрела 20 мкг/24 ч |
прогестерон (гель вагинальный) (МНН: Прогестерон**) | 90 мг 2 раза в неделю |
|
Тиболон
Тиболон | 2,5 мг в сутки |
Рисунок 6. Дозирование менопаузальной гормонотерапии.
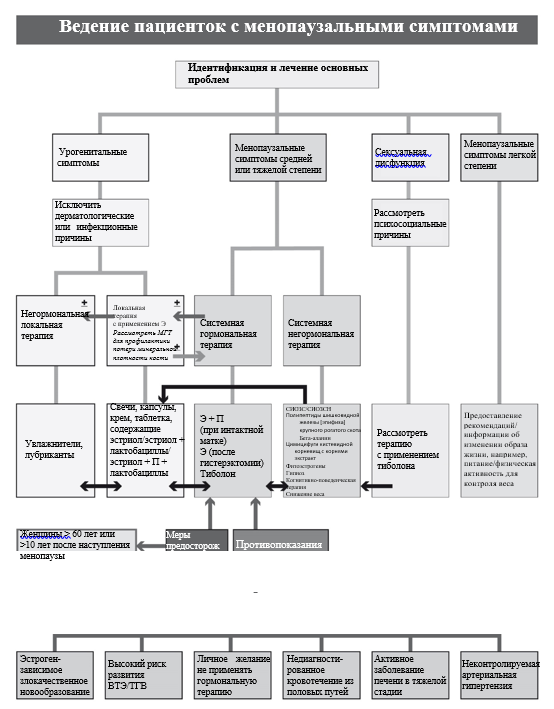
Рисунок 7. Ведение пациенток с менопаузальными симптомами
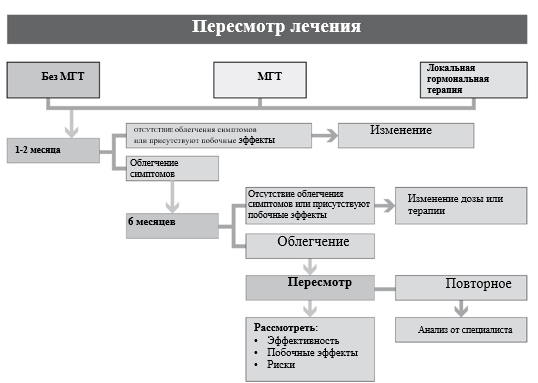
Рисунок 8. Принципы пересмотра терапии.
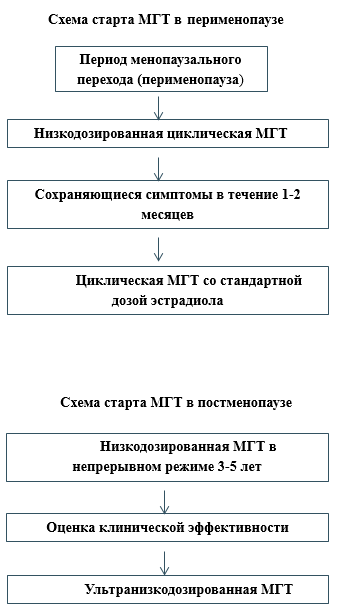
Рисунок 9. Схемы старта МГТ [115].
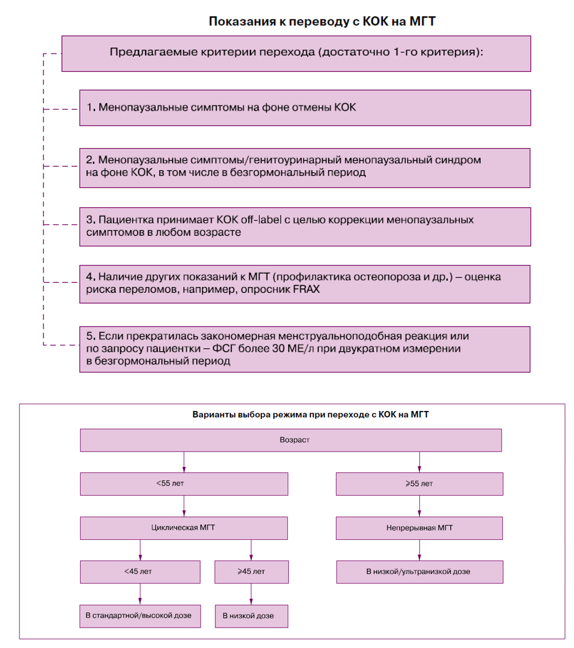
Рисунок 10. Алгоритм перевода пациенток с комбинированных оральных контрацептивов на менопаузальную гормональную терапию [115]
Приложение В. Информация для пациента
Менопауза – стойкое прекращение менструальных циклов вследствие выраженного снижения запаса фолликулов и гормональной активности яичников. Менопауза может быть самопроизвольной (естественная менопауза) или ятрогенной, наступающей в результате удаления яичников, химио- или лучевой терапии. Также менопауза возникает раньше у курильщиц. Самые существенные изменения наблюдаются в переходном периоде (перименопаузе) – за 1-3 года до последней менструации (менопаузы) и в первые два года после нее (постменопаузы). Ранняя стадия перименопаузы характеризуется колебаниями продолжительности менструальных циклов, а также высокой частотой маточных кровотечений. В поздней стадии перименопаузы возникают задержки менструаций до 30 дней и больше. Отсутствие менструации в течение 12 месяцев говорит о наступлении постменопаузы.
Изменение уровня гормонов может сопровождаться возникновением ряда симптомов, именуемых «климактерическим синдром». В переходный период женщины могут предъявлять разнообразные жалобы. Наиболее частые симптомы – вазомоторные – приливы «жара», потливость, но также часто отмечаются усталость, раздражительность, тревога, напряжение, частые ночные пробуждения, нарушения сна, нарушение концентрации внимания, перепады настроения, потеря кратковременной памяти и затруднения мышления и запоминания новой информации, боли в суставах/пояснице, сухость влагалища, дискомфорт и боль при половых контактах, недержание мочи, увеличение веса и/или изменение пропорций тела, женщина отмечает увеличение жировой ткани в области живота, сексуальные нарушения, сухость кожи, ухудшение состояния волос и ногтей, происходит снижение минеральной плотности костной ткани и др. При наличии каких-либо менопаузальных симптомов следует обратиться к гинекологу или гинекологу-эндокринологу для прохождения обследования и получения рекомендаций по коррекции данных нарушении, с использованием гормональной или негормональной терапии, а также рекомендаций по образу жизни и питанию. Наилучший период для начала лечения – перименопауза и ранняя постменопауза, когда можно не только своевременно скорректировать менопаузальные симптомы, но также предотвратить развитие различных хронических заболеваний.
Наступление менопаузы можно предположить, если в течение 12 месяцев отсутствуют менструации. Для постановки диагноза нужно оценить наличие менопаузальных симптомов, провести ультразвуковое исследование органов малого таза и, в ряде случаев, гормональное обследование.
Общая стратегия поддержания здоровья женщин в пери- и постменопаузе, наряду с обязательным соблюдением здорового образа жизни, рациональным питанием, адекватной физической активностью, может включать менопаузальную гормональную терапию (МГТ). Восполнение дефицита половых гормонов при сниженной функции яичников с помощью минимально- оптимальных доз гормональных препаратов позволит купировать проявления климактерического синдрома, улучшит общее состояние женщин и обеспечит профилактику поздних обменных нарушений.
Препараты эстрогенов выпускаются в различных дозах. Дозы гормонов, путь их введения подбирается индивидуально, с учетом предпочтений и ожиданий самой женщины, возраста пациентки, а также в зависимости от имеющихся симптомов и необходимости профилактики заболеваний, риск развития которых выявляется при анализе данных личного и семейного анамнеза, результатов обследования. Очень важно, что менопаузальная гормональная терапия позволяет не только купировать проявления климактерического синдрома, но и в некотором смысле обладает свойством тормозить процессы старения (англ. anti-age effect), а также способствует увеличению продолжительности жизни и повышению ее качества.
При наличии симптомов сухости и дискомфорта во влагалище используются негормональные вагинальные смазки и увлажняющие гели или терапия местными препаратами с эстрогенами.
МГТ является «золотым стандартом» для лечения менопаузальных симптомов, однако некоторые женщины имеют противопоказания для такой терапии (рак молочной железы, выявленный высокий риск тромбозов и др.). Для них могут быть предложены альтернативные методы: антидепрессанты (СИОЗС и СИОЗСН), экстракт цимицифуги (МНН: Цимицифуги кистевидной корневищ с корнями экстракт), полипептиды шишковидной железы (МНН: Полипептиды шишковидной железы [эпифиза] крупного рогатого скота), бета-аланин, фитоэстрогены, когнитивная поведенческая терапия, регулярные физические занятия, снижение веса и избегание факторов, способствующих возникновению приливов (потребление кофе, прямое воздействие высокой температуры) и другие методы. Также рекомендуется отказ от курения и злоупотребления алкоголем.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Паспорт таблицы:
Название на русском языке: Оценка тяжести климактерического синдрома по шкале Грина.
Оригинальное название: The Greene Climacteric Scale
Источник (официальный сайт разработчиков, публикация с валидацией): Greene Climacteric Scale (GCS). Greene J.G. Constructing a standard climacteric scale. Maturitas, 1998. Vol.29, 25-31 [219].
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить):
Содержание (шаблон):
Симптомы | нет симптома | слабое проявление симптома | умеренное проявление симптома | тяжелое проявление симптома |
1. Быстрое или сильное сердцебиение | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
2. Чувство напряженности, нервозности | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
3. Нарушения сна | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
4. Возбудимость | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
5. Приступы тревоги, паники | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
6. Трудности в концентрации внимания | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
7. Чувство усталости или недостатка энергии | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
8. Потеря интереса ко многим вещам | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
9. Чувство недовольства или депрессия | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
10. Плаксивость | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
11. Раздражительность | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
12. Чувство головокружения или обморок | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
13. Давление или напряжение в голове, теле | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
14. Чувство онемения и дрожь в различных частях тела | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
15. Головные боли | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
16. Мышечные и суставные боли | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
17. Слабость в руках или ногах | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
18. Затрудненное дыхание | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
19. Приливы | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
20. Ночная потливость | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
21. Потеря интереса к сексу | 0 ☐ | 1 ☐ | 2 ☐ | 3 ☐ |
Общая сумма баллов по Опроснику: |
| |||
Пояснение: Необходимо выбрать в каждой строке один вариант ответа, наиболее подходящий состоянию на момент осмотра и поставить рядом с ним знак V или X в окошке. После чего, проводится подсчет суммы баллов.
Ключ (интерпретация): 0 – нет симптома.
1 – слабое проявление симптома.
2 – умеренное проявление симптома.
3 – тяжелое проявление симптома.
Степень выраженности климактерического синдрома по результатам тестирования:
1-11 – слабая.
12-19 – средняя.
20 и выше – тяжелая.
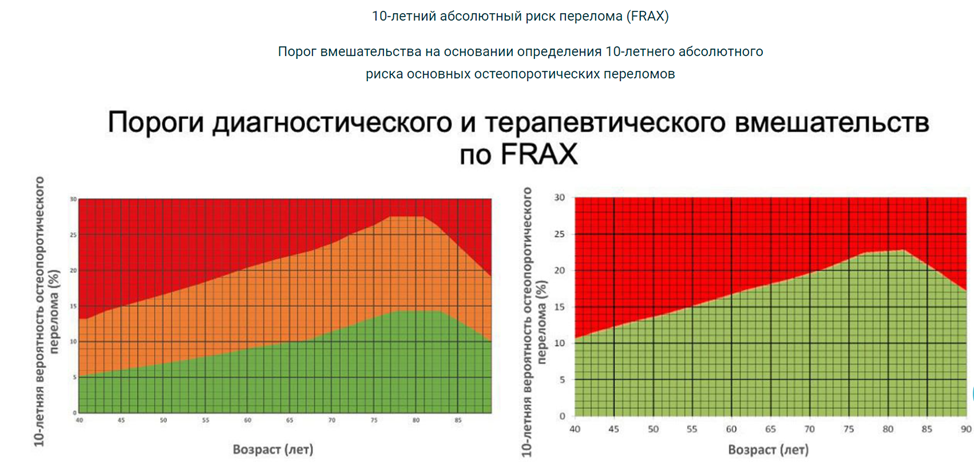
Рисунок 11 а. Порог вмешательства на основании определения 10-летнего абсолютного риска основных остеопоротических переломов.
Порог вмешательства для Российской Федерации на основании 10-летнего абсолютного риска основных остеопоротических переломов: левый график определяет необходимость проведения денситометрического исследования для уточнения риска. Подсчет FRAX® проводится без учета данных денситометрии. Если 10-летний риск пациента находится в нижней зоне – дополнительное обследование и лечение не требуется. Пациенту необходимо дать рекомендации по профилактике остеопороза и провести повторную оценку через 5 лет. Если 10-летний риск находится в верхней зоне, пациенту требуется лечение остеопороза, при этом для начала лечения денситометрическое исследование не требуется. Если 10-летний риск находится в средней зоне (зона неопределенности), то для уточнения риска необходимы результаты денситометрического исследования (ДЭРА) в области шейки бедра. После получения результатов проводится повторный подсчет FRAX® с учетом данных денситометрии, а результат оценивается по правому графику [220].
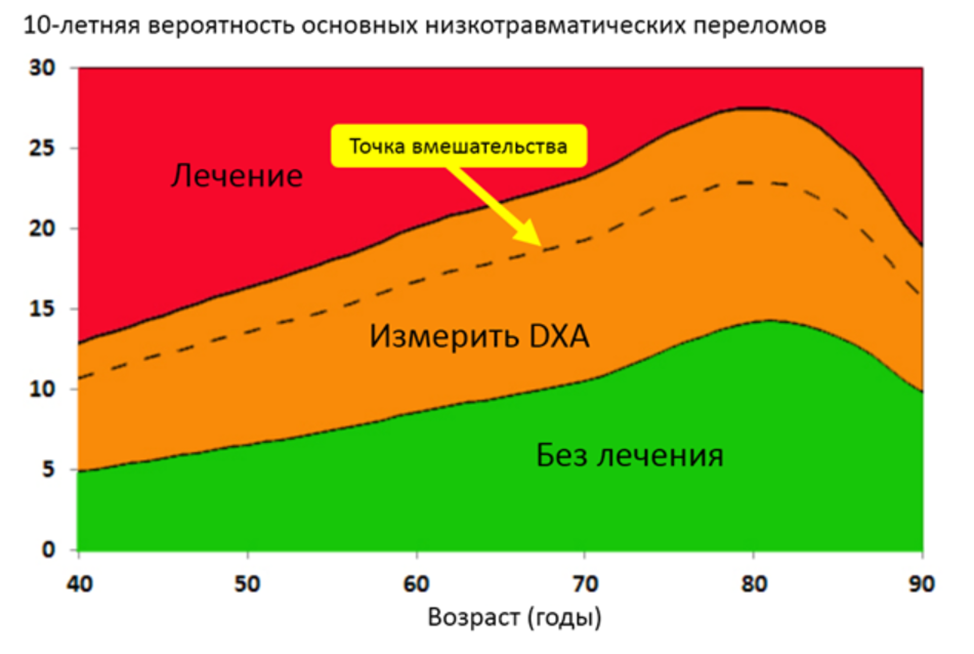
Рисунок 11 б. Порог терапевтического вмешательства, предложенный для российской популяции, на основании 10-летнего абсолютного риска основных остеопоротических переломов по FRAX [60].
Приложение Г2. Российские критерии приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями Согласительный документ РКО, РОАГ, РАЭ, ЕАТ, РАФ [29]. Рисунок 13. Критерии приемлемости назначения МГТ (продолжение) [29] Рисунок 14. Критерии приемлемости назначения МГТ (продолжение) [29] Рисунок 15. Критерии приемлемости назначения МГТ (продолжение) [29]
| |
|
|
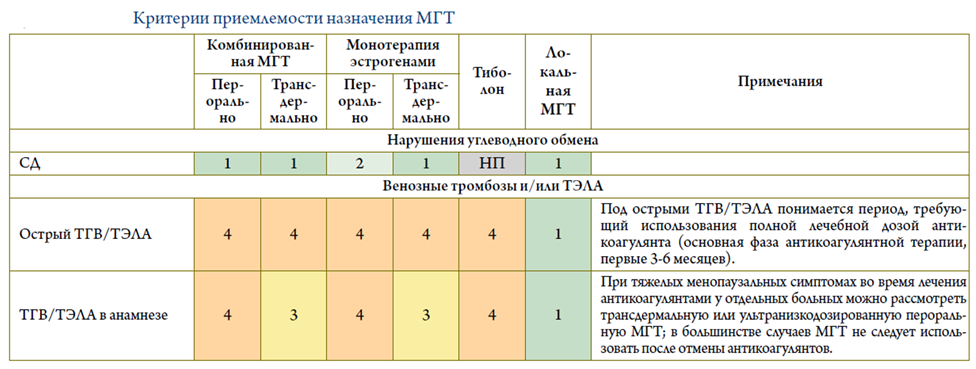 Рисунок 12. Критерии приемлемости назначения МГТ [29]
Рисунок 12. Критерии приемлемости назначения МГТ [29]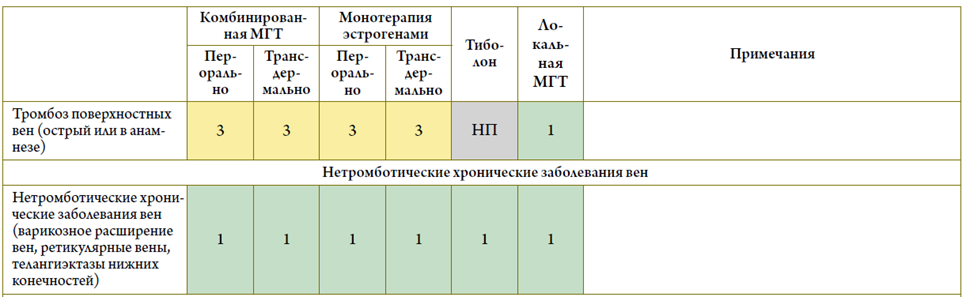
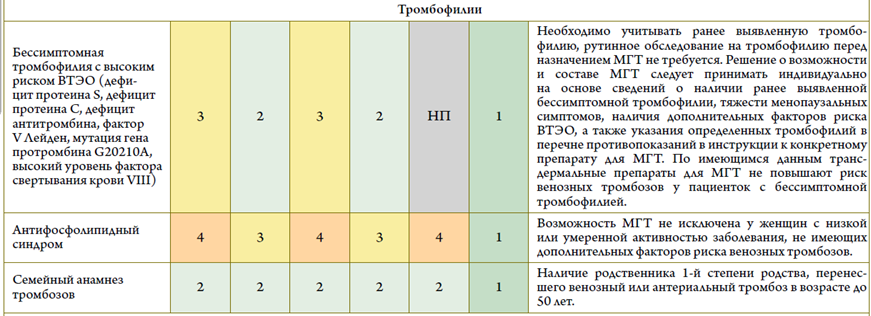
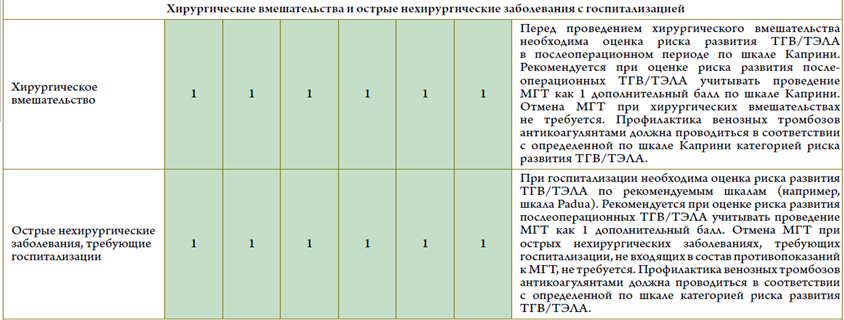
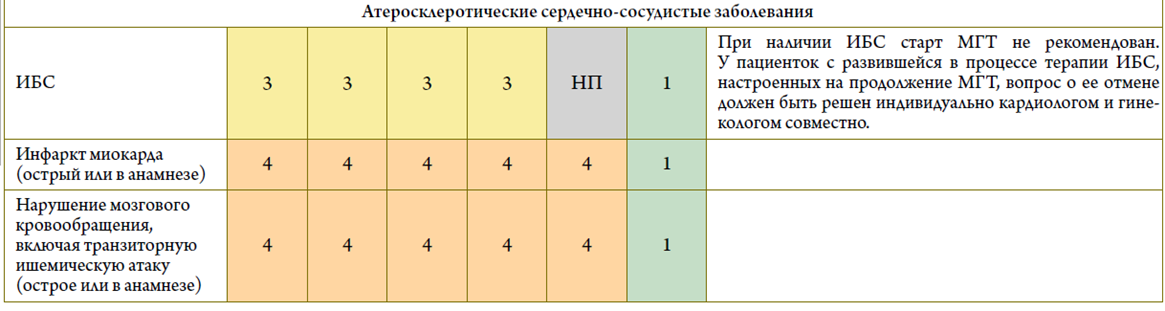 Рисунок 16. Критерии приемлемости назначения МГТ (продолжение) [29]
Рисунок 16. Критерии приемлемости назначения МГТ (продолжение) [29]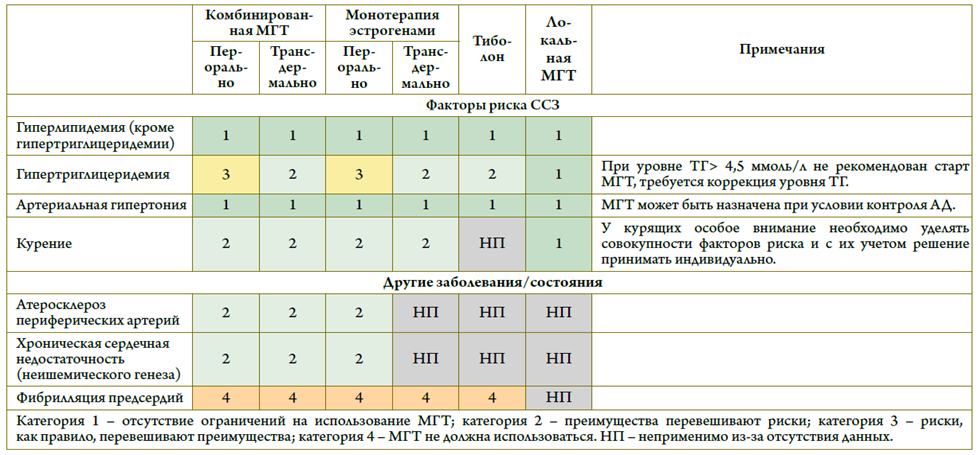 Рисунок 17. Критерии приемлемости назначения МГТ (продолжение) [29]
Рисунок 17. Критерии приемлемости назначения МГТ (продолжение) [29]