Новый курс НМО
Нарушения липидного обмена
классификации болезней и проблем, связанных со здоровьем:E78.0, E78.1, E78.2, E78.3, E78.4
Список сокращений
АГ артериальная гипертония
АД артериальное давление
АЛТ аланинаминотрансфераза
АСБ атеросклеротическая бляшка
АСТ аспартатаминотрансфераза
АССЗ атеросклеротическое сердечно-сосудистое заболевание
ВГН верхняя граница нормы
ДЛП дислипидемия
геСГХС гетерозиготная семейная гиперхолестеринемия
гоСГХС гомозиготная семейная гиперхолестеринемия
ГТГ гипертриглицеридемия
ГХС гиперхолестеринемия
ДИ доверительный интервал
ДЛП дислипидемия
ЕОК Европейское общество кардиологов
ЕОА Европейское общество атеросклероза
ЖНВЛП жизненно-необходимые важнейшие лекарственные препараты
ИБС ишемическая болезнь сердца
ИМ инфаркт миокарда
ИМТ индекс массы тела
КИ кальциевый индекс
КТ компьютерная томография
КФК креатинфосфокиназа
ЛВП липопротеиды высокой плотности
ЛНП липопротеиды низкой плотности
Лп(а) липопротеид(а)
ЛПП липопротеиды промежуточной плотности
ЛОНП липопротеиды очень низкой плотности
миРНК малая интерферирующая рибонуклеиновая кислота
неЛВП липопротеиды невысокой плотности
омега-3 ПНЖК омега-3 триглицериды, включая другие эфиры и кислоты
ОКС острый коронарный синдром
ОР относительный риск
ОХС общий холестерин
РНК рибонуклеиновая кислота
СГХС семейная гиперхолестеринемия
СД сахарный диабет
СКФ скорость клубочковой фильтрации
ССЗ сердечно-сосудистые заболевания
ССО сердечно-сосудистые осложнения
ТГ триглицериды
ТИА транзиторная ишемическая атака
УЗИ ультразвуковое исследование
ФР факторы риска
ХБП хроническая болезнь почек
ХМ хиломикроны
ХС холестерин
ЦУ целевой уровень
РЛНП рецептор к липопротеидам низкой плотности
APOB ген аполипопротеина В
DLCN Dutch Lipid Clinic Network
LDLR ген рецептора липопротеидов низкой плотности
PCSK9 пропротеин-конвертаза субтилин/кексин типа 9 (C10AX Другие гиполипидемические средства)
SCORE системная оценка коронарного риска (Systemic Coronary Risk Evaluation)
Термины и определения
Дислипидемии (ДЛП) — состояния, когда концентрации липидов и липопротеидов крови выходят за пределы нормы.
Доказательная медицина — надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и c учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента [1].
Заболевание — состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [2].
Исход — любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Клиническое исследование — любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность [4].
Конфликт интересов — ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [5].
Медицинское вмешательство — выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [2].
Изменение образа жизни — мероприятия, направленные на нормализацию веса и характера питания, двигательной активности, целью которых является снижение сердечно-сосудистого риска.
Пациент — физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
Пожилые пациенты — пациенты, которым от 60 до 75 лет.
Рабочая группа по разработке/актуализации клинических рекомендаций — коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Синдром — устойчивая совокупность ряда симптомов с единым патогенезом [6].
Состояние — изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [2].
Уровень достоверности доказательств — степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным [7].
Уровень убедительности рекомендаций — степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда, в конкретной ситуации [7].
Хроническая болезнь почек — наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек и/или снижением функции, оцениваемой по величине скорости клубочковой фильтрации, которые сохраняются в течение 3 и более месяцев.
Целевой уровень — уровень того или иного лабораторного, инструментального, клинического показателя, различный для разных групп пациентов с тем или иным заболеванием, достижение которого в процессе лечения позволяет добиться наиболее благоприятного соотношения польза (снижение сердечно-сосудистого риска) — риск (неблагоприятные эффекты).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Дислипидемии (ДЛП) — состояния, когда концентрации липидов и липопротеидов крови выходят за пределы нормы, могут быть вызваны как приобретенными (вторичными), так и наследственными (первичными) причинами [8].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Первичные дислипидемии имеют генетическую природу, развиваются в результате аномалий генов, которые регулируют функции рецепторов, ферментов или транспортных белков, участвующих в липидном обмене. В этих случаях они проявляются как семейные (наследственные) нарушения липидного метаболизма и относятся к первичным моногенным ДЛП. СГХС – это наследственное аутосомно-доминантное заболевание, обусловленное мутациями генов, кодирующие рецептор липопротеидов низкой плотности (LDLR), аполипопротеин В-100 (APOB) и профермента пропротеин-конвертаза субтилин/кексин типа 9 (PCSK9), сопровождающееся стойким повышением уровня холестерина (ХС) липопротеидов низкой плотности (ЛНП) и ранним развитием атеросклероза. Заболевание проявляется в виде двух форм: менее тяжелой гетерозиготной и более тяжелой гомозиготной [9]. Но в подавляющем большинстве случаев они развиваются как первичные полигенные ДЛП, т.е. являются следствием сочетания слабых генетических влияний с факторами внешней среды: курением, нарушением диеты, малоподвижным образом жизни. Наиболее атерогенными ДЛП являются изолированная гиперхолестеринемия (ГХС) (фенотип IIа), представленная семейной и полигенной ГХС, комбинированная гиперлипидемия (различные фенотипы гиперлипидемии в одной семье). Менее атерогенна изолированная гипертриглицеридемия (ГТГ) (фенотип IV или V). ГТГ натощак может быть связана с рядом факторов, внешних и внутренних. К внешним факторам, способствующим развитию ГТГ и, соответственно, высокой ее распространенности в популяции, относятся избыточное питание с преобладанием жирной пищи, простых углеводов с высоким гликемическим индексом (сахар, глюкоза), а также избыточное потребление алкоголя, длительный прием ряда лекарств, в первую очередь глюкокортикоидов, неселективных бета-адреноблокаторов. Вторичная ГТГ встречается значительно чаще первичной и может быть обусловлена, в первую очередь, инсулинорезистентностью и связанными с ней состояниями: СД 2 типа, метаболическим синдромом и ожирением. К метаболическим факторам, способствующим формированию ГТГ, относится низкая активность липолитических ферментов, в частности, периферической липопротеинлипазы (ЛПЛ), которая определяется или генетическими особенностями фермента, или повышением содержания в липопротеидах ингибиторов ЛПЛ в первую очередь апоCIII [10, 11]. Среди первичных причин повышения ТГ следует упомянуть наследственные механизмы (гиперпродукция ЛОНП, дефект гидролиза ТГ, дефект клиренса ремнантов ТГ в печени). [12]. Основными причинами вторичных ДЛП являются сахарный диабет (СД), гипотиреоз, хроническая болезнь почек (ХБП).
Патогенез атеросклероза, ассоциированного с ДЛП
Атеросклероз проявляется уплотнением сосудистой стенки и образованием атеросклеротических бляшек. Это динамичный процесс, для которого характерно как прогрессирование, так и обратное развитие изменений в стенке артерии. Однако со временем атеросклероз прогрессирует, приводя, в итоге, к клиническим проявлениям заболевания. К настоящему времени сложилось четкое представление об атеросклерозе как мультифакториальном заболевании, в основе которого лежат сложные нарушения в биохимических, иммунологических и молекулярно-генетических процессах. Сегодня доминируют две гипотезы развития и становления атеросклероза: гипотеза «ответ на повреждение» и липидно-инфильтрационная гипотеза. Гипотеза «Ответ на повреждение» ставит во главу угла нарушение целостности эндотелия в качестве инициирующего фактора атеросклеротического процесса. Факторы, вызывающие повреждение эндотелия, весьма многообразны, но наиболее распространены окись углерода, поступающая в кровь при активном и «пассивном» курении, повышение артериального давления, дислипидемия, в особенности ГХС, обусловленная либо семейной предрасположенностью, либо вредными привычками, в первую очередь, диетическими погрешностями. В качестве повреждающих агентов могут выступать модифицированные (окисленные, десиалированные) липопротеиды и целый ряд других, как эндогенных, так и экзогенных факторов. На месте повреждения эндотелия происходит адгезия моноцитов и тромбоцитов, сопровождающаяся миграцией моноцитов в интиму. Прогрессирующее утолщение интимы ведет к развитию гипоксии внутри бляшки и в близлежащих участках сосуда. Гипоксия является возможной причиной развития некротических изменений в ядре бляшки и усиленной васкуляризации бляшки из системы ваза вазорум адвентиции. Эти сосуды в сердцевине бляшки являются источником микрогеморрагий (апоплексии) в ней, что в свою очередь ведет к усилению ее тромбогенной активности. В результате ослабления мышечно-эластического слоя сосуда в коронарных артериях происходит их ремоделирование с дилатацией, причем внутренний диаметр просвета сосуда какое-то время поддерживается «нормальным», до тех пор, пока прогрессирующий рост бляшки не превысит компенсаторные возможности медиального слоя артерии, и не приведет к прогрессирующему сужению ее просвета. Именно на этом этапе бляшки приобретают характер нестабильных и играют основную роль в развитии осложнений атеросклероза. Кроме того, происходит изменение фенотипа гладклмышечных клеток, который при поврежедении сосудистой стенки, из сократительного переходит в секреторный с высвобождением провоспалительных цитокинов и активацией молекул адгезии.
Липидная теория атеросклероза предполагает пусковым моментом в развитии атеросклероза инфильтрацию интимы и субэндотелия липидами и липопротеидами. По мере накопления липидов в сердцевине бляшки, происходит увеличение ее размеров, в результате чего фиброзная покрышка бляшки под действием специфических энзимов (эластаз, металлопротеиназ) истончается и при определенных условиях (повышение артериального давления, значительная физическая нагрузка) разрывается. Разрыв сопровождается активацией каскада коагуляции крови, агрегации тромбоцитов с образованием тромба, блокирующего просвет сосуда. Клинически этот процесс проявляется, в зависимости от локализации либо нестабильной стенокардией, либо инфарктом миокарда (ИМ), либо ишемическим инсультом.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Наиболее актуальные данные о распространенности нарушений липидного обмена в РФ получены в ходе многоцентрового исследования ЭССЕ-РФ, проведенного в 13 регионах РФ с включением 21048 человек [13]. Распространенность ГХС (уровень общего холестерина (ОХС) ≥5,0 ммоль/л) в среднем составила 58,4±0,34%. Существенных различий уровня ХС у мужчин и женщин не выявлено. С возрастом распространенность ГХС увеличивается практически в 2 раза: от 37,7±0,73% в возрастной группе 25—34 года до 74,5±0,54% среди лиц в возрасте от 55 до 64 лет (p <0,01). Независимо от пола среди жителей сельской местности ГХС встречается чаще, чем среди горожан (63,2±0,82 и 57,4±0,38% соответственно; p <0,001). Атерогенные сдвиги в липидном профиле в виде ГХС обусловлены в основном повышенным (≥3,0 ммоль/л) уровнем ХС ЛНП. Достоверно более высокая распространенность повышенного уровня ХС ЛНП у жителей села по сравнению с горожанами (62,4±0,60% против 59,2±0,38%; p<0,05) обусловлена в основном более высокими значениями этого показателя среди женщин (61,3±1,08% против 56,5±0,48%; p<0,05). Повышенный уровень ТГ обнаружен у 30,2±0,52% мужчин всей выборки, что достоверно выше, чем у женщин (20,1±0,34%; p<0,0001). Распространенность высокого уровня ТГ связана с возрастом, особенно это харакерно для женщин: 8,8±0,59% в младшей возрастной группе (25-34 года) и 34,4±0,71% среди женщин в возрасте 55-64 лет (p<0,0001). В то же время, частота гипертриглицеридемии достоверно выше у мужчин с низким уровнем благосостояния по сравнению с мужчинами с высоким уровнем благосостояния (30,9±0,66% против 23,8±3,41%; p<0,05). У жителей села распространенность ГТГ незначительно, но достоверно выше, чем у горожан (p<0,05 для всех случаев). Низкий уровень ХС ЛВП (меньше 1,0 ммоль/л для мужчин и 1,2 ммоль/л для женщин) обнаружен в 19,5% случаев.
Так же, результаты исследования ЭССЕ-РФ, показали, что 23% лиц из популяции имели выраженное повышение уровня ОХС >6,2 ммоль/л, а выраженное повышение уровня ХС ЛНП >4,2 ммоль/л встречалось в 20,6%[152].
Взаимосвязь ДЛП с риском развития сердечно-сосудистых осложнений
Крупнейшим проспективным исследованием было исследование MRFIT (Multiple Risk Factor Intervention Trial). У 361662 обследованных мужчин 35-57 лет были определены основные факторы риска ИБС, включая липиды сыворотки крови. Впервые был определен пороговый уровень ОХС (5,2 ммоль⁄л), с которого регистрируется значительный прирост смертности от ИБС. Абсолютный риск ИБС при самых высоких средне-популяционных значениях ОХС был в 20 раз выше, чем при наиболее низких уровнях, равных 4,7 ммоль⁄л [14].
Мета-анализ 4-х проспективных эпидемиологических исследований (Фремингемское, MRFIT, Coronary Primary Prevention Trial, Lipid Research Clinic) выявил зависимость повышения уровня ХС ЛВП на 1 мг⁄дл и снижением на 2-3% риска ИБС, независимо от других ФР, включая ХС ЛНП [15].
В мета-анализе 17 проспективных популяционных исследований было показано, что повышение ТГ сыворотки крови на 1 ммоль⁄ л ассоциируется с увеличением новых случаев ИБС на 32% у мужчин и на 76% – у женщин [15]. По данным крупнейшего эпидемиологического исследования (Framingham Study), уровень ТГ более 1,7 ммоль/л означает достоверно более высокий риск развития ССО [15]. При достижении целевого уровня (ЦУ) ХС ЛНП <1,8 ммоль/л риск ССО у пациентов с ХС ЛВП <1,0 ммоль/л на 64% выше, чем пациентов с ХС ЛВП ≥1,4 ммоль/л [16]. Повышенные уровни ТГ и низкий уровень ХС ЛВП синергично увеличивают риск сердечно-сосудистых событий у пациентов с уже достигнутыми ЦУ ХС ЛНП (<2,1 ммоль/л) [17]. Показано, что у пациентов с ТГ более 2,3 ммоль/л и одновременно ХС ЛВП менее 0,8 ммоль/л, риск ССО увеличивается в 10 раз по сравнению с пациентами с нормальными значениями ТГ и ХС ЛВП [17, 18].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
E78.0 Чистая гиперхолестеринемия
Семейная гиперхолестеринемия
Гиперлипопротеидемия Фредриксона, тип IIa
Гипер-бета-липопротеидемия
Гиперлипидемия, группа A
Гиперлипопротеидемия с липопротеидами низкой плотности
E78.1 Чистая гиперглицеридемия
Эндогенная гиперглицеридемия
Гиперлипопротеидемия Фредриксона, тип IV
Гиперлипидемия, группа B
Гипер-пре-бета-липопротеидемия
Гиперлипопротеидемия с липопротеидами очень низкой плотности
E78.2 Смешанная гиперлипидемия
Обширная или флотирующая бета-липопротеидемия
Гиперлипопортеинемия Фредриксона, типы IIb или III
Гипербеталипопротеидемия с пре-бета-липопротеидемией
Гиперхолестеринемия с эндогенной гиперглицеридемией
Гиперлипидемия, группа C
Тубоэруптивная ксантома
Ксантома туберозная
E78.3 Гиперхиломикронемия
Гиперлипопротеидемия Фредриксона, типы I или V
Гиперлипидемия, группа D
Смешанная гиперглицеридемия
E78.4 Другие гиперлипидемии
Семейная комбинированная гиперлипидемия
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
ДЛП классифицируют в зависимости от того, уровень каких именно липидов и липопротеидов выходит за пределы нормы. Крайне важно дифференцировать первичные и вторичные дислипидемии, так как в этих случаях принципиально отличается тактика лечения. В настоящее время ВОЗ принята классификация Fredrickson (1976), согласно которой выделяют несколько ее фенотипов (Таблица 1, Приложение А3). Следует подчеркнуть, что данная классификация не устанавливает диагноз, а лишь фиксирует тип ДЛП, вне зависимости от того, является ли она приобретенной или наследственной. Класификация также позволяет определить риск развития атеросклероза в зависимости от типа ДЛП. Так, IIа, IIb и III типы являются атерогенными, в то время как I, IV и V типы - «относительно» атерогенными. Классификация наследственных (семейных) дислипидемий приведена в таблице 2, приложение А3.
Принципы формулировки диагноза
Примеры формулировки диагноза
Гиперлипидемия (Гиперлипопротеидемия - ГЛП) IIa типа. Гиперлипопротеидемия(а).
Смешанная гиперлипидемия.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
К клиническим проявлениям заболевания приводят прогрессия атеросклеротического процесса, вызванного ДЛП. В зависимости от преимущественно пораженного сосудистого бассейна комплекс симптомов и синдромов широко варьирует. Основным осложнением атеросклероза коронарных артерий является ИБС, которая клинически проявляется стенокардией, ИМ, с частым исходом в хроническую сердечную недостаточность. Поражение магистральных артерий головного мозга проявляется симптомами его хронической ишемии с последующим развитием атеросклеротической энцефалопатии и/или инсульта. Атеросклероз артерий нижних конечностей сопровождается клинической картиной перемежающей хромоты. При отсутствии соответствующего лечения заболевание прогрессирует и может закончиться развитием гангрены нижних конечностей.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Диагноз ДЛП на основании значения липидных параметров устанавливается в соответствии с пороговыми значениями, указанными в таблице 2, Приложение А3.
Современный алгоритм обследования состоит из следующих основных этапов:
выявление основных факторов риска (ФР) (таблица 3, Приложение А3)
выявление клинических симптомов атеросклероза (данные опроса и осмотра);
определение липидного профиля (венозная кровь) с расчетом ХС ЛНП, ХС неЛВП;
оценка сердечно-сосудистого риска по шкале SCORE2;
исключение/верификация субклинического и клинически значимого атеросклероза (инструментальные методы обследования).
2.1 Жалобы и анамнез
Многие пациенты с повышенным уровнем липидов сыворотки крови могут не иметь никаких жалоб. Симптомы зависят от локализации атеросклеротического процесса - сосудистого бассейна, который преимущественно вовлечен в процесс. Поражение коронарного русла приводит к появлению болей в левой половине грудной клетки, загрудинной области при физической нагрузке или в покое, нарушениям сердечного ритма (жалобы на неритмичное, резко учащенное сердцебиение или ощущение «замирания», «перебоев в работе сердца»), одышки, отеков нижних конечностей. При локализации атеросклеротического процесса преимущественно в цереброваскулярном бассейне превалируют жалобы на головную боль, субъективное чувство головокружения, снижение памяти, внимания, работоспособности, появление «шума в ушах», «шума в голове». Развитие облитерирующего атеросклероза артерий нижних конечностей приводит к перемежающей хромоте, в тяжелых случаях – появлению интенсивных болей в нижних конечностях в покое, больше в ночное время, в горизонтальном положении пациента (интенсивность болевого синдрома может снижаться после пациента перехода в положение сидя/стоя).
На первом этапе обследования собирается анамнез, во время которого выясняется наличие у пациента ИБС, АГ, СД, атеросклероза периферических артерий, семейной гиперхолестеринемии (СГХС), метаболического синдрома, ожирения, ХБП. При сборе семейного анамнеза, особое внимание должно уделяться раннему проявлению ССЗ у родственников пациента 1-й линии родства.
2.2 Физикальное обследование
Всем пациентам для выявления клинических признаков нарушений липидного обмена и признаков состояний/заболеваний, обусловленных нарушениями липидного обмена, рекомендовано проводить физикальное обследование в объеме: осмотр (липоидная дуга роговицы у лиц моложе 45 лет, ксантелазмы, ксантомы); пальпация основных магистральных артерий верхних и нижних конечностей, сонных артерий; определение характера пульса; аускультация сердца и магистральных сосудов; измерение окружности талии [153-154].
ЕОК/ЕОА нет (УУР C, УДД 5)
Комментарии. Ксантомы (xanthomata) – это очаговые образования различного цвета (от нормального до желто-коричневого, оранжевого или розового); чаще всего располагаются в области сухожилий, суставов, на ладонях, стопах, ягодицах, бёдрах. Гистологически ксантомы представляют собой скопление ксантомных (пенистых) клеток, клеток-макрофагов, нагруженных липидами. Ксантомные клетки обычно имеют одно ядро, но встречается и многоядерные клетки типа инородных тел (клетки Тутона); среди них могут быть гистиоциты и лимфоидные клетки. Фиброз обычно не наблюдается. В старых очагах преобладают фибробласты и новообразованные коллагеновые волокна, окружающие группы пенистых клеток. В дальнейшем фиброзная ткань замещает пенистые клетки. Различают 4 клинические разновидности ксантом- плоскую, множественную узелковую (эруптивные ксантомы), туберозную, сухожильную. Плоские ксантомы (xanthoma planes) наблюдаются чаще у пожилых людей, представляют собой желтовато-оранжевые плоские или слегка выпуклые полосы в складках ладони и пальцев. Эруптивные ксантомы (син.: xanthoma papulosum multiplex, множественные узелковые ксантомы) характеризуются множественными плоскими или полусферическими узелками от 2 до 6 мм в диаметре, желтоватого или желтовато-оранжевого цвета с розово-синюшным венчиком у основания. Элементы высыпаний могут быть рассеянными по всему кожному покрову, но чаще – на разгибательных поверхностях конечностей, в области суставов, спины, ягодиц. Туберозные ксантомы (син.: xanthoma tuberosum, туберкулёзная ксантома, узловатая ксантома) встречаются у больных с семейной гиперхолестеринемией в области разгибательных поверхностей коленных и локтевых суставов, на ягодицах. Высыпания симметричны – безболезненные, плотной консистенции узлы величиной от 1,5 до 3,5 см в диаметре, желтоватого цвета с буроватым или синюшным оттенком. Сухожильные ксантомы (син.: xanthoma tendinеа, ксантома сухожилий) – плотные, медленно увеличивающиеся, опухолевидные образования желтого цвета, располагающиеся в области ахилловых сухожилий и сухожилий разгибателей пальцев.
Ксантелазмы - это плоские, желтые, образования на коже век Величина их колеблется от нескольких миллиметров до 3-5 см и более.
Липидная дуга роговицы имеет диагнстическое значение у лиц моложе 40-45 лет.
2.3 Лабораторные диагностические исследования
Всем лицам старше 40 лет рекомендуется скрининг, включающий анализ крови по оценке нарушений липидного обмена биохимический (липидный профиль) с целью стратификации сердечно-сосудистого риска по шкале SCORE2 [50, 241]. ЕОК/ЕОА I C (УУР С, УДД 5)
Пациентам с дислипидеией рекомендуется лабораторное исследование с определением уровня глюкозы, креатинина, мочевины, общего билирубина в крови, определение активности АЛТ, АСТ, КФК в крови и общий (клинический) анализ крови [154].
ЕОК/ЕОА I C (УУР С, УДД 5)
Определение уровеня ХС ЛВП в крови рекомендовано всем пациентам для дополнительной оценки риска в системе SCORE2 [50, 241].
ЕОК/ЕОА I C (УУР С, УДД 5)
У всех пациентов старше 40 лет рекомендовано определять уровень ХС ЛНП как главный показатель оценки сердечно-сосудистого риска [19, 20, 21].
ЕОК/ЕОА I C (УУР С, УДД 4)
Пациентам высокого/очень высокого риска рекомендуется, кроме уровня ХС ЛНП, ХС неЛВП в крови [155, 156].
ЕОК/ЕОА IIa C (УУР B, УДД2)
У пациентов с ГТГ, СД, ожирением, метаболическим синдромом рекомендовано проводить лабораторную оценку ХС неЛВП – для более точной оценки сердечно-сосудистого риска [20, 21, 22].
ЕОК/ЕОА I C (УУР А, УДД 1)
В случаях, когда трактовка сердечно-сосдистого риска вызывает затруднения(сомнения) в особенности у пациентов с ГТГ, СД, ожирением, метаболическим синдромом рекомендовано лабораторное исследование уровня атерогенного аполипопротеина В100[20].
ЕОК/ЕОА I C (УУРС, УДД 5)
Хотя бы раз в жизни у любого взрослого рекомендовано измерить уровень Лп(а) в крови. При значении Лп(а)>180 мг/дл риск эквивалентен гетерозиготной СГХС [20].
ЕОК/ЕОА IIa C (УУР С, УДД 5)
У пациентов с отягощённым семейным анамнезом рекомендовано измерять уровень Лп(а) в крови. Уровень Лп(а)>50 мг/дл ассоциируется с увеличением сердечно-сосудистого риска. [20].
ЕОК/ЕОА IIa C (УУРС, УДД 5)
Комментарии. Принципы определения уровня липидов сыворотки крови: традиционно образцы крови для анализа липидов берутся натощак, однако последние исследования говорят о том, что колебания концентрации липидов плазмы крови незначительны в зависимости от приема пищи [23, 24].Однако у лиц с ГТГ забор крови рекомендуется проводить натощак.
Референсный метод определения уровня ХС ЛНП является многостадийным:
1) ультрацентрифугирование в плотности 1,006 г/мл в течение 18 часов для удаления липопротеидов, богатых ТГ (ХМ и ЛОНП);
2) выделение донной фракции (плотности 1,006 г/мл) и преципитация в ней липопротеидов, содержащих апоВ смесью гепарин и MnCl2 для выделения ЛВП;
3) определение концентрации ХС в донной фракции и супернатанте референсным методом для определения ХС (модифицированный метод Абеля-Кендалла);
4) вычисление ХС ЛНП как разности для значений ХС в донной фракции и ХС ЛВП. Препаративное выделение методом ультрацентрифугирования в солевом растворе определенной плотности позволяет изолировать ЛНП и определить их состав.
Длительность и трудоемкость ультрацентрифугирования привела к разработке методов, более доступных для лабораторной практики. Самым распространенным способом определения уровня ХС ЛНП в клинических лабораториях является расчетный. В этом случае необходимо определить уровень ХС, ТГ и ХС ЛВП в крови и концентрацию ХС ЛВП в супернатанте после преципитации липопротеидов, содержащих апоВ (ЛОНП и ЛНП), и вычислить значение концентрации ХС ЛНП по формуле Фридвальда:
ХС ЛНП (в мг/дл) = общий ХС – ХС ЛВП – ТГ/5
ХС ЛНП (в ммоль/л) = общий ХС – ХС ЛВП – ТГ/2,2
В основе этой формулы лежат два допущения: 1) большая часть ТГ плазмы находится в ЛОНП; 2) массовое отношение ТГ/ХС в ЛОНП равно 5:1.
Формула Фридвальда позволяет получить значения ХС ЛНП, сопоставимые с полученными референсным методом при ТГ < 200 мг/дл, при концентрации 200–400 мг/дл возможна ошибка рассчетов. Применение этой формулы при концентрации ТГ> 400 мг/дл, наличии хиломикронов (ХМ), ДЛП III типа приводит к завышению содержания ХС ЛОНП и занижению ХС ЛНП и не позволяет получить сопоставимые результаты. В настоящее время разработаны прямые методы выделения ЛНП, пригодные для использования в клинико-диагностической лаборатории [5]. Исследовать уровень липидов с целью скрининга для определения риска не обязательно натощак. Однако при таком определении уровня липидов риск может быть недооценен у больных сахарным диабетом, так как в одном исследовании пациенты с диабетом имели на 0,6 ммоль/л ниже ХС ЛНП после приема пищи [8]. В последующем, для уточненной и дальнейшей характеристики тяжелых ДЛП, а также для наблюдения пациентов, рекомендуется определять уровень липидов натощак.
Пациентам с клиническими проявлениями СГХС (ССЗ у мужчин моложе 55 лет и женщин моложе 60 лет, ксантоматоз, гиперхолестеринемия (ХС ЛНП >5 ммоль/л. у взрослых, >4 ммоль/л. у детей) для установления клинического диагноза СГХС рекомендуется использовать диагностические критерии Голландских липидных клиник (Dutch Lipid Clinic Network - DLCN) (Таблица 3/А3) [50, 153].
ЕОК/ЕОА I C (УУР C, УДД 5)
2.4 Инструментальные диагностические исследования
Неинвазивные методы визуализации могут обнаружить наличие, оценить степень и оценить клинические последствия атеросклеротического повреждения сосудов. Визуализация коронарных артерий с помощью компьютерной томографии (КТ) сердца и сонных артерий методом дуплексного сканирования экстракраниальных отделов брахиоцефальных артерий являются информативными в выявлении атеросклеротического поражения артерий. Обнаружение кальцификации коронарной артерии с помощью неконтрастной КТ дает хорошую оценку атеросклеротической нагрузки и тесно связано с ССО. КТ-ангиография имеет высокую чувствительность 95-99% и специфичность 64-83% для диагностики ИБС [25]. Для скрининга атеросклероза коронарных артерий может использоваться кальциевый индекс (КИ), определяемый при КТ по Agatston [26]. Это исследование позволяет обеспечить дополнительную стратификацию риска [27], имеет меньшую стоимость, не требует внутривенного введения контрастных веществ (Таблица 4, Приложение А3). Использование КИ улучшает как дискриминацию, так и реклассификацию категории риска [28, 29]. Оценка атеросклеротических бляшек в сонной или бедренной артерии с помощью ультразвука является прогностическим фактором сердечно-сосудистых событий, сравнимым с КИ [30, 31], в то время как измерение толщины интимы-медиа сонной артерии уступает КИ и наличию бляшек в сонной артерии [32, 33] и не используется в качестве стратификатора риска.
У бессимптомных лиц с умеренным риском наличие КИ > 100 единиц по Agatston и наличие атеросклеротических бляшек в сонной или бедренной артерии по данным дуплексного сканирования может перевести их в категорию более высокого риска. При этом КИ невысок и имеет низкую специфичность у пациентов моложе 45 лет с тяжелой СГХС, включая гомозиготную СГХС (гоСГХС).
Всем пациентам с дислипидемией рекомендовано дуплексное сканирование брахиоцефальных артерий [34]
ЕОК/ЕОА IIaВ (УУР А, УДД1)
У пациентов с выявленными атеросклеротическими бляшками в сонной или бедренной артерии по данным дуплексного сканирования рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективного управления определяющими риск факторами [34, 35, 50].
ЕОК/ЕОА IIaВ (УУР А, УДД1)
У пациентов с коронарным атеросклерозом и значением КИ выше 100 единиц по данным КТ сердца рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективной корекции факторов риска [36, 33].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
2.5 Иные диагностические исследования
Иные диагностические исследования в рамках диагностики ДЛП не предусмотрены, возможно расширение диагностических исследований по решению врача в зависимости от клинической ситуации и состояния пациента.
Оценка сердечно-сосудистого риска
У всех бессимптомных взрослых старше 40 лет, без ССЗ, СД, ХБП, СГХС, с ХС ЛНП < 4,9 ммоль/л рекомендуется проведение скрининга для оценки общего риска с использованием шкалы SCORE2 [50, 241, 254].
ЕОК/ЕОА IC (УУР C, УДД 5)
Пациентов с установленными ранее ССЗ, СГХС, СД, ХБП 3-5 стадий, очень высоким риском по шкале SCORE2 или уровнем ХС ЛНП >4,9 ммоль/л рекомендовано относить к категории высокого или очень высокого риска с целью эффективного управления определяющими ФР [8, 50].
ЕОК/ЕОА IC (УУР C, УДД 5)
Комментарии. В РФ для расчета риска фатальных и нефательных сердечно-сосудистых осложнений в процентах в течение ближайших 10 лет следует использовать шкалу SCORE2 для стран с высоким сердечно-сосудистым риском (приложение Г2) [254]. Для оценки риска по шкале SCORE2 следует выбрать квадрат в зависимости от пола, возраста и статуса курения пациента. В найденном квадрате следует отыскать ячейку, наиболее соответствующую уровню систолического АД и ХС неЛВП данного пациента. Оценка риска по шкале SCORE2 не рекомендована у лиц с подтвержденным ССЗ, СД, ХБП, с единственным, но выраженным ФР (например, тяжелая АГ), с СГХС. Такие пациенты автоматически относятся к группе очень высокого и высокого риска ССО и требуют интенсивной коррекции ФР. Наличие стеноза более 50% в крупных (магистральных) артериях любого сосудистого бассейна по данным любых инструментальных методов исследования, даже в отсутствие клинических симптомов, также переносит пациента в категорию очень высокого риска.
Категории сердечно-сосудистого риска, согласованные со шкалой SCORE2, представлены в Приложении Г2.
Следует обратить особое внимание на выделение внутри категории очень высокого риска категории экстремального риска. К экстремальному риску следует относить: наличие 2 и более сердечно-сосудистых осложнений в течение 2 лет, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП <1,4 ммоль/л.
Под атеросклеротическим сердечно-сосудистым заболеванием (АССЗ) подразумевают все проявления ИБС, ишемический инсульт или транзиторное нарушение мозгового кровообращения, атеросклероз артерий нижних конечностей.
Пациентов с СГХС и АССЗ рекомендовано относить к категории очень высокого риска с целью эффективного управления определяющими ФР [37].
ЕОК/ЕОА IC (УУР В, УДД 2)
Пациентов с СГХС без АССЗ рекомендовано относить к категории высокого риска с целью эффективного управления определяющими ФР [37].
ЕОК/ЕОА IC (УУР В, УДД 2)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня сердечно-сосудистого риска. Тактика немедикаментозной и медикаментозной терапии суммирована в таблице 1, Приложение Б4.
3.1 Целевые уровни ХС ЛНП
У пациентов очень высокого риска рекомендовано достижение целевого уровня ХС ЛНП <1,4 ммоль/л и снижение по меньшей мере на 50% от исходного через 8±4 недель терапии как для первичной, так и вторичной профилактики ССО [39, 42, 50].
ЕОК/ЕОА IС (УУР С, УДД 5)
У пациентов с подтвержденным АССЗ, перенесших повторное сосудистое событие в течение 2 лет (в любом сосудистом бассейне), несмотря на прием максимально переносимой дозы ингибитора гидроксиметилглутарил-кофермента А (ГМГ-КоА) редуктазы, рекомендован целевой уровень ХС ЛНП <1,0 ммоль/л [40, 41, 50].
ЕОК/ЕОА IIbB (УУРС, УДД 5)
У пациентов высокого риска рекомендован целевой уровень ХС ЛНП <1,8 ммоль/л и его снижение по меньшей мере на 50% от исходного [39, 42, 50].
ЕОК/ЕОА IA (УУР С, УДД 5)
У пациентов умеренного риска рекомендован целевой уровень ХС ЛНП <2,6 ммоль/л для первичной профилактики ССЗ [39, 50].
ЕОК/ЕОА IIaА (УУРС, УДД 5)
У пациентов низкого риска рекомендован целевой уровень ХС ЛНП <3,0 ммоль/л [42, 50].
ЕОК/ЕОА IIbA (УУРС, УДД 5)
Комментарии. Статины - C10AA ингибиторы ГМГ-КоА-редуктазы.
3.2 Немедикаментозное лечение ДЛП
Для профилактики ССЗ доказала свое преимущество диета [44] с высоким уровнем употребления фруктов, овощей, цельнозерновых злаков и клетчатки, орехов, рыбы, птицы и молочных продуктов с низким содержанием жира и ограниченным потреблением сладостей, сладких напитков и красного мяса. Рекомендуется использовать жиры растительных масел. Такая диета является эффективным средством первичной и вторичной профилактики атеросклероза [45]. В частности, многоцентровое рандомизированное исследование PREDIMED, выполненное в Испании, у лиц из группы высокого риска, но без ССЗ, доказало снижение частоты основных ССО (ИМ, инсульт или смерть от сердечно-сосудистой причины) на 28-31% при ежедневном употреблении оливкового масла или орехов [46]. Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы, по крайней мере, дважды в неделю и омега-3 полиненасыщенных жирных кислот в низких дозах в качестве пищевой добавки могут снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеидов плазмы [47]. Оценка биологически активных добавок и функциональных продуктов питания должна в обязательном порядке включать в себя не только доказательства полезных свойств по влиянию на липидный профиль и атеросклероз, но, также и хорошую переносимость. Важным является производственный стандарт для указанных продуктов, гарантирующий стандартизацию и качество. К пищевым добавкам, влияющим на липидный профиль относится красный дрожжевой рис (монаколин), действие которого, как и статинов, связано с ингибированием ГМГ-КоА-редуктазы. В крупном исследовании, выполненном в Китае у больных с ИБС, монаколин снижал частоту ССО на 45% [48]. Гипохолестеринемический эффект (снижение ХС ЛНП на 15-25%) наблюдается при ежедневном приеме монаколина K в дозе 10 мг. [49]. Монаколин К можно применять, с учетом доказанной клинической эффективности и безопасности, у лиц низкого и умеренного риска с умеренно повышенным ХС ЛНП и отсутствием показаний для приема статинов. Влияние изменения образа жизни на уровень липидов и рекомендации по диете для улучшения общего профиля липопротеидов представлены в Приложении В («Информация для пациентов») и таблице П2, приложении Б4.
Немедикаментозные методы для снижения ТГ включают в себя снижение избыточной массы тела [ИМТ 20-25 кг/м2, окружность талии <94 см (мужчины) и <80 см (женщины)], уменьшение потребления алкоголя (пациентам с ГТГ следует полностью воздержаться от приема алкоголя), увеличение регулярной физической активности (физические упражнения минимум 30 мин каждый день), ограничение в потреблении легко всасываемых углевовдов[50].
3.3 Медикаментозная терапия ДЛП
3.3.1 Общие принципы медикаментозной терапии
Комментарии: при планировании гиполипидемической терапии рекомендуется придерживаться следующей схемы:
- оценить общий риск развития ССЗ;
- обсудить с пациентом особенности профилактики ССЗ;
- определить ЦУ ХС ЛНП в соответствии с категорией риска;
- подсчитать в процентах степень снижения уровня ХС ЛНП, необходимого для достижения целевого значения;
- выбрать из группы статинов препарат, который может обеспечить такой уровень снижения ХС ЛНП;
-эффективность и переносимость терапии статинами вариабельны, поэтому может потребоваться титрация дозы препарата;
- если монотерапия статином не позволяет достичь цели, следует рассмотреть возможность комбинированной терапии, в том числе статина с эзетимибом, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) (у лиц очень высокого риска возможно начать гиполипидемическую терапию сразу с комбинации статина с эзетимибом).
- врачу убедить пациента в необходимости непрерывной (пожизненной) гиполипидемической терапии.
3.3.2 Основные классы препаратов для лечения дислипидемий
К средствам, корригирующим ДЛП, относятся статины, эзетимиб, фибраты, другие гиполипидемические средства (эзетимиб, омега-3 триглицериды, включая другие эфиры и кислоты (омега-3 ПНЖК), алирокумаб**, эволокумаб**, инклисиран**).
Статины являются одними из наиболее изученных классов препаратов в профилактике ССЗ. Результаты многочисленных клинических исследований свидетельствуют о том, что статины значительно снижают заболеваемость и смертность от ССЗ при первичной и вторичной профилактике во всех возрастных группах, как у мужчин, так и у женщин. В клинических исследованиях статины замедляли прогрессирование и даже вызывали регрессию атеросклеротической бляшки. Крупнейший метаанализ 19 исследований с различными статинами показал снижение смертности от всех причин на 14%, частоты сердечно-сосудистых событий на 27%, нефатальных и фатальных коронарных осложнений на 27%, инсульта на 22% при снижении уровня ХС ЛНП на 1,0 ммоль/л [51]. Относительное снижение риска при первичной профилактике сопоставимо с таковым во вторичной профилактике. Доступные данные позволяют предположить, что клинический эффект в значительной степени зависит не от препарата, а от степени снижения ХС ЛНП. В РФ представлены (в порядке убывания гиполипидемического эффекта) розувастатин в дозах 5, 10, 15, 20 и 40 мг, аторвастатин** — 10, 20, 30, 40 и 80 мг/сут, питавастатин — 1, 2 и 4 мг, симвастатин** — 10, 20 и 40 мг. Максимальное снижение ХС ЛНП на 50–55% возможно при применении высоких доз розувастатина и аторвастатина**. Статины различаются по своим свойствам всасывания, биодоступности, связывания с белками плазмы, выведения и растворимости. Всасывание препаратов варьирует от 20 до 98%. Многие статины в значительной степени подвергаются метаболизму в печени с участием изоферментов цитохрома P450, за исключением правастатина, розувастатина и питавастатина. Препараты, потенциально взаимодействующие с статинами, представлены в таблице П3, приложении Г4 [52, 53, 54, 55, 56, 57, 58, 59, 60]. Важно отметить, что по данным опубликованного в 2014 году метаанализа 8 важнейших рандомизированных клинических исследований с статинами (n=38153, 6286 ССО у 5387 человек) была продемонстрирована меньшая частота ССО при уровне ХС ЛНП <1,3 ммоль/л (50 мг/дл). При сравнении с участниками с уровнем ХС ЛНП >4,5 ммоль/л (175 мг/дл) было отмечено прогрессивное снижение относительного риска развития сердечно-сосудистых осложнений в зависимости от уровня ХС ЛНП: 2,0–2,6 ммоль/л (75–100 мг/дл), 1,3–2,0 ммоль/л (50–75 мг/дл), и <1,3 ммоль/л (50 мг/дл): 0,56 (95% ДИ 0,46–0,67), 0,51 (0,42–0,62) и 0,44 (0,35–0,55), соответственно [61]. В настоящее время для достижения ЦУ ХС ЛНП и снижения риска ССО оправдано использования трех статинов: розувастатина, аторвастатина**, питавастатина, симвастатина.
Фибраты. Механизм их действия заключается в активации альфа-рецепторов, активируемых активатором пероксисом (РРARα), расположенных в печени, мышцах, жировой ткани, сердце, почках, макрофагах и тромбоцитах. Основная роль PPARα-рецепторов заключается в регуляции метаболизма липидов и липопротеидов, воспаления, функции эндотелия. Активированные PPARα-рецепторы связываются со специфическими участками ДНК, стимулируя или угнетая основные гены, кодирующие метаболические процессы. При этом необходимо отметить, что из класса фибратов только фенофибрат** может использоваться в комбинации со статинами [44]. Фенофибрат** увеличивает синтез апоА1, апоА2, активность ЛПЛ и снижает синтез апоСIII, апоВ100 и концентрацию малых плотных частиц ЛНП на 50%. Это ведет к увеличению уровня ХС ЛВП на 10–30%, ускорению превращения ХМ в их ремнанты, снижению уровня ХС ЛНП на 25%, уменьшению синтеза ТГ и ЛОНП. Уровень ТГ может снижаться до 50% [62, 63]. Помимо влияния на обмен липидов, фенофибрат** снижает уровень мочевой кислоты в среднем на 25%, фибриногена на 21%, С-реактивного белка на 34% [62, 63].
Ингибиторы абсорбции холестерина. Эзетимиб ингибирует всасывание в кишечнике холестерина, поступающего с пищей и из желчи, не влияя на всасывание других жирорастворимых пищевых веществ. Ингибируя всасывание ХС на уровне ворсинок слизистой тонкого кишечника (путем взаимодействия с белком NPC1L1), эзетимиб снижает количество холестерина, поступающего в печень. В ответ на снижение поступления ХС печень активирует на своей поверхности рецепторы ЛНП, что ведет к увеличению клиренса ХС ЛНП из крови. В клинических исследованиях монотерапия эзетимибом сопровождалась снижением уровня ХС ЛНП на 15–22%. Комбинация эзетимиба с статинами обеспечивала дополнительное снижение уровня ХС ЛНП на 15-20%. В исследовании SHARP (Study of Heart and Renal Protection) у пациентов с ХБП было отмечено снижение частоты развития ССЗ в основной группе, получавшей терапию эзетимибом в сочетании с симвастатином** по сравнению с группой, получавшей плацебо, на 17% [64]. Исследование IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) — самое крупное и продолжительное рандомизированное клиническое исследование по применению эзетимиба, включившее 18144 больных, госпитализированных по поводу острого коронарного синдрома [38]. На момент включения больные не получали эзетимиба или максимальной дозы любого статина, но должны были иметь относительно невысокий уровень ХС ЛНП (1,3-3,2 ммоль/л или 50-125 мг/дл). Период наблюдения за больными достигал 7 лет. Через 1 год наблюдения средний уровень ХС ЛНП в группе эзетимиба составил 1,4 ммоль/л (54 мг/дл), что на 0,4 ммоль/л (14 мг/дл) меньше, чем в группе симвастатина**. В группе комбинированного лечения было продемонстрировано значимое снижение суммарного количества смертельных исходов вследствие сердечно-сосудистых причин, ИМ, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации и инсульта на 6,4% (относительный риск (ОР)=0,936; 95% доверительный интервал (ДИ)=0,89–0,99, р=0,016), снижение абсолютного риска — на 2,0% [38]. Таким образом, эзетимиб может быть использован в качестве средства второй линии в комбинации со статинами, когда монотерапия статинами не позволяет достичь целевого уровня даже при их назначении в максимальных дозах, а также при непереносимости статинов или наличии противопоказаний к их применению.
Ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9) Алирокумаб ** и эволокумаб ** (по АТХ — C10AX Другие гиполипидемические средства) являются ингибиторами (моноклональными антителами к) PCSK9 — белка, контролирующего экспрессию рецепторов к ХС ЛНП гепатоцитов [65]. Повышенные уровень/функция PCSK9 снижают экспрессию рецепторов ЛНП и увеличивают концентрацию ХС ЛНП в плазме, в то время как снижение уровня/функции PCSK9 вызывает снижение ХС ЛНП в плазме крови [66]. Алирокумаб** в дозировках 75 и 150 мг и эволокумаб** в дозировке 140 мг подкожно с частотой введения 1 раз в 2 недели в клинических исследованиях показали возможность снижения уровня ХС ЛНП на 60% и риска сердечно-сосудистых осложнений на 15% у больных с АССЗ в комбинации с умеренной и высокоинтенсивной терапией статинами. Исследование FOURIER (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk) включило 27564 пациентов с атеросклеротическим поражением различных сосудистых бассейнов: 22040 пациентов (81%) в прошлом перенесли ИМ (из них 5500 в сроки от 4 недель до 1 года перед включением в исследование), у 5330 (19%) в анамнезе был негеморрагический инсульт и у 3640 (13%) — периферический атеросклероз. Пациенты находились на адекватной гиполипидемической терапии: 69,2% получали статины в режиме высокой интенсивности и 30,4% — умеренной интенсивности, у 5,1% дополнительно к статину назначали эзетимиб. Участники, рандомизированные в группу активного лечения, получали эволокумаб** подкожно в дозе 140 мг 1 раз в 2 недели или 420 мг в месяц, тогда как пациентам в группе контроля на протяжении исследования подкожно вводили плацебо [40]. Медиана наблюдения в исследовании составила 2,2 года. Была подтверждена высокая гиполипидемическая эффективность эволокумаба**: уровень ХС ЛНП снизился на 59% с 2,40 ммоль/л до 0,78 ммоль/л. Впервые было продемонстрировано положительное влияние терапии эволокумабом** на сердечно-сосудистые исходы: частота событий, оцениваемых по первичной конечной точке, в группе эволокумаба** была ниже на 15% (ОР=0,85, 95% ДИ=0,79-0,92, p <0,001), а по вторичной точке — ниже на 20% (ОР=0,80, 95% ДИ=0,73–0,88, p <0,001), чем в группе плацебо. Чуть позднее были представлены результаты дополнительного, заранее спланированного анализа, целью которого было определение связи между границами и степенью снижения уровня ХС ЛНП и частоты ССО [67]. В этот анализ были включены 25982 человека (94% от общего количества рандомизированных, 13013 — на эволокумабе**, 12969 — плацебо). Их ранжировали по уровню достигнутого к 4-й неделе лечения ХС ЛНП на 5 подгрупп: <0,5 ммоль/л (n=2669), 0,5–1,3 ммоль/л (n=8003), 1,4–1,8 ммоль/л (n=3444), 1,9–2,6 ммоль/л (n=7471), >2,6 ммоль/л (n=4395). Было отмечено, что при снижении ХС ЛНП вплоть до 0,2 ммоль/л (7,7 мг/дл) уменьшается частота ССО без увеличения риска нежелательных явлений. Однако статистически значимое снижение частоты событий из первичной и вторичной конечных точек было показано только в первых двух подгруппах низких значений ХС ЛНП, т.е. менее 0,5 и 1,3 ммоль/л: на 24% и 15% [ОР=0,76 (0,64–0,90) и 0,85 (0,76–0,96)] для первичной точки и на 31% и 25% [0,69 (0,56–0,85)] и [0,75 (0,64–0,86)] для вторичной точки, соответственно. В связи с этими данными авторы отметили целесообразность пересмотра целевого уровня ХС ЛНП в современных рекомендациях для лиц очень высокого сердечно-сосудистого риска. Исследование ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab) с участием 18 924 пациентов с перенесенным 1–12 месяцев назад ОКС продемонстрировало, что алирокумаб** статистически значимо снижает риск крупных сердечно-сосудистых событий. Они отмечались у 903 пациентов (9,5%) в группе терапии препаратом алирокумаб** и у 1052 пациентов (11,1%) в группе плацебо, что соответствует снижению относительного риска на 15% (ОР 0,85; 95% ДИ, 0,78–0,93; p<0,001). Кроме того, на фоне алирокумаба ** снижался риск смерти от всех причин на 15%. У пациентов с исходно более высоким уровнем ХС ЛНП (≥100 мг/дл/2,6 ммоль/л) при применении алирокумаба ** отмечалось более выраженное снижение риска сердечно-сосудистых событий на 24% ниже (ОР 0,76; 95% ДИ, 0,65–0,87), а смерти от всех причин — на 29% (ОР 0,71; 95% ДИ, 0,56–0,90), в сравнении с плацебо [41].
Инклисиран** — это химически модифицированная двухцепочечная малая интерферирующая рибонуклеиновая кислота (миРНК). В гепатоцитах инклисиран** использует механизм РНК-интерференции, чтобы нацелиться на матричную РНК PCSK9 и запустить процесс ее деградации, тем самым увеличивая рециркуляцию и экспрессию рецепторов ЛНП, с последующим увеличением его захвата и уменьшением уровня ХС ЛНП в крови [157–160]. Инклисиран** вводится подкожно 3 раза в первый год, а затем два раза в год.
В группе клинических исследований ORION (A Randomized Trial Assessing the Effects of Inclisiran on Clinical Outcomes Among People With Cardiovascular Disease) 9, 10, 11 была подтверждена долгосрочная гиполипидемическая эффективность инклисирана** для следующих групп пациентов: СГХС, АССЗ и эквиваленты сердечно-сосудистого риска, такие как как СД 2 типа, СГХС или 10-летний риск ССО >20% по Фрамингемской шкале или эквивалентной ей. Было установлено, что назначение инклисзирана приводит к снижению уровня ХС ЛНП у указанных категорий больных на 50–58%, как в краткосрочной, так и в долгосрочной перспективе [161, 162]. Профиль безопасности инклисирана** сопоставим с плацебо [161, 162], не было получено данных о возникновении специфических серьезных нежелательных явлений, возникших в ходе лечения [50]. В метаанализе по результатам трех рандомизированных клинических исследований было показано снижение частоты серьезных неблагоприятных сердечно-сосудистых событий на 24% (отношение рисков = 0,76; 95% доверительный интервал, 0,61–0,92) [252].
Омега-3 ПНЖК в соответствии с современными воззрениями являются основными препаратами для снижения уровня ТГ. Недавно завершившееся исследование REDUCE-IT (Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia) с участием 8179 пациентов доказало влияние омега-3 ПНЖК на твердые конечные точки [68]. Критериями включения были: установленные в анамнезе ССЗ (~70% пациентов) или СД 2-го типа + >1 ФР, уровень ТГ ≥2,3 ммоль/л и <5,6 ммоль/л, достигнутый целевой уровень ХС ЛНП >1,03 ммоль/л и ≤2,6 ммоль/л. Первичной конечной точкой являлось время от рандомизации до первого события: сердечно-сосудистая смерть, нефатальный ИМ, нефатальный ишемический инсульт, реваскуляризация, нестабильная стенокардия. Было продемонстрировано снижение относительного риска развития серьезных неблагоприятных СС событий на 25% (р <0,001), в группе пациентов, принимавших омега-3 ПНЖК (форма эйкозопентаеновой кислоты 4 г/сут) в сравнении с плацебо. Таким образом, Омега-3 триглицериды, включая другие эфиры и кислоты, могут использоваться для терапии ГТГ в дозе 2–4 г/сут.
Сравнение эффективности статинов, фибратов и эзетимиба представлено в таблице П4, приложении Г4.
Сводные данные по эффективности, дозам, побочным эффектам гиполипидемических препаратов приведены в таблице П8, приложении Г4.
3.3.3 Медикаментозная терапия ДЛП для достижения целевого уровня ХС ЛНП
Всем пациентам с ДЛП рекомендована терапия статином в дозах, необходимых для достижения целевого уровня ХС ЛНП [39, 69, 70].
Комментарии: дозы статинов для интенсивного и умеренного снижения ХС ЛНП приведены в таблице П4, приложение Б3. При непереносимости высокоинтенсивной терапии статинов следует рассмотреть снижение дозы препарата с последующей переоценкой переносимости.
ЕОК/ЕОА IA (УУР В, УДД 1)
Пациентам, не достигшим целевого уровня ХС ЛНП на фоне максимально переносимых доз статинов, следует рассмотреть возможность комбинированной терапии, в том числе статин с эзетимибом, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [38].
ЕОК/ЕОА IВ (УУР А, УДД 2)
У пациентов с очень высоким риском и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина в комбинации с эзетимибом рекомендовано добавить алирокумаб** (ЕОК/ЕОА I A), эволокумаб**(ЕОК/ЕОА I A) или инклисиран** (ЕОК/ЕОА нет) с целью вторичной профилактики ССЗ [40, 41, 67, 243].
(УУР А, УДД 1)
В случае значительного повышения уровня ХС ЛНП у больных очень высокого риска (выше 4,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина и эзетимиба, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [244].
ЕОК/ЕОА нет (УУР А, УДД 1)
В случае значительного повышения уровня ХС ЛНП у больных экстремального или очень высокого риска (выше 5,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина максимально переносимой дозе+эзетимиб+ингибитора PCSK9: алирокумаба** (ЕОК/ЕОА I A), эволокумаба** (ЕОК/ЕОА I A) или инклисирана** (ЕОК/ЕОА нет) [243, 245, 246,255].
(УУР А, УДД 1)
У пациентов с очень высоким риском, без СГХС, и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина с/без эзетимибом рекомендовано добавить алирокумаб**, эволокумаб** или инклисиран** [40, 41, 67, 243] с целью первичной профилактики ССЗ.
ЕОК/ЕОА IIbC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина рекомендован прием эзетимиба [71, 72].
ЕОК/ЕОА IIаC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП, рекомендовано добавление к терапии алирокумаба**, эволокумаба** или инклисирана** [71, 72, 73, 243].
ЕОК/ЕОА IIbC (УУР А, УДД 2)
Комментарии: степень снижения уровня ХС ЛНП при различных вариантах гиполипидемической терапии указан в таблице А3.11. Алгоритм медикаментозной терапии достижения целевого уровня ХС ЛНП приведен в Приложении Б2.
3.3.4 Медикаментозная терапия гипертриглицеридемии
Пациентам любой категории риска рекомендован целевой уровень ТГ <1,7 ммоль/л [16, 156, 163].
ЕОК/ЕОА IIaC (УУР B, УДД 2)
Комментарии: важными причинами остаточного риска являются высокий уровень ТГ и низкий уровень ХС ЛВП в плазме крови. Даже при достижении целевого уровня ХС ЛНП у пациентов сохраняется остаточный риск ССО. По данным крупнейшего эпидемиологического исследования (Framingham Study), уровень ТГ<1,7 ммоль/л (< 150 мг/дл) указывает на более низкий риск ССО, более высокие уровни указывают на необходимость поиска причин повышения уровня ТГ. Повышенные уровни ТГ и низкий уровень ХС ЛВП синергично увеличивают риск ССО у пациентов с уже достигнутыми ЦУ ХС ЛНП [16, 156, 163].
Пациентам высокого и очень высокого риска, достигшим на терапии статином уровня ТГ 1,7–2,3 ммоль/л, рекомендовано добавить препарат омега-3 ПНЖК в дозе до 2 г 2 раза в день [68].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
Пациентам с уровнем ТГ> 2,3 ммоль/л на терапии статином, рекомендовано добавить фенофибрат** (предпочтительно в одной таблетке (зарегистрирован розувастатин+фенофибрат) или препарат омега-3 ПНЖК в дозе до 2 г 2 раза в день [68, 77, 78, 79].
Комментарии: В исследовании ECLIPSE-REAL к концу 12 недель терапии комбинацией фенофибрата** и статина значительно снизили ОХС, ТГ, ХС ЛНП, ХС ЛОНП, но более значимым и статистически значимым снижение было в группе, получавшей комбинацию розувастатина и фенофибрата** [164–166].
ЕОК/ЕОА IIaВ (УУР С, УДД 5)
Пациентам с уровнем ТГ > 5,0 ммоль/л, рекомендовано назначить фенофибрат** и препарат омега-3 ПНЖК в дозе до 2 г 2 раза [242].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
Алгоритм выбора медикаментозной терапии ГТГ представлен в приложении Б1.
3.4 Аппаратное лечение ДЛП
Подразумевает такие экстракорпоральные методы удаления атерогенных липопротеидов как плазмаферез, плазмосорбция. Они назначаются пациентам, у которых после 6 месяцев комбинированной гиполипидемической терапии в максимально переносимых дозах не достигнуты целевые уровни ХС ЛНП. Помимо этого, плазмаферез, плазмосорбция проводятся по следующим показаниям: гомозиготная СГХС и ХС ЛНП >7,8 ммоль/л, или гетерозиготная СГХС и ХС ЛНП >7,8 ммоль/л + 1 дополнительный фактор сердечно-сосудистого риска, или гетерозиготная СГХС и ХС ЛНП > 5,0 ммоль/л + 2 фактора риска или уровень Лп(а) >50 мг/дл; гетерозиготная СГХС и ХС ЛНП >4,1 ммоль/л у лиц очень высокого риска; СГХС при отмене гиполипидемической терапии в связи с беременностью при высоком риске сердечно-сосудистых осложнений [8].
Плазмаферез, плазмосорбция проводятся еженедельно или 1 раз в две недели. Во время процедуры из плазмы крови пациента удаляется до 80% уровня ХС ЛНП, при этом концентрация уровня ХС ЛНП в плазме крови пациента в зависимости от объема обработанной плазмы снижается на 70–80%. В настоящее время существует ряд методов плазмафереза, плазмосорбции ХС ЛНП: каскадная плазмофильтрация, гепарин-преципитация ЛНП (HELP), аффинная плазмо- и гемосорбция липопротеидов, иммуносорбция ЛНП.
Плазмаферез, плазмосорбция проводятся только в специализированных отделениях больниц и клиник.
Показания к ЛНП и Лп(а) плазмаферезу, плазмосорбции приведены в таблице П3, приложении Б.
3.5 Лечение ДЛП в отдельных клинических ситуациях
3.5.1 Семейная гиперхолестеринемия
Определение. Эпидемиология
Семейная гиперхолестеринемия (СГХС) — генетически детерминированное моногенное нарушение липидного обмена с преимущественно аутосомно-доминантным типом наследования, сопровождающееся значительным повышением уровня ХС ЛНП в крови и, как следствие, преждевременным развитием и прогрессирующим течением атеросклероза, как правило, в молодом возрасте [9, 220]. Различают две формы: гетерозиготную (геСГХС) и гомозиготную (гоСГХС). В структуре моногенных дислипидемий геСГХС занимает первое место по распространенности и составляет в среднем 1 на 200–250 человек [9, 220]. Согласно результатам эпидемиологического исследования, проведенного в ряде регионов Российской Федерации, распространенность геСГХС колеблется от 1:108–1:173 лиц [221]. ГоСГХС встречается значительно реже, распространенность составляет 1 случай на 160–300 тыс. населения Европы [222].
Этиология и патогенез
Генетические основы заболевания
Развитие СГХС обусловлено дефектами генов белков, участвующих в метаболизме липопротеидов, в результате которых нарушается захват клетками ЛНП-частиц и в крови повышается уровень ХС ЛНП [223, 224].
Самая частая генетическая причина СГХС — мутация в гене рецептора липопротеидов низкой плотности (LDLR), который расположен главным образом на поверхности гепатоцитов и играет ключевую роль в связывании и выведении из кровотока циркулирующих ЛНП-частиц [225, 226]. На сегодняшний день известно более 1600 мутаций LDLR, способных нарушить функцию рецептора и вызывать развитие СГХС. Мутации в гене LDLR обуславливают от 85 до 90% случаев СГХС [227].
Вторая по частоте причина — мутация в гене аполипопротеина В (APOB), кодирующего апобелок В100, входящий в состав ЛНП-частиц и ответственный за связывание ЛНП с рецептором. В результате изменений в гене половина ЛНП-частиц не способна связаться с ЛНП-рецептором [228]. Мутации гена APOB обеспечивают от 5 до 10% случаев СГХС [229]. Показано, что носители мутаций гена LDLR имеют более высокий уровень ОХС и ХС ЛНП и более выраженные проявления атеросклероза артерий, чем носители мутаций гена APOB [230].
Третий ген, мутации в котором способны приводить к развитию СГХС, — это ген, кодирующий пропротеинконвертазу субтилизин/кексин тип 9 (PCSK9 — ПКСК9) — сериновую протеазу, участвующую в разрушении ЛНП-рецептора [231, 232, 233]. Мутации гена PCSK9 обеспечивают меньше 5% случаев СГХС [227]. Уровни ХС ЛНП у носителей миссенс-мутаций PCSK9 очень варьируют от относительно умеренных до очень высоких [234].
Диагностические критерии заболевания
Потенциальную вероятность наличия СГХС необходимо оценивать в случаях [235, 236]:
ОХС ≥8 ммоль/л и/или ХС ЛНП ≥5 ммоль/л без терапии для взрослых и ОХС> 6,7 ммоль/л или ХС ЛНП ≥3,5 ммоль/л у детей,
Ранний дебют ССЗ атеросклеротического генеза (у мужчин <55 лет; у женщин <60 лет),
Кожные / сухожильные ксантомы,
Случай внезапной сердечной смерти члена семьи.
С учетом генетической предиспозиции быстрая прогрессия атеросклероза у пациентов с СГХС приводит к раннему дебюту ССЗ атеросклеротического генеза, чаще всего — ИБС. Длительное бессимптомное течение заболевания диктует необходимость опираться в первую очередь на лабораторные показатели и семейный анамнез при выявлении новых случаев СГХС для своевременного старта терапии в зоне первичной профилактики.
Для клинической диагностики заболевания целесообразно использование специализированных критериев, разработанных для взрослых и детей с геСГХС и для пациентов с гоСГСХ. Крайне важно проведение дообследования с целью исключения вторичных дислипидемий и их вклада в повышенные значения ХС ЛНП у лиц с подозрением на СГХС.
Диагностические критерии геСГХС
Ø Для диагностики геСГХС у взрослых пациентов 18 лет и старше рекомендовано использовать диагностические критерии Dutch Lipid Clinic Network (DLCN) — шкалы Голландских липидных клиник (Приложение Г1) [50, 235].
ЕОК/ЕОА I С (УУРС, УДД 5)
Диагноз устанавливается на основании суммы баллов, полученных в каждой группе. Внутри группы баллы не суммируются, учитывается только один признак, дающий максимальное количество баллов внутри каждой из групп.
В соответствии с набранной суммой баллов геСГХС может быть определенной, вероятной или возможной. При этом диагноз геСГХС выставляется только при наличии определенной или вероятной формы.
Для определения 95-го перцентиля уровня ХС ЛНП в зависимости от пола и возраста следует использовать значения, приведенные в Таблице П6/А3 (Популяционные показатели ХС ЛНП в зависимости от пола и возраста, по данным исследования ЭССЕ-РФ) [152].
Ø Для диагностики геСГХС у взрослых пациентов 18 лет и старше только в случаях отсутствия возможности определения ХС ЛНП, а также у детей рекомендовано использовать диагностические критерии Simon Broome Registry — Саймона Брума (Таблица 7/А3) [235, 237].
ЕОК/ЕОА I С (УУРС, УДД 5)
Ø Диагноз геСГХС выставляется в случае соответствия пациента критериям определенного или вероятного диагноза СГХС.
Диагностические критерии гоСГХС
Ø Для диагностики гоСГХС и у взрослых, и у детей рекомендовано использовать критерии, предложенные экспертами европейского общества по атеросклерозу (Таблица 8/А3) [222].
ЕОК/ЕОА I С (УУР А, УДД 3)
Согласно данным критериям, диагноз гоСГХС выставляется у детей и взрослых при наличии одного из двух условий.
Таким образом, диагностика СГХС возможна без выполнения молекулярно-генетического исследования по клиническим критериям, однако выявление конкретной мутации существенно облегчает постановку диагноза СГХС и последующее проведение каскадного скрининга, а также позволяет точнее стратифицировать сердечно-сосудистый риск [238].
Выполнение молекулярно-генетического исследования для верификации СГХС показано лицам с суммой баллов 6 и более согласно клиническим критериям DLCN или при постановке диагноза геСГХС согласно критериям Саймона Брума [239, 240].
ЕОК/ЕОА I С (УУРА, УДД 2)
Каскадный скрининг
Каскадный скрининг рекомендован к проведению родственникам первой, второй, и если возможно, третьей степени родства пациента с установленным диагнозом СГХС, а в случае, если у пробанда выявлен патогенный или вероятно-патогенный вариант нуклеотидной последовательности генов LDLR, APOB, PCSK9, — проведение генетического каскадного скрининга у родственников пробанда с целью определения у них наличия или отсутствия данного генетического варианта. При подтверждении наличия патогенных или вероятно-патогенных вариантов у родственника рекомендовано выставление диагноза СГХС, даже если уровень ХС ЛНП ниже диагностических значений согласно клиническим критериям [235, 237].
ЕОК/ЕОА I С (УУРС, УДД 5)
Лечение
Целевые уровни ХС ЛНП
У пациентов очень высокого риска с СГХС рекомендовано достижение целевого уровня ХС ЛНП <1,4 ммоль/л и снижение по меньшей мере на 50% от исходного для первичной профилактики ССО [37, 43, 50]
ЕОК/ЕОА IIaС (УУР С, УДД 5)
У пациентов очень высокого риска с СГХС и АССЗ рекомендовано достижение целевого уровня ХС ЛНП <1,4 ммоль/л и снижение по меньшей мере на 50% от исходного для вторичной профилактики ССО [37, 43]
ЕОК/ЕОА IС (УУР С, УДД5)
У пациентов высокого риска с СГХС рекомендовано достижение целевого уровня ХС ЛНП <1,8 ммоль/л и его снижение по меньшей мере на 50% от исходного [39, 42, 50].
ЕОК/ЕОА IA (УУР С, УДД 5)
Медикаментозная терапия
Гиполипидемическую терапию рекомендовано инициировать сразу после установления диагноза.
Всем пациентам с СГХС рекомендована стартовая терапия статином в дозах, необходимых для достижения целевого уровня ХС ЛНП [39, 69, 70].
ЕОК/ЕОА IA (УУР В, УДД 1)
Комментарии: дозы статинов для интенсивного и умеренного снижения ХС ЛНП приведены в таблице 4, приложение Б3. При непереносимости высокоинтенсивной терапии статинами следует рассмотреть снижение дозы препарата с последующей переоценкой переносимости.
Пациентам, не достигшим целевого уровня ХС ЛНП на фоне максимально переносимых доз статина, рекомендуется комбинированная терапия статином с эзетимибом предпочтительно в одной таблетке (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [38].
ЕОК/ЕОА IВ (УУР А, УДД 2)
У пациентов с очень высоким риском и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина в комбинации с эзетимибом рекомендовано добавить алирокумаб**(ЕОК/ЕОА I A), инклисиран**(ЕОК/ЕОА нет) или эволокумаб**(ЕОК/ЕОА I A) с целью вторичной профилактики ССЗ [40, 41, 67, 243].
(УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина рекомендован прием эзетимиба для достижения целевого уровня ХС ЛНП [71, 72].
ЕОК/ЕОА IIаC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статином, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП, рекомендовано добавление к терапии алирокумаба**(ЕОК/ЕОА IIbC), инклисирана**(ЕОК/ЕОА нет) или эволокумаба**(ЕОК/ЕОА IIbC) [71, 72, 73, 243]
ЕОК/ЕОА IIbC (УУР А, УДД 1)
Пациентам очень высокого риска с СГХС, если не достигнут целевой уровень ХС ЛНП на максимально переносимых дозах статина в комбинации с эзетимибом, рекомендовано добавление к терапии алирокумаба** (ЕОК/ЕОА IC), инклисирана** (ЕОК/ЕОА нет) или эволокумаба** (ЕОК/ЕОА IC) [9, 74, 75, 243, 247]
(УУР A, УДД 1)
3.5.2 ДЛП и сахарный диабет
У пациентов с СД 2-го типа и категории очень высокого риска рекомендовано снижение ХС ЛНП ≥50% и < 1,4 ммоль/л [39, 80, 81].
ЕОК/ЕОА IА (УУР В, УДД 1)
У пациентов с СД 2-го типа и категории высокого риска рекомендовано снижение ХС ЛНП ≥50% и < 1,8 ммоль/л [50, 80, 167].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациентам с СД 1-го типа и высоким/очень высоким риском рекомендована терапия статином [50, 82].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациентам с СД, которым начата терапия ингибитором ГМГ-КоА-редуктазы, но целевой уровень ХС ЛНП не достигнут, рекомендована интенсификация терапии [50].
ЕОК/ЕОА IIaС (УУР С, УДД 5)
Пациентам с СД2, на фоне терапии статином, но с уровнем ТГ ≥ 2,3 ммоль/л, рекомендовано добавление фенофибрата** к терапии статиом, предпочтительно в одной таблетке (зарегистрирован розувастатин+фенофибрат) [79, 167].
ЕОК/ЕОА IIa B (УУР В, УДД 2)
Комментарии: длительное наблюдение за больными СД на фоне комбинированной терапии фенофибратом** и статином позволило доказать состоятельность такой стратегии в плане долгосрочного прогноза — выявлено снижение общей и сердечно-сосудистой смертности. На протяжении всех трех временных срезов было получено достоверное снижение количества больших ССО на 34–36% [248].
Пациентам с СД, у которых после интенсификации терапии статином целевой уровень ХС ЛНП не достигнут, рекомендовано статину добавить эзетимиб [38, 83], в том числе статин с эзетимибом в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб).
ЕОК/ЕОА IА (УУР А, УДД 2)
Рекомендуется назначение других гиполипидемических средств, таких как ингибиторы PCSK9 — алирокумаба**, эволокумаба** или инклисирана** всем пациентам с СД2 высокого и очень высокого сердечно-сосудистого риска с недостаточным снижением ХС ЛНП на фоне приема максимально переносимых доз статинов и эзетимиба для достижения ЦУ ХС ЛНП и снижения риска ССО [50, 249].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациенткам с СД до наступления менопаузы и планирующим беременность или не принимающим контрацептивы не рекомендована терапия статином [8, 50].
ЕОК/ЕОА IIIC (УУР C, УДД 5)
Пациентам с СД 1-го типа и СД 2-го типа в возрасте ≤30 лет с повреждением органов-мишеней и/или ХС ЛНП>2,5 ммоль/л рекомендована терапия статином [8, 50, 81].
ЕОК/ЕОА IIbC (УУР C, УДД 5)
Комментарии. Согласно Российским рекомендациям по лечению сахарного диабета 2019 года (IX пересмотр), рекомендациям ESC по лечению дислипидемии 2019 г, терапию АССЗ в сочетании с СД 2-го типа следует начинать с ингибиторов натрий-зависимого переносчика глюкозы 2-го типа или с аналогов глюкагоноподобного пептида-1. У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендованы эмпаглифлозин** для снижения риска новых сердечно-сосудистых событий или дапаглифлозин** для снижения риска госпитализаций по причине сердечной недостаточности [87].
Для ведения пациентов с ССЗ с целью снижения сердечно-сосудистого риска рекомендуются:
Ингибиторы натрийзависимого переносчика глюкозы 2-го типа: эмпаглифлозин**, дапаглифлозин**. Аналоги глюкагоноподобного пептида 1 (аГПП-1): лираглутид, дулаглутид, семаглутид.
Бигуаниды: метформин** (как препарат второго ряда).
Ингибиторы натрийзависимого переносчика глюкозы 2-го типа
По итогам исследования EMPA-REG Outcome было на фоне эмпаглифлозина(**) продемонстрировано снижение частоты достижения первичной конечной точки на 14% (p=0,038), при этом результаты по каждому из компонентов комбинированной точки были различными: общая смертность снизилась на 32% (p<0,001), сердечно-сосудистая смертность — на 38% (p<0.0001) [84].
Аналоги ГПП-1. В 2016 г. опубликованы результаты исследования LEADER, посвященного эффективности и безопасности лираглутида. Данное многоцентровое двойное слепое плацебо-контролируемое исследование проводилось в 410 центрах 32 стран и включало 9340 пациентов, из которых 4668 были рандомизированы в группу лираглутида, 4672 — в группу плацебо. Частота сердечно-сосудистой смерти была ниже в группе лираглутида (4,7%), чем в группе плацебо (6.0%, ОР 0,78, ДИ 0,66–0,93, p=0,007), общей смертности — 8,2% и 9,6%, соответственно, (ОР 0,85, ДИ 0,74-0,97, p=0,02). Было продемонстрировано снижение риска достижения первичной комбинированной тройной конечной точки на 13%, сердечно-сосудистой смерти — на 22%, композитной конечной точки (коронарная реваскуляризация, нестабильная стенокардия, госпитализация по поводу сердечной недостаточности) — на 20%, риска смерти от всех причин — на 15%, увеличение времени до наступления микрососудистого события (нефропатии) — на 22% [85]. Влияние терапии семаглутидом на сердечно-сосудистые исходы изучалось в исследовании SUSTAIN-6. 3297 пациентов с СД 2-го типа и высоким сердечно-сосудистым риском были рандомизированы в группы семаглутида (0,5 или 1 мг 1 раз в неделю) или плацебо в дополнение к стандартной противодиабетической и сердечно-сосудистой терапии. У 83% включенных пациентов было установлено наличие сердечно-сосудистых заболеваний и/или ХБП III–V стадии. Срок наблюдения составил 104 недели. Выявлено уменьшение риска комбинированной тройной конечной точки на фоне приема семаглутида на 26%, инсультов на 38%, при этом препарат не уменьшал частоты общей и сердечно-сосудистой смертности, нефатального ИМ и госпитализации по поводу сердечной недостаточности [86].
Для снижения количества ССО и улучшения прогноза больных СД 2-го типа рекомендуется отдавать приоритет препаратам с подтвержденными сердечно-сосудистыми преимуществами. С учетом имеющихся доказательств благоприятного влияния эмпаглифлозина** и лираглутида на ССО, данные препараты следует рассматривать, наряду с метформином**, в качестве первой линии терапии больных СД 2-го типа высокого и очень высокого риска. При наличии ХСН предпочтение отдается эмпаглифлозину**.
У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендованы эмпаглифлозин** или дапаглифлозин** для снижения риска новых сердечно-сосудистых событий [87].
ЕОК/ЕОА IА (УУР А, УДД 1)
У пациентов с СД 2-го типа и ССЗ в качестве гипогликемической терапии рекомендован эмпаглифлозин** для снижения риска смерти [88].
ЕОК/ЕОА IB (УУР A, УДД 1)
У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендован лираглутид для снижения риска как новых ССО, так и риска смерти [85].
ЕОК/ЕОА IB (УУР А, УДД 2)
У пациентов с СД 2-го типа без ССЗ рекомендован метформин** для снижения сердечно-сосудистого риска [89].
ЕОК/ЕОА IIaС (УУР А, УДД 2)
3.5.3 ДЛП и хроническая болезнь почек
На начальных стадиях ХБП повышены уровни ТГ, а уровни ХС ЛВП снижены. Для ХБП характерен увеличение уровня Лп(a). Пациенты с ХБП 3–5-й стадии имеют высокий или очень высокий сердечно-сосудистый риск [90, 91].
У диализ-независимых пациентов ХБП 3–5-й стадии рекомендуется применение статина или комбинации статин / эзетимиб [92, 93, 94, 95].
ЕОК/ЕОА IА (УУР В, УДД 1)
У пациентов с ХБП 5-й стадии с атеросклеротическим ССЗ, уже получающих статин, эзетимиб, или комбинацию статин / эзетимиб, при начале диализа, рекомендовано продолжить исходную гиполипидемическую терапию [92, 93, 96, 97, 98].
ЕОК/ЕОА IIaC IА (УУР В, УДД 1)
Пациентам с ХБП 1-4 стадии и уровнем ТГ >1,7 ммоль/л рекомендовано рассмотреть назначение омега-3 ПНЖК с целью снижения уровня ТГ [168-170].
ЕОК/ЕОА IIaВ (УУР А, УДД 2)
У пациентов c диализ-зависимой ХБП и не имеющих атеросклеротических ССЗ, не рекомендуется начало терапии статином [99, 100]
ЕОК/ЕОА IIIA (УУР А, УДД 2)
3.5.4 ДЛП и ОКС/чрескожные коронарные вмешательства
У всех пациентов с ОКС при отсутствии противопоказаний или установленной непереносимости рекомендовано начать или продолжить терапию статином в высоких дозах как можно раньше, вне зависимости от исходных значений ХС ЛНП [101, 102, 103].
ЕОК/ЕОА IА (УУР А, УДД 2)
Всем пациентам через 4–6 недель после ОКС рекомендовано оценить достижение целевых показателей ХС ЛНП (снижение на 50% от исходного и <1,4 ммоль/л), безопасность терапии статином и, при необходимости, скорректировать дозы препаратов [8, 50, 101, 102, 171].
ЕОК/ЕОА IIaC (УУР А, УДД 1)
Пациентам, через 4–6 недель после ОКС не достигшим целевых уровней ХС ЛНП на фоне максимально переносимых доз статином, рекомендована комбинация статина с эзетимибом [38], в том числе статин с эзетимибом в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб).
ЕОК/ЕОА IА (УУР А, УДД 2)
Пациентам после ОКС при недостижении целевых уровней ХС ЛНП через 4–6 недель на фоне максимально переносимых доз статином с и без эзетимиба рекомендовано присоединение алирокумаба** или эволокумаба** [40, 41, 250–252].
ЕОК/ЕОА IВ (УУР А, УДД 2)
Пациентам с противопоказаниями к терапии статином или подтвержденной непереносимостью статинов рекомендована терапия эзетимибом [71, 72].
ЕОК/ЕОА IIaC (УУР А, УДД 2)
У пациентов с ОКС, которые при поступлении имеют уровень ХС ЛНП выше целевого, несмотря на терапию максимально переносимыми дозами статина и эзетимибом, рекомендовано раннее назначение (во время госпитализации в связи с коронарным событием) алирокумаба** или эволокумаба** [104, 105].
ЕОК/ЕОА IIaC (УУР А, УДД 2)
Комментарий: если на фоне терапии статинами в максимально переносимых дозах уровень ХС ЛНП остается значительно повышенным (> 2,5 ммоль/л), можно рассмотреть блокаторы PCSK9 без предварительного применения эзетимиба.
3.5.5 ДЛП у пожилых
У пожилых лиц с АССЗ рекомендована терапия статином так же, как и у более молодых пациентов [106].
ЕОК/ЕОА IА (УУР А, УДД 1)
У пожилых лиц при наличии высокого и очень высокого риска для первичной профилактики рекомендована терапия статином [106].
ЕОК/ЕОА IА (УУР А, УДД 1)
Пациентам старше 75 лет при наличии высокого и очень высокого риска для первичной профилактики рекомендована терапия статином [106].
ЕОК/ЕОА IIbВ (УУР А, УДД 1)
У пожилых пациентов при наличии потенциального риска лекарственного взаимодействия рекомендуется назначать статин в низкой дозе с последующей титрацией до достижения целевого уровня ХС ЛНП [107, 108, 109]. При необходимости достижения более низкого целевого уровня ХС ЛНП у пациентов очень высокого и экстремального риска рассмотреть возможность комбинированной терапии низкими дозами статина и эзетимибом [50].
ЕОК/ЕОА IС (УУР С, УДД 5)
3.5.6 ДЛП у женщин, при беременности и лактации
Назначение гиполипидемических средств не рекомендуется при планировании беременности, во время беременности и в период грудного вскармливания. Пациенткам с тяжелой СГХС возможно назначение секвестрантов желчных кислот (не адсорбируемых) и/или применение
ЕОК/ЕОА нет (УУР С, УДД 5)
У женщин группы высокого риска вне беременности и вне периода грудного вскармливания рекомендуется назначение статинов для первичной профилактики ИБС [39, 42].
ЕОК/ЕОА нет (УУР С, УДД 1)
Женщинам с целью вторичной профилактики вне беременности и вне периода грудного вскармливания рекомендованы статины по тем же показаниям и с теми же целевыми уровнями ХС ЛНП, что и мужчинам [39, 42].
ЕОК/ЕОА нет (УУР С, УДД 1)
Комментарии: использование современных низкодозированных комбинированных гормональных пероральных контрацептивов у женщин в репродуктивном возрасте не приводит к увеличению риска острых коронарных событий [110]. Их применение возможно у женщин после оценки липидных показателей, при нормальном уровне холестерина. При наличии ГХС (уровень ХС ЛНП выше 4 ммоль/л) и/или множественных факторах сердечно-сосудистого риска и/или высоком риске тромбоэмболических осложнений следует рассмотреть альтернативные гормональные пероральные контрацептивы [111]. Заместительная терапия эстрогенами, несмотря на положительное влияние на показатели липидного профиля, не продемонстрировала возможности снижения сердечно-сосудистого риска и не может быть рекомендована для сердечно-сосудистой профилактики у женщин [112].
Прием липидснижающих препаратов при подготовке к беременности, во время беременности и лактации запрещен. У пациенток с тяжелой СГХС во время беременности/лактации следует использовать плазмаферез, плазмосорбцию.
Женщины репродуктивного возраста:
- во время лечения должны пользоваться адекватными методами контрацепции;
- женщины с СГХС должны получить консультацию перед беременностью и инструкции по отмене гиполипидемических средств не позднее, чем за 4 недели до прекращения предохранения от беременности и не должны принимать эти препараты до окончания грудного вскармливания;
- в случае незапланированной беременности женщина с СГХС должна незамедлительно прекратить прием любых гиполипидемических средств и срочно проконсультироваться со своим лечащим врачом;
- в связи с результатами нескольких пилотных клинических исследований о негативном влиянии статинов на фертильную функцию у мужчин можно рекомендовать пациенту с СГХС воздержаться от приема статинов на период планируемого зачатия.
3.5.7 ДЛП и цереброваскулярная болезнь
Пациентам с перенесенным ишемическим инсультом рекомендована интенсивная липидснижающая терапия для достижения целевого уровня ХС ЛНП менее 1,4 ммоль/л [38, 50, 113, 114, 203, 204, 205].
ЕОК/ЕОА IA (УУР В, УДД 1)
Комментарий: дополнительные преимущества от снижения уровня ХС ЛНП ниже 1,8 ммоль/л были продемонстрированы в исследовании TST (Treat Stroke to Target): у пациентов с ранее перенесенным ИИ выбор такой тактики лечения позволял уменьшать риск развития повторных сердечно-сосудистых событий событий на 22%. Результаты исследования IMPOVE-IT и двух метаанализов показали дополнительное снижение риска развития СС событий при снижении уровня ХС ЛНП<1,4%, позволив определить формулу «чем ниже ХС ЛНП, тем ниже риск CC событий».
Рекомендуется большинству пациентам с ИИ или ТИА назначение высокоинтенсивной терапии статинами в максимально переносимых дозах для достижения целевого уровня ХС ЛНП [76, 204, 207].
ЕОК/ЕОА I A (УУР В, УДД 1)
Комментарий: под высокоинтенсивной терапией статинами подразумевается назначение аторвастатина** в дозах 40–80 мг/сут или розувастатина в дозах 20–40 мг/сут. При повышении уровня ТГ выше целевого значения (2,3 ммоль/л) назначение статинов также является терапией первой линии.
Рекомендуется пациентам старше 75 лет, перенесшим ИИ или ТИА, начинать умеренно-интенсивную терапию статинами [207, 208, 209].
ЕОК/ЕОА I A (УУР А, УДД 1)
Комментарий: под умеренно интенсивной терапией статинами подразумевают назначение аторвастатина** 10–20 мг/сут, розувастатина 5–10 мг/сут, питавастатина 4 мг.
Рекомендуется пациентам старше 75 лет с ИИ или ТИА, ранее получавшим высокоинтенсивную терапию статинами, продолжить ее, не изменяя режим интенсивности [210, 211].
ЕОК/ЕОА нет (УУР С, УДД 4)
Рекомендуется пациентам с ИИ или ТИА, не достигшим целевых значений ХС ЛНП на фоне терапии максимально переносимыми дозами статинами в течение 4-12 недель, добавление к терапии эзетимиба [203, 212].
ЕОК/ЕОА 1 А (УУР В, УДД 4)
Рекомендуется пациентам с ИИ или ТИА и непереносимостью статинаов назначение эзетимиба с целью достижения целевого значения ХС ЛНП [72, 73].
ЕОК/ЕОА I B (УУР С, УДД 5)
Комментарий: под непереносимостью статинов понимается развитие побочных эффектов после отмены и повторного рестарта терапии, в том числе с назначением другого статина и/или в сниженной дозе.
Рекомендуется пациентам с ИИ или ТИА добавление к проводимой терапии статинами и эзетимибом алирокумаба**, инклисирана** или эволокумаба**, с целью достижения целевого значения ХС ЛНП [40, 206, 250-252].
ЕОК/ЕОА 1 А (УУР A, УДД 1)
Рекомендуется пациентам с ИИ и ТИА оценка эффективности проводимой гиполипидемической терапии, ее безопасности и приверженности пациента к проводимому лечению (включая изменение образа жизни) [213, 214].
ЕОК/ЕОА нет (УУР С, УДД 4)
Комментарий: целесообразно проводить оценку лабораторных параметров (измерение уровня липидов натощак, АЛТ, АСТ) спустя 4–12 недель после начала приема статинов или увеличения их дозы. После достижения целевого уровня ХС ЛНП и ТГ (целевое значение для ТГ — менее 2,3 ммоль/л) рекомендован ежегодный лабораторный контроль (при отсутствии проблем с приверженностью пациента или других конкретных причин более частого мониторинга). Рутинный контроль печеночных ферментов во время лечения статинами не рекомендуется, за исключением наличия симптомов, свидетельствующих о патологии печени.
3.5.8 ДЛП и клапанные пороки сердца
Пациентам с аортальным стенозом без сопутствующей ИБС не рекомендовано начинать гиполипидемическую терапию с целью замедления прогрессирования аортального стеноза в отсутствие других показаний к такому лечению [115, 116, 117, 118].
ЕОК/ЕОА IIIА (УУР А, УДД 2)
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Для всех пациентов с нарушениями липидного обмена рекомендована разработка индивидуального плана реабилитационных мероприятий, включающая в себя рекомендации по достижению ЦУ ХС ЛНП, повышению приверженности к лечению, питанию, физической активности, контролю веса [108].
ЕОК/ЕОА нет (УУР B, УДД 2)
С целью снижения риска ССО всем пациентам с ДЛП рекомендованы по крайней мере 3,5–7 ч умеренной физической активности в неделю или 30–60 мин большинство дней в неделю [119, 120, 121].
ЕОК/ЕОА нет (УУР А, УДД 1)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Курение
Рекомендовано прекратить курение в любой форме [173]
ЕОК/ЕОА I A (УУР В, УДД 2)
Курильщикам рекомендуется назначение никотинзаместительной терапии или варениклина [174,175]
ЕОК/ЕОА IIa A (УУР A, УДД 1)
Отказ от курения рекомендован вне зависимости от набора веса, так как прибавка в весе не уменьшает пользы прекращения курения для АССЗ [176].
ЕОК/ЕОА I B (УУР B, УДД 3)
Комментарии: несмотря на то, что в сигаретах по типу «нагревание без горения» содержится меньше токсичных веществ, чем в обычных сигаретах, они содержат табак, поэтому их использование не рекомендуется. Долгосрочное влияние электронных сигарет на сердечно-сосудистую и дыхательную системы требует дополнительных исследований [177].
Физическая активность
Взрослым любого возраста для снижения общей смертности, СС заболеваемости и смертности рекомендовано стремиться по крайней мере к 150–300 мин аэробной физической активности умеренной интенсивности в неделю или 75–150 мин интенсивных нагрузок или эквиваленту из их сочетания [178]
ЕОК/ЕОА I A (УУР С, УДД 5)
Взрослым, которые не могут выполнять 150 минут физической активности средней интенсивности в неделю, рекомендуется оставаться настолько активными, насколько позволяют их способности и состояние здоровья [179]
ЕОК/ЕОА I A (УУР В, УДД 2)
Питание
Для снижения риска ССЗ рекомендовано использование cредиземноморской диеты и ее аналогов [46], замена насыщенных жиров на ненасыщенные [180] и ограничение употребления соли [181].
ЕОК/ЕОА I A (УУР B, УДД 1)
Рекомендовано употребление большего количества растительной пищи, богатой клетчаткой, включая цельнозерновые, фрукты, овощи, бобовые и орехи [182], рыбы, преимущественно жирных сортов, по крайней мере 1 раз в неделю и ограничение обработанного мяса [183] Рекомендуется ограничить потребление простых углеводов, в частности сахаросодержащих напитков, максимум до 10% от потребляемой энергии [184].
ЕОК/ЕОА I B (УУР С, УДД 5)
Рекомендовано ограничение употребления алкоголя до 100 г (чистого алкоголя) в неделю [185].
ЕОК/ЕОА I B (УУР B, УДД 2)
Ожирение
Людям с избыточным весом и лицам c ожирением рекомендуется снижение веса для уменьшения АД, дислипидемии и риска СД 2-го типа, и, таким образом, улучшения профиля ССР [186].
ЕОК/ЕОА I A (УУР А, УДД 1)
Следует рассмотреть возможность бариартрической хирургии при морбидном ожирении и отсутствии эффекта от немедикаментозных мер [187].
ЕОК/ЕОА IIa B (УУР А, УДД 1)
Сахарный диабет
Для скрининга сахарного диабета у лиц с АССЗ или без нее рекомендуется оценить HbA1c (который можно брать не натощак) или уровень глюкозы в крови натощак [188].
ЕОК/ЕОА IIa A (УУР С, УДД 5)
Рекомендуемый уровень HbA1c для снижения ССР и микроваскулярных осложнений СД у большинства пациентов 1-го и 2-го типов СД равен <7.0% [189].
ЕОК/ЕОА I A (УУР А, УДД 2)
Артериальное давление
Рекомендуется достижение уровня АД <140/90 мм рт. ст. у всех пациентов, индивидуальные целевые уровни зависят от возраста и наличия сопутствующей патологии [190].
ЕОК/ЕОА I A (УУР А, УДД 1)
Рекомендуется для пациентов 18–69 лет поддерживать САД в интервале 120–130 мм рт. ст. [191]. У пациентов ≥70 лет, получающих терапию, рекомендовано целевое значение САД <140 мм рт. ст. со снижением до 130 мм рт. ст. при удовлетворительной переносимости [192]. У всех пациентов, получающих терапию, рекомендовано снижение ДАД <80 мм рт. ст. [193]
ЕОК/ЕОА I A (УУР А, УДД 1)
Антитромботическая терапия
Антитромботическая терапия рекомендована для вторичной профилактики ССЗ [194].
ЕОК/ЕОА I A (УУР А, УДД 1)
Профилактика при различных клинических состояниях
Пациентам с онкологическими заболеваниями рекомендуется выявление и контроль факторов риска АССЗ [196].
ЕОК/ЕОА I С (УУР С, УДД 4)
Всем пациентам с ХОБЛ рекомендовано обследование на АССЗ и факторы риска АССЗ [197].
ЕОК/ЕОА I С (УУР В, УДД 2)
У взрослых с ревматоидным артритом рекомендуется умножение имеющегося риска сердечно-сосудистых осложнений на 1,5 [198].
ЕОК/ЕОА IIa B (УУР B, УДД 3)
У пациентов с АССЗ, ожирением и гипертонической болезнью, рекомендуется регулярный скрининг на полноценность сна (например, с помощью вопроса: «Как часто вас беспокоили проблемы с засыпанием, сонливостью или слишком долгого сна?») [199].
ЕОК/ЕОА I С (УУР С, УДД 5)
У мужчин с эректильной дисфункцией следует оценивать ССР [200, 201].
ЕОК/ЕОА IIa С (УУР В, УДД 3)
Динамическое наблюдение — чрезвычайно важная составляющая медицинской помощи пациентам с ДЛП, задачами которого являются: поддержание ЦУ ЛНП, ТГ, контроль выполнения врачебных рекомендаций по коррекции ФР, контроль за соблюдением режима приема медикаментозной терапии. Все рекомендации, даваемые пациенту, должны быть ясными, четкими и соответствовать его интеллектуальному уровню. С целью обеспечить осознанное участие пациента в лечебно-профилактическом процессе и повысить эффективность лечения целесообразно для ряда пациентов, для которых устных рекомендаций недостаточно, продублировать их в письменном виде.
После старта или изменения дозировок гиполипидемической терапии необходим контроль липидов сыворотки через 8 (±4) недель до достижения целевого уровня липидов, далее ежегодно (если нет проблем с приверженностью или других причин для более частого контроля). Контроль АЛТ, АСТ, билирубин, КФК проводится через 4–6 недель после изменения гиполипидемической терапии, после достижения целевого уровня липидов рутинный контроль не требуется, только при наличии жалоб, характерных для поражения печени или мышц.
Согласно рекомендациям по диспансерному наблюдению пациентов с АГ, стабильной ИБС, перенесенным ОНМК в анамнезе требуется контроль уровня ХС ЛНП и АД дважды в год. При гиперхолестеринемии выше 8,0 ммоль/л рекомендован контроль ХС ЛНП не реже 1 раза в год. У пациентов со стенозом сонной артерией более 50% требуется контроль ХС ЛНП дважды в год [202].
Регулярный мониторинг HbA1c и/или уровня глюкозы плазмы должен проводиться пациентам с высоким риском развития СД и при высокодозной терапии статинами.
С целью своевременной модификации сердечно-сосудистого риска у больных с ДЛП рекомендуется динамическое наблюдение за выраженностью атеросклеротического процесса. Согласно консенсусу российких экспертов [256], при отсутствии АСБ в сонных и бедренных артериях пациенту должно быть рекомендовано повторное УЗИ через 3 года. При наличии АСБ высотой <1,5 мм и максимальном стенозе <25% в сонных артериях, а также при максимальном стенозе <25% в бедренных артериях повторное УЗИ артерий следует провести через 2 года. При АСБ высотой ≥1,5 мм и максимальном стенозе <50% в сонных артериях, а также при максимальном стенозе 25-49% в бедренных артериях повторное УЗИ рекомендуется проводить через 1 год, при отсутствии динамики атеросклеротического процесса частоту исследований можно сократить до 1 исследования в 2–3 года. При выявлении максимального стеноза ≥50% в сонных артериях следует ежегодно проводить стандартное дуплексное сканирование экстракраниального отдела брахиоцефальных артерий, частоту которого можно сократить до 1 раза в 2 года при отсутствии динамики атеросклеротического процесса.
6. Организация оказания медицинской помощи
Показания для плановой госпитализации: не предусмотрены
Показания для экстренной госпитализации: не предусмотрены
Показания к выписке пациента из стационара: не предусмотрены
Иные организационные технологии
При анализе работы медицинской организации с пациентами с нарушениями липидного обмена целесообразно анализировать следующие показатели:
процент пациентов высокого риска, достигших ЦУ ХС ЛНП менее 1,8 ммоль/л через 8 и 52 недели наблюдения;
процент пациентов, получающих комбинированную гиполипидемическую терапию.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Достижение и удержание ЦУ ХС ЛНП, ТГ является ключевым фактором, влияющим на прогноз и улучшающим сердечно-сосудистые исходы у пациентов как с ССЗ, так и СД.
Важными целями при лечении ДЛП являются:
- максимальное снижение риска развития ССО и смертельных исходов;
- коррекция всех модифицируемых ФР (курение, избыточная масса тела, ожирение, гипергликемия, АГ).
Критерии оценки качества медицинской помощи
№ | Критерий качества | EОК Класс и уровень | УУР | УДД | Да/ нет |
|---|---|---|---|---|---|
1 | У лиц старше 40 лет выполнено лабораторное исследование уровня холестерина и ХС ЛНП | IС
| С | 1 | Да/нет |
2 | У пациентов при высоких триглицеридах, СД, ожирении, метаболическом синдроме или очень низком ХС ЛНП проведена лабораторная оценка ХС неЛВП | IС
| С | 1 | Да/нет |
3 | У всех бессимптомных взрослых старше 40 лет, без ССЗ, СД, ХБП, СГХС, с ХС ЛНП < 4,9 ммоль/л выполнена оценка общего риска с использованием шкалы SCORE2 | IС
| С | 5 | Да/нет |
4 | Выполнен сбор анамнеза о наличии у пациента ИБС, АГ, СД, атеросклероза периферических артерий, СГХС, МС, ожирения, хронических заболеваний почек | IС
| С | 5 | Да/нет |
5 | Проведено физикальное обследование на предмет выявления кожных и сухожильных ксантом, ксантелазм и липоидной дуги роговицы | IС
| С | 5 | Да/нет |
6 | Ультразвуковое исследование сонных и бедренных артерий с целью выявления АСБ | IIaB | А | 2 | Да/Нет |
7
В качестве стартовой терапии пациенту с установленным нарушением липидного обмена назначена терапия статином в дозовом режиме, достаточном для достижения целевого уровня ХС ЛНП
IA
А
1
Да/нет
8
При отсутствии целевого уровня ХС ЛНП на фоне максимально переносимых доз статином через 8±4 нед. к терапии добавлен эзетимиб или алирокумаб**/эволокумаб**/
инклисиран** (у пациентов очень высокого риска)
IВ
В
2
Да/нет
9
При отсутствии целевого уровня ХС ЛНП на фоне максимально переносимых доз статином и эзетимиба через 8±4 нед. к терапии добавлен алирокумаб**/эволокумаб**/инклисиран**
IA
A
1
Да/нет
10
Достигнут целевой уровень ХС ЛНП < 1,8 ммоль/л (или его снижение по меньшей мере на 50% от исходного) у пациентов высокого риска через 8±4 нед.терапии
IA
А
1
Да/нет
11
Достигнут целевой уровень ХС ЛНП < 1,4 ммоль/л (или снижение по меньшей мере на 50% от исходного) у пациентов очень высокого риска (кроме пациентов с СГХС) через 8±4 нед. терапии
IС
С
1
Да/не
Список литературы
Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn"t. BMJ 1996, January; 312 (7023): 71–72.
Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации».
Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М, 2009. 316 с.
Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТР 52379–2005. Надлежащая клиническая практика. Москва, 2005.
Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств».
Малая медицинская энциклопедия. М.: Медицинская энциклопедия, 1991—96 гг. [Электронный ресурс]. Режим доступа:http://dic.academic.ru/dic.nsf/enc_medicine/28878/Синдром.
Андреева Н. С, Реброва О. Ю, Зорин Н. А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012. №. 4. С. 10–24.
Кухарчук В. В. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VII пересмотр //Атеросклероз и дислипидемии. 2020. Т. 11. №. 1 (38).
Nordestgaard BG et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. //European heart journal. 2013. Vol. 34. №. 45. P. 3478–3490.
Yao Z. Human apolipoprotein C-III — a new intrahepatic protein factor promoting assembly and secretion of very low density lipoproteins. Cardiovasc Hematol Disord Drug Targets. 2012;12(2):133–140.
Sacks FM, Alaupovic P, Moye LA, et al. VLDL, apolipoproteins B, CIII, and E, and risk of recurrent coronary events in the Cholesterol and Recurrent Events (CARE) trial. Circulation. 2000;102:1886–1892.
Hegele RA, Ginsberg HN, Chapman MJ et al. The polygenic nature of hypertriglyceridaemia: implications for definition, diagnosis, and management. Lancet Diabetes Endocrinol. 2014. 2(8): 655–666. doi:10.1016/S2213-8587(13)70191-8
Метельская В. А. и др. Анализ распространенности показателей, характеризующих атерогенность спектра липопротеидов, у жителей Российской Федерации (по данным исследования ЭССЕ-РФ) //Профилактическая медицина. 2016. Т. 19. №. 1. P. 15–23.
Caggiula AW et al. The multiple risk factor intervention trial (MRFIT): IV. Intervention on blood lipids //Preventive Medicine. 1981. Vol. 10. №. 4. P. 443–475.
Castelli WP. Epidemiology of triglycerides: A view from Framingham. Am J Cardiol. 1992. 70(19): H3–H9. doi:10.1016/0002-9149(92)91083-g
Carey VJ et al. Contribution of high plasma triglycerides and low high-density lipoprotein cholesterol to residual risk of coronary heart disease after establishment of low-density lipoprotein cholesterol control //The American journal of cardiology. 2010. Vol. 106. №. 6. P. 757–763.
Barter P, Gotto AM, LaRosa JC et al. HDL Cholesterol, Very Low Levels of LDL Cholesterol, and Cardiovascular Events. New England Journal of Medicine. 2007. 357(13): 1301–1310. doi:10.1056/nejmoa064278
Aguiar C et al. A review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidaemia: A report from an expert consensus meeting on the role of fenofibrate–statin combination therapy //Atherosclerosis Supplements. 2015. Vol. 19. P. 1–12.
Prospective Studies Collaboration et al. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55 000 vascular deaths //The Lancet. 2007. Vol. 370. №. 9602. P. 1.
Catapano AL et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. // Eur Heart J. 2016. Vol. 37. №. 39. P. 2999–3058.
Holewijn S et al. Apolipoprotein B, non-HDL cholesterol and LDL cholesterol for identifying individuals at increased cardiovascular risk // Journal of internal medicine. 2010. Vol. 268. №. 6. P. 567–577.
Boekholdt SM et al. Association of LDL cholesterol, non–HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins: a meta-analysis // Jama. 2012. Vol. 307. №. 12. P. 1302–1309.
Langsted A, Nordestgaard BG. Nonfasting versus fasting lipid profile for cardiovascular risk prediction. Pathology. 2019. 51(2): 131–141. doi:10.1016/j.pathol.2018.09.062
Farukhi Z, Mora S. The Future of Low-Density Lipoprotein Cholesterol in an Era of Nonfasting Lipid Testing and Potent Low-Density Lipoprotein Lowering. Circulation. 2018. 137(1): 20–23. doi:10.1161/CIRCULATIONAHA.117.031857
Meijboom WB, Meijs MF, Schuijf JD et al. Diagnostic accuracy of 64-slice computed tomography coronary angiography: a prospective, multicenter, multivendor study. J Am Coll Cardiol. 2008. 52(25): 2135–2144. doi:10.1016/j.jacc.2008.08.058
Agatston AS, Janowitz WR, Hildner FJ et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990. 15(4): 827–832. doi:10.1016/0735-1097(90)90282-t
Serrano CV, de Mattos FR, Pitta FG et al. Association between Neutrophil-Lymphocyte and Platelet-Lymphocyte Ratios and Coronary Artery Calcification Score among Asymptomatic Patients: Data from a Cross-Sectional Study. Mediators Inflamm. 2019. 2019: 1–8. doi:10.1155/2019/6513847
Piepoli MF et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice, (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR) // European heart journal. 2016. Vol. 37. №. 29. P. 231.
Mortensen MB, Falk E, Li D et al. Statin Trials, Cardiovascular Events, and Coronary Artery Calcification. JACC: Cardiovascular Imaging. 2018. 11(2): 221–230. doi:10.1016/j.jcmg.2017.01.029
McDermott MM, Kramer CM, Tian L et al. Plaque Composition in the Proximal Superficial Femoral Artery and Peripheral Artery Disease Events. JACC: Cardiovascular Imaging. 2017. 10(9): 1003–1012. doi:10.1016/j.jcmg.2016.08.012
Sillesen H, Sartori S, Sandholt B et al. Carotid plaque thickness and carotid plaque burden predict future cardiovascular events in asymptomatic adult Americans. European Heart Journal — Cardiovascular Imaging. 2017. 19(9): 1042–1050. doi:10.1093/ehj
Perrone-Filardi P, Achenbach S, Mohlenkamp S et al. Cardiac computed tomography and myocardial perfusion scintigraphy for risk stratification in asymptomatic individuals without known cardiovascular disease:, a position statement of the Working Group on Nuclear Cardiology and Cardiac CT of the European Society of Cardiology //European heart journal. 2011. Vol. 32. №. 16. P. 1986–1993.
Den Ruijter HM, Peters SAE, Anderson TJ et al. Common Carotid Intima-Media Thickness Measurements in Cardiovascular Risk Prediction. JAMA. 2012. 308(8): 796–803. doi:10.1001/jama.2012.9630
Inaba Y, Chen JA, Bergmann SR. Carotid plaque, compared with carotid intima-media thickness, more accurately predicts coronary artery disease events: a meta-analysis // Atherosclerosis. 2012. Vol. 220. №. 1. P. 128–133.
Lorenz MW et al. Carotid intima-media thickness progression to predict cardiovascular events in the general population (the PROG-IMT collaborative project): a meta-analysis of individual participant data // The Lancet. 2012. Vol. 379. №. 9831. P. 2053–2062.
Pletcher MJ et al. Using the coronary artery calcium score to predict coronary heart disease events: a systematic review and meta-analysis // Archives of internal medicine. 2004. Vol. 164. №. 12. P. 1285–1292.
Akioyamen LE et al. Risk factors for cardiovascular disease in heterozygous familial hypercholesterolemia: A systematic review and meta-analysis // Journal of clinical lipidology. 2019. Vol. 13. №. 1. P. 15–30.
Cannon C. P et al. Ezetimibe added to statin therapy after acute coronary syndromes // New England Journal of Medicine. 2015. Vol. 372. №. 25. P. 2387–2397.
Trialists CT et al. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174 000 participants in 27 randomised trials // The Lancet. 2015. Vol. 385. №. 9976. P. 1397–1405.
Sabatine MS et al. Evolocumab and clinical outcomes in patients with cardiovascular disease // New England Journal of Medicine. 2017. Vol. 376. №. 18. P. 1713–1722.
Jukema JW et al. ODYSSEY OUTCOMES Committees and Investigators. Alirocumab in patients with polyvascular disease and recent acute coronary syndrome: ODYSSEY OUTCOMES trial // J Am Coll Cardiol. 2019. Vol. 74. №. 9. P. 1167–1176.
Trialists CT et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials // The Lancet. 2012. Vol. 380. №. 9841. P. 581–590.
Santos RD et al. Defining severe familial hypercholesterolaemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel // The lancet Diabetes & endocrinology. 2016. Vol. 4. №. 10. P. 850–861.
Eckel RH, Jakicic JM, Ard JD et al. 2013 AHA/ACC Guideline on Lifestyle Management to Reduce Cardiovascular Risk. Circulation. 2013. 129(25 suppl 2): S76–S99. doi:10.1161/01.cir.0000437740.48606.d1
de Lorgeril M, Salen P, Martin J-L et al. Mediterranean Diet, Traditional Risk Factors, and the Rate of Cardiovascular Complications After Myocardial Infarction. Circulation. 1999. 99(6): 779–785. doi:10.1161/01.cir.99.6.779.
Estruch R, Ros E, Salas-Salvado J, et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med. 2018. 378(25): e34. doi:10.1056/NEJMoa1800389.
Mozaffarian D, Lemaitre RN, King IB et al. Plasma Phospholipid Long-Chain ω-3 Fatty Acids and Total and Cause-Specific Mortality in Older Adults. Ann Intern Med. 2013. 158(7): 515–525. doi:10.7326/0003-4819-158-7-201304020-00003
Lu Z, Kou W, Du B, et al. Effect of Xuezhikang, an Extract From Red Yeast Chinese Rice, on Coronary Events in a Chinese Population With Previous Myocardial Infarction. Am J Cardiol. 2008. 101(12): 1689–1693. doi:10.1016/j.amjcard.2008.02.056
Li Y, Jiang L, Jia Z, et al. A Meta-Analysis of Red Yeast Rice: An Effective and Relatively Safe Alternative Approach for Dyslipidemia. PLoS One. 2014. 9(6): e98611. doi:10.1371/journal.pone.0098611
Mach F, Baigent C, Catapano A.L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2019. doi:10.1093/eurheartj/ehz455
Taylor F, Huffman MD, Macedo AF et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database of Systematic Reviews. 2013. doi:10.1002/14651858.cd004816.pub5
Sever PS, Dahlöf B, Poulter NR et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial, Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. The Lancet. 2003. 361(9364): 1149–1158. doi:10.1016/s0140-6736(03)12948-0
Colhoun HM, Betteridge DJ, Durrington PN et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. The Lancet, 2004. 364(9435): 685–696. doi:10.1016/s0140-6736(04)16895-5
Schwartz GG. Effects of Atorvastatin on Early Recurrent Ischemic Events in Acute Coronary Syndromes «SUBTITLE»The MIRACL Study: A Randomized Controlled Trial «SUBTITLE». JAMA. 2001. 285(13): 1711. doi:10.1001/jama.285.13.1711
Cannon CP, Braunwald E, McCabe CH et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004. 350(15): 1495–1504. doi:10.1056/NEJMoa040583
Patti G, Pasceri V, Colonna G et al. Atorvastatin Pretreatment Improves Outcomes in Patients With Acute Coronary Syndromes Undergoing Early Percutaneous Coronary Intervention. J Am Coll Cardiol. 2007. 49(12): 1272–1278. doi:10.1016/j.jacc.2007.02.025
Shepherd J, Kastelein JJ, Bittner V et al. Intensive lipid lowering with atorvastatin in patients with coronary heart disease and chronic kidney disease: the TNT (Treating to New Targets) study. J Am Coll Cardiol. 2008. 51(15): 1448–1454. doi:10.1016/j.jacc.2007.11.072
Athyros VG, Papageorgiou AA, Mercouris BR et al. Treatment with atorvastatin to the National Cholesterol Educational Program goal versus "usual" care in secondary coronary heart disease prevention. The GREek Atorvastatin and Coronary-heart-disease, Evaluation (GREACE) study. Curr Med Res Opin. 2002. 18(4): 220–228. doi:10.1185/030079902125000787
Amarenco P, Bogousslavsky J, Callahan A 3rd et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med. 2006. 355(6): 549–559. doi:10.1056/NEJMoa061894
Newman CB, Palmer G, Silbershatz H et al. Safety of atorvastatin derived from analysis of 44 completed trials in 9,416 patients. Am J Cardiol. 2003. 92(6): 670–676. doi:10.1016/s0002-9149(03)00820-8
Boekholdt SM, Hovingh GK, Mora S et al. Very Low Levels of Atherogenic Lipoproteins and the Risk for Cardiovascular Events. J Am Coll Cardiol. 2014. 64(5): 485–494. doi:10.1016/j.jacc.2014.02.615
Fruchart JC, Duriez P. Mode of action of fibrates in the regulation of triglyceride and HDL-cholesterol metabolism. Drugs of Today. 2006. 42(1): 39. doi:10.1358/dot.2006.42.1.963528.
Keating GM, Croom KF. Fenofibrate. Drugs. 2007. 67(1): 121–153. doi:10.2165/00003495-200767010-00013.
Group SC. Study of Heart and Renal Protection (SHARP): Randomized trial to assess the effects of lowering low-density lipoprotein cholesterol among 9,438 patients with chronic kidney disease. Am Heart J. 2010. 160(5): 785–794.e710. doi:10.1016/j.ahj.201.
Abifadel M, Varret M, Rabès J-P et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003. 34(2): 154–156. doi:10.1038/ng1161
Norata GD, Tibolla G, Catapano AL. Targeting PCSK9 for Hypercholesterolemia. Annual Review of Pharmacology and Toxicology. 2014. 54(1): 273–293. doi:10.1146/annurev-pharmtox-011613-140025
Giugliano RP et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial //The Lancet. 2017. Vol. 390. №. 10106. P. 1962–1971.
Bhatt DL et al. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia //New England Journal of Medicine. 2019. Vol. 380. №. 1. P. 11–22.
Brugts JJ et al. The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials // Bmj. 2009. Vol. 338.
Mills EJ et al. Primary prevention of cardiovascular mortality and events with statin treatments: a network meta-analysis involving more than 65,000 patients // Journal of the American College of Cardiology. 2008. Vol. 52. №. 22. P. 1769–1781.
Moriarty PM et al. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: the ODYSSEY ALTERNATIVE randomized trial // Journal of clinical lipidology. 2015. Vol. 9. №. 6. P. 758–769.
Nissen SE et al. Efficacy and tolerability of evolocumab vs ezetimibe in patients with muscle-related statin intolerance: the GAUSS-3 randomized clinical trial // Jama. 2016. Vol. 315. №. 15. P. 1580–1590.
Schreml J, Gouni-Berthold I. Role of anti-PCSK9 antibodies in the treatment of patients with statin intolerance // Current medicinal chemistry. 2018. Vol. 25. №. 13. P. 1538–1548.
Landmesser U et al. European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk //, European Heart Journal. 2017. Vol. 38. №. 29. P. 2245–2255.
Ridker PM et al. Cardiovascular efficacy and safety of bococizumab in high-risk patients // New England Journal of Medicine. 2017. Vol. 376. №. 16. P. 1527–1539.
Vallejo-Vaz AJ et al. Triglyceride-rich lipoprotein cholesterol and risk of cardiovascular events among patients receiving statin therapy in the TNT trial //Circulation. 2018. Vol. 138. №. 8. P. 770–781.
Chapman MJ et al. Niacin and fibrates in atherogenic dyslipidemia: pharmacotherapy to reduce cardiovascular risk //Pharmacology & therapeutics. 2010. Vol. 126. №. 3. P. 314–345.
ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus // New England Journal of Medicine. 2010. Vol. 362. №. 17. P. 1563–1574.
FIELD Study Investigators et al. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial // The Lancet. 2005. Vol. 366. №. 9500. P. 1849–1861.
Doll R. Efficacy of cholesterol-lowering therapy in 18 686 people with diabetes in 14 randomised trials of statins: a meta-analysis // Lancet. 2008. Vol. 371. №. 9607. P. 117–125.
Nicholls SJ et al. Effect of diabetes on progression of coronary atherosclerosis and arterial remodeling: a pooled analysis of 5 intravascular ultrasound trials // Journal of the American College of Cardiology. 2008. Vol. 52. №. 4. P. 255–262.
Laing SP et al. Mortality from heart disease in a cohort of 23,000 patients with insulin-treated diabetes //Diabetologia. 2003. Vol. 46. №. 6. P. 760–765.
Giugliano RP et al. Benefit of adding ezetimibe to statin therapy on cardiovascular outcomes and safety in patients with versus without diabetes mellitus: results from IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) //, Circulation. 2018. Vol. 137. №. 15. P. 1571–1582.
Zinman B, Wanner C, Lachin JM et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. New England Journal of Medicine. 2015. 373(22): 2117–2128.
Marso SP et al. Liraglutide and cardiovascular outcomes in type 2 diabetes //New England Journal of Medicine. 2016. Vol. 375. № 4. P. 311–322.
Marso SP et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes //N Engl J Med. 2016. Vol. 375. P. 1834–1844.
McGuire DK et al. Association of SGLT2 inhibitors with cardiovascular and kidney outcomes in patients with type 2 diabetes: a meta-analysis // JAMA cardiology. 2020.
88. McGuire DK et al. Association of SGLT2 inhibitors with cardiovascular and kidney outcomes in patients with type 2 diabetes: a meta-analysis // JAMA cardiology. 2020.
UK Prospective Diabetes Study (UKPDS) Group et al. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // The Lancet. 1998. Vol. 352. №. 9131. P. 854–865.
Franczyk-Skora B et al. Acute coronary syndromes in patients with chronic kidney disease // Current vascular pharmacology. 2013. Vol. 11. №. 5. P. 758–767.
Loncar G et al. Impact of renal failure on all-cause mortality and other outcomes in patients treated by percutaneous coronary intervention //Archives of Cardiovascular Diseases. 2015. Vol. 108. №. 11. P. 554–562.
Herrington W et al. Impact of renal function on the effects of LDL cholesterol lowering with statin-based regimens: a meta-analysis of individual participant data from 28 randomised trials //Lancet Diabetes and Endocrinology. 2016. Vol. 4. №. 10.
Baigent C et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial // The Lancet. 2011. Vol. 377. №. 9784. P, 2181–2192.
Barylski M et al. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy—a meta-analysis of 11 randomized controlled trials involving 21,295 participants // Pharmacological research. 2013. Vol. 72. P. 35–44.
Palmer SC et al. HMG CoA reductase inhibitors (statins) for people with chronic kidney disease not requiring dialysis // Cochrane Database of Systematic Reviews. 2014. №. 5.
Sun L et al. Meta-analysis of statin therapy in maintenance dialysis patients // Renal Failure. 2015. Vol. 37. №. 7. P. 1149–1156.
Green D, Ritchie JP, Kalra PA. Meta-analysis of lipid-lowering therapy in maintenance dialysis patients // Nephron Clinical Practice. 2013. Vol. 124. №. 3–4. P. 209–217.
Lin YC et al. Effects and Safety of Statin and Ezetimibe Combination Therapy in Patients with Chronic Kidney Disease: A Systematic Review and Meta-Analysis // Clinical Pharmacology & Therapeutics. 2020.
Wanner C et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis // New England Journal of Medicine. 2005. Vol. 353. №. 3. P. 238–248.
Fellström BC et al. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis // New England Journal of Medicine. 2009. Vol. 360. №. 14. P. 1395–1407.
de Lemos JA et al. Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial // Jama. 2004. Vol. 292. №. 11. P. 1307–1316.
Ray KK et al. Early and late benefits of high-dose atorvastatin in patients with acute coronary syndromes: results from the PROVE IT-TIMI 22 trial // Journal of the American College of Cardiology. 2005. Vol. 46. №. 8. P. 1405–1410.
Schwartz GG et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial // Jama. 2001. Vol. 285. №. 13. P. 1711–1718.
Koskinas KC et al. Evolocumab for early reduction of LDL cholesterol levels in patients with acute coronary syndromes (EVOPACS) // Journal of the American College of Cardiology. 2019. Vol. 74. №. 20. P. 2452–2462.
Trankle CR et al. Alirocumab in acute myocardial infarction: results from the Virginia commonwealth university alirocumab response trial (VCU-AlirocRT) // Journal of cardiovascular pharmacology. 2019. Vol. 74. №. 3. P. 266–269.
Armitage J et al. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials // The Lancet. 2019. Vol. 393. №. 10170. P. 407–415.
Taskinen MR et al. Adverse effects of fructose on cardiometabolic risk factors and hepatic lipid metabolism in subjects with abdominal obesity // Journal of internal medicine. 2017. Vol. 282. №. 2. P. 187–201.
Look AHEAD Research Group. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes // New England journal of medicine. 2013. Vol. 369. №. 2. P. 145–154.
Batsis JA et al. Weight loss interventions in older adults with obesity: a systematic review of randomized controlled trials since 2005 // Journal of the American Geriatrics Society. 2017. Vol. 65. №. 2. P. 257–268.
Khader YS et al. Oral contraceptives use and the risk of myocardial infarction: a meta-analysis // Contraception. 2003. Vol. 68. №. 1. P. 11–17.
Shufelt CL, Merz CNB. Contraceptive hormone use and cardiovascular disease // Journal of the American College of Cardiology. 2009. Vol. 53. №. 3. P. 221–231.
Manson JAE et al. Estrogen plus progestin and the risk of coronary heart disease // New England Journal of Medicine. 2003. Vol. 349. №. 6. P. 523–534.
Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. High-dose atorvastatin after stroke or transient ischemic attack // New England Journal of Medicine. 2006. Vol. 355. №. 6. P. 549–559.
Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention // The Lancet Neurology. 2009. Vol. 8. №. 5. P. 453–463.
Chan K et al. Effect of Lipid lowering with rosuvastatin on progression of aortic stenosis: results of the aortic stenosis progression observation: measuring effects of rosuvastatin (ASTRONOMER) trial // Circulation. 2010. Vol. 121. №. 2. P. 306–314.
Cowell SJ et al. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis // New England Journal of Medicine. 2005. Vol. 352. №. 23. P. 2389–2397.
Dichtl W et al. Prognosis and risk factors in patients with asymptomatic aortic stenosis and their modulation by atorvastatin (20 mg) // The American journal of cardiology. 2008. Vol. 102. №. 6. P. 743–748.
Rossebø AB et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis // New England journal of medicine. 2008. Vol. 359. №. 13. P. 1343–1356.
Kelley GA, Kelley KS, Tran ZV. Walking, lipids, and lipoproteins: a meta-analysis of randomized controlled trials // Preventive medicine. 2004. Vol. 38. №. 5. P. 651–661.
Hardman AE. Physical activity, obesity and blood lipids // International Journal of Obesity. 1999. Vol. 23. №. 3. P. S64–S71.
Tran ZV et al. The effects of exercise on blood lipids and lipoproteins: a meta-analysis of studies // Med Sci Sports Exerc. 1983. Vol. 15. №. 5. P. 393–402.
Mozaffarian D, Micha R, Wallace S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials // PLoS Med. 2010. Vol. 7. №. 3. P. e1000252.
Mozaffarian D, Aro A, Willett W. C. Health effects of trans-fatty acids: experimental and observational evidence // European journal of clinical nutrition. 2009. Vol. 63. №. 2. P. S5–S21.
Clifton P. M, Keogh J. B. A systematic review of the effect of dietary saturated and polyunsaturated fat on heart disease // Nutrition, Metabolism and Cardiovascular Diseases. 2017. Vol. 27. №. 12. P. 1060–1080.
Brown L et al. Cholesterol-lowering effects of dietary fiber: a meta-analysis // The American journal of clinical nutrition. 1999. Vol. 69. №. 1. P. 30–42.
Hollænder PLB, Ross AB, Kristensen M. Whole-grain and blood lipid changes in apparently healthy adults: a systematic review and meta-analysis of randomized controlled studies // The American journal of clinical nutrition. 2015. Vol. 102. №. 3. P. 556–572.
Gylling H et al. Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease // Atherosclerosis. 2014. Vol. 232. №. 2. P. 346–360.
Musa-Veloso K et al. A comparison of the LDL-cholesterol lowering efficacy of plant stanols and plant sterols over a continuous dose range: results of a meta-analysis of randomized, placebo-controlled trials // Prostaglandins, Leukotrienes and Essential Fatty Acids. 2011. Vol. 85. №. 1. P. 9–28.
Poli A et al. Nutraceuticals and functional foods for the control of plasma cholesterol levels. An intersociety position paper // Pharmacological research. 2018. Vol. 134. P. 51–60.
Li Y et al. A meta-analysis of red yeast rice: an effective and relatively safe alternative approach for dyslipidemia // PloS one. 2014. Vol. 9. №. 6. P. e98611.
Nordmann AJ et al. Effects of low-carbohydrate vs low-fat diets on weight loss and cardiovascular risk factors: a meta-analysis of randomized controlled trials // Archives of internal medicine. 2006. Vol. 166. №. 3. P. 285–293.
Zomer E et al. Interventions that cause weight loss and the impact on cardiovascular risk factors: a systematic review and meta-analysis // Obesity reviews. 2016. Vol. 17. №. 10. P. 1001–1011.
Berger S et al. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis // The American journal of clinical nutrition. 2015. Vol. 102. №. 2. P. 276–294.
Griffin JD, Lichtenstein AH. Dietary cholesterol and plasma lipoprotein profiles: randomized controlled trials // Current nutrition reports. 2013. Vol. 2. №. 4. P. 274–282.
Shaw K et al. Exercise for overweight or obesity. Cochrane Database Syst Rev 2006; CD003817. 2013.
Droste DW et al. A daily glass of red wine associated with lifestyle changes independentlyimproves blood lipids in patients with carotid arteriosclerosis: results from arandomized controlled trial // Nutrition journal. 2013. Vol. 12. №. 1. P. 147.
Rimm EB et al. Moderate alcohol intake and lower risk of coronary heart disease: meta-analysis of effects on lipids and haemostatic factors // Bmj. 1999. Vol. 319. №. 7224. P. 1523–1528.
Yu-Poth S et al. Effects of the National Cholesterol Education Program"s Step I and Step II dietary intervention programs on cardiovascular disease risk factors: a meta-analysis // The American journal of clinical nutrition. 1999. Vol. 69. №. 4. P. 632–646.
Santos FL et al. Systematic review and meta-analysis of clinical trials of the effects of low carbohydrate diets on cardiovascular risk factors // Obesity Reviews. 2012. Vol. 13. №. 11. P. 1048–1066.
Rivellese AA et al. Effects of dietary saturated, monounsaturated and n-3 fatty acids on fasting lipoproteins, LDL size and post-prandial lipid metabolism in healthy subjects // Atherosclerosis. 2003. Vol. 167. №. 1. P. 149–158.
Wei MY, Jacobson TA. Effects of eicosapentaenoic acid versus docosahexaenoic acid on serum lipids: a systematic review and meta-analysis // Current atherosclerosis reports. 2011. Vol. 13. №. 6. P. 474–483.
Kelishadi R, Mansourian M, Heidari-Beni M. Association of fructose consumption and components of metabolic syndrome in human studies: a systematic review and meta-analysis // Nutrition. 2014. Vol. 30. №. 5. P. 503–510.
Stanhope KL et al. Consuming fructose-sweetened, not glucose-sweetened, beverages increases visceral adiposity and lipids and decreases insulin sensitivity in overweight/obese humans // The Journal of clinical investigation. 2009. Vol. 119. №. 5. P. 1322–1334.
Gayet-Boyer C et al. Is there a linear relationship between the dose of ruminant trans-fatty acids and cardiovascular risk markers in healthy subjects: results from a systematic review and meta-regression of randomised clinical trials // British Journal of Nutrition. 2014. Vol. 112. №. 12. P. 1914–1922.
Kelley GA, Kelley KS. Impact of progressive resistance training on lipids and lipoproteins in adults: a meta-analysis of randomized controlled trials // Preventive medicine. 2009. Vol. 48. №. 1. P. 9–19.
Kastorini CM et al. The effect of Mediterranean diet on metabolic syndrome and its components: a meta-analysis of 50 studies and 534,906 individuals // Journal of the American college of cardiology. 2011. Vol. 57. №. 11. P. 1299–1313.
Maeda K, Noguchi Y, Fukui T. The effects of cessation from cigarette smoking on the lipid and lipoprotein profiles: a meta-analysis // Preventive medicine. 2003. Vol. 37. №. 4. P. 283–290.
Mark L et al. Effects of ezetimibe on lipids and lipoproteins in patients with hypercholesterolemia and different apolipoprotein E genotypes // Current medical research and opinion. 2007. Vol. 23. №. 7. P. 1541–1548.
Li YH et al. 2017 Taiwan lipid guidelines for high risk patients // Journal of the Formosan Medical Association. 2017. Vol. 116. №. 4. P. 217–248.
Robinson JG et al. Eradicating the burden of atherosclerotic cardiovascular disease by lowering apolipoprotein B lipoproteins earlier in life // Journal of the American Heart Association. 2018. Vol. 7. №. 20. P. e009778.
Wilson DP et al. Use of Lipoprotein (a) in clinical practice: A biomarker whose time has come. A scientific statement from the National Lipid Association // Journal of clinical lipidology. 2019. Vol. 13. №. 3. P. 374–392.
Мешков А. Н. и др. Распределение показателей липидного спектра у мужчин и женщин трудоспособного возраста в Российской Федерации: результаты исследования эссе-РФ за 2012–2014 гг. // Кардиоваскулярная терапия и профилактика. 2017. Vol. 16. № 4. C. 62–67.
Болезни сердца по Браунвальду: руководство по сердечно-сосудистой медицине / под ред. П. Либби и др.; пер. с англ. под общ. ред. Р. Г. Оганова. В 4 т. Том 1. М.: Логосфера, 2012. 596 с.: ил.; 21,6 см. Перевод изд. Braunwald’s heart disease: a textbook of cardiovascular medicine, Peter Libby et al, 8th ed.
The Merck manual of diagnosis and therapyed. MH.Beers [et. al]. 17th ed. XXXIII, 2833 p.: il. Index.: p. 2657–2833. ISBN 0911910-10-7.
Lawler PR et al. Real-world risk of cardiovascular outcomes associated with hypertriglyceridaemia among individuals with atherosclerotic cardiovascular disease and potential eligibility for emerging therapies // Eur Heart J. 2020 Jan 1;41(1):86–94.
Liu J et al. Effects of blood triglycerides on cardiovascular and all-cause mortality: a systematic review and meta-analysis of 61 prospective studies // Lipids in health and disease. 2013. Vol. 12. №. 1. P. 1–11.
Kosmas CE, Estrella AM, Sourlas A et al. Inclisiran: A New Promising Agent in the Management of Hypercholesterolemia.
Levin AA. Treating disease ath the RNA levek with oligonucleotides. NEJM 2019;380:57–70.
Tsouka AN, Tellis CC, Tseplis AD. Pharmacology of PCK9 Inhibitors: current status and future perspectives. Current Pharmaceutical Design 2018;24:3622–3633.
Wang N, Tall AR. New approach to PCSK9 therapeutics. NEJM 2017; 376:41–51.
Ray KK, Phill M, Scot Wright R et al. Two phase 3 trials of Inclisiran in patients with elevated LDL cholesterol. NEJM 2020;382:1507–1519
Raal JF, Kallend D, Ray KK et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. NEJM 2020; 382:1520–1530.
Marston NA, Giugliano RP, Im K, Silverman MG, O"Donoghue ML, Wiviott SD, Ference BA, Sabatine MS. Association Between Triglyceride Lowering and Reduction of Cardiovascular Risk Across Multiple Lipid-Lowering Therapeutic Classes: A Systematic Review and Meta-Regression Analysis of Randomized Controlled Trials. Circulation. 2019 Oct 15;140(16):1308–1317.
Rohit D, Shankar J. Comparative Study of Atorvastatin and Rosuvastatin in Combination with Fenofibrate in mixed Hyperlipidemia. Int J Pharmacol and Clin Sci. 2016;5(1):25–31.
Bangalore S, Kamalakkannan G, Parkar S, Messerli FH. Fixed-dose combinations improve medication compliance: a meta-analysis. American Journal of Medicine 2007; 120(8): 713–719.
Baumgartner A, Drame K, Geutjens S, Airaksinen M (2020). Does the Polypill Improve Patient Adherence Compared to Its Individual Formulations? A Systematic Review. Pharmaceutics, 12(2), 190.
Cholesterol Treatment Trialists Collaboration, Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R, Armitage J, Baigent C. Efficacy of cholesterol lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008;371:117–125.
Bouzidi N et al. Effects of omega-3 polyunsaturated fatty-acid supplementation on redox status in chronic renal failure patients with dyslipidemia // Journal of renal nutrition. 2010. Vol. 20. №. 5. P. 321–328.
Svensson M et al. The effect of n-3 fatty acids on plasma lipids and lipoproteins and blood pressure in patients with CRF // American journal of kidney diseases. 2004. Vol. 44. №. 1. P. 77–83
Li WL et al. Dietary Omega-3 Fatty Acid Intake and Mortality in CKD Population: A 1999–2014 NHANES Analysis // American Journal of Nephrology. 2021. P. 1–10
Navarese EP, Kowalewski M, Andreotti F, van Wely M, Camaro C, Kolodziejczak M, Gorny B, Wirianta J, Kubica J, Kelm M, de Boer MJ, Suryapranata H. Meta-analysis of time-related benefits of statin therapy in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Am J Cardiol 2014;113:1753_1764.
Visseren FLJ et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227–3337.
Anthonisen NR et al. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial // Ann Intern Med. 2005. Vol. 142. № 4. P. 233–239.
Hughes JR et al. Antidepressants for smoking cessation // Cochrane Database Syst Rev. 2007. № 1. P. CD000031.
Lindson N et al. Different doses, durations and modes of delivery of nicotine replacement therapy for smoking cessation // Cochrane Database Syst Rev. 2019. Vol. 4. № 4. P. CD013308.
Hu Y et al. Smoking Cessation, Weight Change, Type 2 Diabetes, and Mortality. // N Engl J Med. 2018. Vol. 379. № 7. P. 623–632.
Kavousi M et al. Electronic cigarettes and health with special focus on cardiovascular effects: position paper of the European Association of Preventive Cardiology (EAPC) // Eur J Prev Cardiol. 2020. 2047487320941993.
Powell K. E. et al. The Scientific Foundation for the Physical Activity Guidelines for Americans, 2nd Edition // J Phys Act Health. 2018. P. 1–11.
Hupin D et al. Even a low-dose of moderate-to-vigorous physical activity reduces mortality by 22% in adults aged >/=60 years: a systematic review and meta-analysis // Br J Sports Med. 2015. Vol. 49. № 19. P. 1262–1267.
Sacks FM et. al. American Heart Association. Dietary Fats and Cardiovascular Disease: A Presidential Advisory From the American Heart Association // Circulation. 2017. Vol. 136. № 10. P. e1e23.
He FJ et. al. Salt Reduction to Prevent Hypertension and Cardiovascular Disease: JACC State-of-the-Art Review // J Am Coll Cardiol. 2020. Vol. 75. № 6. P. 632–647.
World Health Organization. A healthy diet sustainably produced. https://apps.who.int/iris/bitstream/handle/10665/278948/WHO-NMH-NHD-18.12-eng.pdf? ua=1 (21 July 2020)
Zhong VW et. al. Associations of Processed Meat, Unprocessed Red Meat, Poultry, or Fish Intake With Incident Cardiovascular Disease and AllCause Mortality // JAMA Intern Med. 2020. Vol. 180. № 6. P.503–512.
World Health Organization. Guideline: sugars intake for adults and children. https://www.who.int/publications/i/item/9789241549028 (21 July 2020).
Wood AM et. al. Emerging Risk Factors Collaboration/EPIC-CVD/UK Biobank Alcohol Study Group. Risk thresholds for alcohol consumption: combined analysis of individual-participant data for 599 912 current drinkers in 83 prospective studies // Lancet. 2018. Vol. 391. № 10129. P. 1513–1523.
Wing RR et. al. Association of Weight Loss Maintenance and Weight Regain on 4-Year Changes in CVD Risk Factors: the Action for Health in Diabetes (Look AHEAD) Clinical Trial // Diabetes Care. 2016. Vol. 39 № 12. P. 1345–1355.
Cardoso L et. al. Short- and long-term mortality after bariatric surgery: A systematic review and meta-analysis // Diabetes Obes Metab. 2017. Vol. 19. № 9. P. 1223–1232.
Sattar N. et. al. HbA1c in type 2 diabetes diagnostic criteria: addressing the right questions to move the field forwards // Diabetologia. 2012. Vol. 55. № 6. P. 1564–1567.
ADVANCE Collaborative Group et. al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N Engl J Med. 2008. Vol. 358. № 24. P. 2560–2572.
Ettehad D et. al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis // Lancet. 2016. Vol. 387. № 10022. P. 957–967.
SPRINT Research Group et. al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control // N Engl J Med. 2015. Vol. 373. № 22. P. 2103–2116.
Williamson JD et. al. Intensive vs Standard Blood Pressure Control and Cardiovascular Disease Outcomes in Adults Aged >/=75 Years: A Randomized Clinical Trial // JAMA. 2016. Vol. 315. № 24. P. 2673–2682.
Thomopoulos C et. al. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels — updated overview and meta-analyses of randomized trials // J Hypertens. 2016. Vol. 34. № 4. P. 613–622.
Antithrombotic Trialists’ (ATT) Collaboration et. al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials // Lancet. 2009. Vol. 373. № 9678. P. 1849–1860.
Cosentino F et. al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD // Eur Heart J. 2020. Vol. 41. № 2. P. 255–323.
Armenian SH et. al. Cardiovascular Disease Among Survivors of Adult-Onset Cancer: A Community-Based Retrospective Cohort Study // J Clin Oncol. 2016. Vol. 34. № 10. P. 1122–1130.
Chen W et. al. Risk of cardiovascular comorbidity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis // Lancet Respir Med. 2015. Vol. 3. № 8. P. 631–639.
Ogdie Aet. al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study // Ann Rheum Dis. 2015. Vol. 74. № 2. P. 326–332.
Badran M et. al. Epidemiology of Sleep Disturbances and Cardiovascular Consequences // Can J Cardiol. 2015. Vol. 31. № 7. P. 873–879.
Zhao B et. al. Does erectile dysfunction independently predict cardiovascular events? It"s time to act on the evidence // Eur J Prev Cardiol. 2018. Vol. 25. № 12. P. 1307–1311.
Visseren FLJ et al, ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice // Eur Heart J. 2021. Vol. 42(34). P. 3227–3337
Приказ Министерства здравоохранения РФ от 29 марта 2019 г. N 173н «Об утверждении порядка проведения диспансерного наблюдения за взрослыми».
Amarenco P, Kim JS, Labreuche J, Charles H, Abtan J, Béjot Y et al. A comparison of two LDL cholesterol targets after ischemic stroke. N Engl J Med. 2020;382(1):9. doi:10.1056/NEJMoa1910355
Cholesterol Treatment Trialists Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a metaanalysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376:16701681
Cholesterol Treatment Trialists Collaboration, Fulcher J, O’Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, Simes J, Collins R, Kirby A, Colhoun H, Braunwald E, La Rosa J, Pedersen TR, Tonkin A, Davis B, Sleight P, Franzosi MG, Baigent C, Keech A. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials.Lancet2015;385:13971405
Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM, Goodman SG, Hanotin C, Harrington RA et al; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med.2018;379:2097–2107. doi:10.1056/NEJMoa1801174
Weng TC, Yang YH, Lin SJ, Tai SH. A systematic review and meta-analysis on the therapeutic equivalence of statins. J Clin Pharm Ther. 2010 Apr;35(2):139–51. doi:10.1111/j.1365-2710.2009.01085.x. PMID: 20456733
Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet. 2016;388:2532-61
Group HPSC. Randomized trial of the effects of cholesterol-lowering with simvastatin on peripheral vascular and other major vascular outcomes in 20,536 people with peripheral arterial disease and other high-risk conditions. J Vasc Surg. 2007;45:645–54.
Nanna MG, Navar AM, Wang TY, Mi X, Virani SS, Louie MJ, Lee LV, Goldberg AC, Roger VL, Robinson J, Peterson ED. Statin Use and Adverse Effects Among Adults >75 Years of Age: Insights From the Patient and Provider Assessment of Lipid Management (PALM) Registry. J Am Heart Assoc. 2018 May 8;7(10):e008546. doi:10.1161/JAHA.118.008546. PMID: 29739801; PMCID: PMC6015311.
Yang Z, Edwards D, Massou E, Saunders CL, Brayne C, Mant J. Statin use and high-dose statin use after ischemic stroke in the UK: a retrospective cohort study. Clin Epidemiol. 2019 Jun 28;11:495–508. doi:10.2147/CLEP.S201983. PMID: 31388316; PMCID: PMC6607979.
Bohula EA, Wiviott SD, Giugliano RP, Blazing MA, Park JG, Murphy SA, White JA, Mach F, Van de Werf F, Dalby AJ, et al. Prevention of stroke with the addition of ezetimibe to statin therapy in patients with acute coronary syndrome in IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Circulation.2017;136:2440–2450. doi:10.1161/CIRCULATIONAHA.117.029095
Chiavaroli L, Nishi SK, Khan TA, Braunstein CR, Glenn AJ, Mejia SB, RahelićD, Kahleová H, Salas-Salvadó J, Jenkins DJA, et al. Portfolio dietary pattern and cardiovascular disease: a systematic review and metaanalysis of controlled trials. Prog Cardiovasc Dis.2018;61:43–53. doi:10.1016/j.pcad.2018.05.004
Benner JS, Tierce JC, Ballantyne CM, Prasad C, Bullano MF, Willey VJ, Erbey J, Sugano DS. Follow-up lipid tests and physician visits are associated with improved adherence to statin therapy. Pharmacoeconomics. 2004;22(suppl 3):13–23. doi:10.2165/00019053-200422003-00003
Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, Forder P, Pillai A, Davis T, Glasziou P, Drury P, Kesaniemi YA, Sullivan D, Hunt D, Colman P, d’Emden M, Whiting M, Ehnholm C, Laakso M; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet2005;366:18491861
Aim-High Investigators, Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, McBride R, Teo K, Weintraub W. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy.N Engl J Med2011;365:22552267.
Group HTC, Landray MJ, Haynes R, Hopewell JC, Parish S, Aung T, Tomson J, Wallendszus K, Craig M, Jiang L, Collins R, Armitage J. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med2014;371:203–212.
Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, Helo P, Huttunen JK, Kaitaniemi P, Koskinen P, Manninen V et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987 Nov 12;317(20):1237–45. doi:10.1056/NEJM198711123172001. PMID: 3313041
Lipids and lipoproteins in symptomatic coronary heart disease. Distribution, intercorrelations, and significance for risk classification in 6,700 men and 1,500 women. The Bezafibrate Infarction Prevention (BIP) Study Group, Israel. Circulation1992;86:839848
Defesche JC, Gidding SS, Harada-Shiba M et al. Familial hypercholesterolaemia. Nat Rev Dis Primers. 2017 Dec 7;3:17093. doi:10.1038/nrdp.2017.93.
Ershova AI, Meshkov AN, Bazhan SS et al. The prevalence of familial hypercholesterolemia in the West Siberian region of the Russian Federation: A substudy of the ESSE-RF. PLoS One. 2017; 12 (7): e0181148.
Cuchel M, Bruckert E, Ginsberg HN et al. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J. 2014 Aug 21;35(32):2146–57. doi:10.1093/eurheartj/ehu274
Civeira F; International Panel on Management of Familial Hypercholesterolemia. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis. 2004 Mar;173(1):55–68. doi:10.1016/j.atherosclerosis.2003.11.010
Кухарчук В. В, Малышев П. П., Мешков А. Н. Семейная гиперхолестеринемия: современные аспекты диагностики, профилактики и терапии. Кардиология. 2009;49(1):76–83.
Yuan G, Wang J, Hegele RA. Heterozygous familial hypercholesterolemia: an underrecognized cause of early cardiovascular disease. CMAJ. 2006 Apr 11;174(8):1124–9. doi:10.1503/cmaj.051313
Vuorio A, Docherty KF, Humphries SE et al. Statin treatment of children with familial hypercholesterolemia — trying to balance incomplete evidence of long-term safety and clinical accountability: are we approaching a consensus? Atherosclerosis. 2013 Feb;226(2):315–20. doi:10.1016/j.atherosclerosis.2012.10.032
Hopkins PN, Toth PP, Ballantyne CM, Rader DJ. Familial hypercholesterolemias: prevalence, genetics, diagnosis and screening recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011 Jun;5(3 Suppl):S9–17. doi:10.1016/j.jacl.2011.03.452
Myant NB. Familial defective apolipoprotein B-100: a review, including some comparisons with familial hypercholesterolaemia. Atherosclerosis. 1993 Dec;104(1–2):1–18. doi:10.1016/0021-9150(93)90171-p
Meriño-Ibarra E, Castillo S, Mozas P et al. Screening of APOB gene mutations in subjects with clinical diagnosis of familial hypercholesterolemia. Hum Biol. 2005 Oct;77(5):663–73. PMID: 16596945.
Мешков А. Н, Ершова А. И, Щербакова Н. В. и др. Фенотипические особенности течения гетерозиготной формы семейной гиперхолестеринемии у носителей мутаций генов LDLR и APOB. Кардиоваскулярная терапия и профилактика. 2011;10(8):63–65.
Burnett JR, Hooper AJ. Common and rare gene variants affecting plasma LDL cholesterol. Clin Biochem Rev. 2008 Feb;29(1):11–26. PMID: 18566665.
Мандельштам М. Ю, Васильев В. Б. Моногенные гиперхолестеринемии: новые гены, новые мишени для лечения. Генетика. 2008;44(10):1309–1316.
Шахтшнейдер Е. В., Иванощук Д. Е., Макаренкова К. В. и др. Каскадный генетический скрининг в диагностике гетерозиготной формы семейной гиперхолестеринемии: клинический случай. Российский кардиологический журнал 2017;146(6):178–179.
Abifadel M, Rabès JP, Devillers M et al. Mutations and polymorphisms in the proprotein convertase subtilisin kexin 9 (PCSK9) gene in cholesterol metabolism and disease. Hum Mutat. 2009 Apr;30(4):520–9. doi:10.1002/humu.20882
Ежов М. В., Бажан С. С., Ершова А. И. и др. Клинические рекомендации по семейной гиперхолестеринемии. Атеросклероз. 2019;15(1):58–98.
Wiegman A, Gidding SS, Watts GF et al. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015 Sep 21;36(36):2425–37. doi:10.1093/eurheartj/ehv157
Watts GF, Gidding S, Wierzbicki AS et al. Integrated guidance on the care of familial hypercholesterolaemia from the International FH Foundation: executive summary. J Atheroscler Thromb. 2014;21(4):368–74. PMID: 24892180.
Marteau T, Senior V, Humphries SE et al. Psychological impact of genetic testing for familial hypercholesterolemia within a previously aware population: a randomized controlled trial. Am J Med Genet A. 2004 Jul 30;128A(3):285–93. doi:10.1002/ajmg.a.30102
Civeira F, Ros E, Jarauta E et al. Comparison of genetic versus clinical diagnosis in familial hypercholesterolemia. Am J Cardiol. 2008 Nov 1;102(9):1187–93, 1193.e1. doi:10.1016/j.amjcard.2008.06.056
Palacios L, Grandoso L, Cuevas N, et al. Molecular characterization of familial hypercholesterolemia in Spain. Atherosclerosis. 2012 Mar;221(1):137–42. doi:10.1016/j.atherosclerosis.2011.12.021
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227–3337. doi:10.1093/eurheartj/ehab484
Oscarsson J, Önnerhag K, Risérus U, Sundén M, Johansson L, Jansson PA, Moris L, Nilsson PM, Eriksson JW, Lind L. Effects of free omega-3 carboxylic acids and fenofibrate on liver fat content in patients with hypertriglyceridemia and non-alcoholic fatty liver disease: A double-blind, randomized, placebo-controlled study. J Clin Lipidol. 2018 Nov-Dec;12(6):1390–1403.e4. doi:10.1016/j.jacl.2018.08.003. Epub 2018 Aug 10. PMID: 30197273.
Wang X, Wen D, Chen Y, Ma L, You C. PCSK9 inhibitors for secondary prevention in patients with cardiovascular diseases: a bayesian network meta-analysis. Cardiovasc Diabetol. 2022 Jun 15;21(1):107. doi:10.1186/s12933-022-01542-4. PMID: 35706032; PMCID: PMC9202167.
Lee J, Egolum U, Parihar H, Cooley M, Ling H. Effect of Ezetimibe Added to High-Intensity Statin Therapy on Low-Density Lipoprotein Cholesterol Levels: A Meta-Analysis. Cardiol Res. 2021 Apr;12(2):98–108. doi:10.14740/cr1224. Epub 2021 Feb 23. PMID: 33738013; PMCID: PMC7935639.
Banach M, Burchardt P, Chlebus K et al. PoLA/CFPiP/PCS/PSLD/PSD/PSH guidelines on diagnosis and therapy of lipid disorders in Poland 2021. Archives of Medical Science. 2021;17(6):1447–1547. doi:10.5114/aoms/141941
Ray KK, Reeskamp LF, Laufs U, Banach M, Mach F, Tokgözoğlu LS, Connolly DL, Gerrits AJ, Stroes ESG, Masana L, Kastelein JJP. Combination lipid-lowering therapy as first-line strategy in very high-risk patients. Eur Heart J. 2022 Feb 22;43(8):830–833. doi:10.1093/eurheartj/ehab718. PMID: 34636884.
Burnett H, Fahrbach K, Cichewicz A, Jindal R, Tarpey J, Durand A, Di Domenico M, Reichelt A, Viljoen A. Comparative efficacy of non-statin lipid-lowering therapies in patients with hypercholesterolemia at increased cardiovascular risk: a network meta-analysis. Curr Med Res Opin. 2022 May;38(5):777–784. doi:10.1080/03007995.2022.2049164. Epub 2022 Mar 20. PMID: 35262430.
Zhu L, Hayen A, Bell KJL. Legacy effect of fibrate add-on therapy in diabetic patients with dyslipidemia: a secondary analysis of the ACCORDION study. Cardiovasc Diabetol. 2020 Mar 5;19(1):28. doi:10.1186/s12933-020-01002-x. PMID: 32138746; PMCID: PMC7059389.
Blonde L, Umpierrez GE, Reddy SS, McGill JB, Berga SL, Bush M, Chandrasekaran S, DeFronzo RA, Einhorn D, Galindo RJ, Gardner TW, Garg R, Garvey WT, Hirsch IB, Hurley DL, Izuora K, Kosiborod M, Olson D, Patel SB, Pop-Busui R, Sadhu AR, Samson SL, Stec C, Tamborlane WV Jr, Tuttle KR, Twining C, Vella A, Vellanki P, Weber SL. American Association of Clinical Endocrinology Clinical Practice Guideline: Developing a Diabetes Mellitus Comprehensive Care Plan-2022 Update. Endocr Pract. 2022 Oct;28(10):923–1049. doi:10.1016/j.eprac.2022.08.002. Epub 2022 Aug 11. PMID: 35963508.
Ray KK, Wright RS, Kallend D, Koenig W, Leiter LA, Raal FJ, Bisch JA, Richardson T, Jaros M, Wijngaard PLJ, Kastelein JJP; ORION-10 and ORION-11 Investigators. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020 Apr 16;382(16):1507–1519. doi:10.1056/NEJMoa1912387. Epub 2020 Mar 18. PMID: 32187462.
Raal FJ, Kallend D, Ray KK, Turner T, Koenig W, Wright RS, Wijngaard PLJ, Curcio D, Jaros MJ, Leiter LA, Kastelein JJP; ORION-9 Investigators. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med. 2020 Apr 16;382(16):1520–1530. doi:10.1056/NEJMoa1913805. Epub 2020 Mar 18. PMID: 32197277.
Khan SA, Naz A, Qamar Masood M, Shah R. Meta-Analysis of Inclisiran for the Treatment of Hypercholesterolemia. Am J Cardiol. 2020 Nov 1;134:69–73. doi:10.1016/j.amjcard.2020.08.018. Epub 2020 Aug 15. PMID: 32892993.
Klebs S, Lecocq J, Mann С et al. Characterization of Inclisiran Use in Real World: Prescription Data from Germany. Journal og clinical lipidology 2022;16(3): Suppl e73; https://doi.org/10.1016/j.jacl.2022.05.060
SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe // European heart journal. 2021. Vol. 42. №. 25. P. 2439–2454.
Lloyd-Jones DM, Morris PB, Ballantyne CM, Birtcher KK, Covington AM, DePalma SM, Minissian MB, Orringer CE, Smith SC Jr, Waring AA, Wilkins JT. 2022 ACC Expert Consensus Decision Pathway on the Role of Nonstatin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2022 Oct 4;80(14):1366–1418. doi:10.1016/j.jacc.2022.07.006
Балахонова Т.В., Ершова А.И., Ежов М.В., Барбараш О. Л., Берштейн Л. Л., Богачев В. Ю., Воевода М. И., Генкель В.В., Гуревич В.С., Дупляков Д.В., Имаев Т.Э., Коновалов Г.А., Космачева Е. Д., Лобастов К.В., Митькова М. Д., Никифоров В. С., Ротарь О.П., Сучков И.А., Явелов И.С., Митьков В.В., Акчурин Р.С., Драпкина О.М., Бойцов С.А. Фокусированное ультразвуковое исследование сосудов. Консенсус российских экспертов. Кардиоваскулярная терапия и профилактика. 2022;21(7):3333. doi:10.15829/1728-8800-2022-3333. EDN WLJEHZ
Ершова А. И., Балахонова Т.В., Мешков А. Н., Куценко В. А., Яровая Е.Б., Шальнова С. А., Лищенко Н. Е., Новикова А. С., Александрова Е. Л., Шутемова Е. А., Белова О. А., Рачкова С. А., Бойцов С. А., Драпкина О. М. Распространенность атеросклероза сонных и бедренных артерий среди населения Ивановской области: исследование АТЕРОГЕН-Иваново. Кардиоваскулярная терапия и профилактика. 2021;20(5):2994.doi:10.15829/1728-8800-2021-2994.
Ershova A., Balakhonova T., Meshkov A., Kutsenko V., Belova O., Rachkova S., Shutemova E., Shalnova S., Boytsov S., Drapkina O. Carotid and femoral artery plaques as predictors of cardiovascular and all-cause mortality in the middle-aged general population. Atherosclerosis Supplements. 2022;355:e43–e44. DOI:https://doi.org/10.1016/j.atherosclerosis.2022.06.212.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Президиум рабочей группы:
Ежов М. В.
Кухарчук В. В.
Сергиенко И. В.
Другие члены рабочей группы:
Алиева А. С.
Анциферов М. Б.
Аншелес А. А.
Арабидзе Г. Г.
Аронов Д. М.
Арутюнов Г. П.
Ахмеджанов Н. М.
Балахонова Т. В.
Барбараш О. Л.
Бойцов С. А.
Бубнова М. Г.
Воевода М. И.
Галстян Г. Р.
Галявич А. С.
Горнякова Н. Б.
Гуревич В. С.
Дедов И.И.
Драпкина О. М.
Дупляков Д. В.
Ерегин С. Я.
Ершова А. И.
Иртюга О. Б.
Карпов Р. С.
Карпов Ю. А.
Качковский М. А.
Кобалава Ж. Д.
Козиолова Н. А.
Коновалов Г. А.
Константинов В. О.
Космачева Е. Д.
Котовская Ю. В.
Мартынов А. И.
Мешков А. Н.
Небиеридзе Д. В.
Недогода С. В.
Обрезан А. Г.
Олейников В. Э.
Покровский С. Н.
Рагино Ю. И.
Ротарь О. П.
Скибицкий В. В.
Смоленская О. Г.
Соколов А. А.
Сумароков А. Б.
Ткачева О. Н.
Филиппов А. Е.
Халимов Ю. Ш.
Чазова И. Е.
Шапошник И. И.
Шестакова М.В.
Шляхто Е. В.
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Представленные Рекомендации разработаны на основе Рекомендаций по лечению нарушений липидного обмена Европейского общества кардиологов и Европейского общества по изучению атеросклероза 2019 года [50].
В Рекомендациях, основанных на результатах крупнейших эпидемиологических, рандомизированных клинических исследований и метаанализов, обобщены и изложены основные принципы лечения пациентов с нарушениями липидного обмена в целом и в особых клинических ситуациях. Основная цель Рекомендаций — облегчить принятие решения при выборе оптимальной стратегии лечения конкретного пациента с дислипидемией. Тем не менее окончательное решение о лечении должно быть принято с учетом индивидуальных особенностей механизмов развития и течения заболевания.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог.
2. Врач-терапевт.
3. Врач общей практики.
4. Врач-эндокринолог.
5. Врач-невролог.
Вследствие того, что члены Российского кардиологического общества входят в состав Европейского общества кардиологов и также являются его членами, все рекомендации Европейского общества кардиологов (ЕОК) формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций (Таблицы 1, 2, 3, 4, 5).
Таблица 1. Шкала оценки классов рекомендаций Европейского общества кардиологов (ЕОК)
Класс рекомендаций ЕОК | Определение | Предлагаемая формулировка |
|---|---|---|
I | Доказано или общепризнано, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными | Рекомендовано/ показано |
II
| Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения | Целесообразно применять
|
IIa
| Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения | Целесообразно применять |
IIb | Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно | Можно применять |
III | Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред | Не рекомендуется применять |
Таблица 2. Шкала оценки уровней достоверности доказательств Европейского общества кардиологов (ЕОК)
| Уровни достоверности доказательств ЕОК |
|---|---|
A | Данные многочисленных рандомизированных клинических исследований или метаанализов |
B | Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований |
C | Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров |
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровни достоверности доказательств (УДД) Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научнойобоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588) | |
|---|---|
1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай–контроль» |
5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД | Расшифровка |
|---|---|
1. | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
2. | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа |
3. | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
4. | Несравнительные исследования, описание клинического случая |
5. | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 5. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендации (УРР), Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588) | |
|---|---|
А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 918н «Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями».
2. Приказ Минестерства здравоохранения Российской Федерации от 10 мая 2017 г. № 203н «Об утверждении критериев оценки качества медицинской помощи».
3. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588)
Таблица А3.1. Классификация дислипидемий (ВОЗ, адаптировано из классификации Fredrickson)
Фенотип | Синоним | Повышение уровня липопротеидов плазмы | Повышение уровня липидов плазмы | Атерогенность | Частота (%) в структуре ДЛП | |
|---|---|---|---|---|---|---|
I | a | Наследственная гиперхиломикронемия, дефицит липопротеинлипазы | ХМ | ТГ | ? | <1 |
b | Наследственный дефицит апобелка CII | |||||
c | Гиперхиломикронемия при циркуляции ингибитора Липопротеидлипазы | |||||
II | a | Семейная гиперхолестеринемия, полигенная наследственная гиперхолестеринемия | ЛНП | ХС | +++ | 10 |
b | Комбинированная гиперлипидемия | ЛНП, ЛОНП | ХС и ТГ | +++ | 40 | |
III | Наследственная дисбета-липопротеидемия | ЛПП | ТГ и ХС | +++ | <1 | |
IV | Наследственная гипертриглицеридемия | ЛОНП | ТГ | + | 45 | |
V | Смешанная гиперлипидемия | ХМ, ЛОНП | ТГ и ХС | + | 5 | |
ДЛП — дислипидемия, ОХС — общий холестерин, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ТГ — триглицериды, ЛОНП — липопротеиды очень низкой плотности, ХМ — хиломикроны.
Таблица А3.2. Оптимальные значения липидных параметров в зависимости от категории риска

* И снижение ХС ЛНП >50% от исходного уровня.
ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ТГ — триглицериды, Лп(а) — липопротеид(а).
Таблица А3.3. Факторы риска развития и прогрессирования атеросклероза
Факторы риска | |
|---|---|
Возраст | Мужчины >40 лет, женщины >55 лет или с ранней менопаузой |
Курение | Вне зависимости от количества |
Артериальная гипертония | АД ≥ 140/90 мм рт. ст. или постоянный прием антигипертензивных препаратов |
Сахарный диабет 2-го типа | Глюкоза натощак >6,1 и 7,0 ммоль/л (капиллярная и венозная кровь, соответственно) |
Раннее начало ИБС у ближайших родственников (отягощенная наследственность) | Инфаркт миокарда или нестабильная стенокардия у мужчин в возрасте <55 лет, у женщин <60 лет |
Семейная гиперлипидемия, по данным анамнеза | IIа, IIb и III тип |
Абдоминальное ожирение | Окружность талии: у мужчин ≥94 см, у женщин ≥80 см |
Хроническое заболевание почек | Снижение скорости клубочковой фильтрации <60 мл/мин |
Ожирение | Повышение ИМТ > 25 кг/м2 |
Приложение А3.1. Принципы диагностики и оценки сердечно-сосудистого риска
Таблица А3.4. Количественная оценка индекса коронарного кальция
Индекс коронарного кальция | Изменения коронарных артерий | Риск |
|---|---|---|
0 | Нет признаков поражения | низкий |
1–10 | Минимальная кальцификация | умеренный |
11–100 | Незначительная кальцификация. Обычно имеются атеросклеротические бляшки до 50% | высокий |
101–400 | Умеренная кальцификация. Обычно имеются 2–4 атеросклеротические бляшки с сужением коронарной артерии более 50% | высокий или очень высокий |
> 400 | Выраженная кальцификация | очень высокий |
Таблица А3.5. Основные наследственные (генетические) дислипидемии [9]
Дислипидемия |
Дефект гена | Повышение липидов или липопротеидов |
Клинические признаки |
Встречаемость |
|---|---|---|---|---|
Семейная гиперхолестеринемия |
LDLR, PCSK9, APOB |
ХС ЛНП | Ксантоматоз сухожилий, ранний атеросклероз | 1/250 — гетерозиготная, 1/300 000 — гомозиготная |
Cемейная гиперхиломикронемия |
LPL, APOС2 |
Хиломикроны | Эруптивные ксантомы, гепатоспленомегалия, панкреатиты |
1/1 000 000 |
Наследственный дефицит печеночной липазы |
Печеночная липаза |
Ремнанты ЛОНП (ЛПП) | Ранний атеросклероз, панкреатиты |
1/10 000 |
Бета-цитостеролемия |
APOЕ | Хиломикроны, ремнанты ЛОНП | Пальмарные и тубуло- эруптивные ксантомы, периферический атеросклероз |
1/1 000 000 |
Семейная дисбеталипопротеидемия |
APOЕ |
Хиломикроны, ремнанты ЛОНП | Пальмарные и тубуло-эруптивные ксантомы, периферический атеросклероз |
1/10 000 |
Семейная комбинированная гиперлипидемия |
Модифицирующие гены |
ХС ЛНП, ЛОНП |
– |
1/200 |
Болезнь Tangier, семейная гипо-альфа-липопротеидемия |
AВCA-1 |
Снижение ХС ЛВП |
Гепатоспленомегалия, увеличение небных миндалин, ИБС |
1/1 000 000 |
ХС ЛНП — холестерин липопротеидов низкой плотности; ХС ЛОНП — холестерин липопротеидов очень низкой плотности; ХС ЛПП — холестерин липопротеидов промежуточной плотности ХС ЛВП — холестерин липопротеидов высокой плотности; ИБС — ишемическая болезнь сердца.
Таблица А3.6 Популяционные показатели ХС ЛНП в зависимости от пола и возраста для РФ.
Пол | Возраст | ХС-ЛНП (моль/л) 95 перцентиль |
|---|---|---|
Мужской | 25–34 | 4,56 |
35–44 | 5,04 | |
45–54 | 5,31 | |
55–64 | 5,16 | |
Женский | 25–34 | 4,24 |
35–44 | 4,68 | |
45–54 | 5,29 | |
55–64 | 5,56 |
Таблица А3.7. Диагностические критерии Simon Broome Registry — Саймона Брума

Таблица А3.8. Диагностические критерии гоСГХС

Таблица А3.9. Препараты, потенциально взаимодействующие с статинами
Противомикробные препараты системного действия | Блокаторы кальциевых каналов | Другое |
|---|---|---|
Итраконазол | Верапамил** | Циклоспорин** |
Кетоконазол | Дилтиазем | Даназол |
Позаконазол** | Амлодипин** | Амиодарон** |
Эритромицин |
| Ранолазин |
Кларитромицин** |
| Грейпфрутовый сок |
Таблица А3.10. Сравнение эффективности фенофибрата**, статинов и эзетимиба [38, 62, 63, 148, 8]
Механизм действия | Статины | Эзетимиб | Фенофибрат** |
|---|---|---|---|
ингибируют фермент ГМГ-КоА-редуктазу, который участвует в синтезе холестерина | селективно ингибирует абсорбцию холестерина и некоторых растительных стеринов в кишечнике | активирует работу клеточных PPARa- рецепторов, которые нормализуют метаболизм липидов | |
Снижение концентрации ХС ЛНП | 18–55% | 15–30% | 5–20% |
Снижение уровня триглицеридов | 7–20% | 3–5% | 20–50% |
Увеличение уровня ХС ЛВП | 5–15% | 3–5% | 10–20% |
Увеличение размеров частиц ЛНП | нет | нет | 50% |
Таблица А3.11. Расчет степени снижения ХС ЛНП при различных вариантах гиполипидемической терапии
Терапия | Снижение ХС ЛНП в % |
|---|---|
Умеренная терапия статином | ≈ 30 |
Интенсивная терапия статином | ≈ 50 |
Интенсивная терапия статином + эзетимиб | ≈ 65 |
Алирокумаб**/эволокумаб**/инклисиран** | ≈ 60 |
Алирокумаб**/эволокумаб**/инклисиран** + интенсивная терапия статином | ≈ 75 |
Алирокумаб**/эволокумаб**/инклисиран** + интенсивная терапия статином + эзетимиб | ≈ 85 |
Таблица А3.12. Показания к плазмаферезу, плазмосорбции
Показания |
|---|
Гомозиготная форма СГХС — абсолютное показание |
Гетерозиготная форма СГХС — тяжелое течение Недостаточный эффект от медикаментозной терапии; непереносимость лекарственных препаратов |
Другие формы ГХС, рефрактерные к максимальной медикаментозной терапии у больных с ИБС |
Гиперлипопротеидемия(а) (>60 мг/дл) у больных с ИБС, особенно в сочетании с рефрактерной к терапии ГХС |
Рефрактерная к терапии ГХС у больных, перенесших реваскуляризацию, с целью предотвращения рестенозов и окклюзий шунтов и стентов |
Рефрактерная дислипидемия у беременных с высоким риском осложнений, особенно с наследственной формой дислипидемии, гиперлипопротеидемии(а), выраженной гипервязкостью крови |
СГХС — семейная гиперхолестеринемия.
Таблица А3.13. Сводные данные по эффектам гиполипидемических препаратов [149]
Код АТХ | Препараты и суточные дозы | Липидные эффекты | Побочные эффекты | Примечание |
|---|---|---|---|---|
C10AA Ингибиторы ГМГ-КоА-редуктазы (статины) | Симвастатин** (20–40 мг) Аторвастатин** (10–80 мг) Розувастатин 5–40 мг Питавастатин 1–4 мг | ХС ЛНП ↓ 20–60% ХС ЛВП ↑ 5–15% ТГ ↓ 7–30% ХС не-ЛВП ↓ 15–50% | Миалгия Миозит Увеличение сывороточных трансаминаз | Редкие осложнения: рабдомиолиз, снижение когнитивных способностей, развитие СД |
C10AX Другие гиполипидемические средства | Эзетимиб 10 мг | ХС ЛНП ↓ 15–22% ХС ЛВП ↑ 1–2% TГ ↓ 5–10% ХС не-ЛВП ↓ 14–19% | Головная боль Боль в мышцах | Эффективен в сочетании со статинами |
C10AX Другие гиполипидемические средства | Эволокумаб (**) (140 мг (1 мл), подкожно, раз в 2 нед./420 мг (3х1 мл), подкожно, раз в месяц) Алирокумаб (**) (75 мг, подкожно, раз в 2 нед); 150 мг (1 мл) раз в 2 нед./300мг (2х1 мл или 2 мл) раз в месяц Инклисиран** (284 мг, подкожно, 1-й год — 3 инъекции, далее 2 инъекции в год | ХС ЛНП ↓ 50–70% ХС ЛВП ↑ 4–7% TГ ↓ 6–19% ХС не-ЛВП ↓ 20–50% | Реакция в месте инъекции (5%) | Не влияет на уровень трансаминаз
Требуется подкожная инъекция |
C10AB Фибраты | Фенофибрат**, 145 мг в сутки | ХС ЛНП ↓ 10–15% ХС ЛВП ↑ 10-20% TГ ↓ 20–50% ХС не-ЛВП ↓ 5-19% | Диспепсия Миопатия Возможно ↑ креатинина и желчных кислот | Возможно совместное применение в комбинации со статинами и эзетимибом |
C10AX Другие гиполипидемические средства | Омега-3 кислоты этиловых эфиров 2–4 г в сут. | ХС ЛНП ↓ 6% — ↑ 25% ХС ЛВП ↓ 5% — ↑ 7% TГ ↓ 20–45% ХС не-ЛВП ↓ 5–14% | Рыбный запах Экзема | Комбинация со статинами улучшает постпрандиальный уровень ТГ |
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм лечения гипертриглицеридемии
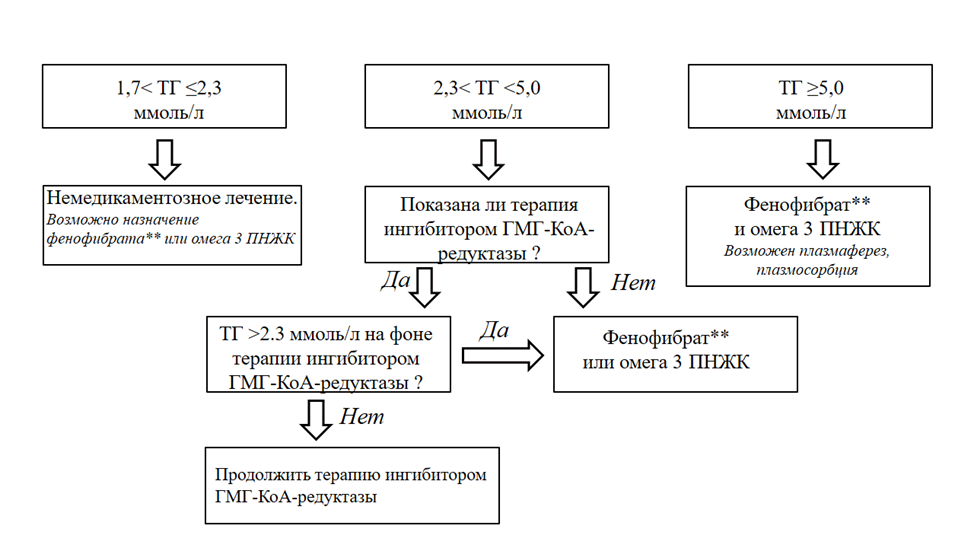
Примечание. Омега3 ПНЖК — Омега-3 кислоты этиловых эфиров, включая другие эфиры и кислоты, в дозе 2–4 г/сут. При тяжелой гипертриглицеридемии рассмотреть вопрос использования плазмафереза, плазмосорбции.
Приложение Б2. Алгоритм медикаментозной терапии для достижения целевого уровня ХС ЛНП
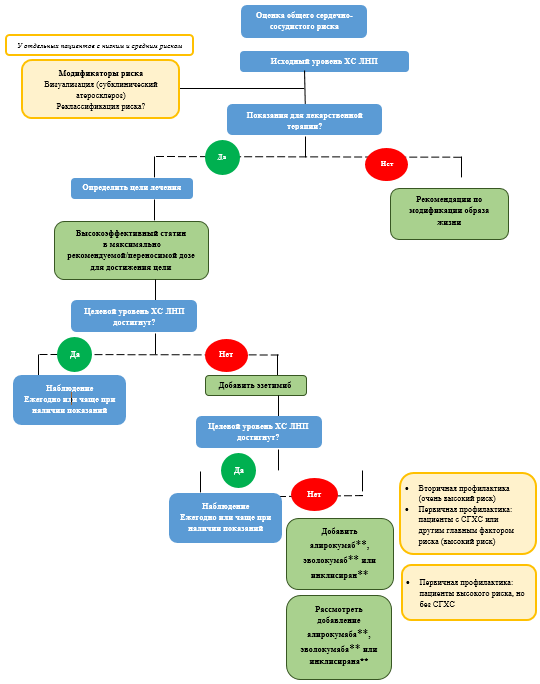
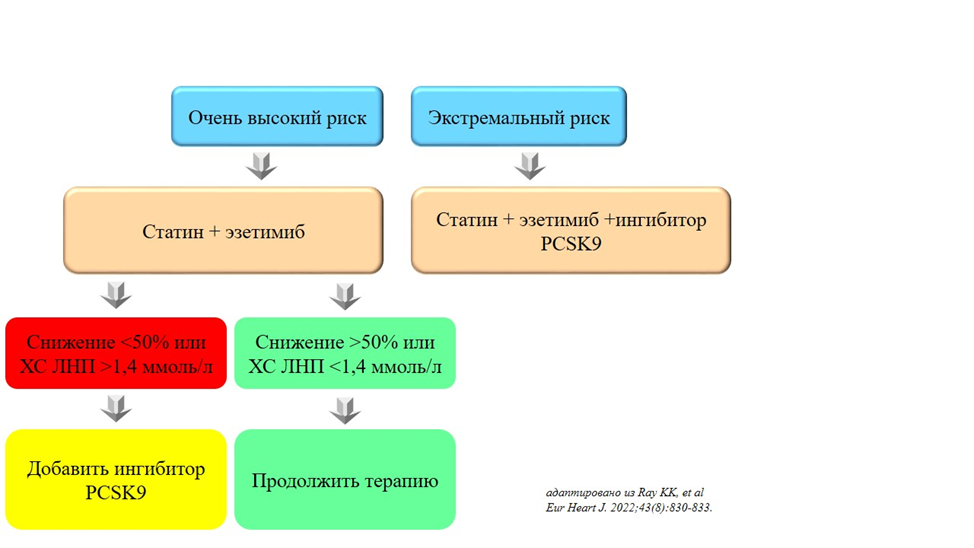
Таблица Б1. Лабораторный контроль безопасности и эффективности (показатели, кратность) до и во время гиполипидемической терапии
Определение липидов сыворотки крови | |
|---|---|
Перед назначением гиполипидемической терапии | требуется, как минимум, 2-кратное определение с интервалом 1–12 нед, кроме пациентов с ОКС и относящихся к категории очень высокого риска |
После старта гиполипидемической терапии | через 8 (±4) нед до достижения целевого уровня |
По достижении пациентом целевого уровня липидов | ежегодно (если нет проблем с приверженностью или других причин для более частого контроля) |
АЛТ и ферменты мышечной ткани | |
Частота лабораторного контроля АЛТ, АСТ
| · до начала гиполипидемической терапии · однократно через 8–12 нед от начала гиполипидемической терапии · рутинный контроль в дальнейшем не рекомендован (за исключением появления симптомов возможного поражения печени) · на фоне приема фибратов |
Действия врача при выявлении повышенного уровня АЛТ на фоне гиполипидемической терапии:
| повышение АЛТ ˂ 3 N · продолжить гиполипидемическую терапию · повторный контроль АЛТ через 4–6 нед. повышение АЛТ ≥3 N · отмена гиполипидемической терапии, · контроль АЛТ через 4–6 нед. после отмены · возобновление гиполипидемической терапии после нормализации АЛТ · при сохранении повышенного уровня АЛТ — поиск других возможных причин повышения АЛТ |
Мониторинг КФК (креатинфосфокиназы)
| · до начала терапии · при повышении исходно уровня КФК > 4 N гиполипидемическую терапию не начинать мониторинг на фоне гиполипидемической терапии: · рутинно не рекомендован · выполняется при появлении миалгии/мышечной слабости факторы риска миопатии/повышения КФК на фоне гиполипидемической терапии: · пожилой возраст, прием сопутствующей терапии (с возможным неблагоприятным взаимодействием с гиполипидемическими препаратами) · спортсмены · патология печени, почек Повышение КФК ˂ 4N: · при отсутствии симптомов миопатии прием статина продолжить (при появлении симптомов пациент должен обратиться к врачу для лабораторного определения уровня КФК) · при наличии симптомов миопатии необходим регулярный мониторинг КФК · если симптомы миопатии сохраняются необходимо отменить прием статина, провести повторную оценку симптомов и уровня КФК через 6 нед. после отмены · после исчезновения симптомов и нормализации КФК возобновить назначение статина в меньшей дозе, с режимом приема через день или 2 раза в неделю · возможна комбинированная гиполипидемическая терапия Повышение КФК ≥ 4N: оценить показания для назначения статина Повышение КФК >10N: · отмена статина · контроль функции почек · мониторинг КФК каждые 2 недели Повышение КФК ˂ 10 N, симптомы миопатии отсутствуют: · продолжить терапию статином, · мониторинг КФК осуществлять через 2–6 нед. Повышение КФК ˂ 10 N, симптомы миопатии присутствуют: · отмена статина · мониторинг уровня КФК до его нормализации · после нормализации уровня КФК ре-старт терапии статином в меньшей дозе · исключение др. причин возможного повышения КФК (физическая нагрузка) · если уровень КФК сохраняется высоким при мониторинге — подтверждение развития миопатии |
Контроль HbA1c и/или уровня глюкозы плазмы натощак
| · регулярный мониторинг HbA1c и/или уровня глюкозы плазмы должен проводиться пациентам с высоким риском развития СД и при высокодозной терапии статином · мониторинг уровня глюкозы плазмы показан пожилым пациентам с метаболическим синдромом, ожирением, признаками инсулинорезистентности |
Таблица Б3/4. Интенсивность терапии статинами
Суточная доза статина высокой интенсивности для ↓ ЛНП ≥ 50% | Суточная доза статина умеренной интенсивности для ↓ ЛНП от 30% до <50% |
|---|---|
Аторвастатин (**), 40–80 мг | Аторвастатин(**), 10–20 мг |
Розувастатин, 20–40 мг | Питавастатин, 2–4 мг |
Розувастатин, 5–10 мг | |
Симвастатин (**), 20–40 мг |
Приложение Б4: принципы гиполипидемической терапии и диспансерное наблюдение больных с ДЛП
Таблица Б4/1. Тактика ведения в зависимости от сердечно-сосудистого риска и уровня холестерина [50]
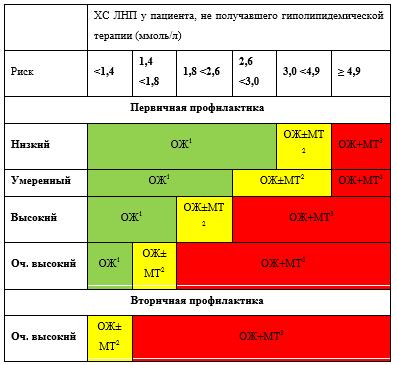
Примечание: ХС ЛНП — холестерин липопротеидов низкой плотности. У больных ССЗ терапия статинами назначается вне зависимости от уровня ХС.
1 ОЖ: лечение не требуется, рекомендуется поддержание здорового образа жизни и контроль факторов риска.
2 ОЖ±МТ: рекомендуется поддержание здорового образа жизни и, возможно (по решению врача), назначение липидснижающей терапии, если целевой уровень ХС ЛНП не достигнут.
3 ОЖ+МТ: рекомендуется поддержание здорового образа жизни и одновременное назначение липидснижающей терапии.
Таблица Б4/2 Влияние изменения образа жизни на уровень липидов [50]
Изменения образа жизни для снижения уровня ОХС и ХС ЛНП | Источник литературы | |
|---|---|---|
Исключение трансжиров | ++ | [122, 123] |
Снижение употребления насыщенных жиров | ++ | [122, 124] |
Увеличить потребление пищевых волокон | ++ | [125, 126] |
Употребление продуктов, богатые фитостеролами | ++ | [127, 128] |
Красный дрожжевой рис | ++ | [129, 130] |
Снижение избыточной массы тела | ++ | [131, 132] |
Снижение количества холестерина с пищей | + | [133, 134] |
Повышение уровня регулярной физической активности | + | [135] |
Изменения образа жизни для снижения уровня ТГ | ||
Снижение избыточной массы тела | + | [131, 132] |
Исключение алкоголя | +++ | [136, 137] |
Повышение уровня регулярной физической активности | ++ | [135, 138] |
Снижение общего количества углеводов, поступающих с пищей | ++ | [131, 139] |
Применение омега-3 ПНЖК в качестве пищевой добавки | ++ | [140, 141] |
Снижение потребления моно- и дисахаридов | ++ | [142, 143] |
Замена насыщенных жиров моно- и полиненасыщенными жирам | + | [122, 46]
|
Изменения образа жизни для повышения уровня ХС ЛВП | ||
Снижение потребления трансжиров | ++ | [122, 144] |
Повышение уровня регулярной физической активности | +++ | [135, 145] |
Снижение избыточной массы тела | ++ | [131, 132] |
Снижение количества углеводов, поступающих с пищей, и замена их на ненасыщенные жиры | ++ | [131, 146] |
Умеренное употребление алкоголя | ++ | [137] |
Прекращение курения | + | [147] |
Примечание: +++ Общее соглашение об эффективности влияния на уровень липидов. ++ Менее выраженное влияние на уровень липидов; имеющиеся свидетельства/мнения специалистов указывают на эффективность мероприятий. + Противоречивые сведения.
Приложение В. Информация для пациента
Таблица В1. Рекомендации по диете для улучшения общего профиля липопротеидов
| Предпочтительно | Употреблять умеренно | Употреблять редко и в ограниченных количествах |
|---|---|---|---|
Злаки | Цельнозерновые | Рафинированный хлеб, рис и макаронные изделия, печенье, кукурузные хлопья | Пирожные, кексы, пирожки, круассаны |
Овощи | Сырые и обработанные овощи | Картофель | Овощи, приготовленные с маслом или сливками |
Бобовые | Чечевица, фасоль, бобы, горох, нут, соя |
|
|
Фрукты | Свежие и замороженные фрукты | Сухофрукты, желе, варенье, консервированные фрукты, шербет, фруктовое мороженое, фруктовый сок |
|
Сладости и подсластители |
Некалорийные подсластители | Сахароза, мед, шоколад, конфеты | Мороженое, фруктоза, безалкогольные напитки |
Мясо и рыба | Постная и жирная рыба, мясо птицы без кожи | Постная вырезка говядины, баранины, свинины или телятины, морепродукты, моллюски и ракообразные | Колбасы, салями, бекон, свиные ребрышки, хот-доги, мясные субпродукты |
Молочная пища и яйца | Обезжиренное молоко и йогурт | Молоко, сыры со сниженным содержанием жира, другие молочные продукты, яйца | Обычный сыр, сливки, цельное молоко и йогурт |
Приправы | Уксус, горчица, обезжиренные приправы | Оливковое масло, нетропические растительные масла, мягкие маргарины, майонез, кетчуп | Трансжиры и твердые маргарины, пальмовое, кокосовое и сливочное масло, сало |
Орехи |
| Все несоленые (кроме кокоса) | Кокос |
Приготовление пищи | Гриль, пароварение | Обжаривание | Жарка |
Примечание: умеренное употребление алкоголя (не более 50 мг в день крепких напитков, 200 мг красного или белого вина и не более 350 мл пива во время приема пищи) является приемлемым, при условии, что уровень ТГ не повышен, отсутствует гипертоническая болезнь и/или печеночная недостаточность.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Голландские диагностические критерии гетерозиготной семейной гиперхолестеринемии
Название на русском языке: Голландские диагностические критерии гетерозиготной семейной гиперхолестеринемии
Оригинальное название (если есть): Dutch Lipid Clinic Network criteria
Источник (официальный сайт разработчиков, публикация с валидацией): [9]
Тип (подчеркнуть): шкала оценки
Назначение: постановка клинического диагноза гетерозиготной семейной гиперхолестеринемии
Содержание (шаблон):
Критерий | Баллы |
|---|---|
1. Наследственный анамнез | |
Раннее (у мужчин <55 лет; у женщин <60 лет) развитие ССЗ или уровень ХС ЛНП выше 95-й процентили у ближайшего родственника | 1 |
Наличие сухожильных ксантом у ближайшего родственника или уровень ХС ЛНП выше 95-й процентили у детей младше 18 лет | 2 |
2. Персональный анамнез |
|
Раннее развитие ССЗ (у мужчин <55 лет; у женщин <60 лет) | 2 |
Раннее развитие атеросклеротического поражения церебральных/периферических артерий (у мужчин <55 лет; у женщин <60 лет) | 1 |
3. Физикальное обследование* | |
Сухожильные ксантомы | 6 |
Липидная дуга роговицы <45 лет | 4 |
4. Уровень ХС ЛНП | |
> 8,5 ммоль/л | 8 |
6,5–8,4 ммоль/л | 5 |
4,9–6,4 ммоль/л | 3 |
4,0–4,8 ммоль/л | 1 |
5. Анализ ДНК | |
Функциональная мутация генов LDLR, APOB или PCSK9 | 8 |
|
|
* исключают друг друга (т. е. максимум 6 баллов). ССЗ — сердечно-сосудистое заболевание, ХС ЛНП — холестерин липопротеидов низкой плотности, СГХС — семейная гиперхолестеринемия.
Ключ (интерпретация): Диагноз ставится на основании суммы баллов: «определенная» СГХС — >8 баллов, «предположительная» ИЛИ «вероятная» СГХС — 6–8 баллов, «возможная» СГХС — 3–5 баллов, «маловероятная» СГХС — 0–2 баллов.
Таблица Г2. Шкала SCORE2 расчета нефатальных СС осложнений для стран очень высокого риска.
Название на русском языке: Шкала SCORE2
Оригинальное название (если есть): Systematic COronary Risk Evaluation model
Источник (официальный сайт разработчиков, публикация с валидацией): escardio.org. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe // European heart journal. 2021. Vol. 42. №. 25. P. 2439–2454.
Тип (подчеркнуть): шкала оценки
Назначение: расчет риска нефатальных сердечно-сосудистых осложнений
Содержание (шаблон) и интерпретация:
SCORE2 для пожилых лиц 70–89 лет в популяции очень высокого риска
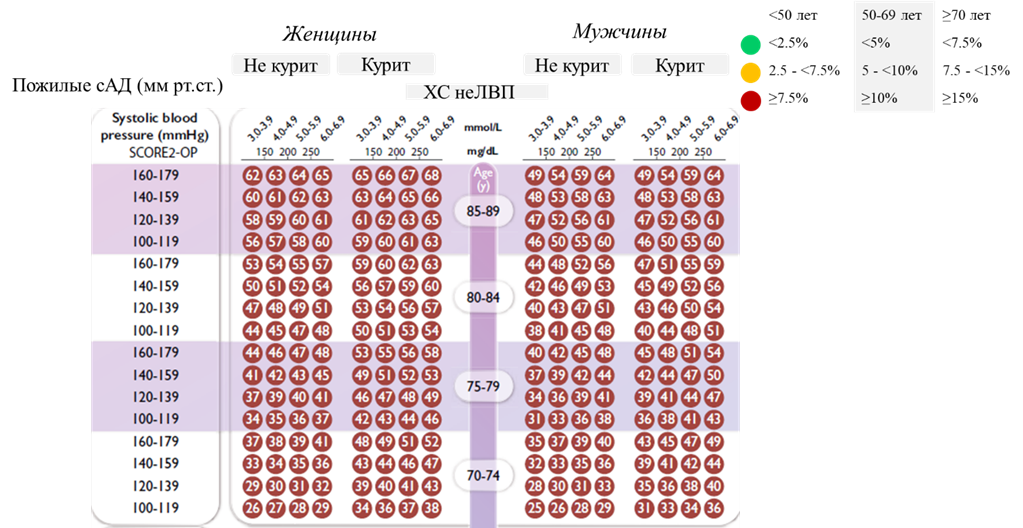
SCORE2 для лиц 40–69 лет в популяции очень высокого риска
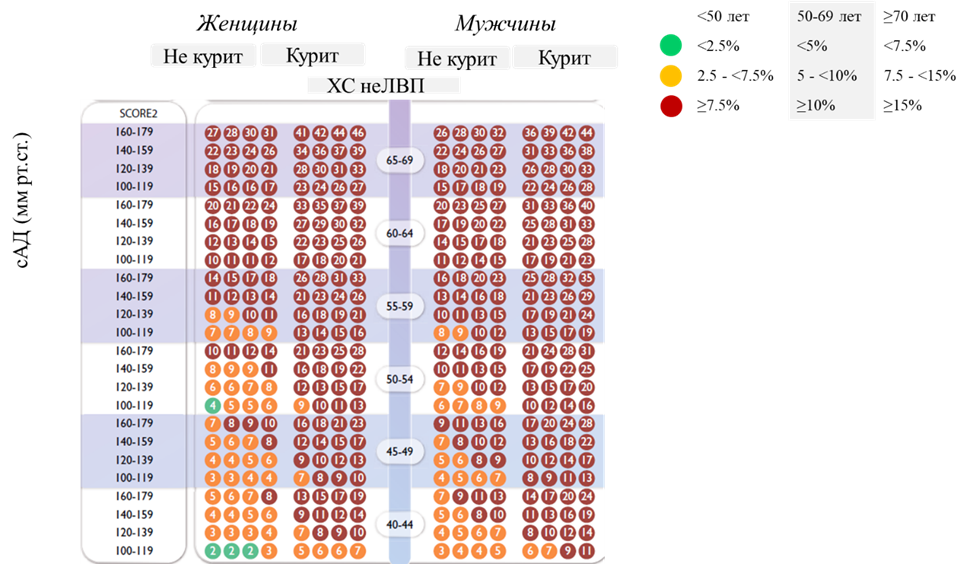
Пояснения: ХС не ЛВП=ОХС-ЛВП
Таблица Г3. Шкала глобальной оценки 10-летнего сердечно-сосудистого риска
Название на русском языке: Шкала глобальной оценки 10-летнего сердечно-сосудистого риска
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): escardio.org. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe // European heart journal. 2021. Vol. 42. №. 25. P. 2439–2454.
Тип (подчеркнуть): шкала оценки
Назначение: оценка 10-летнего сердечно-сосудистого риска
Содержание (шаблон) и интерпретация:
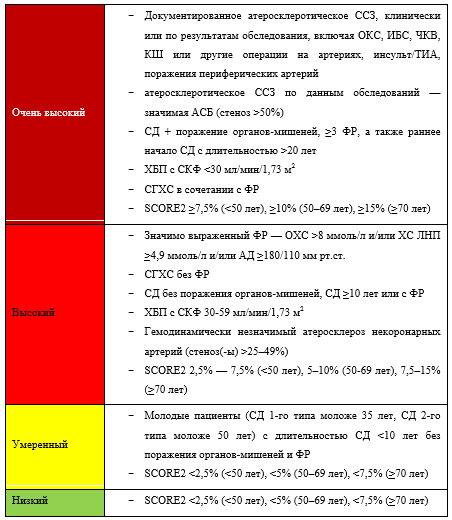
АГ — артериальная гипертензия, ХБП — хроническая болезнь почек, СКФ — скорость клубочковой фильтрации, ТИА — транзиторная ишемическая атака, CCЗ — сердечно-сосудистые заболевания, АСБ — атеросклеротическая бляшка, СГХС — семейная гиперхолестеринемия, ФР — фактор риска.
Комментарии • 0
Чтобы оставить комментарий, пожалуйста, войдите или зарегистрируйтесь.