O’Connell J B, Quiñones-Baldrich W J. Proper evaluation and management of acute embolic versus thrombotic limb ischemia. Semin Vasc Surg. 2009;22(01):10–16.
Santistevan J R. Acute limb ischemia: an emergency medicine approach. Emerg Med Clin North Am. 2017;35(04):889–909.
Callum K, Bradbury A.ABC of arterial and venous disease: Acute limb ischaemia BMJ 2000320(7237):764–767.
Thai T.T.et al.The Contemporary Safety and Effectiveness of Lower Extremity Bypass Surgery and Peripheral Endovascular Interventions in the Treatment of Symptomatic Peripheral Arterial Disease. Circulation. 2015; 132 (21) :1999-2011.
Earnshaw J. J. Where we have come from: a short history of surgery for acute limb ischaemia //European Journal of Vascular and Endovascular Surgery. – 2020. – Т. 59. – №. 2. – С. 169-170. doi: 10.1016/j.ejvs.2019.07.032.
European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia. Eur J Vasc Endovasc Surg. 2020; 59: , 173 – 218; https://doi.org/10.1016/j.ejvs.2019.09.006.
Anand SS, Caron F, Eikelboom JW, Bosch J, Dyal L, Aboyans V, Abola MT, Branch KRH, Keltai K, Bhatt DL, Verhamme P, Fox KAA, Cook-Bruns N, Lanius V, Connolly SJ, Yusuf S. Major Adverse Limb Events and Mortality in Patients With Peripheral Artery Disease: The COMPASS Trial. J Am Coll Cardiol. 2018.
Ljungman C, Adami HO, Bergqvist D, Sparen P, Bergström R. Risk factors for early lower limb loss after embolectomy for acute arterial occlusion: a population-based case-control study. Br J Surg. 1991;78(12):1482-1485. doi:10.1002/bjs.1800781224.
Gandini R, Merolla S, Chegai F, Del Giudice C, Stefanini M, Pampana E. Foot embolization during limb salvage procedures in critical limb ischemia patients successfully managed with mechanical thromboaspiration: a technical note. J Endovasc Ther. 2015;22(04):558–563.].
Acar R D, Sahin M, Kirma C. One of the most urgent vascular circumstances: Acute limb ischemia. SAGE Open Med. 2013;1:2.05031211351611E.
Lau J F, Weinberg M D, Olin J W. Peripheral artery disease. Part 1: clinical evaluation and noninvasive diagnosis. Nat Rev Cardiol. 2011;8(07):405–418.
Hess C N, Huang Z, Patel M R. Acute limb ischemia in peripheral artery disease. Circulation. 2019;140(07):556–565.
Creager M A, Kaufman J A, Conte M S. Clinical practice. Acute limb ischemia. N Engl J Med. 2012;366(23):2198–2206.
Hess C N, Rogers R K, Wang T Y. Major adverse limb events and 1-year outcomes after peripheral artery revascularization. J Am Coll Cardiol. 2018;72(09):999–1011.
Grip O. Open or endovascular revascularization in the treatment of acute lower limb ischaemia. Br.J.Surg. 2018105(12):1598-1606.
Darwood R. Acute limb ischaemia. Available at: www. rcemlearning.co.uk/references/acute-limb-ischaemia (accessed 21 August 2019).
Enezate TH, Omran J, Mahmud E, et al. Endovascular versus surgical treatment for acute limb ischemia: a systematic review and meta-analysis of clinical trials. Cardiovasc Diagn Ther. 2017;7(3):264-271. doi:10.21037/cdt.2017.03.03.
Howard DP, Banerjee A, Fairhead JF, et al. Population-Based Study of Incidence, Risk Factors, Outcome, and Prognosis of Ischemic Peripheral Arterial Events: Implications for Prevention [published correction appears in Circulation. 2015 Nov 10;132(19):e234]. Circulation. 2015;132(19):1805-1815.
Natarajan B,Patel P, Mukherjee F. Acute Lower Limb Ischemia - Etiology, Pathology, and Management. Int J Angiol. 2020;29:168–174.DOI https://doi.org/10.1055/s-0040-1713769.
Behrendt С-A, Seiffert M, Gerloff C, L’Hoest H, Acar L,Thomalla G. How Does SARS-CoV-2 Infection Affect Survival of Emergency Cardiovascular Patients? A Cohort Study From a German Insurance Claims Database. Eur J Vasc Endovasc Surg (2021) 62(1), 119-125. doi: 10.1016/j.ejvs.2021.03.006.
Винокуров И.А. Острая ишемия нижних конечностей в условиях пандемии COVID-19. Кардиоваскулярная терапия и профилактика. 2021;20(4):2932. https://doi.org/10.15829/1728-8800-2021-2932.
Острая артериальная непроходимость. В кн. Клиническая хирургия: национальное руководство. Том 3. Под редакцией Савельева В.С., Кириенко А.И. М.: ГЭОТАР-Медиа. 2010; 95: 830–914.
Затевахин И.И., Цициашвили М.Ш,, Золкин В.Н. Острая артериальная непроходимость В кн. Клиническая ангиология/ под ред А.В.Покровского. М.:Медицина,2004. С. 596- 623.
Синявин Г.В., Винокуров И.А., Мнацаканян Г.В., Белов Ю.В. Эпидемиология и патогенез острой ишемии нижних конечностей Кардиология и сердечно-сосудистая хирургия 2019, Т. 12, No4, с. 291-295https://doi.org/10.17116/kardio201912041291.
Соpока В., Нохpин С., Магамедов И. Основные механизмыостpой тpомбоэмбологенной ишемии нижних конечностей.Pоссийский биомедицинский жуpнал. 2015;16(4):12-14.
Савельев В.С., Затевахин И.И., Степанов Н.В. Острая непроходимость бифуркации аорты и магистральных артерий конечностей.М.:Медицина.1987-304с.
Кошкин В.М.,Каралкин А.В., Насташева О.Д., Кошкина И.В., Зимин В.Р., Сергеева Н.А. Феномен реактивной гиперемии в клинической практике. Регионарное кровообращение и микроциркуляция. 2012. 11; 3 (43): 45-50.
Феномен реактивной гиперемии в клинической практике. Регионарное кровообращение и микроциркуляция. 2012. 11; 3 (43): 45-50.
Natarajan B,Patel P, Mukherjee F. Acute Lower Limb Ischemia - Etiology, Pathology, and Management. Int J Angiol. 2020;29:168–174.DOI https://doi.org/10.1055/s-0040-1713769.
Creager MA, Kaufman JA, Conte MS. Clinical practice. Acute limb ischemia N Engl J Med . 2012;366(23):2198-206. doi: 10.1056/NEJMcp1006054.
Davies B., Braithwaite B.D., Birch P.A., Poskitt K.R., Heather B.P., Earnshaw JJ Acute leg ischaemia in Gloucestershire. Br J Surg 1997;84 (4):504-508 https://doi.org/10.1046/j.1365-2168.1997.02601.x.
Eyers P, Earnshaw JJ. Acute non-traumatic arm ischaemia .British Journal of Surgery, 1998;85 (10):1340–1346, https://doi.org/10.1046/j.1365-2168.1998.00884.x.
Dryjski M, Swedenborg J. Acute ischemia of the extremities in a metropolitan area during one year. J Cardiovasc Surg (Torino). 1984;25(6):518-522.
Christer Ljungman, Lars Holmberg, David Bergqvist, Reinhold Bergström, Hans-Olov Adami, Amputation risk and survival after embolectomy for acute arterial ischaemia. Time trends in a defined Swedish population, European Journal of Vascular and Endovascular Surgery, Volume 11, Issue 2, 1996, Pages 176-182, ISSN 1078-5884, https://doi.org/10.1016/S1078-5884(96)80048-7.
Korabathina R, Weintraub AR, Price LL, et al. Twenty-year analysis of trends in the incidence and in-hospital mortality for lower-extremity arterial thromboembolism. Circulation. 2013;128(2):115-121. doi:10.1161/CIRCULATIONAHA.113.003543.
Baril D. T., Ghosh K., Rosen A. B. Trends in the incidence, treatment, and outcomes of acute lower extremity ischemia in the United States Medicare population //Journal of vascular surgery. – 2014. – Т. 60. – №. 3. – С. 669-677. e2.
Grip O, Kuoppala M, Acosta S, Wanhainen A Åkeson, J, Björck M, Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion, British Journal of Surgery, Volume 101, Issue 9, August 2014, Pages 1105 -1112, https://doi.org/10.1002/bjs.9579.
Grip O, Kuoppala M, Acosta S, Wanhainen A, Åkeson J, M Björck, Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion, British Journal of Surgery, Volume 101, Issue 9, August 2014, Pages 1105 -1112, https://doi.org/10.1002/bjs.9579.
Grip O., Wanhainen A., Acosta S., Björck M., Long-term Outcome after Thrombolysis for Acute Lower Limb Ischaemia, European Journal of Vascular and Endovascular Surgery, Volume 53, Issue 6, 2017, Pages 853-861, ISSN 1078-5884, https://doi.org/10.1016/j.ejvs.2017.02.003].
Bath J, Kim RJ, Dombrovskiy VY, Vogel TR. Contemporary trends and outcomes of thrombolytic therapy for acute lower extremity ischemia. Vascular. 2019;27(1):71-77. doi:10.1177/1708538118797782.
Grip O, Kuoppala M, Acosta S, Wanhainen A Åkeson, J, Björck M, Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion, British Journal of Surgery, Volume 101, Issue 9, August 2014, Pages 1105 -1112, https://doi.org/10.1002/bjs.9579.
Национальные рекомендации по ведению больных с заболеваниями артерий нижних конечностей. Российский согласительный документ.Москва,2013.68с.
Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM Ahn S, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26: 517-538.
European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia. Eur J Vasc Endovasc Surg. 2020; 59: , 173 – 218. https://doi.org/10.1016/j.ejvs.2019.09.006.
Callum K, Bradbury A. ABC of arterial and venous disease: Acute limb ischaemia. BMJ 2000;320(7237):764–767.
Olinic D-M, Stanek A, Tătaru D-A, Homorodean C, Olinic M. Acute Limb Ischemia: An Update on Diagnosis and Management. J Clin Med 2019;8(08):1215.
Dieter R, Dieter RA III, Dieter RA III, Nanjundappa A, eds. Critical Limb Ischemia Acute and Chronic. Switzerland: Springer International Publishing; 2017.
Aboyans V, Ricco J-B, Bartelink MEL, et al; ESC Scientific Document Group. 2017 ESC Guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal,upper and lower extremity arteries endorsedby: theEuropeanStroke Organization (ESO)The Task Force for theDiagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39(09):763–816.
Natarajan В, Patel Р, Mukherjee А. Acute Lower Limb Ischemia - Etiology, Pathology, and Management.Int J Angiol 2020;29:168–174.
Björck M, Earnshaw JJ, Acosta S, et al. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia. European Journal of Vascular and Endovascular Surgery. 2020;59(2):173-218. doi:10.1016/j.ejvs.2019.09.006.
Menke J, Lüthje L, Kastrup A, Larsen J. Thromboembolism in Atrial Fibrillation. American Journal of Cardiology. 2010;105(4):502-510. doi:10.1016/j.amjcard.2009.10.018.
Preuss A, Elgeti T, Hamm B, Werncke T. Extravascular incidental findings in run-off CT angiography in patients with acute limb ischaemia: incidence and clinical relevance. Clin Radiol 2015;70: 622e9.
Björck M. и др. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia: 2 // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2020. Т. 59, № 2. С. 173–218.
Grip O, Wanhainen A, Michaëlsson K, Lindhagen L, Björck M, Open or endovascular revascularization in the treatment of acute lower limb ischaemia, British Journal of Surgery, Volume 105, Issue 12, November 2018, Pages 1598–1606, https://doi.org/10.1002/bjs.10954.
Santistevan JR. Acute limb ischemia: an emergency medicine approach. Emerg Med Clin North Am 2017;35:889e909.
Fluck F, Augustin AM, Bley T, Kickuth R. Current Treatment Options in Acute Limb Ischemia. RoFo Fortschritte auf dem Gebiet der Rontgenstrahlen und der Bildgebenden Verfahren. 2020;192(4):319-326. doi:10.1055/a-0998-4204.
Pahuja M, Ranka S, Chehab O, et al. Incidence and clinical outcomes of bleeding complications and acute limb ischemia in STEMI and cardiogenic shock. Catheterization and Cardiovascular Interventions. 2021;97(6):1129-1138. doi:10.1002/ccd.29003.
Nicolajsen CW, Dickenson MH, Budtz-Lilly J, Eldrup N. Frequency of cancer in patients operated on for acute peripheral arterial thrombosis and the impact on prognosis. Journal of Vascular Surgery. 2015;62(6):1598-1606. doi:10.1016/j.jvs.2015.06.223.
Currie IS, Wakelin SJ, Lee AJ, Chalmers RT. Plasma creatine kinase indicates major amputation or limb preservation in acute lower limb ischemia. Journal of Vascular Surgery. 2007;45(4):733-739. doi:10.1016/j.jvs.2006.12.050.
Watson JDB, Gifford SM, Clouse WD. Biochemical markers of acute limb ischemia, rhabdomyolysis, and impact on limb salvage. Seminars in Vascular Surgery. 2014;27(3-4):176-181. doi:10.1053/j.semvascsurg.2015.01.007.
Bjorck M, Beiles B, Menyhei G, Thomson I, Wigger P, Venermo M, et al. Editor’s Choice: Contemporary treatment of popliteal artery aneurysm in eight countries: A Report from the Vascunet collaboration of registries. Eur J Vasc Endovasc Surg 2014;47:164e71.
Weiss CR, Azene EM, Majdalany BS, AbuRahma AF, Collins JD, Francois CJ, et al. ACR Appropriateness Criteria((R)) Sudden Onset of Cold, Painful Leg. J Am Coll Radiol 2017;14:S307e13.
Fowkes F Gerald R *, Rudan Diana *, Rudan Igor *, Aboyans Victor, Denenberg Julie O, McDermott Mary M, Norman Paul E, Sampson Uchechukwe K A, Williams Linda J, Mensah George A, Criqui Michael H. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Published Online August 1, 2013 http://dx.doi.org/10.1016/ S0140-6736(13)61249-0.
Спиридонов А.А., Бузиашвили Ю.И., Шумилина М.В. Ультразвуковая диагностика патологии артерий нижних конечностей: Учебно-метод. руководство. М.: Спектромед; 1996.
Шумилина М.В., Аракелян В. С. Алгоритм неинвазивной диагностики при ишемии нижних конечностей. Учебно-методическое пособие. Москва.: НМИЦ ССХ им. АН Бакулева МЗ РФ; 2019.- 46с. 46. ISBN: 978-5-7982-0396-3. УДК: 616.137-005.4-089.819.
Шумилина, М.В. Комплексная ультразвуковая диагностика патологии периферических сосудов.М.: Издательство НЦССХ им. А.Н. Бакулева РАМН; 2012.
ESUR Guidelines on Contrast Agents. Available at: http://www. esur-cm.org/index.php/b-renal-adverse-reactions-2. (Accessed 21 August 2019).
Zlatanovic P, Koncar I, Dragas M, Ilic N, Sladojevic M, Mutavdzic P, et al. Combined impact of chronic kidney disease and contrast induced acute kidney injury on long-term outcomes in patients with acute lower limb ischaemia. Eur J Vasc Endovasc Surg 2018;56:78e86.
Madhuripan N, Mehta P, Smolinski SE, Njuguna N. Computed tomography angiography of the extremities in emergencies. Semin Ultrasound CT MR 2017;38:357e69.
Jens S, Koelemay MJ, Reekers JA, Bipat S. Diagnostic perfor- mance of computed tomography angiography and contrast- enhanced magnetic resonance angiography in patients with critical limb ischaemia and intermittent claudication: systematic review and meta-analysis. Eur Radiol 2013;23:3104e14.
Jens S, Kerstens MK, Legemate DA, Reekers JA, Bipat S, Koelemay MJ. Diagnostic performance of computed tomography angiography in peripheral arterial injury due to trauma: a sys- tematic review and meta-analysis. Eur J Vasc Endovasc Surg 2013;46:329e37.
Jakubiak A, Waliszewska M, Guzin ski M, Sasiadek M. The value Î of 64-detector computed tomography angiography as a diag- nostic method during emergency service in acute lower limbs ischemia. Polish J Radiol 2009;74:37e41.
Crawford JD, Perrone KH, Jung E, Mitchell EL, Landry GJ, Moneta GL. Arterial duplex for diagnosis of peripheral arterial emboli. J Vasc Surg 2016;64:1351e6.
Collins R, Cranny G, Burch J, et al. A systematic review of duplex ultrasound, magnetic resonance angiography and computed tomography angiography for the diagnosis and assessment of symptomatic, lower limb peripheral arterial disease HTA Health Technology Assessment NHS R&D HTA Programme www.hta.ac.uk. Health Technology Assessment. 2007;11(20). http://www.hta.ac.uk.
Met R, Bipat S, Legemate DA, Reekers JA, Koelemay MJW. Diagnostic performance of computed tomography angiography in peripheral arterial disease: a systematic review and meta-analysis. JAMA. 2009;301(4):415-424. doi:10.1001/JAMA.301.4.415.
Lapeyre M, Kobeiter H, Desgranges P, Rahmouni A, Becquemin JP, Luciani A. Assessment of critical limb ischemia in patients with diabetes: Comparison of MR angiography and digital subtraction angiography. American Journal of Roentgenology. 2005;185(6):1641-1650. doi:10.2214/AJR.04.1111.
Sultan S, Tawfick W, Hynes N. Ten-year technical and clinical outcomes in TransAtlantic Inter-Society Consensus II infrainguinal C/D lesions using duplex ultrasound arterial mapping as the sole imaging modality for critical lower limb ischemia. Journal of Vascular Surgery. 2013;57(4):1038-1045. doi:10.1016/j.jvs.2012.10.005.
Menke J, Larsen J. Meta-analysis: Accuracy of contrast-enhanced magnetic resonance angiography for assessing steno-occlusions in peripheral arterial disease. Ann Intern Med. 2010;153(5):325-334. doi:10.7326/0003-4819-153-5-201009070-00007.
Heijenbrok-Kal MH, Kock MCJM, Hunink MGM. Lower extremity arterial disease: Multidetector CT angiography - Meta-analysis. Radiology. 2007;245(2):433-439. doi:10.1148/radiol.2451061280.
Riambau V, Bockler D, Brunkwall J, Cao P, Chiesa R, Coppi G, et al. Editor’s choice e Management of descending thoracic aorta diseases: clinical practice guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2017;53:4e52.
Ebben HP, Jongkind V, Wisselink W, Hoksbergen AWJ, Yeung KK. Catheter directed thrombolysis protocols for periph- eral arterial occlusions: a systematic review. Eur J Vasc Endovasc Surg 2019;57:667e75.
Janzing H. и др. Chylothorax after blunt chest trauma: 1 // ACTA Chir. Belg. 1992. Т. 92, № 1. С. 26–27.
Ulmer T. The clinical diagnosis of compartment syndrome of the lower leg: are clinical findings predictive of the disorder? // J. Orthop. Trauma. 2002. Т. 16, № 8. С. 572–577.
Lappalainen H. и др. Elimination kinetics of myoglobin and creatine kinase in rhabdomyolysis: implications for follow-up // Crit. Care Med. 2002. Т. 30, № 10. С. 2212–2215.
Ward M.M. Factors predictive of acute renal failure in rhabdomyolysis // Arch. Intern. Med. 1988. Т. 148, № 7. С. 1553–1557.
Bhat T.M., Afari M.E., Garcia L.A. Neutrophil lymphocyte ratio in peripheral vascular disease: a review // Expert Rev. Cardiovasc. Ther. 2016. Т. 14, № 7. С. 871–875.
Bhutta H. и др. Neutrophil-lymphocyte ratio predicts medium-term survival following elective major vascular surgery: a cross-sectional study // Vasc. Endovascular Surg. 2011. Т. 45, № 3. С. 227–231.
Gerhard-Herman M.D. и др. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines // Circulation. American Heart Association, 2017. Т. 135, № 12. С. e726–e779.
Gourgiotis S. и др. Acute limb compartment syndrome: a review // J. Surg. Educ. 2007. Т. 64, № 3. С. 178–186.
McQueen M.M., Court-Brown C.M. Compartment monitoring in tibial fractures. The pressure threshold for decompression // J. Bone Joint Surg. Br. 1996. Т. 78, № 1. С. 99–104.
Williams P.R., Russell I.D., Mintowt-Czyz W.J. Compartment pressure monitoring--current UK orthopaedic practice // Injury. 1998. Т. 29, № 3. С. 229–232.
Prayson M.J. и др. Baseline compartment pressure measurements in isolated lower extremity fractures without clinical compartment syndrome // J. Trauma. 2006. Т. 60, № 5. С. 1037–1040.
Papalambros E.L. и др. Prophylactic fasciotomy of the legs following acute arterial occlusion procedures // Int. Angiol. J. Int. Union Angiol. 1989. Т. 8, № 3. С. 120–124.
Orrapin S. и др. Predictive Factors for Post-Ischemic Compartment Syndrome in Non-Traumatic Acute Limb Ischemia in a Lower Extremity // Ann. Vasc. Dis. 2017. Т. 10, № 4. С. 378–385.
Deguara J. и др. Upper limb ischemia: 20 years experience from a single center // Vascular. 2005. Т. 13, № 2. С. 84–91.
Kayssi A. и др. The spectrum and management of noniatrogenic vascular trauma in the pediatric population // J. Pediatr. Surg. 2018. Т. 53, № 4. С. 771–774.
Stonebridge P.A. и др. Acute ischaemia of the upper limb compared with acute lower limb ischaemia; a 5-year review // Br. J. Surg. 1989. Т. 76, № 5. С. 515–516.
Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM Ahn S, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26: 517-538.
Aboyans V. и др. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS): 9 // Eur. Heart J. 2018. Т. 39, № 9. С. 763–816.
Clair D., Shah S., Weber J. Current state of diagnosis and management of critical limb ischemia // Curr. Cardiol. Rep. 2012. Т. 14, № 2. С. 160–170.
Chisari A. и др. Upper limb ischemia from arterial thromboembolism: a comprehensive review of incidence, etiology, clinical aspects, diagnostic tools, treatment options and prognosis // Minerva Cardioangiol. 2016. Т. 64, № 6. С. 625–634.
Dabbous M.K., Sakr F.R., Malaeb D.N. Anticoagulant therapy in pediatrics // J. Basic Clin. Pharm. 2014. Т. 5, № 2. С. 27–33.
Lazarides M.K. и др. Operative and nonoperative management of children aged 13 years or younger with arterial trauma of the extremities // J. Vasc. Surg. 2006. Т. 43, № 1. С. 72–76.
Campbell W.B. и др. Non-operative treatment of advanced limb ischaemia: the decision for palliative care // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2000. Т. 19, № 3. С. 246–249.
Aboyans V, Ricco J-B, Bartelink MEL, et al; ESC Scientific Document Group. 2017 ESC Guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal,upper and lower extremity arteries endorsedby: theEuropeanStroke Organization (ESO)The Task Force for theDiagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39(09):763–816.
Alonso-Coello P. и др. Antithrombotic Therapy in Peripheral Artery Disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. 2012. Т. 141, № 2, Supplement. С. e669S-e690S.
Jivegård L. и др. Acute lower limb ischemia: failure of anticoagulant treatment to improve one-month results of arterial thromboembolectomy. A prospective randomized multi-center study // Surgery. 1991. Т. 109, № 5. С. 610–616.
Wang S.K. и др. Perioperative Outcomes are Adversely Affected by Poor Pretransfer Adherence to Acute Limb Ischemia Practice Guidelines // Ann. Vasc. Surg. 2018. Т. 50. С. 46–51.
Linkins L.-A. и др. Treatment and Prevention of Heparin-Induced Thrombocytopenia: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. 2012. Т. 141, № 2, Supplement. С. e495S-e530S.
Berridge D.C., Hopkinson B.R., Makin G.S. Acute lower limb arterial ischaemia: a role for continuous oxygen inhalation // Br. J. Surg. 1989. Т. 76, № 10. С. 1021–1023.
Mangiafico R.A., Mangiafico M. Medical treatment of critical limb ischemia: current state and future directions // Curr. Vasc. Pharmacol. 2011. Т. 9, № 6. С. 658–676.
Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients // BMJ. 2002. Т. 324, № 7329. С. 71–86.
Antithrombotic Trialists’ (ATT) Collaboration и др. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials // Lancet Lond. Engl. 2009. Т. 373, № 9678. С. 1849–1860.
Kumbhani D.J. и др. Statin therapy and long-term adverse limb outcomes in patients with peripheral artery disease: insights from the REACH registry // Eur. Heart J. 2014. Т. 35, № 41. С. 2864–2872.
Bedenis R. и др. Antiplatelet agents for preventing thrombosis after peripheral arterial bypass surgery // Cochrane Database Syst. Rev. 2015. № 2. С. CD000535.
Perk J. и др. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts) // Eur. Heart J. 2012. Т. 33, № 13. С. 1635–1701.
Rooke T.W. и др. 2011 ACCF/AHA Focused Update of the Guideline for the Management of Patients With Peripheral Artery Disease (updating the 2005 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. 2011. Т. 58, № 19. С. 2020–2045.
Stone N.J. и др. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. 2014. Т. 63, № 25 Pt B. С. 2889–2934.
Björck M. и др. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2020. Т. 59, № 2. С. 173–218.
CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee // Lancet Lond. Engl. 1996. Т. 348, № 9038. С. 1329–1339.
Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial // Lancet Lond. Engl. 2002. Т. 360, № 9326. С. 7–22.
Hirsch A.T., Duval S. The global pandemic of peripheral artery disease // Lancet Lond. Engl. 2013. Т. 382, № 9901. С. 1312–1314.
Momsen A.H. и др. Drug therapy for improving walking distance in intermittent claudication: a systematic review and meta-analysis of robust randomised controlled studies // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2009. Т. 38, № 4. С. 463–474.
Liang N.L. и др. Comparative effectiveness of anticoagulation on midterm infrainguinal bypass graft patency // J. Vasc. Surg. 2017. Т. 66, № 2. С. 499-505.e2.
Elliott J.P. и др. Arterial embolization: problems of source, multiplicity, recurrence, and delayed treatment // Surgery. 1980. Т. 88, № 6. С. 833–845.
Petersen P. Thromboembolic complications in atrial fibrillation // Stroke. 1990. Т. 21, № 1. С. 4–13.
Ljungman C, Adami HO, Bergqvist D, Sparen P, Bergström R. Risk factors for early lower limb loss after embolectomy for acute arterial occlusion: a population-based case-control study. Br J Surg. 1991;78(12):1482-1485. doi:10.1002/bjs.1800781224.
Campbell W.B., Ridler B.M.F., Szymanska T.H. Two-year Follow-up After Acute Thromboembolic Limb Ischaemia: the Importance of Anticoagulation // Eur. J. Vasc. Endovasc. Surg. 2000. Т. 19, № 2. С. 169–173.
Gómez-Outes A. и др. Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups // Thrombosis. 2013. Т. 2013. С. 640723.
De Haro J. и др. Meta-analysis and adjusted indirect comparison of direct oral anticoagulants in prevention of acute limb ischemia in patients with atrial fibrillation // Curr. Med. Res. Opin. Taylor & Francis, 2016. Т. 32, № 6. С. 1167–1173.
Robinson T. и др. Audit of anticoagulation after embolectomy for acute ischaemia // Ann. R. Coll. Surg. Engl. 2009. Т. 91, № 6. С. 470–472.
Anand S.S. и др. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial // Lancet Lond. Engl. 2018. Т. 391, № 10117. С. 219–229.
Morrow D.A. и др. Evaluation of a novel antiplatelet agent for secondary prevention in patients with a history of atherosclerotic disease: design and rationale for the Thrombin-Receptor Antagonist in Secondary Prevention of Atherothrombotic Ischemic Events (TRA 2 degrees P)-TIMI 50 trial // Am. Heart J. 2009. Т. 158, № 3. С. 335-341.e3.
Bonaca M.P. и др. Rivaroxaban in Peripheral Artery Disease after Revascularization // N. Engl. J. Med. Massachusetts Medical Society, 2020. Т. 382, № 21. С. 1994–2004.
Grip O, Kuoppala M, Acosta S, Wanhainen A, Åkeson J, M Björck, Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion, British Journal of Surgery, Volume 101, Issue 9, August 2014, Pages 1105 -1112, https://doi.org/10.1002/bjs.9579.
Baril D. T., Ghosh K., Rosen A. B. Trends in the incidence, treatment, and outcomes of acute lower extremity ischemia in the United States Medicare population //Journal of vascular surgery. – 2014. – Т. 60. – №. 3. – С. 669-677. e2.
Downey C. и др. An algorithmic approach to the management of limb ischemia in infants and young children // Plast. Reconstr. Surg. 2013. Т. 131, № 3. С. 573–581.
Enezate TH, Omran J, Mahmud E, et al. Endovascular versus surgical treatment for acute limb ischemia: a systematic review and meta-analysis of clinical trials. Cardiovasc Diagn Ther. 2017;7(3):264-271. doi:10.21037/cdt.2017.03.03.
Taha A.G. и др. Comparative effectiveness of endovascular versus surgical revascularization for acute lower extremity ischemia // J. Vasc. Surg. 2015. Т. 61, № 1. С. 147–154.
Davis F.M. и др. Early Outcomes following Endovascular, Open Surgical, and Hybrid Revascularization for Lower Extremity Acute Limb Ischemia // Ann. Vasc. Surg. 2018. Т. 51. С. 106–112.
de Donato G. и др. The combination of surgical embolectomy and endovascular techniques may improve outcomes of patients with acute lower limb ischemia: 3 // J. Vasc. Surg. 2014. Т. 59, № 3. С. 729–736.
Forbes T.L., DeRose G., Harris K.A. Is long-term anticoagulation after acute thromboembolic limb ischemia always necessary? // Can. J. Surg. J. Can. Chir. 2002. Т. 45, № 5. С. 337–340.
Fogarty T.J. и др. A method for extraction of arterial emboli and thrombi // Surg. Gynecol. Obstet. 1963. Т. 116. С. 241–244.
Pemberton M. и др. The Surgical Management of Acute Limb Ischaemia due to Native Vessel Occlusion // Eur. J. Vasc. Endovasc. Surg. 1999. Т. 17, № 1. С. 72–76.
Lipsitz E.C., Veith F.J. Fluoroscopically assisted thromboembolectomy: should it be routine? // Semin. Vasc. Surg. 2001. Т. 14, № 2. С. 100–106.
Kempe K. и др. Results of surgical management of acute thromboembolic lower extremity ischemia // J. Vasc. Surg. 2014. Т. 60, № 3. С. 702–707.
Wyffels P.L., DeBord J.R. Increased limb salvage. Distal tibial/peroneal artery thrombectomy/embolectomy in acute lower extremity ischemia // Am. Surg. 1990. Т. 56, № 8. С. 468–475.
Mahmood A. и др. Microtibial embolectomy // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2003. Т. 25, № 1. С. 35–39.
Morris-Stiff G. и др. Update Experience of Surgery for Acute Limb Ischaemia in a District General Hospital – Are We Getting Any Better? // Ann. R. Coll. Surg. Engl. 2009. Т. 91, № 8. С. 637–640.
de Donato G. и др. The combination of surgical embolectomy and endovascular techniques may improve outcomes of patients with acute lower limb ischemia // J. Vasc. Surg. 2014. Т. 59, № 3. С. 729–736.
Morris-Stiff G., Lewis M.H. Surgical treatment of acute limb iscahemia in the presence of malignancy // Int. J. Surg. 2010. Т. 8, № 3. С. 233–235.
Baril D.T. и др. Outcomes of lower extremity bypass performed for acute limb ischemia // J. Vasc. Surg. 2013. Т. 58, № 4. С. 949–956.
Conte M.S. и др. Global vascular guidelines on the management of chronic limb-threatening ischemia // J. Vasc. Surg. 2019. Т. 69, № 6S. С. 3S-125S.e40.
Soden P.A. и др. Regional variation in patient selection and treatment for lower extremity vascular disease in the Vascular Quality Initiative // J. Vasc. Surg. 2017. Т. 65, № 1. С. 108–118.
Marqués de Marino P. и др. Results of Infrainguinal Bypass in Acute Limb Ischaemia // Eur. J. Vasc. Endovasc. Surg. 2016. Т. 51, № 6. С. 824–830.
Grego F. и др. Popliteal-to-Distal Bypass for Limb Salvage // Ann. Vasc. Surg. 2004. Т. 18, № 3. С. 321–328.
Jungi S. и др. Limb Salvage by Open Surgical Revascularisation in Acute Ischaemia due to Thrombosed Popliteal Artery Aneurysm // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2019. Т. 57, № 3. С. 393–398.
Kropman R.H.J. и др. Clinical outcome of acute leg ischaemia due to thrombosed popliteal artery aneurysm: systematic review of 895 cases // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2010. Т. 39, № 4. С. 452–457.
Cervin A. и др. Treatment of Popliteal Aneurysm by Open and Endovascular Surgery: A Contemporary Study of 592 Procedures in Sweden // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2015. Т. 50, № 3. С. 342–350.
Huang Y. и др. Outcomes of endovascular and contemporary open surgical repairs of popliteal artery aneurysm // J. Vasc. Surg. 2014. Т. 60, № 3. С. 631-638.e2.
Phair A. и др. Meta-analysis of posterior versus medial approach for popliteal artery aneurysm repair // J. Vasc. Surg. 2016. Т. 64, № 4. С. 1141-1150.e1.
Zaraca F. и др. Routine Versus Selective Use of Intraoperative Angiography During Thromboembolectomy for Acute Lower Limb Ischemia: Analysis of Outcomes // Ann. Vasc. Surg. 2010. Т. 24, № 5. С. 621–627.
Balaz P. и др. Early and late outcomes of hybrid endovascular and open repair procedures in patients with peripheral arterial disease // Vasa. Hogrefe AG, 2013. Т. 42, № 4. С. 292–300.
Argyriou C. и др. Hybrid Revascularization Procedures in Acute Limb Ischemia // Ann. Vasc. Surg. 2014. Т. 28, № 6. С. 1456–1462.
Investigators T.S. Results of a prospective randomized trial evaluating surgery versus thrombolysis for ischemia of the lower extremity // Ann Surg. Т. 220. С. 251–268.
Comerota A.J. и др. Results of a prospective, randomized trial of surgery versus thrombolysis for occluded lower extremity bypass grafts // Am. J. Surg. 1996. Т. 172, № 2. С. 105–112.
Ouriel K., Veith F.J. Acute lower limb ischemia: determinants of outcome // Surgery. 1998. Т. 124, № 2. С. 336–341; discussion 341-342.
Vakhitov D. и др. Survival of Patients and Treatment-Related Outcome After Intra-Arterial Thrombolysis for Acute Lower Limb Ischemia // Ann. Vasc. Surg. 2019. Т. 55. С. 251–259.
Byrne R.M. и др. Contemporary outcomes of endovascular interventions for acute limb ischemia // J. Vasc. Surg. 2014. Т. 59, № 4. С. 988–995.
Kashyap V.S. и др. Endovascular therapy for acute limb ischemia // J. Vasc. Surg. 2011. Т. 53, № 2. С. 340–346.
Grip O, Wanhainen A, Michaëlsson K, Lindhagen L, Björck M, Open or endovascular revascularization in the treatment of acute lower limb ischaemia, British Journal of Surgery, Volume 105, Issue 12, November 2018, Pages 1598–1606, https://doi.org/10.1002/bjs.10954.
Lurie F., Vaidya V., Comerota A.J. Clinical outcomes and cost-effectiveness of initial treatment strategies for nonembolic acute limb ischemia in real-life clinical settings // J. Vasc. Surg. 2015. Т. 61, № 1. С. 138–146.
Falkowski A. и др. Safety and Efficacy of Ultra-high-dose, Short-term Thrombolysis with rt-PA for Acute Lower Limb Ischemia // Eur. J. Vasc. Endovasc. Surg. 2013. Т. 46, № 1. С. 118–123.
Braithwaite B.D. и др. Peripheral thrombolysis for acute-onset claudication. Thrombolysis Study Group // Br. J. Surg. 1999. Т. 86, № 6. С. 800–804.
Korn P. и др. Thrombolysis for native arterial occlusions of the lower extremities: Clinical outcome and cost // J. Vasc. Surg. 2001. Т. 33, № 6. С. 1148–1157.
Acosta S., Kuoppala M. Update on intra-arterial thrombolysis in patients with lower limb ischemia // J. Cardiovasc. Surg. (Torino). 2015. Т. 56, № 2. С. 317–324.
Kuoppala M., Åkeson J., Acosta S. Outcome after thrombolysis for occluded endoprosthesis, bypasses and native arteries in patients with lower limb ischemia // Thromb. Res. 2014. Т. 134, № 1. С. 23–28.
Braithwaite B.D. и др. Prospective randomized trial of high-dose bolus versus low-dose tissue plasminogen activator infusion in the management of acute limb ischaemia. Thrombolysis Study Group // Br. J. Surg. 1997. Т. 84, № 5. С. 646–650.
Working Party on Thrombolysis in the Management of Limb Ischemia. Thrombolysis in the management of lower limb peripheral arterial occlusion--a consensus document // J. Vasc. Interv. Radiol. JVIR. 2003. Т. 14, № 9 Pt 2. С. S337-349.
Marquis-Gravel G. и др. Ultrasound guidance versus anatomical landmark approach for femoral artery access in coronary angiography: A randomized controlled trial and a meta-analysis // J. Intervent. Cardiol. 2018. Т. 31, № 4. С. 496–503.
Stone P.A., Campbell J.E. Complications related to femoral artery access for transcatheter procedures // Vasc. Endovascular Surg. 2012. Т. 46, № 8. С. 617–623.
Poorthuis M.H.F. и др. Plasma fibrinogen level as a potential predictor of hemorrhagic complications after catheter-directed thrombolysis for peripheral arterial occlusions // J. Vasc. Surg. 2017. Т. 65, № 5. С. 1519-1527.e26.
Berridge D.C. и др. Randomized trial of intra-arterial recombinant tissue plasminogen activator, intravenous recombinant tissue plasminogen activator and intra-arterial streptokinase in peripheral arterial thrombolysis // Br. J. Surg. 1991. Т. 78, № 8. С. 988–995.
Ebben H.P. и др. Low-dose Thrombolysis for Thromboembolic Lower Extremity Arterial Occlusions is Effective Without Major Hemorrhagic Complications // Eur. J. Vasc. Endovasc. Surg. 2014. Т. 48, № 5. С. 551–558.
Ebben H.P. и др. Catheter Directed Thrombolysis Protocols for Peripheral Arterial Occlusions: a Systematic Review // Eur. J. Vasc. Endovasc. Surg. 2019. Т. 57, № 5. С. 667–675.
Darwood R. и др. Surgery versus thrombolysis for initial management of acute limb ischaemia // Cochrane Database Syst. Rev. 2018. Т. 8. С. CD002784.
Wang J.C., Kim A.H., Kashyap V.S. Open surgical or endovascular revascularization for acute limb ischemia // J. Vasc. Surg. 2016. Т. 63, № 1. С. 270–278.
Kuoppala M. и др. Risk factors for haemorrhage during local intra-arterial thrombolysis for lower limb ischaemia // J. Thromb. Thrombolysis. 2011. Т. 31, № 2. С. 226–232.
Galland R.B. и др. Acute limb deterioration during intra-arterial thrombolysis // Br. J. Surg. 1993. Т. 80, № 9. С. 1118–1120.
Ouriel K. и др. A comparison of thrombolytic therapy with operative revascularization in the initial treatment of acute peripheral arterial ischemia // J. Vasc. Surg. 1994. Т. 19, № 6. С. 1021–1030.
Ouriel K., Veith F.J., Sasahara A.A. A comparison of recombinant urokinase with vascular surgery as initial treatment for acute arterial occlusion of the legs. Thrombolysis or Peripheral Arterial Surgery (TOPAS) Investigators // N. Engl. J. Med. 1998. Т. 338, № 16. С. 1105–1111.
Grip O. Open or endovascular revascularization in the treatment of acute lower limb ischaemia. Br.J.Surg. 2018105(12):1598-1606.
Grip O. и др. Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion // Br. J. Surg. 2014. Т. 101, № 9. С. 1105–1112.
Ravn H., Björck M. Popliteal artery aneurysm with acute ischemia in 229 patients. Outcome after thrombolytic and surgical therapy // Eur. J. Vasc. Endovasc. Surg. Off. J. Eur. Soc. Vasc. Surg. 2007. Т. 33, № 6. С. 690–695.
Gabrielli R. и др. Outcome after preoperative or intraoperative use of intra-arterial urokinase thrombolysis for acute popliteal artery thrombosis and leg ischemia // Thorac. Cardiovasc. Surg. 2015. Т. 63, № 2. С. 164–167.
Wagner H.J., Starck E.E. Acute embolic occlusions of the infrainguinal arteries: percutaneous aspiration embolectomy in 102 patients // Radiology. 1992. Т. 182, № 2. С. 403–407.
Kwok C.H.R. и др. Aspiration Thrombectomy versus Conventional Catheter-Directed Thrombolysis as First-Line Treatment for Noniatrogenic Acute Lower Limb Ischemia // J. Vasc. Interv. Radiol. JVIR. 2018. Т. 29, № 5. С. 607–613.
Schrijver A.M. и др. Dutch randomized trial comparing standard catheter-directed thrombolysis and ultrasound-accelerated thrombolysis for arterial thromboembolic infrainguinal disease (DUET) // J. Endovasc. Ther. Off. J. Int. Soc. Endovasc. Spec. 2015. Т. 22, № 1. С. 87–95.
Shoenfeld N.A. и др. The Management of Early In Situ Saphenous Vein Bypass Occlusions // Arch. Surg. 1987. Т. 122, № 8. С. 871–875.
Cohen J.R. и др. Recognition and Management of Impending Vein-Graft Failure: Importance for Long-term Patency // Arch. Surg. 1986. Т. 121, № 7. С. 758–759.
Whittemore A.D. и др. Secondary Femoropopliteal Reconstruction // Ann. Surg. 1981. Т. 193, № 1. С. 35–42.
Bandyk D.F. и др. Therapeutic options for acute thrombosed in situ saphenous vein arterial bypass grafts // J. Vasc. Surg. 1990. Т. 11, № 5. С. 680–687.
Koraen L. и др. Thrombolysis for lower extremity bypass graft occlusion // J. Vasc. Surg. 2011. Т. 54, № 5. С. 1339–1344.
Crawford JD, Perrone KH, Wong VW, Mitchell EL, Azarbal AF, Liem TK, et al. A modern series of acute aortic occlusion. J Vasc Surg 2014;59:1044e50.
Hines G.L, Liu H.H. Acute Aortic Occlusion and Its Sequelae: Metabolic, Pathologic Etiology, and Management. // Cardiol Rev. 2021 Mar-Apr 01;29(2):57-61. doi: 10.1097/CRD.0000000000000313.
Meagher AP, Lord RS, Graham AR, Hill DA. Acute aortic occlu-sion presenting with lower limb paralysis. J Cardiovasc Surg 1991;32:643e7.
Robinson WP, Patel RK, Columbo JA, Flahive J, Aiello FA, Baril DT, et al. Contemporary management of acute aortic occlusion has evolved but outcomes have not significantly improved. Ann Vasc Surg 2016;34:178e86.
Grip O., Wanhainen A., Björck M. Time-trends and management of acute aortic occlusion: a 21-year experience. // Eur J Vasc Endovasc Surg 2019;58:690e6.
Greenhalgh RM, Brown LC, Powell JT, Thompson SG, Epstein D, Sculpher MJ. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med 2010;362:1863e71.
Behrendt C.A., Dayama A., Debus E.S., Heidemann F., Matolo N.M., Kolbel T. Lower extremity ischemia after abdominal aortic aneurysm repair. // Ann Vasc Surg 2017;45:206e12.
Grip O., Wanhainen A., Bjorck M. Acute aortic occlusion. // Circulation 2019;139:292e4.
Gursoy M., Duygu E., Karabulut U., Çakir I., Hokenek A.F. Endovascular treatment of acute aortic occlusion with critical limb ischemia using an AngioJet device. // Ann Vasc Surg 2017;39:285.e1-3.
Jayakrishnan R., Yazicioglu C., Monareng T., Veller M.G. Endovascular treatment of an acutely thrombosed abdominal aortic aneurysm. // Ann Vasc Surg 2015;29:1455.e13-5.
Rolon S., Wood J.C., Mansukhani N.A., Hieb R.A., Malinowski M.,J., Lewis B.D., Brown K.R., Rossi P.J. Hybrid repair for acute aortic occlusion using aortobifemoral bypass and AngioVac thrombectomy // Journal of Vascular Surgery Cases and Innovative Techniques, 2021. Vol. 7, № 3. P. 429-432. https://doi.org/10.1016/j.jvscit.2021.05.003.
Grace P.A. Ischaemia-reperfusion injury // Br. J. Surg. 1994. Т. 81, № 5. С. 637–647.
de Franciscis S. и др. Biomarkers in post-reperfusion syndrome after acute lower limb ischaemia // Int. Wound J. 2016. Т. 13, № 5. С. 854–859.
Затевахин И.И., Цициашвили М.Ш., Матюшкин А.В. Глава 12. Острая артериальная непроходимость. с.183. В кн.: Савельев В.С., Кириенко А.И. Сосудистая хирургия. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа, 2015.
Schmidt C.A.P. и др. Hypothermic, initially oxygen-free, controlled limb reperfusion for acute limb ischemia // Ann. Vasc. Surg. 2015. Т. 29, № 3. С. 560–572.
Cooper G.G. A method of single-incision, four compartment fasciotomy of the leg // Eur. J. Vasc. Surg. 1992. Т. 6, № 6. С. 659–661.
von Keudell A.G. и др. Diagnosis and treatment of acute extremity compartment syndrome // Lancet Lond. Engl. 2015. Т. 386, № 10000. С. 1299–1310.
Rothenberg K.A. и др. Delayed Fasciotomy Is Associated with Higher Risk of Major Amputation in Patients with Acute Limb Ischemia // Ann. Vasc. Surg. 2019. Т. 59. С. 195–201.
Johnson S.B. и др. Clinical results of decompressive dermotomy-fasciotomy // Am. J. Surg. 1992. Т. 164, № 3. С. 286–290.
Kayssi A. и др. Management of acute limb ischemia in the pediatric population // J. Vasc. Surg. 2014. Т. 60, № 1. С. 106–110.
A Conservative Approach to Acute Upper Limb Ischemia // Vasc. Dis. Manag. 2010. Т. 7, № 11.
Wong V.W., Katz R.D., Higgins J.P. Interpretation of upper extremity arteriography: vascular anatomy and pathology [corrected] // Hand Clin. 2015. Т. 31, № 1. С. 121–134.
Zaraca F. и др. Routine Versus Selective Use of Intraoperative Angiography During Thromboembolectomy for Acute Lower Limb Ischemia: Analysis of Outcomes: 5 // Ann. Vasc. Surg. 2010. Т. 24, № 5. С. 621–627.
Hernandez-Richter T. и др. Acute ischemia of the upper extremity: long-term results following thrombembolectomy with the Fogarty catheter // Langenbecks Arch. Surg. 2001. Т. 386, № 4. С. 261–266.
Ueda T. и др. Endovascular Treatment Strategy Using Catheter-Directed Thrombolysis, Percutaneous Aspiration Thromboembolectomy, and Angioplasty for Acute Upper Limb Ischemia // Cardiovasc. Intervent. Radiol. 2017. Т. 40, № 7. С. 978–986.
Kim S.-K. и др. Acute Upper Limb Ischemia due to Cardiac Origin Thromboembolism: the Usefulness of Percutaneous Aspiration Thromboembolectomy via a Transbrachial Approach // Korean J. Radiol. 2011. Т. 12, № 5. С. 595–601.
Ouellette E.A., Kelly R. Compartment syndromes of the hand // J. Bone Joint Surg. Am. 1996. Т. 78, № 10. С. 1515–1522.
Mancia G., et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). // Eur. Heart J. — 2013; 34 (28): 2159-2219.
Приказ Министерства труда и социальной защиты РФ от 13 июня 2017 г. N 486н «Об утверждении Порядка разработки и реализации индивидуальной программы реабилитации или абилитации инвалида, индивидуальной программы реабилитации или абилитации ребенка-инвалида, выдаваемых федеральными государственными учреждениями медико-социальной экспертизы, и их форм» (с изменениями и дополнениями). [Электронный ресурс]. (URL: https://minjust.consultant.ru/files/36170).
Moroz A., Flanagan S. R., and Zaretsky H. Medical aspects of disability for the rehabilitation professional New York, NY : Springer Publishing Company, 814 pages.
Покровский А.В. и др. Отдаленные результаты аорто-бедренных реконструкций у больных сахарным диабетом 2 типа // Ангиология и сосудистая хирургия. — 2010. — Т. 16 — № 1. — С. 48-53.
Курдыбайло С.Ф., Яхонтова В.Г. Средства повышения двигательных возможностей инвалидов после ампутации конечностей // Травматология и ортопедия России. – 1994. - No1. – С. 16-24.
Лечебная физическая культура: учебник для студ. высш. учеб. завед. /[С.Н. Попов, Н.М. Валеев., Т.С. Гарасева и др.]; под ред. С.Н. Попова. – 5-е изд., стер. – М.: Издательский центр «Академия», 2008. – 416 с.
Лечебная физическая культура: учебное пособие /В.А. Епифанов – М.: ГЭОТАР – Медиа, 2006. – С. 468 – 475.
Мухін В.М. Фізична реабілітація /В.М. Мухін. – Київ: Олімпійська література, 2005. – С. 203-219.
Национальные рекомендации по диагностике и лечению заболеваний артерий нижних конечностей. М. 2019. Электронный документ. URL: https://www.angiolsurgery.org/library/recommendations/2019/recommendations_LLA_2019.pdf?ysclid=l21m387fgz.
Hiatt W.R. et al. Benefit of exercise conditioning for patients with peripheral arterial disease // Circulation. Ovid Technologies (Wolters Kluwer Health), 1990. Vol. 81, No 2. P. 602–609.
Parmenter B.J., Dieberg G., Smart N.A. Exercise Training for Management of Peripheral Arterial Disease: A Systematic Review and Meta-Analysis // Sport. Med. Springer Nature, 2014. Vol. 45, No 2. P. 231–244.
Pilz M. et al. Evaluation of 6- and 12-month supervised exercise training on strength and endurance parameters in patients with peripheral arterial disease // Wien. Klin. Wochenschr. Springer Nature, 2014. Vol. 126, No 11–12. P. 383–389.
Regensteiner J.G. Exercise in the Treatment of Claudication: Assessment and Treatment of Functional Impairment // Vasc. Med. SAGE Publications, 1997. Vol. 2, No 3. P. 238–242.
Regensteiner J.G., Steiner J.F., Hiatt W.R. Exercise training improves functional status in patients with peripheral arterial disease // J. Vasc. Surg. Elsevier BV, 1996. Vol. 23, No 1. P. 104–115.
Stewart K.J. et al. Exercise Training for Claudication // N. Engl. J. Med. New England Journal of Medicine (NEJM/MMS), 2002. Vol. 347, No 24. P. 1941–1951.
Brenner I., Parry M., Brown C.A. Exercise Interventions for Patients with Peripheral Arterial Disease: A Review of the Literature // Phys. Sportsmed. Informa UK Limited, 2012. Vol. 40, No 2. P. 41–55.
Corra U. et al. Secondary prevention through cardiac rehabilitation: physical activity counselling and exercise training: Key components of the position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitat // Eur. Heart J. Oxford University Press (OUP), 2010. Vol. 31, No 16. P. 1967–1974.
Fokkenrood H.J.P. et al. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication. // Cochrane database Syst. Rev. 2013. No 8. P. 5263.
Murphy T.P. et al. Supervised exercise, stent revascularization, or medical therapy for claudication due to aortoiliac peripheral artery disease: The CLEVER study // J. Am. Coll. Cardiol. 2015. Vol. 65, No 10. P. 999–1009.
Murphy T.P., Cutlip D.E., Regensteiner J.G. Supervised Exercise Versus Primary Stenting for Claudication Resulting From Aortoiliac Peripheral Artery Disease: Six-Month Outcomes From the Claudication: Exercise Versus Endoluminal Revascularization (CLEVER) Study // J. Vasc. Surg. Elsevier BV, 2012. Vol. 55, No 3. P. 886–887.
Мятыга Д. С. Восстановительное лечение средствами лечебной физической культуры после ампутаций нижних конечностей // Pedagogics, psychology, medical-biological problems of physical training and sports. 2009. №5.).
Мухін В.М. Фізична реабілітація /В.М. Мухін. – Київ: Олімпійська література, 2005. – С. 203-219.Мухін В.М. Фізична реабілітація /В.М. Мухін. – Київ: Олімпійська література, 2005. – С. 203-219.
Пономаренко Г.Н. Частная физиотерпия. Атеросклероз периферичпеских сосудов. М., Медицина, 2005, стр. 68-73.
Клячкин Л.М., Щегольков А.М. Медицинская реабилитация больных с заболеваниями внутренних органов: Руководство для врачей.— М., 2000.— 308 с.
Немедикаментозное лечение в клинике внутренних болезней/Под ред. Л.А.Серебриной, Н.Н. Середюка, Л.Е. Михно. - Киев, 1995. - 528 с.
Сорокина Е.И. Физические методы лечения в кардиологии. — М.: Медицина, 1989. - 384 с. Пономаренко Г.Н., Воробьев М.Г. Практическое руководство по физиотерапии. - СПб., 2005. - 416 с.
Gerhard-Herman MD, Gornik HL, Barrett C, Barshes NR, Corriere MA, Drachman DE, et al. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2017;135:e726e79.
Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893e962.
Приказ Министерства здравоохранения Российской Федерации от 29.03.2019 г. № 173н «Об утверждении порядка проведения диспансерного наблюдения за взрослыми. (злектронный ресурс). URL: https://alfastrahoms.ru/about-oms/normative-base/doc/prikaz-minzdrava-173n.pdf).
Heller S. и др. Percutaneous Mechanical Thrombectomy Using Rotarex® S Device in Acute Limb Ischemia in Infrainguinal Occlusions // BioMed Res. Int. 2017. Т. 2017. С. 2362769.
Freitas B. и др. Rotarex Mechanical Debulking in Acute and Subacute Arterial Lesions: 3 // Angiology. 2017. Т. 68, № 3. С. 233–241.
Campbell W.B., Ridler B.M.F., Szymanska T.H. Two-year Follow-up After Acute Thromboembolic Limb Ischaemia: the Importance of Anticoagulation: 2 // Eur. J. Vasc. Endovasc. Surg. 2000. Т. 19, № 2. С. 169–173.
Gomez-Outes A, Terleira-Fernandez AI, Calvo-Rojas G, Suarez- Gea ML, Vargas-Castrillon E. Dabigatran, rivaroxaban, or apixaban versus warfarin in patients with nonvalvular atrial fibrillation: a systematic review and meta-analysis of subgroups. Thrombosis 2013;2013:640723.
Zierler RE, Jordan WD, Lal BK, Mussa F, Leers S, Fulton J, Pevec W, et al. The Society for Vascular Surgery practice guidelines on follow-up after vascular surgery arterial procedures. J Vasc Surg 2018;68:256e84.
Forbes T.L., DeRose G., Harris K.A. Is long-term anticoagulation after acute thromboembolic limb ischemia always necessary? 5 // Can. J. Surg. J. Can. Chir. 2002. Т. 45, № 5. С. 337–340.
Ansel GM, Botti Jr CF, Silver MJ. Treatment of acute limb ischemia with a percutaneous mechanical thrombectomy-based endovascular approach: 5-year limb salvage and survival results from a single center series. Catheter Cardiovasc Interv 2008;72:325e30.
Campbell WB, Ridler BM, Szymanska TH. Two-year follow-up after acute thromboembolic limb ischaemia: the importance of anticoagulation. Eur J Vasc Endovasc Surg 2000;19:169e73.
Ravn H, Wanhainen A, Bjorck M. Risk of new aneurysms after surgery for popliteal artery aneurysm. Br J Surg 2008;95:571e5.
Dawson I, van Bockel JH, Brand R, Terpstra JL. Popliteal artery aneurysms. Long-term follow-up of aneurysmal disease and results of surgical treatment. J Vasc Surg 1991;13:398e407.
Loftus IM, McCarthy MJ, Lloyd A, Naylor AR, Bell PR, Thompson MM. Prevalence of true vein graft aneurysms: impli- cations for aneurysm pathogenesis. J Vasc Surg 1999;29:403e8.
Liang N.L. и др. Comparative effectiveness of anticoagulation on midterm infrainguinal bypass graft patency: 2 // J. Vasc. Surg. 2017. Т. 66, № 2. С. 499-505.e2.
Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017;377:1319e30.
Venermo M, Sprynger M, Desormais I, Björck M, Brodmann M, Cohnert T, et al. Follow-up of patients after revascularization for peripheral arterial diseases. A consensus document from the European Society of Cardiology (ESC) working group on Aorta & Peripheral Vascular Diseases and the European Society of Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2019;58:641e53.
Hanover T.M. и др. Safety and Efficacy of Reteplase for the Treatment of Acute Arterial Occlusion: Complexity of Underlying Lesion Predicts Outcome // Ann. Vasc. Surg. 2005. Т. 19, № 6. С. 817–822.
Armstrong EJ, Wu J, Singh GD, Dawson DL, Pevec WC, Amsterdam EA, et al. Smoking cessation is associated with decreased mortality and improved amputation-free survival among patients with symptomatic peripheral artery disease. J Vasc Surg 2014;60:1565e71.
Willigendael EM, Teijink JA, Bartelink ML, Kuiken BW, Boiten J, Moll FL, et al. Influence of smoking on incidence and prevalence of peripheral arterial disease. J Vasc Surg 2004;40:1158e65.
Hoel AW, Nolan BW, Goodney PP, Zhao Y, Schanzer A, Stanley AC, et al. Variation in smoking cessation after vascular operations. J Vasc Surg 2013;57:1338e44.
Schmit K. и др. Comparative Effectiveness Review of Antiplatelet Agents in Peripheral Artery Disease // J. Am. Heart Assoc. Cardiovasc. Cerebrovasc. Dis. 2014. Т. 3, № 6. С. e001330.
Belch J.J.F. и др. Results of the randomized, placebo-controlled clopidogrel and acetylsalicylic acid in bypass surgery for peripheral arterial disease (CASPAR) trial // J. Vasc. Surg. 2010. Т. 52, № 4. С. 825–833, 833.e1-2.
Cacoub P.P. и др. Patients with peripheral arterial disease in the CHARISMA trial // Eur. Heart J. 2009. Т. 30, № 2. С. 192–201.
Hiatt W.R. и др. Ticagrelor versus Clopidogrel in Symptomatic Peripheral Artery Disease // N. Engl. J. Med. 2017. Т. 376, № 1. С. 32–40.
Efficacy of oral anticoagulants compared with aspirin after infrainguinal bypass surgery (The Dutch Bypass Oral anticoagulants or Aspirin study): a randomised trial // The Lancet. Elsevier, 2000. Т. 355, № 9201. С. 346–351.
Johnson W.C., Williford W.O., Department of Veterans Affairs Cooperative Study #362. Benefits, morbidity, and mortality associated with long-term administration of oral anticoagulant therapy to patients with peripheral arterial bypass procedures: a prospective randomized study // J. Vasc. Surg. 2002. Т. 35, № 3. С. 413–421.
Monaco M. и др. Combination therapy with warfarin plus clopidogrel improves outcomes in femoropopliteal bypass surgery patients // J. Vasc. Surg. 2012. Т. 56, № 1. С. 96–105.
Aung P.P. и др. Lipid-lowering for peripheral arterial disease of the lower limb // Cochrane Database Syst. Rev. 2007. № 4. С. CD000123.
Kalinowski M. и др. Mid-term follow-up after percutaneous hydrodynamic thrombectomy in lower limb ischemia: initial experience with two-dimensional MR imaging and three-dimensional MR angiography // J. Vasc. Interv. Radiol. JVIR. 2000. Т. 11, № 6. С. 747–753.
Davies A.H. и др. Is duplex surveillance of value after leg vein bypass grafting? Principal results of the Vein Graft Surveillance Randomised Trial (VGST) // Circulation. 2005. Т. 112, № 13. С. 1985–1991.
Tinder C.N. и др. Efficacy of duplex ultrasound surveillance after infrainguinal vein bypass may be enhanced by identification of characteristics predictive of graft stenosis development // J. Vasc. Surg. 2008. Т. 48, № 3. С. 613–618.
Abu Dabrh A.M. и др. Systematic review and meta-analysis of duplex ultrasound surveillance for infrainguinal vein bypass grafts // J. Vasc. Surg. 2017. Т. 66, № 6. С. 1885-1891.e8.
Калинин Р.Е., Сучков И.А., Пшенников А.С. Коррекция эндотелиальной дисфункции как компонент в лечении облитерирующего атеросклероза артерий нижних конечностей. Ангиология и сосудистая хирургия. 2014; 20 (3): 17-22.
Министерство Здравоохранения Российской Федерации Приказ от 15 ноября 2012 г. N 918Н “Об утверждении порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями”. Электронный документ. URL: https://bazanpa.ru/download/pdf/?target_url=/minzdrav-rossii-prikaz-n918n-ot15112012-h2008385/.
Приказ Минздравсоцразвития РФ от 01.11.2004 N 179 (ред. от 30.01.2012) Об утверждении Порядка оказания скорой медицинской помощи. Электронных документ. URL: https://legalacts.ru/doc/prikaz-minzdravsotsrazvitija-rf-ot-01112004-n-179.
Приказ Минздравсоцразвития РФ от 02.08.2010 N 586н О внесении изменений в Порядок оказания скорой медицинской помощи, утвержденный Приказом Министерства здравоохранения и социального развития Российской Федерации от 1 ноября 2004 г. N 179. Электронный документ. URL: https://legalacts.ru/doc/prikaz-minzdravsotsrazvitija-rf-ot-02082010-n-586n/.
Rutherford R. B., Baker J. D., Ernst C., Johnston K.W, Porter J. M., Ahn S., Jones D. N., Recommended standards for reports dealing with lower extremity ischemia: Revised version, Journal of Vascular Surgery, Volume 26, Issue 3, 1997, Pages 517-538, ISSN 0741-5214, https://doi.org/10.1016/S0741-5214(97)70045-4.
Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’s choice e European Society for Vascular Surgery (ESVS) 2019 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg 2019;57:8e93.
Conte MS, Bradbury AW, Kolh P, White JV, Dick F, Fitridge R, et al. Global vascular guidelines on the management of chronic limb-threatening ischemia. Eur J Vasc Endovasc Surg 2019;58. S1eS109.e33.
Björck M. и др. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia: 2 // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2020. Т. 59, № 2. С. 173–218.
Lim S. и др. Epidemiology, treatment, and outcomes of acute limb ischemia in the pediatric population // J. Vasc. Surg. 2018. Т. 68, № 1. С. 182–188.
Monagle P. и др. Arterial thromboembolic disease: a single-centre case series study // J. Paediatr. Child Health. 2008. Т. 44, № 1–2. С. 28–32.
Barmparas G. и др. Pediatric vs adult vascular trauma: a National Trauma Databank review // J. Pediatr. Surg. 2010. Т. 45, № 7. С. 1404–1412.
Matos J.M. и др. Evidence for nonoperative management of acute limb ischemia in infants // J. Vasc. Surg. 2012. Т. 55, № 4. С. 1156–1159.
Alexander J. и др. Ultrasound-guided femoral arterial access in pediatric cardiac catheterizations: A prospective evaluation of the prevalence, risk factors, and mechanism for acute loss of arterial pulse // Catheter. Cardiovasc. Interv. 2016. Т. 88, № 7. С. 1098–1107.
Kulkarni S., Naidu R. Vascular ultrasound imaging to study immediate postcatheterization vascular complications in children // Catheter. Cardiovasc. Interv. 2006. Т. 68, № 3. С. 450–455.
Knirsch W. и др. Femoral Arterial Thrombosis After Cardiac Catheterization In Infancy: Impact of Doppler Ultrasound for Diagnosis // Pediatr. Cardiol. 2013. Т. 34, № 3. С. 530–535.
Rizzi M. и др. Long-Term Outcome of Catheter-Related Arterial Thrombosis in Infants with Congenital Heart Disease // J. Pediatr. 2016. Т. 170. С. 181-187.e1.
Sadat U., Hayes P.D., Varty K. Acute Limb Ischemia in Pediatric Population Secondary to Peripheral Vascular Cannulation: Literature Review and Recommendations // Vasc. Endovascular Surg. 2015. Т. 49, № 5–6. С. 142–147.
Wang S.K. и др. Results of nonoperative management of acute limb ischemia in infants // J. Vasc. Surg. 2018. Т. 67, № 5. С. 1480–1483.
Lim S. и др. Epidemiology, treatment, and outcomes of acute limb ischemia in the pediatric population // J. Vasc. Surg. 2018. Т. 68, № 1. С. 182–188.
Lin P.H. и др. Surgical intervention for complications caused by femoral artery catheterization in pediatric patients // J. Vasc. Surg. 2001. Т. 34, № 6. С. 1071–1078.
Rizzi M. и др. Catheter-Related Arterial Thrombosis in Neonates and Children: A Systematic Review // Thromb. Haemost. 2018. Т. 118, № 6. С. 1058–1066.
Griffin K.J. и др. The Pink Pulseless Hand: A Review of the Literature Regarding Management of Vascular Complications of Supracondylar Humeral Fractures in Children // Eur. J. Vasc. Endovasc. Surg. 2008. Т. 36, № 6. С. 697–702.
Wahlgren C.-M., Kragsterman B. Management and outcome of pediatric vascular injuries // J. Trauma Acute Care Surg. 2015. Т. 79, № 4. С. 563–567.
Gaskell P, Krisman AM: An auscultatory technique for measuring the digital blood pressure. Canad J Biochem Physiol 36: 883, 19583.
Lezack J.D., Carter S.A.: Systolic pressures in the extremities of man with special reference to the toes. Canad. J. Physiol. Pharmacol. 48: 469, 1970.
Carter S.A., Lezack J.D.: Digital Systolic Pressures in the Lower Limb in Arterial Disease. Circulation. 1971., Vol. XLII, p. 905-914.
Conrad M.C., Green H.D.: Hemodynamics of large and small vessels in peripheral vascular disease. Circulation. 29: 847, 1964.
Collins R, Burch J, Cranny G, Aguiar-Ibanez R, Craig D, Wright K, Berry E, et al. Duplex ultrasonography, magnetic resonance angiography, and computed tomography angiography for diag- nosis and assessment of symptomatic, lower limb peripheral arterial disease: systematic review. BMJ 2007;334:1257.
Hingorani AP, Ascher E, Marks N, Puggioni A, Shiferson A, Tran V, et al. Limitations of and lessons learned from clinical experience of 1,020 duplex arteriography. Vascular 2008;16:147e53.
Затевахин И.И., Цициашвили М.Ш., Матюшкин А.В. Глава 12. Острая артериальная непроходимость. с.183. В кн.: Савельев В.С., Кириенко А.И. Сосудистая хирургия. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа, 2015.
O’Connell J.B., Rutherford R.B.: Clinical staging of acute limb ischemia as the basis for choice of revascularization method: when and how to intervene. Semin. Vasc. Surg. 2009; 22(1), 5–9.
Plecha F.R., Pories W.J.: Intraoperative angiography in the immediate assessment of arterial reconstruction. Arch. Surg. 1972; 105(6), 902–907.
O’Connell J B, Quiñones-Baldrich W J. Proper evaluation and management of acute embolic versus thrombotic limb ischemia. Semin Vasc Surg. 2009;22(01):10–16.
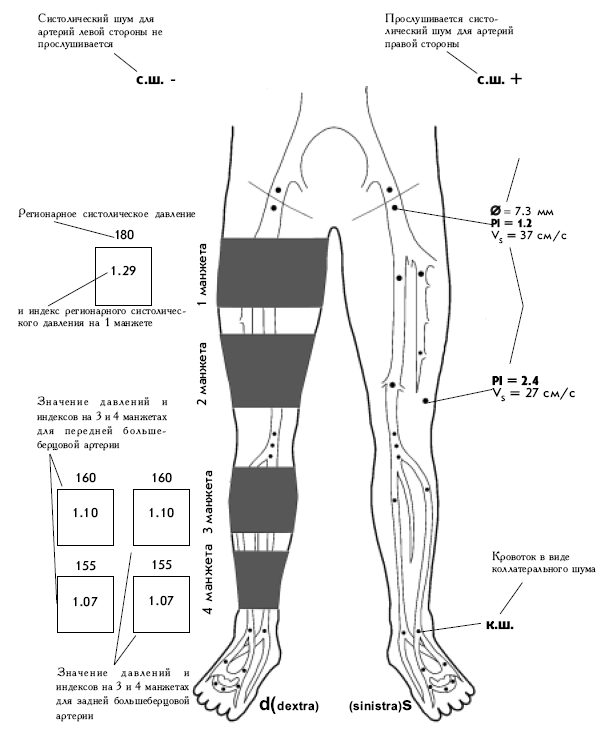
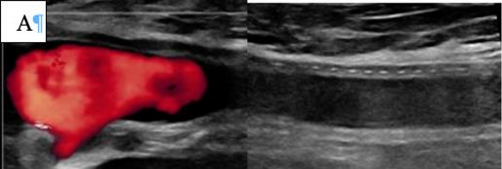
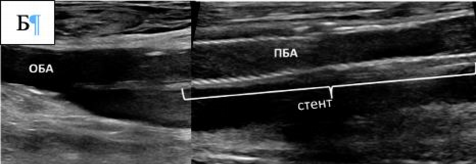
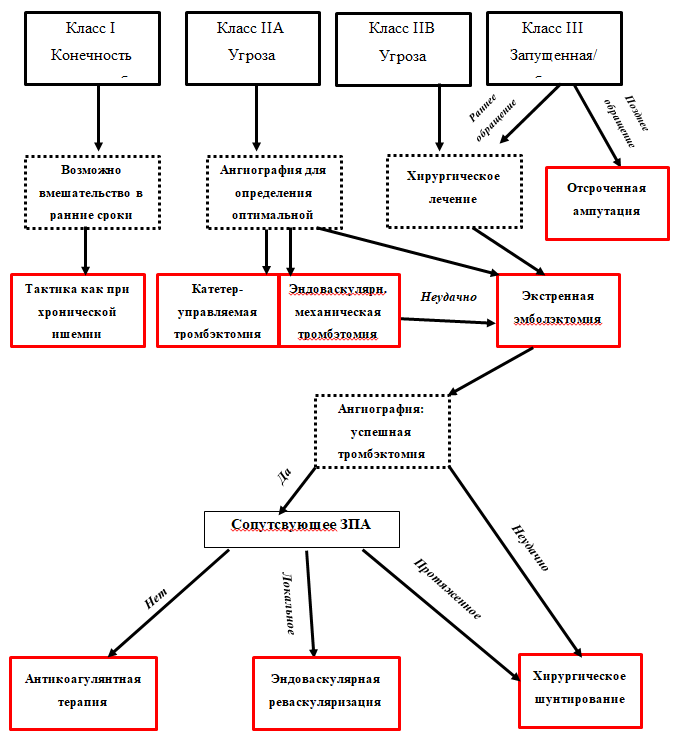
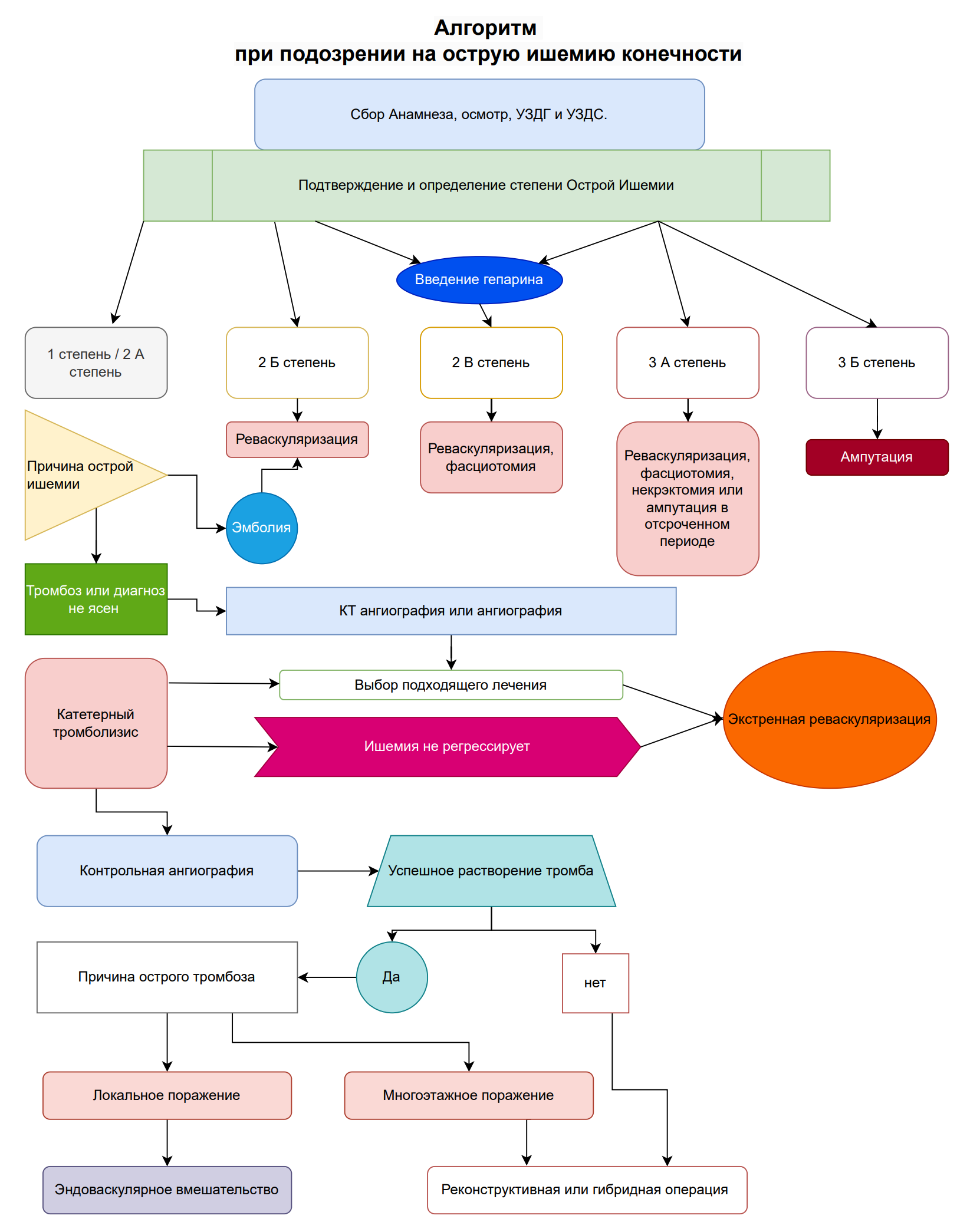 Рисунок 3. Алгоритм принятия решения при острой ишемии конечности приведен.
Рисунок 3. Алгоритм принятия решения при острой ишемии конечности приведен.