Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 24.07.2023) "Об основах охраны здоровья граждан в Российской Федерации" (с изм. и доп., вступ. в силу с 01.09.2023).
Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТ Р 52379-2005. Надлежащая клиническая практика. Москва, 2005.
Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств».
Андреева Н. С., Реброва О.Ю., Зорин Н.А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012;4:10–24.
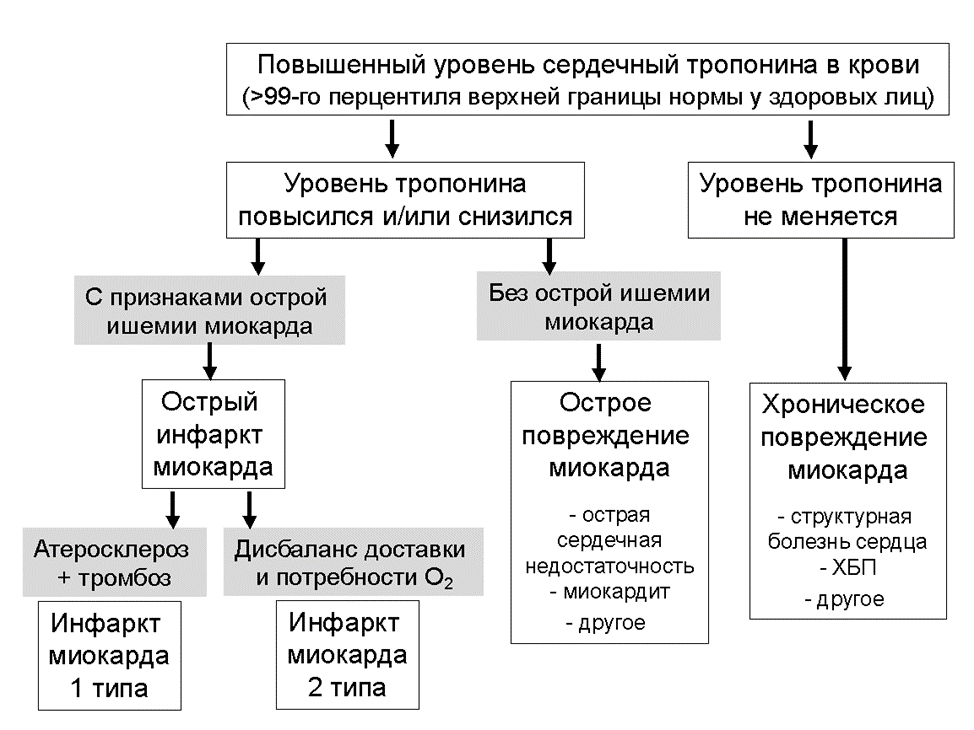
Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD; ЕОК Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019; 40: 237–269.
Muthiah Vaduganathan, George A Mensah, Justine Varieur Turco, Valentin Fuster, Gregory A Rot The Global Burden of Cardiovascular Diseases and Risk: A Compass for Future Health.
Данные Росстата на 2022 год. https://rosstat.gov.ru/folder/12781
McManus DD, Gore J, Yarzebski J, Spencer F, Lessard D, Goldberg RJ. Recent trends in the incidence, treatment, and outcomes of patients with STEMI and NSTEMI. Am J Med 2011;124(1):40–47.
Статистические данные находятся в печати (журнал «Кардиология», 2024).
Tomas Jernberg, Pål Hasvold, Martin Henriksson, Hans Hjelm, Marcus Thuresson, Magnus Janzon. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur Heart J. 2015 May 14;36(19):1163-70. doi: 10.1093/eurheartj/ehu505. Epub 2015 Jan 13.
Jernberg T, Hasvold P, Henriksson M, Hjelm H, Thuresson M, Janzon M. Eur Heart J. 2015;36(19):1163-1170. doi:10.1093/eurheartj/ehu505
Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015;131:861–870.
Niccoli G, Scalone G, Crea F. Acute myocardial infarction with no obstructive coronary atherosclerosis: mechanisms and management. Eur Heart J 2015; 36: 475–481.
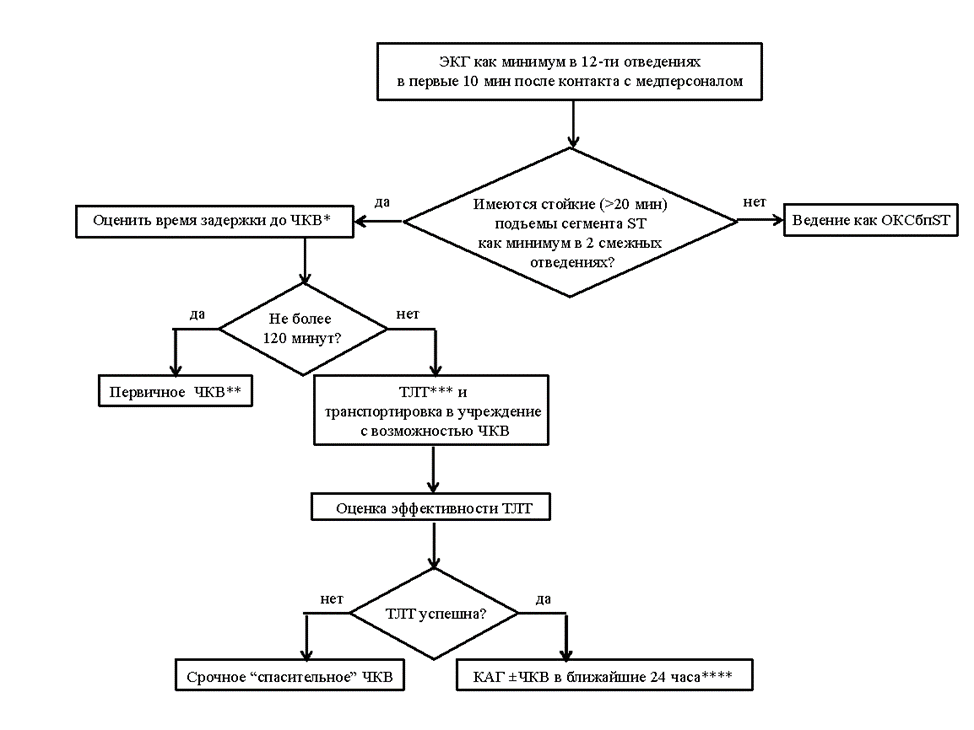
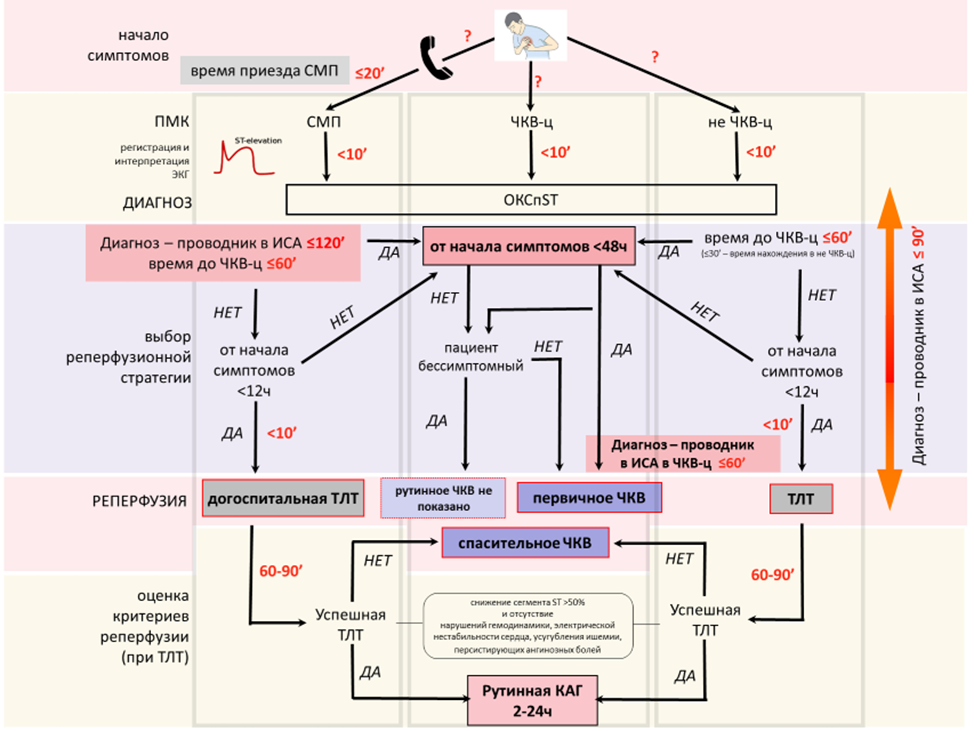
Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, Claeys MJ, Dan GA, Dweck MR, Galbraith M, Gilard M, Hinterbuchner L, Jankowska EA, Jüni P, Kimura T, Kunadian V, Leosdottir M, Lorusso R, Pedretti RFE, Rigopoulos AG, Rubini Gimenez M, Thiele H, Vranckx P, Wassmann S, Wenger NK, Ibanez B; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023 Oct 12;44(38):3720-3826. doi: 10.1093/eurheartj/ehad191.
Neumann J.T., Twerenbold R., Ojeda F., Sörensen N.A., Chapman A.R., Shah A.S.V., et al. Application of High-Sensitivity Troponin in Suspected Myocardial Infarction. N Engl J Med 2019; 380: 2529-2540.
Pickering JW, Than MP, Cullen L, Aldous S, Ter Avest E, Body R, Carlton EW, Collinson P, Dupuy AM, Ekelund U, Eggers KM, Florkowski CM, Freund Y, George P, Goodacre S, Greenslade JH, Jaffe AS, Lord SJ, Mokhtari A, Mueller C, Munro A, Mustapha S, Parsonage W, Peacock WF, Pemberton C, Richards AM, Sanchis J, Staub LP, Troughton R, Twerenbold R, Wildi K, Young J. Rapid Rule-out of Acute Myocardial Infarction With a Single High-Sensitivity Cardiac Troponin T Measurement Below the Limit of Detection: A Collaborative Meta-analysis. Ann Intern Med 2017; 166: 715-3724.
Twerenbold R, Boeddinghaus J, Nestelberger T, Wildi K, Rubini Gimenez M, Badertscher P, et al. Clinical use of high-sensitivity cardiac troponin in patients with suspected myocardial infarction. J Am Coll Cardiol 2017;70:996–1012. https://doi.org/10. 1016/j.jacc.2017.07.718.
Camaro C, Aarts, GWA, Abang EMM et al. Rule-out of non-ST-segment elevation acute coronary syndrome by a single, pre-hospital troponin measurement: a randomized trial // European Heart Journal, Volume 44, Issue 19, 14 May 2023, Pages 1705–1714, https://doi.org/10.1093/eurheartj/ehad056.
Ghaffari S, Pourafkari L, Sepehrvand N, Aslanabadi N, Faridi L, Tajlil A, Masoumi N, Nader N. Red Cell Distribution Width Is a Predictor of ST Resolution and Clinical Outcome Following Thrombolysis in Acute ST Elevation Myocardial Infarction. Thromb Res. 2016 Apr;140:1-6
Gore JM, Spencer FA, Gurfinkel EP, López-Sendón J, Steg PG, Granger CB, et al. Thrombocytopenia in patients with an acute coronary syndrome (from the Global Registry of Acute Coronary Events [GRACE]). Am J Cardiol 2009;103:175–180. https://doi.org/10.1016/j.amjcard.2008.08.055
Long M, Ye Z, Zheng J, Chen W, Li L. Dual anti-platelet therapy following percutaneous coronary intervention in a population of patients with thrombocytopenia at baseline: a meta-analysis. BMC Pharmacol Toxicol 2020;21:31. https://doi.org/10.1186/ s40360-020-00409-2
Mathews R, Peterson E, Chen AY, et al. In-Hospital Major Bleeding During ST-Elevation and Non–STElevation Myocardial Infarction Care: Derivation and Validation of a Model from the ACTION Registry®-GWTG™. Am J Cardiol 2011; 107: 1136–1143.
D"Ascenzo F, Biondi-Zoccai G, Moretti C, Bollati M, Omede P et al: TIMI, GRACE and alternative risk scores in acute coronary syndromes: a meta-analysis of 40 derivation studies on 216,552 patients and of 42 validation studies on 31,625 patients. Contemporary clinical trials. 2012;33:507–514.
McNamara RL, Kennedy KF, Cohen DJ, et al. Predicting In-Hospital Mortality in Patients With Acute Myocardial Infarction. JACC 2016; 68: 626-635.
Bartnik M, Malmberg K, Norhammar A, Tenerz A, Ohrvik J, Ryden L. Newly detected abnormal glucose tolerance: an important predictor of long-term outcome after myocardial infarction. Eur Heart J 2004;25:1990–1997.
Ferrannini G, De Bacquer D, De Backer G, Kotseva K, Mellbin L, Wood D, et al. Screening for glucose perturbations and risk factor management in dysglycemic patients with coronary artery disease–a persistent challenge in need of substantial improvement: a report from ESC EORP EUROASPIRE V. Diabetes Care 2020;43: 726–733. https://doi.org/10.2337/dc19-2165
Ritsinger V, Tanoglidi E, Malmberg K, Näsman P, Rydén L, Tenerz Å, et al. Sustained prognostic implications of newly detected glucose abnormalities in patients with acute myocardial infarction: long-term follow-up of the Glucose Tolerance in Patients with Acute Myocardial Infarction cohort. Diab Vasc Dis Res 2015;12:23–32. https://doi.org/ 10.1177/1479164114551746
Svensson AM, McGuire DK, Abrahamsson P, Dellborg M. Association between hyperand hypoglycaemia and 2 year all-cause mortality risk in diabetic patients with acute coronary events. Eur Heart J 2005;26:1255–1261. https://doi.org/10.1093/eurheartj/ ehi230
Pinto DS, Skolnick AH, Kirtane AJ, Murphy SA, Barron HV, Giugliano RP, et al. U-shaped relationship of blood glucose with adverse outcomes among patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2005;46:178–180. https://doi.org/10.1016/j.jacc.2005.03.052
Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023;44(39):4043-4140. doi:10.1093/eurheartj/ehad192
Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/ EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41:111–188. https://doi.org/10.1093/eurheartj/ ehz455
Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017;38: 2459–2472. https://doi.org/10.1093/eurheartj/ehx144
Sidhu D, Naugler C. Fasting time and lipid levels in a community-based population: a cross-sectional study. Arch Intern Med 2012;172(22):1707–1710.
Goyal A, Spertus JA, Gosch K, Venkitachalam L, Jones PG, Van den Berghe G, Kosiborod M. Serum potassium levels and mortality in acute myocardial infarction. JAMA 2012; 307: 157–164.
Diercks DB, Peacock WF, Hiestand BC, Chen AY, Pollack CV, Kirk JD, et al. Frequency and consequences of recording an electrocardiogram >10 minutes after arrival in an emergency room in non-ST-segment elevation acute coronary syndromes (from the CRUSADE Initiative). Am J Cardiol 2006;97:437–442. https://doi.org/10.1016/j.amjcard.2005.09.073
Schmitt C, Lehmann G, Schmieder S, Karch M, Neumann F-J, Scho¨mig A. Diagnosis of acute myocardial infarction in angiographically documented occluded infarct vessel: limitations of ST-segment elevation in standard and extended ECG leads. Chest 2001;120:1540–1546. https://doi.org/10.1378/chest.120.5.1540
Fesmire FM, Percy RF, Bardoner JB et al. Usefulness of automated serial 12-lead ECG monitoring during the initial emergency department evaluation of patients with chest pain. Ann Emerg Med. 1998; 31:3–11.
Rouan GW, Lee TH, Cook EF, Brand DA, Weisberg MC et al. Clinical characteristics and outcome of acute myocardial infarction in patients with initially normal or nonspecific electrocardiograms (a report from the Multicenter Chest Pain Study). Am J Cardiol. 1989;64:1087–1092.
McCarthy BD, Wong JB, Selker HP. Detecting acute cardiac ischemia in the emergency department: a review of the literature. J Gen Intern Med. 1990;5:365–373.
Savonitto S, Ardissino D, Granger CB, Morando G, Prando MD et al. Prognostic value of the admission electrocardiogram in acute coronary syndromes. JAMA 1999;281: 707–713.
Zalenski RJ, Rydman RJ, Sloan EP et al. Value of posterior and right ventricular leads in comparison to the standard 12-lead electrocardiogram in evaluation of ST-segment elevation in suspected acute myocardial infarction. Am J Cardiol. 1997;79: 1579–1585.
Matetzky S, Freimark D, Feinberg MS et al. Acute myocardial infarction with isolated ST-segment elevation in posterior chest leads V7–9: "hidden" ST-segment elevations revealing acute posterior infarction. J Am Coll Cardiol. 1999;34:748–753.
Boden WE, Kleiger RE, Gibson RS et al. Electrocardiographic evolution of posterior acute myocardial infarction: importance of early precordial ST-segment depression. Am J Cardiol. 1987;59:782–787.
Winkler C, Funk M, Schindler DM, Hemsey JZ, Lampert R, Drew BJ. Arrhythmias in patients with acute coronary syndrome in the first 24 hours of hospitalization. Heart Lung 2013;42:422–427. https://doi.org/10.1016/j.hrtlng.2013.07.010
O’Doherty M, Tayler DI, Quinn E, Vincent R, Chamberlain DA. Five hundred patients with myocardial infarction monitored within one hour of symptoms. Br Med J (Clin Res Ed) 1983;286:1405–1408. https://doi.org/10.1136/bmj.286.6375.1405
Mehta RH, Starr AZ, Lopes RD, Hochman JS, Widimsky P, Pieper KS, et al. Incidence of and outcomes associated with ventricular tachycardia or fibrillation in patients undergoing primary percutaneous coronary intervention. JAMA 2009;301:1779–1789. https://doi.org/10.1001/jama.2009.600
Kalarus Z, Svendsen JH, Capodanno D, et al. Cardiac arrhythmias in the emergency settings of acute coronary syndrome and revascularization: an European Heart Rhythm Association (EHRA) consensus document, endorsed by the European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Acute Cardiovascular Care Association (ACCA) Europace (2019) 21, 1603–1604.
Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet. 2003;361:13–20.
Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y, Sulimov V, Rosell Ortiz F, Ostojic M, Welsh RC, Carvalho AC, Nanas J, Arntz HR, Halvorsen S, Huber K, Grajek S, FrЕОКo C, Bluhmki E, Regelin A, Vandenberghe K, Bogaerts K, Van de Werf F, STREAM Investigative Team. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med. 2013;368(15):1379–1387.
Funke Küpper AJ, Verheugt FW, Peels CH, Galema TW, Roos JP. Left ventricular thrombus incidence and behavior studied by serial two-dimensional echocardiography in acute anterior myocardial infarction: left ventricular wall motion, systemic embolism and oral anticoagulation. J Am Coll Cardiol 1989;13:1514–1520. https://doi.org/10.1016/ 0735-1097(89)90341-0
Weinsaft JW, Kim J, Medicherla CB, Ma CL, Codella NCF, Kukar N, et al. Echocardiographic algorithm for post-myocardial infarction LV thrombus: a gatekeeper for thrombus evaluation by delayed enhancement CMR. JACC Cardiovasc Imaging 2016;9:505–515. https://doi.org/10.1016/j.jcmg.2015.06.017
Lancellotti P, Price S, Edvardsen T, Cosyns B, Neskovic AN, Dulgheru R, et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and the Acute Cardiovascular Care Association. Eur Heart J Cardiovasc Imaging 2015;16:119–146. https://doi.org/10.1093/ehjci/jeu210
Kim HW, Faraneh-Far A, Kim RJ. Cardiovascular magnetic resonance in patients with myocardial infarction. J Am Coll Cardiol. 2009;55:1–16.
Beek AM, van Rossum AC. Cardiovascular magnetic resonance imaging in patients with acute myocardial infarction. Heart 2010;96:237–243.
de Waha S, Eitel I, Desch S, Fuernau G, Lurz P, Stiermaier T, et al. Prognosis after ST-elevation myocardial infarction: a study on cardiac magnetic resonance imaging versus clinical routine. Trials 2014;15:249. https://doi.org/10.1186/1745-6215-15-249
Larose E, Côté J, Rodés-Cabau J, Noël B, Barbeau G, Bordeleau E, et al. Contrast-enhanced cardiovascular magnetic resonance in the hyperacute phase of ST-elevation myocardial infarction. Int J Cardiovasc Imaging 2009;25:519–527. https:// doi.org/10.1007/s10554-009-9451-4
Stiermaier T, Jobs A, de Waha S, Fuernau G, Pöss J, Desch S, et al. Optimized prognosis assessment in ST-segment-elevation myocardial infarction using a cardiac magnetic resonance imaging risk score. Circ Cardiovasc Imaging 2017;10:e006774. https://doi. org/10.1161/circimaging.117.006774
de Waha S, Desch S, Eitel I, Fuernau G, Zachrau J, Leuschner A, et al. Impact of early vs. late microvascular obstruction assessed by magnetic resonance imaging on long-term outcome after ST-elevation myocardial infarction: a comparison with traditional prognostic markers. Eur Heart J 2010;31:2660–2668. https://doi.org/10.1093/eurheartj/ ehq247
van Kranenburg M, Magro M, Thiele H, de Waha S, Eitel I, Cochet A, et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc Imaging 2014;7:930–939. https://doi.org/10.1016/j.jcmg.2014. 05.010
Bulluck H, Chan MHH, Paradies V, Yellon RL, Ho HH, Chan MY, et al. Incidence and predictors of left ventricular thrombus by cardiovascular magnetic resonance in acute ST-segment elevation myocardial infarction treated by primary percutaneous coronary intervention: a meta-analysis. J Cardiovasc Magn Reson 2018;20:72. https://doi.org/10.1186/s12968-018-0494-3 МРТ
Velangi PS, Choo C, Chen KA, Kazmirczak F, Nijjar PS, Farzaneh-Far A, et al. Long-term embolic outcomes after detection of left ventricular thrombus by late gadolinium enhancement cardiovascular magnetic resonance imaging: a matched cohort study. Circ Cardiovasc Imaging 2019;12:e009723. https://doi.org/10.1161/circimaging.119.009723].
Dedic A, Lubbers MM, Schaap J, Lammers J, Lamfers EJ, Rensing BJ, et al. Coronary CT angiography for suspected ACS in the era of high-sensitivity troponins: randomized multicenter study. J Am Coll Cardiol 2016;67:16–26. https://doi.org/10.1016/j.jacc. 2015.10.045
Hoffmann U, Truong QA, Schoenfeld DA, Chou ET, Woodard PK, Nagurney JT, et al. Coronary CT angiography versus standard evaluation in acute chest pain. N Engl J Med 2012;367:299–308. https://doi.org/10.1056/NEJMoa1201161
Gray AJ, Roobottom C, Smith JE, Goodacre S, Oatey K, O’Brien R, et al. Early computed tomography coronary angiography in patients with suspected acute coronary syndrome: randomised controlled trial. BMJ 2021;374:n2106. https://doi.org/10. 1136/bmj.n2106
Lee KK, Bularga A, O’Brien R, Ferry AV, Doudesis D, Fujisawa T, et al. Troponin-guided coronary computed tomographic angiography after exclusion of myocardial infarction. J Am Coll Cardiol 2021;78:1407–1417. https://doi.org/10.1016/j.jacc.2021.07.055
Linde JJ, Hove JD, Sorgaard M, Kelbæk H, Jensen GB, Kühl JT, et al. Long-term clinical impact of coronary CT angiography in patients with recent acute-onset chest pain: the randomized controlled CATCH trial. JACC Cardiovasc Imaging 2015;8:1404–1413. https://doi.org/10.1016/j.jcmg.2015.07.015
Litt HI, Gatsonis C, Snyder B, Singh H, Miller CD, Entrikin DW, et al. CT angiography for safe discharge of patients with possible acute coronary syndromes. N Engl J Med 2012;366:1393–1403. https://doi.org/10.1056/NEJMoa1201163
Hulten E, Pickett C, Bittencourt MS, Villines TC, Petrillo S, Di Carli MF, et al. Outcomes after coronary computed tomography angiography in the emergency department: a systematic review and meta-analysis of randomized, controlled trials. J Am Coll Cardiol 2013;61:880–892. https://doi.org/10.1016/j.jacc.2012.11.061
Nabi F, Kassi M, Muhyieddeen K, Chang SM, Xu J, Peterson LE, et al. Optimizing evaluation of patients with low-to-intermediate-risk acute chest pain: a randomized study comparing stress myocardial perfusion tomography incorporating stress-only imaging versus cardiac CT. J Nucl Med 2016;57:378–384. https://doi.org/10.2967/jnumed.115. 166595
Lim TW, Karim TS, Fernando M, Haydar J, Lightowler R, Yip B, Sriamareswaran R, Tong DC, Layland J. Utility of Zwolle Risk Score in Guiding Low-Risk STEMI Discharge. Heart Lung Circ. 2021 Apr;30(4):489-495. doi: 10.1016/j.hlc.2020.08.026.
Parr CJ, Avery L, Hiebert B, Liu S, Minhas K, Ducas J. Using the Zwolle Risk Score at Time of Coronary Angiography to Triage Patients With ST-Elevation Myocardial Infarction Following Primary Percutaneous Coronary Intervention or Thrombolysis. J Am Heart Assoc. 2022 Feb 15;11(4):e024759. doi: 10.1161/JAHA.121.024759.
Williams C, Fordyce CB, Cairns JA, Turgeon RD, Lee T, Singer J, Mackay M, Wong GC. Temporal Trends in Reperfusion Delivery and Clinical Outcomes Following Implementation of a Regional STEMI Protocol: A 12-Year Perspective. CJC Open. 2022 Dec 14;5(3):181-190. doi: 10.1016/j.cjco.2022.11.015. PMID: 37013074; PMCID: PMC10066451.
Jortveit J, Pripp AH, Halvorsen S. Outcomes after delayed primary percutaneous coronary intervention vs. pharmaco-invasive strategy in ST-segment elevation myocardial infarction in Norway. Eur Heart J Cardiovasc Pharmacother. 2022 Aug 11;8(5):442-451. doi: 10.1093/ehjcvp/pvab041. PMID: 34038535; PMCID: PMC9366642.
Bainey KR, Armstrong PW, Zheng Y, Brass N, Tyrrell BD, Leung R, Westerhout CM, Welsh RC. Pharmacoinvasive Strategy Versus Primary Percutaneous Coronary Intervention in ST-Elevation Myocardial Infarction in Clinical Practice: Insights From the Vital Heart Response Registry. Circ Cardiovasc Interv. 2019 Oct;12(10):e008059. doi: 10.1161/CIRCINTERVENTIONS.119.008059. Epub 2019 Oct 14. PMID: 31607152.
Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996;348:771–775. https://doi.org/10.1016/s0140-6736(96)02514-7
Boersma E. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J 2006;27:779–788. https://doi.org/10.1093/eurheartj/ehi810
Hochman JS, Lamas GA, Buller CE, Dzavik V, Reynolds HR, Abramsky SJ,Forman S, Ruzyllo W, Maggioni AP, White H, Sadowski Z, Carvalho AC, Rankin JM, Renkin JP, Steg PG, Mascette AM, Sopko G, Pfisterer ME, Leor J, Fridrich V, Mark DB, Knatterud GL, Occluded Artery Trial Investigators. Coronary intervention for persistent occlusion after myocardial infarction. N Engl J Med. 2006;355(23):2395–2407.
Schomig A, Mehilli J, Antoniucci D, Ndrepepa G, Markwardt C, Di Pede F, Nekolla SG, Schlotterbeck K, Schuhlen H, Pache J, Seyfarth M, Martinoff S, Benzer W, Schmitt C, Dirschinger J, Schwaiger M, Kastrati A. Beyond 12 hours reperfusion alternative evaluation trial investigators. Mechanical reperfusion in patients with acute myocardial infarction presenting more than 12 hours from symptom onset: a randomized controlled trial. JAMA. 2005;293(23):2865–2872.
Nadrepepa G, Kastrati A, Mehilli J, Antoniucci D, Schomig A. Mechanical reperfusion and long-term mortality in patients with acute myocardial infarction presenting 12 to 48 hours from onset of symptoms. JAMA. 2009;301(5):487–488.
Bouisset F, Gerbaud E, Bataille V, Coste P, Puymirat E, Belle L, et al. Percutaneous myocardial revascularization in late-presenting patients with STEMI. J Am Coll Cardiol 2021;78:1291–1305. https://doi.org/10.1016/j.jacc.2021.07.039
Busk M, Kaltoft A, Nielsen SS, Bottcher M, Rehling M, Thuesen L, et al. Infarct size and myocardial salvage after primary angioplasty in patients presenting with symptoms for < 12 h vs. 12–72 h. Eur Heart J 2009;30:1322–1330. 13 https://doi.org/10.1093/eurheartj/ehp113
Gierlotka M, Gasior M, Wilczek K, Hawranek M, Szkodzinski J, Paczek P, et al. Reperfusion by primary percutaneous coronary intervention in patients with ST-segment elevation myocardial infarction within 12 to 24 hours of the onset of symptoms (from a prospective national observational study [PL-ACS]). Am J Cardiol 2011;107:501–508. 8 https://doi.org/10.1016/j.amjcard.2010.10.008
Ioannidis JP, Katritsis DG. Percutaneous coronary intervention for late reperfusion after myocardial infarction in stable patients. Am Heart J. 2007;154(6):1065–1071.
Menon V, Pearte CA, Buller CE, Steg PG, Forman SA, White HD, Marino PN, Katritsis DG, Caramori P, Lasevitch R, Loboz-Grudzien K, Zurakowski A, Lamas GA, Hochman JS. Lack of benefit from percutaneous intervention of persistently occluded infarct arteries after the acute phase of myocardial infarction is time independent: insights from Occluded Artery Trial. Eur Heart J. 2009;30(2):183–191.
Bangalore S, Toklu B, Wetterslev J. Complete versus culprit-only revascularization for ST-segment-elevation myocardial infarction and multivessel disease: a meta-analysis and trial sequential analysis of randomized trials. Circ Cardiovasc Interv. 2015;8(4):e002142.
Jang JS, Jin HY, Seo JS et al. The transradial versus the transfemoral approach for primary percutaneous coronary intervention in patients with acute myocardial infarction: a systematic review and meta-analysis. EuroIntervention. 2012;8(4):501–510. 32.
Joyal D, Bertrand OF, Rinfret S et al. Meta-analysis of ten trials on the effectiveness of the radial versus the femoral approach in primary percutaneous coronary intervention. Am J Cardiol. 2012;109(6):813–818.
Bertrand OF, Bélisle P, Joyal D et al. Comparison of transradial and femoral approaches for percutaneous coronary interventions: a systematic review and hierarchical Bayesian meta-analysis. Am J Cardiol. 2012;163(4):632‒648.
Valgimigli M, Gagnor A, Calabró P, et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet. 2015;385(9986):2465‒2476. 31.
Zhu MM, Feit A, Chadow H et al. Primary stent implantation compared with primary balloon angioplasty for acute myocardial infarction: a meta-analysis of randomized clinical trials. Am J Cardiol. 2001;88:297–301.
Nordmann AJ, Hengstler P, Harr T, Young J, Bucher HC. Clinical outcomes of primary stenting versus balloon angioplasty in patients with myocardial infarction: a meta-analysis of randomized controlled trials. Am J Med. 2004;116(4):253–262.
Kastrati A, Dibra A, Spaulding C, Laarman GJ, Menichelli M, Valgimigli M, DiLorenzo E, Kaiser C, Tierala I, Mehilli J, Seyfarth M, Varenne O, Dirksen MT, Percoco G, Varricchio A, Pittl U, Syvanne M, Suttorp MJ, Violini R, Schomig A. Meta-analysis of randomized trials on drug-eluting stents vs. bare-metal stents in patients with acute myocardial infarction. Eur Heart J 2007;28(22):2706–2713.
Philip F, Stewart S, Southard J. Very late stent thrombosis with second generation drug eluting stents compared to bare metal stents: Network meta-analysis of randomized primary percutaneous coronary intervention trials. Cathet Cardiovasc Interv. 2016;88:38–48.
Sabaté M, Brugaletta S, Cequier A, Iñiguez A, Serra A, Jiménez-Quevedo P, et al. Clinical outcomes in patients with ST-segment elevation myocardial infarction treated with everolimus-eluting stents versus bare-metal stents (EXAMINATION): 5-year results of a randomised trial. Lancet 2016;387:357–366. https://doi.org/10.1016/s0140-6736(15)00548-6
Räber L, Yamaji K, Kelbæk H, Engstrøm T, Baumbach A, Roffi M, et al. Five-year clinical outcomes and intracoronary imaging findings of the COMFORTABLE AMI trial: randomized comparison of biodegradable polymer-based biolimus-eluting stents with bare-metal stents in patients with acute ST-segment elevation myocardial infarction. Eur Heart J 2019;40:1909–1919. https://doi.org/10.1093/eurheartj/ehz074
Jolly SS, James S, Dzavik V, Cairns JA, Mahmoud KD, Zijlstra F et al. Thrombus aspiration in ST-segment-elevation myocardial infarction: an individual patient meta-analysis: Thrombectomy trialists collaboration. Circulation. 2017;135:143–152.
LOWER-MI Li Kam Wa, M. E., De Silva, K., Collet, C., & Perera, D. (2021). FLOWER-MI and the root of the problem with non-culprit revascularisation. Open heart, 8(2), e001763. https://doi.org/10.1136/openhrt-2021-001763
Cuculi F, De Maria GL, Meier P, Dall’Armellina E, de Caterina AR, Channon KM, et al. Impact of microvascular obstruction on the assessment of coronary flow reserve, index of microcirculatory resistance, and fractional flow reserve after ST-segment elevation myocardial infarction. J Am Coll Cardiol 2014;64:1894–1904. https://doi.org/10.1016/j.jacc.2014.07.987
De Bruyne B, Pijls NH, Bartunek J, Kulecki K, Bech J-W, De Winter H, et al. Fractional flow reserve in patients with prior myocardial infarction. Circulation 2001;104: 157–162. https://doi.org/10.1161/01.cir.104.2.157
Bainey KR, Engstrøm T, Smits PC, Gershlick AH, James SK, Storey RF, et al. Complete vs culprit-lesion-only revascularization for ST-segment elevation myocardial infarction: a systematic review and meta-analysis. JAMA Cardiol 2020;5:881–888. https://doi.org/10.1001/jamacardio.2020.1251
Sels JW, Tonino PA, Siebert U, Fearon WF, Van’t Veer M, De Bruyne B, et al. Fractional flow reserve in unstable angina and non-ST-segment elevation myocardial infarction experience from the FAME (Fractional flow reserve versus Angiography for Multivessel Evaluation) study. JACC Cardiovasc Interv 2011;4:1183–1189. https://doi.org/10.1016/j.jcin.2011.08.008
Wald DS, Hadyanto S, Bestwick JP. Should fractional flow reserve follow angiographic visual inspection to guide preventive percutaneous coronary intervention in ST-elevation myocardial infarction? Eur Heart J Qual Care Clin Outcomes 2020;6:186–192. https://doi.org/10.1093/ehjqcco/qcaa012
Gallone G, Angelini F, Fortuni F, Gnecchi M, De Filippo O, Baldetti L, et al. Angiography- vs. physiology-guided complete revascularization in patients with ST-elevation myocardial infarction and multivessel disease: who is the better gatekeeper in this setting? A meta-analysis of randomized controlled trials. Eur Heart J Qual Care Clin Outcomes 2020;6:199–200. https://doi.org/10.1093/ehjqcco/qcaa007
Lee JM, Kim HK, Park KH, Choo EH, Kim CJ, Lee SH, et al. Fractional flow reserve versus angiography-guided strategy in acute myocardial infarction with multivessel disease: a randomized trial. Eur Heart J 2023;44:473–484. https://doi.org/10.1093/eurheartj/ehac763
Wald, D. S., Morris, J. K., Wald, N. J., Chase, A. J., Edwards, R. J., Hughes, L. O., Berry, C., Oldroyd, K. G., & PRAMI Investigators (2013). Randomized trial of preventive angioplasty in myocardial infarction. The New England journal of medicine, 369(12), 1115–1123. https://doi.org/10.1056/NEJMoa1305520
Engstrøm T, Kelbæk H, Helqvist S, Høfsten DE, Kløvgaard L, Holmvang L, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI): an open-label, randomised controlled trial. Lancet 2015; 386:665–671. https://doi.org/10.1016/s0140-6736(15)60648-1
Smits PC, Abdel-Wahab M, Neumann FJ, Boxma-de Klerk BM, Lunde K, Schotborgh CE, et al. Fractional flow reserve-guided multivessel angioplasty in myocardial infarction. N Engl J Med 2017;376:1234–1244. https://doi.org/10.1056/NEJMoa1701067
Mehta, S. R., Wang, J., Wood, D. A., Spertus, J. A., Cohen, D. J., Mehran, R., Storey, R. F., Steg, P. G., Pinilla-Echeverri, N., Sheth, T., Bainey, K. R., Bangalore, S., Cantor, W. J., Faxon, D. P., Feldman, L. J., Jolly, S. S., Kunadian, V., Lavi, S., Lopez-Sendon, J., Madan, M., … COMPLETE Trial Investigators (2022). Complete Revascularization vs Culprit Lesion-Only Percutaneous Coronary Intervention for Angina-Related Quality of Life in Patients With ST-Segment Elevation Myocardial Infarction: Results From the COMPLETE Randomized Clinical Trial. JAMA cardiology, 7(11), 1091–1099. https://doi.org/10.1001/jamacardio.2022.3032
Gershlick AH, Khan JN, Kelly DJ, Greenwood JP, Sasikaran T, Curzen N, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol 2015;65:963–972. https://doi.org/10.1016/j.jacc.2014.12.038
COMPARE-ACUTE Chin, C. T., L"Allier, P., Neumann, F. J., Engstrøm, T., Jüni, P., & Olivecrona, G. K. (2017). The Compare-Acute trial of fractional flow reserve-guided multivessel angioplasty in myocardial infarction. EuroIntervention : journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology, 13(5), e613–e616. https://doi.org/10.4244/EIJV13I5A96
Diletti, R., den Dekker, W. K., Bennett, J., Schotborgh, C. E., van der Schaaf, R., Sabaté, M., Moreno, R., Ameloot, K., van Bommel, R., Forlani, D., van Reet, B., Esposito, G., Dirksen, M. T., Ruifrok, W. P. T., Everaert, B. R. C., Van Mieghem, C., Elscot, J. J., Cummins, P., Lenzen, M., Brugaletta, S., … BIOVASC Investigators (2023). Immediate versus staged complete revascularisation in patients presenting with acute coronary syndrome and multivessel coronary disease (BIOVASC): a prospective, open-label, non-inferiority, randomised trial. Lancet (London, England), 401(10383), 1172–1182. https://doi.org/10.1016/S0140-6736(23)00351-3
Simone Biscaglia, M.D., Vincenzo Guiducci, M.D., Javier Escaned, M.D., Raul Moreno, M.D., Valerio Lanzilotti, M.D., Andrea Santarelli, M.D., Enrico Cerrato, M.D., Giorgio Sacchetta, M.D., Alfonso Jurado-Roman, M.D., Alberto Menozzi, M.D., Ignacio Amat Santos, M.D., José Luis Díez Gil, M.D., et al., for the FIRE Trial Investigators† Complete or Culprit-Only PCI in Older Patients with Myocardial Infarction
Puymirat E, Cayla G, Simon T, Steg PG, Montalescot G, Durand-Zaleski I, et al. Multivessel PCI guided by FFR or angiography for myocardial infarction. N Engl J Med 2021;385:297–308. https://doi.org/10.1056/NEJMoa2104650 47
Darmoch F, Alraies MC, Al-Khadra Y, Moussa Pacha H, Pinto DS, Osborn EA. Intravascular ultrasound imaging-guided versus coronary angiography-guided percutaneous coronary intervention: a systematic review and meta-analysis. J Am Heart Assoc 2020;9:e013678. https://doi.org/10.1161/jaha.119.013678
Hong SJ, Kim BK, Shin DH, Nam CM, Kim JS, Ko Y-G, et al. Effect of intravascular ultrasound-guided vs angiography-guided everolimus-eluting stent implantation: the IVUS-XPL randomized clinical trial. JAMA 2015;314:2155–2163. https://doi.org/10.1001/jama.2015.15454
Zhang J, Gao X, Kan J, Ge Z, Han L, Lu S, et al. Intravascular ultrasound versus angiography-guided drug-eluting stent implantation: the ULTIMATE trial. J Am Coll Cardiol 2018;72:3126–3137. https://doi.org/10.1016/j.jacc.2018.09.013
Gao XF, Ge Z, Kong XQ, Kan J, Han L, Lu S, et al. 3-Year outcomes of the ULTIMATE trial comparing intravascular ultrasound versus angiography-guided drug-eluting stent implantation. JACC Cardiovasc Interv 2021;14:247–257. https://doi.org/10.1016/j.jcin.2020.10.001
Johnson TW, Räber L, di Mario C, Bourantas C, Jia H, Mattesini A, et al. Clinical use of intracoronary imaging. Part 2: acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making: an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J 2019;40:2566–2584. https://doi.org/10.1093/eurheartj/ehz332
Jia H, Dai J, He L, Xu Y, Shi Y, Zhao L, et al. EROSION III: a multicenter RCT of OCT-guided reperfusion in STEMI with early infarct artery patency. JACC Cardiovasc Interv 2022;15:846–856. https://doi.org/10.1016/j.jcin.2022.01.298
Meneveau N, Souteyrand G, Motreff P, Caussin C, Amabile N, Ohlmann P, et al. Optical coherence tomography to optimize results of percutaneous coronary intervention in patients with non-ST-elevation acute coronary syndrome: results of the multicenter, randomized DOCTORS study (Does Optical Coherence Tomography Optimize Results of Stenting). Circulation 2016;134:906–917. https://doi.org/10.1161/circulationaha.116.024393
Kala P, Cervinka P, Jakl M, Kanovsky J, Kupec A, Spacek R, et al. OCT guidance during stent implantation in primary PCI: a randomized multicenter study with nine months of optical coherence tomography follow-up. Int J Cardiol 2018;250:98–103. https://doi.org/10.1016/j.ijcard.2017.10.059
Kim Y, Bae S, Johnson TW, Son NH, Sim DS, Hong YJ, Kim SW, Cho DK, Kim JS, Kim BK, Choi D, Hong MK, Jang Y, Jeong MH; KAMIR‐NIH (Korea Acute Myocardial Infarction Registry‐National Institutes of Health) Investigators [Link]. Role of Intravascular Ultrasound-Guided Percutaneous Coronary Intervention in Optimizing Outcomes in Acute Myocardial Infarction. J Am Heart Assoc. 2022 Mar;11(5):e023481. doi: 10.1161/JAHA.121.023481. Epub 2022 Feb 18. PMID: 35179041; PMCID: PMC9075077.
Morrison LJ, Verbeek PR, McDonald AC, et al. Mortality and prehospital thrombolysis for acute myocardial infarction: a meta-analysis. J Am Med Assoc. 2000;283:2686–2692.
McCaul M, Lourens A, Kredo T. Pre-hospital versus in-hospital thrombolysis for ST-elevation myocardial infarction Cochrane Database Syst Rev. 2014, Issue 9. Art. No.: CD010191. doi: 10.1002/14651858.CD010191.pub2
Bonnefoy E, Steg PG, Boutitie F, Dubien PY, Lapostolle F, Roncalli J, Dissait F, Vanzetto G, Leizorowicz A, Kirkorian G, Mercier C, McFadden EP, Touboul P. Comparison of primary angioplasty and pre-hospital fibrinolysis in acute myocardial infarction (CAPTIM) trial: a 5-year follow-up. Eur Heart J. 2009;30 (13):1598–1606.
Gershlick AH, Stephens-Lloyd A, Hughes S, Abrams KR, Stevens SE, Uren NG, de Belder A, Davis J, Pitt M, Banning A, Baumbach A, Shiu MF, Schofield P, Dawkins KD, Henderson RA, Oldroyd KG, Wilcox R, REACT Trial Investigators. Rescue angioplasty after failed thrombolytic therapy for acute myocardial infarction. N Engl J Med. 2005;353(26):2758–2768.
Borgia F, Goodman SG, Halvorsen S, Cantor WJ, Piscione F, Le May MR, Fernandez-Aviles F, Sanchez PL, Dimopoulos K, Scheller B, Armstrong PW, Di Mario C. Early routine percutaneous coronary intervention after fibrinolysis vs. standard therapy in ST-segment elevation myocardial infarction: a meta-analysis. Eur Heart J. 2010;31(17):2156–2169.
D’Souza SP, Mamas MA, Fraser DG, Fath-Ordoubadi F. Routine early coronary angioplasty versus ischaemia-guided angioplasty after thrombolysis in acute ST-elevation myocardial infarction: a meta-analysis. Eur Heart J 2011;32(8):972–982.
Cantor WJ, Fitchett D, Borgundvaag B, Ducas J, Heffernan M, Cohen EA, Morrison LJ, Langer A, Dzavik V, Mehta SR, Lazzam C, Schwartz B, Casanova A, Goodman SG, TRANSFER-AMI Trial Investigators. Routine early angioplasty after fibrinolysis for acute myocardial infarction. N Engl J Med 2009;360(26):2705–2718.
GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. The GUSTO investigators. N Engl J Med. 1993;329:673–682.
Frans Van de Werf, Arsen D. Ristić, Oleg V. Averkov, Alexandra AriasMendoza, Yves Lambert, José F. Kerr Saraiva, Pablo Sepulveda, Fernando Rosell-Ortiz, John K. French , MBChB, PhD; Ljilja B. Musić, MD; Katleen Vandenberghe, Kris Bogaerts, Cynthia M. Westerhout, PhD., Alain Pagès, Thierry Danays , MD; Kevin R. Bainey, Peter Sinnaeve, Patrick Goldstein, Robert C. Welsh,Paul W. Armstrong. Half-Dose Tenecteplase or Primary Percutaneous Coronary Intervention in Older Patients With ST-Segment–Elevation Myocardial Infarction in STREAM-2: A Randomized, Open-Label Trial. Circulation. 2023;148:00–00. DOI:10.1161/CIRCULATIONAHA.123.064521].
Ellis SG, da Silva ER, Heyndrickx G, Talley JD, Cernigliaro C, Steg G, Spaulding C, Nobuyoshi M, Erbel R, Vassanelli C, Topol EJ, RЕSCUE Investigators. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation. 1994;90(5):2280–2284.
Sutton AGC, Campbell PG, Graham R et al. A randomized trial of rescue angioplasty versus a conservative approach for failed fibrinolysis in ST-segment elevation myocardial infarction: the Middlesbrough Early Revascularization to Limit INfarction (MERLIN) trial. J Am Coll Cardiol. 2004;44:287–296.
Wijeysundera HC, Vijayaraghavan R, Nallamothu BK et al. Rescue angioplasty or repeat fibrinolysis after failed fibrinolytic therapy for ST-segment myocardial infarction: a meta-analysis of randomized trials. J Am Coll Cardiol. 2007;49:422–430.
Collet JP, Montalesot G, Le May M et al. Percutaneous coronary intervention after fibrinolysis: a multiple meta-analyses approach according to the type of strategy. J Am Coll Cardiol. 2006;48:1326 –1335.
Appleton DL, Abbate A, Biondi-Zoccai GGL. Late percutaneous coronary intervention for the totally occluded infarct-related artery: a meta-analysis of the effects on cardiac function and remodeling. Catheter Cardiovasc Interv. 2008;71:772–781.
Ibanez B, James S, Agewall S et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology. Eur Heart J. 2018;39:119–177.
O"Gara PT, Kushner FG, Ascheim DD et al. 2013 ACCF/aha guideline for the management of ST-elevation myocardial infarction. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. JACC 2013; 61: 485–510.
Brar SS, Shen AY, Jorgensen MB, Kotlewski A, Aharonian VJ, Desai N, et al. Sodium bicarbonate vs sodium chloride for the prevention of contrast medium-induced nephropathy in patients undergoing coronary angiography: a randomized trial. JAMA 2008;300:1038–1046. https://doi.org/10.1001/jama.300.9.1038
Brar SS, Aharonian V, Mansukhani P, Moore N, Shen AYJ, Jorgensen M, et al. Haemodynamic-guided fluid administration for the prevention of contrast-induced acute kidney injury: the POSEIDON randomised controlled trial. Lancet 2014;383: 1814–1823. https://doi.org/10.1016/s0140-6736(14)60689-9
Giacoppo D, Gargiulo G, Buccheri S, Aruta P, Byrne RA, Cassese S, et al. Preventive strategies for contrast-induced acute kidney injury in patients undergoing percutaneous coronary procedures: evidence from a hierarchical Bayesian network meta-analysis of 124 trials and 28240 patients. Circ Cardiovasc Interv 2017;10: e004383. https://doi.org/10.1161/circinterventions.116.004383
Nijssen EC, Rennenberg RJ, Nelemans PJ, Essers BA, Janssen MM, Vermeeren MA, et al. Prophylactic hydration to protect renal function from intravascular iodinated contrast material in patients at high risk of contrast-induced nephropathy (AMACING): a prospective, randomised, phase 3, controlled, open-label, non-inferiority trial. Lancet 2017;389:1312–1322. https://doi.org/10.1016/s0140-6736(17)30057-0
Aspelin P, Aubry P, Fransson SG, Strasser R, Willenbrock R, Berg KJ. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med 2003; 348: 491-499.
Jo SH, Youn TJ, Koo BK, Park JS, Kang HJ, Cho YS, Chung WY, Joo GW, Chae IH, Choi DJ, Oh BH, Lee MM, Park YB, Kim HS. Renal toxicity evaluation and comparison between Visipaque (iodixanol) and Hexabrix (ioxaglate) in patients with renal insufficiency undergoing coronary angiography: the RECOVER study: a randomized controlled trial. J Am Coll Cardiol 2006; 48: 924-930.
Solomon RJ, Natarajan MK, Doucet S, Sharma SK, Staniloae CS, Katholi RE, Gelormini JL, Labinaz M, Moreyra AE. Cardiac Angiography in Renally Impaired Patients (CARE) study: a randomized double-blind trial of contrast-induced nephropathy in patients with chronic kidney disease. Circulation 2007; 115: 3189-3196.
Maioli M, Toso A, Leoncini M, Micheletti C, Bellandi F. Effects of hydration in contrast-induced acute kidney injury after primary angioplasty: a randomized, controlled trial. Circ Cardiovasc Interv 2011; 4: 456-462.
Tweet MS, Eleid MF, Best PJM, Lennon RJ, Lerman A, Rihal CS, et al. Spontaneous coronary artery dissection: revascularization versus conservative therapy. Circ Cardiovasc Interv 2014;7:777–786. https://doi.org/10.1161/circinterventions.114.001659
Hayes SN, Tweet MS, Adlam D, Kim ESH, Gulati R, Price JE, et al. Spontaneous coronary artery dissection: JACC State-of-the-Art Review. J Am Coll Cardiol 2020;76:961–984. https://doi.org/10.1016/j.jacc.2020.05.084
Adlam D, Alfonso F, Maas A, Vrints C. European Society of Cardiology, Acute Cardiovascular Care Association, SCAD study group: a position paper on spontaneous coronary artery dissection. Eur Heart J 2018;39:3353–3368. https://doi.org/10.1093/eurheartj/ehy080
Jackson R, Al-Hussaini A, Joseph S, van Soest G, Wood A, Macaya F, et al. Spontaneous coronary artery dissection: pathophysiological insights from optical coherence tomography. JACC Cardiovasc Imaging 2019;12:2475–2488. https://doi.org/10.1016/j.jcmg.2019.01.015
Hayes SN, Kim ESH, Saw J, Adlam D, Arslanian-Engoren C, Economy KE, et al. Spontaneous coronary artery dissection: current state of the science: a scientific statement from the American Heart Association. Circulation 2018;137:e523–e557. https://doi.org/10.1161/cir.0000000000000564
Alfonso F, de la Torre Hernández JM, Ibáñez B, Sabaté M, Pan M, Gulati R, et al. Rationale and design of the BA-SCAD (Beta-blockers and Antiplatelet agents in patients with Spontaneous Coronary Artery Dissection) randomized clinical trial. Rev Esp Cardiol (Engl Ed) 2022;75:515–522. https://doi.org/10.1016/j.rec.2021.08.003
Tweet MS, Eleid MF, Best PJM, Lennon RJ, Lerman A, Rihal CS, et al. Spontaneous coronary artery dissection: revascularization versus conservative therapy. Circ Cardiovasc Interv 2014;7:777–786. https://doi.org/10.1161/circinterventions.114.001659
Hayes SN, Tweet MS, Adlam D, Kim ESH, Gulati R, Price JE, et al. Spontaneous coronary artery dissection: JACC State-of-the-Art Review. J Am Coll Cardiol 2020;76:961–984. https://doi.org/10.1016/j.jacc.2020.05.084
Corrigendum to: 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019 Oct 1;40(37):3096. doi: 10.1093/eurheartj/ehz507. Erratum for: Eur Heart J. 2019 Jan 7;40(2):87-165. PMID: 31292611.
Thielmann M, Wendt D, Slottosch I, Welp H, Schiller W, Tsagakis K, et al. Coronary artery bypass graft surgery in patients with acute coronary syndromes after primary percutaneous coronary intervention: a current report from the north-Rhine Westphalia surgical myocardial infarction registry. J Am Heart Assoc 2021;10: e021182. https://doi.org/10.1161/jaha.121.021182
Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, Buller CE, Jacobs AK, Slater JN, Col J, McKinlay SM, LeJemtel TH. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999 Aug 26;341(9):625-34. doi: 10.1056/NEJM199908263410901. PMID: 10460813.
Thiele H, Akin I, Sandri M, Fuernau G et al., on behalf of the CULPRIT‐SHOCK Investigators. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med. 2017; 377:2419–2432.
Ellis SG, Tendera M, de Belder MA et al. Facilitated PCI in patients with ST-elevation myocardial infarction. N Engl J Med. 2008;358:2205–2217.
Thiele H, Eitel I, Meinberg C, et al. Randomized comparison of pre-hospital-initiated facilitated percutaneous coronary intervention versus primary percutaneous coronary intervention in acute myocardial infarction very early after symptom onset: the LIPSIA-STEMI trial (Leipzig immediate prehospital facilitated angioplasty in ST-segment myocardial infarction) JACC Cardiovasc Interv. 2011;4:605–614.
Lemkes JS, Janssens GN, van der Hoeven NW, Jewbali LSD, Dubois EA, Meuwissen MM, et al. Coronary angiography after cardiac arrest without ST segment elevation: one-year outcomes of the COACT randomized clinical trial. JAMA Cardiol 2020;5: 1358–1365. https://doi.org/10.1001/jamacardio.2020.3670
Kunadian V, Chieffo A, Camici PG, Berry C, Escaned J, Maas AHEM, et al. An EAPCI expert consensus document on ischaemia with non-obstructive coronary arteries in collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J 2020;41:3504–3520. https://doi.org/10.1093/eurheartj/ehaa503
Pathik B, Raman B, Mohd Amin NH, Mahadavan D, Rajendran S, McGavigan AD, et al. Troponin-positive chest pain with unobstructed coronary arteries: incremental diag- nostic value of cardiovascular magnetic resonance imaging. Eur Heart J Cardiovasc Imaging 2016;17:1146–1152. https://doi.org/10.1093/ehjci/jev289
Reynolds HR, Maehara A, Kwong RY, Sedlak T, Saw J, Smilowitz NR, et al. Coronary optical coherence tomography and cardiac magnetic resonance imaging to determine underlying causes of myocardial infarction with nonobstructive coronary arteries in women. Circulation 2021;143:624–640. https://doi.org/10.1161/circulationaha.120. 052008
Bonin M, Mewton N, Roubille F, Morel O et al; for CIRCUS Study Investigators. Effect and safety of morphine use in acute anterior ST-segment elevation myocardial infarction. J Am Heart Assoc. 2018 Feb 10;7(4). pii: e006833. doi: 10.1161/JAHA.117.006833.
Lapostolle F, Van"t Hof AW, Hamm CW, Stibbe O et al. for ATLANTIC Investigators. Morphine and ticagrelor interaction in primary percutaneous coronary intervention in ST-segment elevation myocardial infarction: ATLANTIC-Morphine. Am J Cardiovasc Drugs. 2019 Apr;19(2):173–183. doi: 10.1007/s40256-018-0305-0
Thomas MR, Morton AC, Hossain R, Chen B, Luo L, Shahari NN, Hua P, Beniston RG, Judge HM, Storey RF. Morphine delays the onset of action of prasugrel in patients with prior history of ST-elevation myocardial infarction. Thromb Haemost. 2016 Jul 4;116(1):96–102. doi: 10.1160/TH16-02-0102. Epub 2016, Apr 21.
Hobl EL, Stimpfl T, Ebner J, Schoergenhofer C, Derhaschnig U, Sunder-Plassmann R, Jilma-Stohlawetz P, Mannhalter C, Posch M, Jilma B. Morphine decreases clopidogrel concentrations and effects: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol 2014;63(7):630–635.
Baumeister H, Hutter N, Bengel J. Psychological and pharmacological interventions for depression in patients with coronary artery disease. Cochrane Database Syst Rev 2011; 2011:Cd008012. https://doi.org/10.1002/14651858.CD008012.pub3
Richards SH, Anderson L, Jenkinson CE, Whalley B, Rees K, Davies P, et al. Psychological interventions for coronary heart disease: cochrane systematic review and meta-analysis. Eur J Prev Cardiol 2018;25:247–259. https://doi.org/10.1177/ 2047487317739978
Hofmann R, James SK, PhD, Jernberg T, MD, Lindahl B, Erlinge D, Witt N, Arefalk G, Frick M, Alfredsson J, Nilsson L, Ravn‑Fischer A, Omerovic E, Kellerth T, Sparv D, Ekelund U, Linder R, Ekström M, Lauermann J, Haaga U, Pernow J, Östlund O, Herlitz J, Svensson L, DETO2X-SWEDEHEART Investigators. Oxygen therapy in suspected acute myocardial infarction. N Engl J Med 2017; 377:1240–1249.
Stub D, Smith K, Bernard S, Nehme Z, Stephenson M, Bray JE, Cameron P, Barger B, Ellims AH1, Taylor AJ, Meredith IT1, Kaye DM; AVOID Investigators. Air versus oxygen in ST-segment-elevation myocardial infarction. Circulation. 2015 Jun 16;131(24):2143–2150. doi: 10.1161/CIRCULATIONAHA.114.014494.
Antithrombotic Trialists" Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002 Jan 12;324(7329):71–86.
Antithrombotic Trialists’ (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009;373:1849–1860. https://doi.org/10.1016/ s0140-6736(09)60503-1
Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361: 1045–1057. https://doi.org/10.1056/NEJMoa0904327
Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007;357:2001–2015. https://doi.org/10.1056/NEJMoa0706482
Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001; 358:527–533. https://doi.org/10.1016/s0140-6736(01)05701-4
Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, Collins R, Liu LS, COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial) Collaborative Group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet 2005;366(9497):1607–1621.
Sabatine MS, Cannon CP, Gibson CM, Lopez-Sendon JL, Montalesot G, Theroux P, Claeys MJ, Cools F, Hill KA, Skene AM, McCabe CH, Braunwald E, CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med. 2005;352(12):1179–1189.
Berwanger O, Lopes RD, Moia DDF, Fonseca FA, Jiang L, Goodman SG, et al. Ticagrelor versus clopidogrel in patients with STEMI treated with fibrinolysis: TREAT trial. J Am Coll Cardiol 2019;73:2819–2828. https://doi.org/10.1016/j.jacc. 2019.03.011
James SK, Roe MT, Cannon CP, Cornel JH, Horrow J, Husted S, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes intended for non-invasive management: substudy from prospective randomised PLATelet inhibition and patient Outcomes (PLATO) trial. BMJ 2011;342:d3527. https://doi.org/10.1136/bmj.d3527
Montalescot G, Wiviott SD, Braunwald E, Murphy SA, Gibson CM, McCabe CH et al. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009;373:723–731. 10.1016/S0140-6736(09)60441-4.
Schüpke S, Neumann FJ, Menichelli M, Mayer K, Bernlochner I, Wöhrle J, et al. Ticagrelor or prasugrel in patients with acute coronary syndromes. N Engl J Med 2019;381:1524–1534. https://doi.org/10.1056/NEJMoa1908973
Coughlan JJ, Aytekin A, Lahu S, Ndrepepa G, Menichelli M, Mayer K, et al. Ticagrelor or prasugrel for patients with acute coronary syndrome treated with percutaneous coronary intervention: a prespecified subgroup analysis of a randomized clinical trial. JAMA Cardiol 2021;6:1121–1129. https://doi.org/10.1001/jamacardio.2021.2228
Khan SU, Khan MZ, Asad ZUA, Valavoor S, Khan MU, Khan MS, Krupica T, Alkhouli M, Kaluski E. Efficacy and safety of low dose rivaroxaban in patients with coronary heart disease: a systematic review and meta-analysis. J Thromb Thrombolysis. 2020 Nov;50(4):913-920. doi: 10.1007/s11239-020-02114-7. PMID: 32281069; PMCID: PMC7554154.
Sanchez PL, Gimeno F, Ancillo P, Sanz JJ, Alonso-Briales JH, Bosa F, Santos I, Sanchis J, Bethencourt A, Lopez-Messa J, de Prado AP, Alonso JJ, San Roman JA, Fernandez-Aviles F. Role of the paclitaxel-eluting stent and tirofiban in patients with ST-elevation myocardial infarction undergoing postfibrinolysis angioplasty: the GRACIA-3 randomized clinical trial. Circ Cardiovasc Interv. 2010;3(4):297–307.
Gurm HS, Lincoff AM, Lee D, Tang WH, Jia G, Booth JE, Califf RM, Ohman EM, Van de Werf F, Armstrong PW, Guetta V, Wilcox R, Topol EJ, GUSTO V Trial. Outcome of acute ST-segment elevation myocardial infarction in diabetics treated with fibrinolytic or combination reduced fibrinolytic therapy and platelet glycoprotein IIb/IIIa inhibition: lessons from the GUSTO V trial. J Am Coll Cardiol. 2004 Feb 18; 43(4):542–548.
Bhatt DL, Cryer BL, Contant CF, Cohen M, Lanas A, Schnitzer TJ, et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010;363: 1909–1917. https://doi.org/10.1056/NEJMoa1007964.
Gargiulo G, Costa F, Ariotti S, Biscaglia S, Campo G, Esposito G, et al. Impact of proton pump inhibitors on clinical outcomes in patients treated with a 6- or 24-month dual-antiplatelet therapy duration: insights from the PROlonging Dual-antiplatelet treatment after Grading stent-induced Intimal hyperplasia studY trial. Am Heart J 2016;174:95–102. https://doi.org/10.1016/j.ahj.2016.01.015.
Eikelboom JW, Anand SS, Malmberg K, Weitz JI, Ginsberg JS, Yusuf S. Unfractionated heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a meta-analysis. Lancet 2000;355:1936–1942. https://doi.org/10.1016/ s0140-6736(00)02324-2
Eikelboom JW, Quinlan DJ, Mehta SR et al. Unfractionated and low-molecular-weight heparin as adjuncts to thrombolysis in aspirin-treated patients with ST-elevation acute myocardial infarction: a meta-analysis of the randomized trials. Circulation 2005; 112:3855.
Navarese EP, De Luca G, Castriota F et al. Low-molecular-weight heparins vs. unfractionated heparin in the setting of percutaneous coronary intervention for ST-elevation myocardial infarction: a meta-analysis. J Thromb Haemost. 2011; 9:1902.
Silvain J, Beygui F, Barthélémy O et al. Efficacy and safety of enoxaparin versus unfractionated heparin during percutaneous coronary intervention: systematic review and meta-analysis. BMJ. 2012; 344:e553.
White H, Hirulog and Early Reperfusion or Occlusion (HERO)-2 Trial Investigators. Thrombin-specific anticoagulation with bivalirudin versus heparin in patients receiving fibrinolytic therapy for acute myocardial infarction: the HERO-2 randomised trial. Lancet. 2001;358:1855.
Antman EM, Louwerenburg HW, Baars HF et al. Enoxaparin as adjunctive antithrombin therapy for ST-elevation myocardial infarction: results of the ENTIRE-Thrombolysis in Myocardial Infarction (TIMI) 23 Trial. Circulation. 2002;105:1642–1649.
Giraldez RR, Nicolau JC, Corbalan R, Gurfinkel EP, Juarez U, Lopez-Sendon J, Parkhomenko A, Molhoek P, Mohanavelu S, Morrow DA, Antman EM. Enoxaparin is superior to unfractionated heparin in patients with ST elevation myocardial infarction undergoing fibrinolysis regardless of the choice of lytic: an ExTRACT-TIMI 25 analysis. Eur Heart J. 2007;28(13):1566–1573.
White HD, Braunwald E, Murphy SA, Jacob AJ, Gotcheva N, Polonetsky L, et al. Enoxaparin vs. unfractionated heparin with fibrinolysis for ST-elevation myocardial infarction in elderly and younger patients: results from ExTRACT-TIMI 25. Eur Heart J 2007;28:1066–1071. https://doi.org/10.1093/eurheartj/ehm081
ASSENT-3 Investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab, or unfractionated heparin: the ASSENT-3 randomised trial in acute myocardial infarction. Lancet 2001;358:605–613. https://doi.org/10.1016/s0140- 6736(01)05775-0
Wallentin L, Goldstein P, Armstrong PW, Granger CB, Adgey AAJ, Arntz HR, et al. Efficacy and safety of tenecteplase in combination with the low-molecular-weight heparin enoxaparin or unfractionated heparin in the prehospital setting: the Assessment of the Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)-3 PLUS randomized trial in acute myocardial infarction. Circulation 2003;108:135–142. https://doi. org/10.1161/01.Cir.0000081659.72985.A8
Ross AM, Molhoek P, Lundergan C, Knudtson M, Draoui Y, Regalado L, et al. Randomized comparison of enoxaparin, a low-molecular-weight heparin, with unfractionated heparin adjunctive to recombinant tissue plasminogen activator thrombolysis and aspirin: second trial of Heparin and Aspirin Reperfusion Therapy (HART II). Circulation 2001;104:648–652. https://doi.org/10.1161/hc3101.093866
Tatu-Chiţoiu G, Oprişan M, Cismara O, Marinescu R, Marinescu A. Streptokinase and enoxaparin in the pre-hospital management of the ST-segment elevation acute myocardial infarction. Rom J Intern Med. 2002;40(1-4):11-25. PMID: 15526537.
Giraldez RR, Wiviott SD, Nicolau JC, Mohanavelu S, Morrow DA, Antman EM, Giugliano RP. Streptokinase and enoxaparin as an alternative to fibrin-specific lytic-based regimens: an ExTRACT-TIMI 25 analysis. Drugs. 2009 Jul 30;69(11):1433-43. doi: 10.2165/00003495-200969110-00003. PMID: 19634922.
Yusuf S, Mehta SR, Chrolavicius S, Cohen M, Grines CL, Goodman S, et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA 2006;295: 1519–1530. https://doi.org/10.1001/jama.295.13.joc60038
Montalesot G, Van’t Hof AW, Lapostolle F et al., on behalf of the ATLANTIC Investigators. Prehospital Ticagrelor in ST-Segment Elevation Myocardial Infarction. N Engl J Med. 2014;371:1016–1027.
Mehta SR, Tanguay JF, Eikelboom JW, Jolly SS, Joyner CD, Granger CB, Faxon DP, Rupprecht HJ, Budaj A, Avezum A, Widimsky P, Steg PG, Bassand JP, Montalescot G, Macaya C, Di Pasquale G, Niemela K, Ajani AE, White HD, Chrolavicius S, Gao P, Fox KA, Yusuf S, for CURRENT-OASIS Trial Investigators. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet. 2010;376:1233–1243.
Husted S, James S, Becker RC, Horrow J, Katus H, Storey RF, et al. Ticagrelor versus clopidogrel in elderly patients with acute coronary syndromes: a substudy from the prospective randomized PLATelet inhibition and patient Outcomes (PLATO) trial. Circ Cardiovasc Qual Outcomes 2012;5:680–688. https://doi.org/10.1161/ circoutcomes.111.964395
Gimbel M, Qaderdan K, Willemsen L, Hermanides R, Bergmeijer T, de Vrey E, et al. Clopidogrel versus ticagrelor or prasugrel in patients aged 70 years or older with non-ST-elevation acute coronary syndrome (POPular AGE): the randomised, openlabel, non-inferiority trial. Lancet 2020;395:1374–1381. https://doi.org/10.1016/ s0140-6736(20)30325-1
Boersma E, Harrington RA, Moliterno DJ, White H, Théroux P, Van de Werf F, et al. Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes: a meta-analysis of all major randomised clinical trials. Lancet 2002;359:189–198. https://doi.org/10.1016/ s0140-6736(02)07442-1
Long M, Ye Z, Zheng J, Chen W, Li L. Dual anti-platelet therapy following percutaneous coronary intervention in a population of patients with thrombocytopenia at baseline: a meta-analysis. BMC Pharmacol Toxicol 2020;21:31. https://doi.org/10.1186/ s40360-020-00409-2
Capodanno D, Gargiulo G, Capranzano P et al. Bivalirudin versus heparin with or without glycoprotein IIb/IIIa inhibitors in patients with STEMI undergoing primary PCI: An updated meta-analysis of 10,350 patients from five randomized clinical trials. Eur Heart J Acute Cardiovasc Care. 2016;5:253–262.
Erlinge D, Omerovic E, Fröbert O et al. Bivalirudin versus heparin monotherapy in myocardial infarction. N Engl J Med. 2017;377:1132–1142.
Valgimigli M, Frigoli E, Leonardi S, Rothenbuhler M, Gagnor A, Calabro P, Garducci S, Rubartelli P, Briguori C, Ando G, Repetto A, Limbruno U, Garbo R, Sganzerla P, Russo F, Lupi A, Cortese B, Ausiello A, Ierna S, Esposito G, Presbitero P, Santarelli A, Sardella G, Varbella F, Tresoldi S, de Cesare N, Rigattieri S, Zingarelli A, Tosi P, van’t Hof A, Boccuzzi G, Omerovic E, Sabate M, Heg D, Juni P, Vranckx P; MATRIX Investigators. Bivalirudin or unfractionated heparin in acute coronary syndromes. N Engl J Med. 2015;373:997–1009.
Zhang S, Gao W, Li H, Zou M, Sun S, Ba Y, Liu Y, Cheng G. Efficacy and safety of bivalirudin versus heparin in patients undergoing percutaneous coronary intervention: A meta-analysis of randomized controlled trials. Int J Cardiol. 2016 Apr 15;209:87-95. doi: 10.1016/j.ijcard.2016.01.206. Epub 2016 Jan 26. PMID: 26882192.
Nuhrenberg TG, Hochholzer W, Mashayekhi K, Ferenc M, Neumann FJ. Efficacy and safety of bivalirudin for percutaneous coronary intervention in acute coronary syndromes: A meta-analysis of randomized-controlled trials. Clin Res Cardiol. 2018;107:807–815.
Cannon CP, Bhatt DL, Oldgren J, Lip GYH, Ellis SG, Kimura T, Maeng M, Merkely B, Zeymer U, Gropper S, Nordaby M, Kleine E, Harper R, Manassie J, Januzzi JL, Ten Berg JM, Steg PG, Hohnloser SH; RE-DUAL Steering Committee PCI and Investigators. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med. 2017;377:1513–1524.
Dewilde WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Herrman JP, Adriaenssens T, Vrolix M, Heestermans AA, Vis MM, Tijsen JG, van’t Hof AW, ten Berg JM: WOEST Study Investigators. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013;381:1107–1115.
Gibson CM, Mehran R, Bode C, Halperin J, Verheugt FW, Wildgoose P, Birmingham M, Ianus J, Burton P, van Eickels M, Korjian S, Daaboul Y, Lip GY, Cohen M, Husted S, Peterson ED, Fox KA. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med. 2016;375:2423–2434.
Lopes RD., Heizer G, Aronson R, Vora AN., Massaro T, Mehran R, Goodman SG., Windecker S, Darius H, Averkov O, Bahit MC, Berwanger O, Budaj A, Hijazi Z, Parkhomenko A, Sinnaeve P, Storey F., Thiele H, Vinereanu D, Granger CB., Alexander JH., for the AUGUSTUS Investigators. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. NEJM. 2019;380:1509-1524.
Vranckx P, Valgimigli M, Eckardt L, Tijssen J, Lewalter T, Gargiulo G, et al. Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet 2019;394:1335–1343. https://doi.org/10. 1016/s0140-6736(19)31872-0
Gargiulo G, Goette A, Tijssen J, Eckardt L, Lewalter T, Vranckx P, et al. Safety and efficacy outcomes of double vs. triple antithrombotic therapy in patients with atrial fibrillation following percutaneous coronary intervention: a systematic review and meta-analysis of non-vitamin K antagonist oral anticoagulant-based randomized clinical trials. Eur Heart J 2019;40:3757–3767. https://doi.org/10.1093/eurheartj/ehz732
Ray WA, Chung CP, Murray KT, Smalley WE, Daugherty JR, Dupont WD, Stein CM. Association of Oral Anticoagulants and Proton Pump Inhibitor Cotherapy With Hospitalization for Upper Gastrointestinal Tract Bleeding. JAMA 2018; 320: 2221-2230 DOI:10.1001/jama.2018.17242.
Moayyedi P., Eikelboom J.W., Bosch J., Connolly S.J., et al.; COMPASS Investigators. Pantoprazole to Prevent Gastroduodenal Events in Patients Receiving Rivaroxaban and/or Aspirin in a Randomized, Double-Blind, Placebo-Controlled Trial Gastroenterology 2019; 157(2): 403-412. doi: 10.1053/j.gastro.2019.04.041.
Lee SR, Kwon S, Choi EK, Jung JH, Han KD, Oh S, Lip GYH. Proton Pump Inhibitor Co-Therapy in Patients with Atrial Fibrillation Treated with Oral Anticoagulants and a Prior History of Upper Gastrointestinal Tract Bleeding. Cardiovasc Drugs Ther 2022; 36: 679-689. DOI: 10.1007/s10557-021-07170-6.
Ahn HJ, Lee SR, Choi EK, Rhee TM, Kwon S, Oh S, Lip GYH. Protective effect of proton-pump inhibitor against gastrointestinal bleeding in patients receiving oral anticoagulants: A systematic review and meta-analysis. Br J Clin Pharmacol 2022; 88: 4676-4687. DOI: 10.1111/bcp.15478.
Urban P, Mehran R, Colleran R, Angiolillo DJ, Byrne RA, Capodanno D, et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention: a consensus document from the Academic Research Consortium for High Bleeding Risk. Eur Heart J 2019;40:2632–2653. https://doi.org/10.1093/eurheartj/ehz372
Palmerini T, Della Riva D, Benedetto U, Reggiani LB, Feres F, Abizaid A, Gilard M, Morice M, Valgimigli M, Hong M, Kim B, Jang Y, Kim H, Park KW, Colombo A, Chieffo A, Sangiorgi D, Biondi-Zoccai G, Genereux P, Angelini GD, White, Bhatt DL, Stone GW. Three, six or twelve months of dual antiplatelet therapy after drug-eluting stent implantation in patients with or without acute coronary syndromes: an individual patient data pairwise and network meta-analysis of six randomized trials and 11,473 patients. Eur Heart J. 2017; 38: 1034–1043.
Hahn J-Y, Song YB, Oh J-H, Chun WJ, Park YH, Jang WJ, et al. Effect of P2Y12 inhibitor monotherapy vs dual antiplatelet therapy on cardiovascular events in patients undergoing percutaneous coronary intervention: the SMART-CHOICE randomized clinical trial. JAMA 2019;321:2428–2437. https://doi.org/10.1001/jama.2019.8146.
Vranckx P, Valgimigli M, Jüni P, Hamm C, Steg PG, Heg D, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomized superiority trial. Lancet 2018;392:940–949. https://doi.org/10.1016/s0140-6736(18)31858-0.
Mehran R, Baber U, Sharma SK, Cohen DJ, Angiolillo DJ, Briguori C, et al. Ticagrelor with or without aspirin in high-risk patients after PCI. N Engl J Med 2019;381: 2032–2042. https://doi.org/10.1056/NEJMoa1908419.
Kim BK, Hong SJ, Cho YH, Yun KHo, Kim YH, Suh Y, et al. Effect of ticagrelor monotherapy vs ticagrelor with aspirin on major bleeding and cardiovascular events in patients with acute coronary syndrome: the TICO randomized clinical trial. JAMA 2020;323:2407–2416. https://doi.org/10.1001/jama.2020.7580.
Giacoppo D, Matsuda Y, Fovino LN, D’Amico G, Gargiulo G, Byrne RA, et al. Short dual antiplatelet therapy followed by P2Y12 inhibitor monotherapy vs. prolonged dual antiplatelet therapy after percutaneous coronary intervention with secondgeneration drug-eluting stents: a systematic review and meta-analysis of randomized clinical trials. Eur Heart J 2021;42:308–319. https://doi.org/10.1093/eurheartj/ehaa739.
Valgimigli M, Gragnano F, Branca M, Franzone A, Baber U, Jang Y, et al. P2Y12 inhibitor monotherapy or dual antiplatelet therapy after coronary revascularisation: individual patient level meta-analysis of randomised controlled trials. BMJ 2021;373:n1332. https://doi.org/10.1136/bmj.n1332.
Smits PC, Frigoli E, Tijssen J, Jüni P, Vranckx P, Ozaki Y, et al. Abbreviated antiplatelet therapy in patients at high bleeding risk with or without oral anticoagulant therapy after coronary stenting: an open-label, randomized, controlled trial. Circulation 2021; 144:1196–1211. https://doi.org/10.1161/circulationaha.121.056680.
Watanabe H., Morimoto T., Natsuaki M., et al.; STOPDAPT-2 ACS Investigators. Comparison of Clopidogrel Monotherapy After 1 to 2 Months of Dual Antiplatelet Therapy With 12 Months of Dual Antiplatelet Therapy in Patients With Acute Coronary Syndrome: The STOPDAPT-2 ACS Randomized Clinical Trial. JAMA Cardiol 2022 Apr 1;7(4):407-417. doi: 10.1001/jamacardio.2021.5244.
Sibbing D, Aradi D, Jacobshagen C, Gross L, Trenk D, Geisler T, Orban M, Hadamitzky M, Merkely B, Kiss RG, Komócsi A, Dézsi CA, Holdt L, Felix SB, Parma R, Klopotowski M, Schwinger RHG, Rieber J, Huber K, Neumann F-J, Koltowski Mehilli J, Huczek Z, Massberg S, on behalf of the TROPICAL-ACS Investigators. Guided de-ЕОКalation of antiplatelet treatment in patients with acute coronary syndrome undergoing percutaneous coronary intervention (TROPICAL-ACS): a randomised, open-label, multicentre trial. Lancet. 2017;390:1747–1757.
Cuisset T, Deharo P, Quilici J, Johnson TW., Deffarges S, Bassez C, Bonnet G, Fourcade L, Mouret JP, Lambert, Verdier V, Morange PE, Alessi MC, Bonnet JL. Benefit of switching dual antiplatelet therapy after acute coronary syndrome: the TOPIC (timing of platelet inhibition after acute coronary syndrome) randomized study. Eur Heart J. 2017;38: 3070-3078.
Kim CJ, Park MW, Kim MC, Choo EH, Hwang B-H, Lee KY, et al. Unguided de-escalation from ticagrelor to clopidogrel in stabilised patients with acute myocardial infarction undergoing percutaneous coronary intervention (TALOS-AMI): an investigator-initiated, open-label, multicentre, non-inferiority, randomised trial.Lancet 2021;398:1305–1316. https://doi.org/10.1016/s0140-6736(21)01445-8.
Claassens DMF, Vos GJA, Bergmeijer TO, Hermanides RS, van’t Hof AWJ, van der Harst P, et al. A genotype-guided strategy for oral P2Y12 inhibitors in primary PCI. N Engl J Med 2019;381:1621–1631. https://doi.org/10.1056/NEJMoa1907096.
Eikelboom JW, Connolly SJ, Bosch J et al., on behalf of the COMPASS Investigators. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med. 2017; 377:1319–1930.
Connolly SJ, Eikelboom JW, Bosch J et al. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet 2018;391:205–218.
Mauri L, Kereiakes DJ, Yeh RW, Driscoll-Shempp P, Cutlip DE, Steg PG, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371:2155–2166. https://doi.org/10.1056/NEJMoa1409312
Bonaca MP, Bhatt DL, Steg PG, Storey RF, Cohen M, Im K, et al. Ischaemic risk and efficacy of ticagrelor in relation to time from P2Y12 inhibitor withdrawal in patients with prior myocardial infarction: insights from PEGASUS-TIMI 54. Eur Heart J 2016; 37:1133–1142. https://doi.org/10.1093/eurheartj/ehv531
Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372: 1791–1800. https://doi.org/10.1056/NEJMoa1500857
Chiarito M, Sanz-Sánchez J, Cannata F, Cao D, Sturla M, Panico C, et al. Monotherapy with a P2Y(12) inhibitor or aspirin for secondary prevention in patients with established atherosclerosis: a systematic review and meta-analysis. Lancet 2020;395:1487–1495. https://doi.org/10.1016/s0140-6736(20)30315-9.
Koo BK, Kang J, Park KW, Rhee T-M, Yang H-M, Won KB, et al. Aspirin versus clopidogrel for chronic maintenance monotherapy after percutaneous coronary intervention (HOST-EXAM): an investigator-initiated, prospective, randomised, open-label, multicentre trial. Lancet 2021;397:2487–2496. https://doi.org/10.1016/s0140-6736(21)01063-1.
Leonardi S, Franzone A, Piccolo R, McFadden E, Vranckx P, Serruys P, Benit E, Liebetrau C, Janssens L, Ferrario M, Zurakowski A, van Geuns RJ, Dominici M, Huber K, Slagboom T, Buszman P, Bolognese L, Tumscitz C, Bryniarski K, Aminian A, Vrolix M, Petrov I, Garg S, Naber C, Prokopczuk J, Hamm C, Steg G, Heg D, Juni P, Windecker S, Valgimigli M. Rationale and design of a prospective substudy of clinical endpoint adjudication processes within an investigator-reported randomised controlled trial in patients with coronary artery disease: the GLOBAL LEADERS Adjudication Sub-StudY (GLASSY). BMJ Open. 2019 Mar 9;9(3):e026053. doi: 10.1136/bmjopen-2018-026053. PMID: 30852547; PMCID: PMC6429932.
ISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo STudio della Sopravvivenza nell’infarto Miocardico // Lancet. 1994. Vol. 343. 1115.
ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet 1995;345(8951):669–685.
Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico. GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Lancet. 1994; 343: 1115–1122.
R Roberts. Intravenous Nitroglycerin in Acute Myocardial Infarction. Am J Med. 1983 Jun 27;74(6B): 45-52.
Charvat J, Kuruvilla T, al Amad H. Beneficial Effect of Intravenous Nitroglycerin in Patients With non-Q Myocardial Infarction. Cardiologia. 1990 Jan;35(1):49-54.
Ibanez B, Macaya C, Sánchez-Brunete V, Pizarro G, Fernández-Friera L, Mateos A, et al. Effect of early metoprolol on infarct size in ST-segment-elevation myocardial infarction patients undergoing primary percutaneous coronary intervention: the effect of metoprolol in cardioprotection during an acute myocardial infarction (METOCARD-CNIC) trial. Circulation 2013;128:1495–1503. https://doi.org/10.1161/circulationaha.113. 003653
Roolvink V, Ibáñez B, Ottervanger JP, Pizarro G, van Royen N, Mateos A, et al. Early intravenous beta-blockers in patients with ST-segment elevation myocardial infarction before primary percutaneous coronary intervention. J Am Coll Cardiol 2016;67: 2705–2715. https://doi.org/10.1016/j.jacc.2016.03.522
Pizarro G, Fernández-Friera L, Fuster V, Fernández-Jiménez R, García-Ruiz JM, García-Álvarez A, et al. Long-term benefit of early pre-reperfusion metoprolol administration in patients with acute myocardial infarction: results from the METOCARD-CNIC trial (effect of metoprolol in cardioprotection during an acute myocardial infarction). J Am Coll Cardiol 2014;63:2356–2362. https://doi.org/10.1016/ j.jacc.2014.03.014
García-Ruiz JM, Fernández-Jiménez R, García-Alvarez A, Pizarro G, Galán-Arriola C, Fernández-Friera L, et al. Impact of the timing of metoprolol administration during STEMI on infarct size and ventricular function. J Am Coll Cardiol 2016;67:2093–2104. https://doi.org/10.1016/j.jacc.2016.02.050
Hoedemaker NP, Roolvink V, de Winter RJ, van Royen N, Fuster V, García-Ruiz JM, et al. Early intravenous beta-blockers in patients undergoing primary percutaneous coronary intervention for ST-segment elevation myocardial infarction: a patientpooled meta-analysis of randomized clinical trials. Eur Heart J Acute Cardiovasc Care 2020;9:469–477. https://doi.org/10.1177/2048872619830609
Sun B, Wang CY, Chen RR. Clinical Efficacy and Safety of Early Intravenous Administration of Beta-Blockers in Patients Suffering from Acute ST-Segment Elevation Myocardial Infarction Without Heart Failure Undergoing Primary Percutaneous Coronary Intervention: A Study-Level Meta-Analysis of Randomized Clinical Trials.Cardiovasc Drugs Ther. 2023 Apr 1. Doi: 10.1007/s10557-023-07448-x
Postgrad Med. 1985 Dec;78(8):40-6 Freemantle N, Cleland J, Young P, Mason J, Harrison J. Beta blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999;318(7200):1730–1737.
Watanabe H, Ozasa N, Morimoto T, Shiomi H, Bingyuan B, Suwa S, Nakagawa Y, Izumi 4, Kadota K, Ikeguchi S, Hibi K, Furukawa Y, Kaji S, Suzuki T, Akao M, Inada T, Hayashi Y, Nanasato M, Okutsu M, Kametani R, Sone T, Sugimura Y, Kawai K, Abe M, Kaneko H, Nakamura S, Kimura T; CAPITAL-RCT investigators. Long-term use of carvedilol in patients with ST-segment elevation myocardial infarction treated with primary percutaneous coronary intervention. PLoS One. 2018 Aug 28;13(8):e0199347.
Bangalore S, Makani H, Radford M, Thakur K, Toklu B, Katz SD, DiNicolantonio JJ, Devereaux PJ, Alexander KP, Wetterslev J, Messerli FH. Clinical outcomes with β-blockers for myocardial infarction: a meta-analysis of randomized trials. Am J Med. 2014 Oct;127(10):939–953.
Huang BT, Huang FY, Zuo ZL, Liao YB, Heng Y, Wang PJ, Gui YY, Xia TL, Xin ZM, Liu W, Zhang C, Chen SJ, Pu XB, Chen M, Huang DJ. Meta-analysis of relation between oral β-blocker therapy and outcomes in patients with acute myocardial infarction who underwent percutaneous coronary intervention. Am J Cardiol. 2015 Jun 1;115(11):1529–1538.
Munkhaugen J, Ruddox V, Halvorsen S, Dammen T, Fagerland MW, Hernæs KH, Vethe NT, Prescott E, Jensen SE, Rødevand O. Betablocker treatment after acute myocardial infarction in revascularized patients without reduced left ventricular ejection fraction (BETAMI): rationale and design of a prospective, randomized, open, blinded end point study. Am Heart J 2019;208:37–46.
Kristensen AMD, Bovin A, Zwisler AD, Cerquira C, Torp-Pedersen C, Bøtker HE, Gustafsson I, Veien KT, Thomsen KK, Olsen MH. Design and rationale of the Danish trial of beta-blocker treatment after myocardial infarction without reduced ejection fraction: study protocol for a randomized controlled trial. Trials 2020;21:1–11.
Rossello X, Raposeiras-Roubin S, Latini R, Dominguez-Rodriguez A, Barrabés JA, Sánchez PL, Anguita M, Fernández-Vázquez F, Pascual-Figal D, De la Torre Hernandez JM. Rationale and design of the pragmatic clinical trial tREatment with beta-blockers after ayesiand infarction ayesia reduced ejection ayesian (REBOOT). Eur Heart J Cardiovasc Pharmacother 2022;8(3):291–301.
Yndigegn T, Lindahl B, Alfredsson J, Benatar J, Brandin L, Erlinge D, Haaga U, Held C, Johansson P, Karlström P, Kellerth T, Marandi T, Mars K, Ravn-Fischer A, Sundström J, Östlund O, Hofmann R, Jernberg T. Design and rationale of randomized evaluation of decreased usage of beta-blockers after acute myocardial infarction (REDUCE-AMI). Eur Heart J Cardiovasc Pharmacother. 2023 Feb 2;9(2):192-197. doi: 10.1093/ehjcvp/pvac070].
Goldberger JJ, Bonow RO, Cuffe M, Liu L, Rosenberg Y, Shah PK, Smith SC, Jr, Subacius H, OBTAIN Investigators. Effect of beta-blocker dose on survival after acute myocardial infarction. J Am Coll Cardiol. 2015;66(13):1431–1441.
Andersson C, Shilane D, Go AS, Chang TI, Kazi D, Solomon MD, Boothroyd DB, Hlatky MA. Beta-blocker therapy and cardiac events among patients with newly diagnosed coronary heart disease. J Am Coll Cardiol. 014;64(3):247–252.
Safi S, Sethi NJ, Korang SK, Nielsen EE, Feinberg J, Gluud C, Jakobsen JC.Beta-blockers in patients without heart failure after myocardial infarction.Cochrane Database Syst Rev. 2021 Nov 5;11(11):CD012565. Doi: 10.1002/14651858.
Wen XS, Luo R, Liu J, Duan Q, Qin S, Xiao J, Zhang DY. Short-term/long-term prognosis with or without beta-blockers in patients without heart failure and with preserved ejection fraction after acute myocardial infarction: a multicenter retrospective cohort study. BMC Cardiovasc Disord. 2022 Apr 26;22(1):193. Doi: 10.1186/s12872-022-02631-8.
Won H, Suh Y, Kim GS, Ko YG, Hong MK. Clinical Impact of Beta-Blockers in Patients with Myocardial Infarction from the Korean National Health Insurance Database. Korean Circ J. 2020 Jun;50(6):499-508. Doi: 10.4070/kcj.2019.0231.
Desta L, Khedri M, Jernberg T, Andell P, Mohammad MA, Hofman-Bang C, Erlinge D, Spaak J, Persson H. Adherence to beta-blockers and long-term risk of heart failure and mortality after a myocardial infarction. ESC Heart Fail. 2021 Feb;8(1):344-355. Doi: 10.1002/ehf2.13079.
Song PS, Kim M, Seong SW, Park JH, Choi SW, Hahn JY, Gwon HC, Hur SH, Rha SW, Yoon CH, Jeong MH, Seong IW, Jeong JO. Heart failure with mid-range ejection fraction and the effect of β-blockers after acute myocardial infarction. Heart Vessels. 2021 Dec;36(12):1848-1855. doi: 10.1007/s00380-021-01876-1.
Velásquez-Rodríguez J, Bruña V, Vicent L, Díez-Delhoyo F, Valero-Masa MJ, Sousa-Casasnovas I, Juárez M, Devesa C, Fernández-Avilés F, Martínez-Sellés M. Influence of left ventricular systolic function on the long-term benefit of beta-blockers after ST-segment elevation myocardial infarction. Rev Port Cardiol (Engl Ed). 2021 Apr;40(4):285-290. doi: 10.1016/j.repc.2020.07.017.
Puymirat E, Riant E, Aissaoui N, Soria A, Ducrocq G, Coste P, et al. βblockers and mor- tality after myocardial infarction in patients without heart failure: ayesiand pro- spective cohort study. BMJ 2016;354:i4801. https://doi.org/10.1136/bmj.i4801
Zeitouni M, Kerneis M, Lattuca B, Guedeney P, Cayla G, Collet JP, et al. Do patients need lifelong β-blockers after an uncomplicated myocardial infarction? Am J Cardiovasc Drugs 2019;19:431–438. doi: https://doi.org/10.1007/s40256-019-00338-4].
Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet. 2001;357(9266):1385–1390.
Sterling LH, Filion KB, Atallah R, Reynier P, Eisenberg MJ. Intravenous beta-blockers in ST-segment elevation myocardial infarction: a systematic review and meta-analysis. Int J Cardiol. 2017 Feb 1;228:295–302.
Crea F, Deanfield J, Crean P, Sharom M, Davies G, Maseri A. Effects of verapamil in preventing early postinfarction angina and reinfarction. Am J Cardiol. 1985, 1;55(8):900-904.
Yusuf S, Held P, Furberg C. Update of effects of calcium antagonists in myocardial infarction or angina in light of the second Danish Verapamil Infarction Trial (DAVIT-II) and other recent studies. Am J Cardiol 1991;67(15):1295–1297.
Goldbourt U, Behar S, Reicher-Reiss H, Zion M, Mandelzweig L, Kaplinsky E. Early administration of nifedipine in suspected acute myocardial infarction. The secondary prevention reinfarction Israel nifedipine trial 2 study. Arch Intern Med. 1993 Feb 8;153(3):345–353.
ACE Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. Circulation 1998;97(22):2202–2212.
Flather MD, Yusuf S, Køber L, Pfeffer M, Hall A, Murray G, Torp-Pedersen C, Ball S, Pogue J, Moyé L, Braunwald E.Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE-Inhibitor Myocardial Infarction Collaborative Group. Lancet. 2000 May 6;355(9215):1575–1581.
Pfeffer MA, Greaves SC, Arnold JM, Glynn RJ, LaMotte FS, Lee RT, Menapace FJ, Jr, Rapaport E, Ridker PM, Rouleau JL, Solomon SD, Hennekens CH. Early versus delayed angiotensin-converting enzyme inhibition therapy in acute myocardial infarction. The healing and early afterload reducing therapy trial. Circulation. 1997;95(12):2643–2651.
Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Kober L, Maggioni AP, Solomon SD, Swedberg K, Van de Werf F, White H, Leimberger JD, Henis M, Edwards S, Zelenkofske S, Sellers MA, Califf RM, Valsartan in Acute Myocardial Infarction Trial Investigators. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med 2003;349(20):1893–1906.
McMurray JJ, Packer M, Desai AS et al., on behalf of the PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014. 371(11):993–1004.
Berwanger O, Pfeffer M, Claggett D, Jering KS, Maggioni AP, et al. Sacubitril/valsartan versus ramipril for patients with acute myocardial infarction: win-ratio analysis of the PARADISE-MI trial. European Journal of Heart Failure (2022) doi:10.1002/ejhf.2663.
Gu J, Wang Y, Wang CQ, Zhang JF. The initial timing and dosage pattern of sacubitril/valsartan in patients with acute myocardial infarction undergoing percutaneous coronary intervention. Eur J Intern Med. 2023 Mar 27:S0953-6205(23)00091-2. Doi: 10.1016/j.ejim.2023.03.019.
Jering KS, Claggett B, Pfeffer MA, Granger C, Køber L, et al. Prospective ARNI vs. ACE inhibitor trial to DetermIne Superiority in reducing heart failure Events after Myocardial Infarction (PARADISE-MI): design and baseline characteristics. Eur J Heart Fail. 2021 Jun;23(6):1040-1048. Doi: 10.1002/ejhf.2191.
Lin G, Chen W, Wu M, Dai C, Xu K. The value of sacubitril/valsartan in acute anterior wall ST-segment elevation myocardial infarction before emergency Percutaneous coronary intervention. Cardiology. 2022 Oct 5. Doi: 10.1159/000527357.
Mehran R, Steg PhG, Pfeffer MA, Jering K, Claggett B, et al. The Effects of Angiotensin Receptor-Neprilysin Inhibition on Major Coronary Events in Patients With Acute Myocardial Infarction: Insights From the PARADISE-MI Trial. Circulation. 2022; 146:1749–1757. DOI: 10.1161/CIRCULATIONAHA.122.060841.
Pfeffer MA, Claggett B, Lewis EF, et al. Impact of Sacubitril/Valsartan Versus Ramipril on Total Heart Failure Events in the PARADISE-MI Trial. Circulation. 2022; 145:87–89. DOI: 10.1161/CIRCULATIONAHA.121.057429.
Pfeffer MA, Claggett B, Lewis EF, Granger CB, Køber L, et al. Angiotensin Receptor–Neprilysin Inhibition in Acute Myocardial Infarction. N Engl J Med 2021; 385:1845-1855. DOI: 10.1056/NEJMoa2104508.
Rezq A, Saad M, El Nozahi M. Comparison of the Efficacy and Safety of Sacubitril/Valsartan versus Ramipril in Patients With ST-Segment Elevation Myocardial Infarction. Am J Cardiol. 2021 Mar 15;143:7-13. Doi: 10.1016/j.amjcard.2020.12.037.
Shah AM, Claggett B, Prasad N, Li G, Volquez M, et al. Impact of Sacubitril/Valsartan Compared With Ramipril on Cardiac Structure and Function After Acute Myocardial Infarction: The PARADISE-MI Echocardiographic Substudy. Circulation. 2022;146:1067–1081. DOI: 10.1161/CIRCULATIONAHA.122.059210.
Xiong B, Nie D, Qian J, Yao Y, Yang G, Rong S, Zhu Q, Du Y, Jiang Y, Huang J. The benefits of sacubitril-valsartan in patients with acute myocardial infarction: a systematic review and meta-analysis. ESC Heart Fail. 2021 Dec;8(6):4852-4862. Doi: 10.1002/ehf2.13677. Epub 2021 Oct 30. PMID: 34716749.
Yang P, Han Y, Lian C, Wu X. Efficacy and safety of sacubitril/valsartan vs. valsartan in patients with acute myocardial infarction: A meta-analysis. Front Cardiovasc Med. 2022 Aug 24;9:988117. Doi: 10.3389/fcvm.2022.988117.
Zhou X, Zhu H, Zheng Y, Tan X, Tong X. A systematic review and meta-analysis of sacubitril-valsartan in the treatment of ventricular remodeling in patients with heart failure after acute myocardial infarction. Front Cardiovasc Med. 2022 Oct 11;9:953948. Doi: 10.3389/fcvm.2022.953948.].
Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, Bittman R, Hurley S, Kleiman J, Gatlin M, Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348(14):1309–1321.
Montalescot G, Pitt B, Lopez de Sa E, Hamm CW, Flather M, Verheugt F, Shi H, Turgonyi E, Orri M, Vincent J, Zannad F, REMINDER Investigators. Early eplerenone treatment in patients with acute ST-elevation myocardial infarction without heart failure: the Randomized Double-Blind Reminder Study. Eur Heart J 2014;35(34):2295–2302.
Dahal K, Hendrani A, Sharma SP et al. Aldosterone antagonist therapy and mortality in patients with ST-segment elevation myocardial infarction without heart failure: a systematic review and meta-analysis. JAMA Intern Med. 2018;178(7):913–920. doi:10.1001/jamainternmed.2018.0850
Beygui F, Van Belle E, Ecollan P et al. Individual participant data analysis of two trials on aldosterone blockade in myocardial infarction. Heart. 2018;104:1843–1849.
Stenestrand U, Wallentin L, for the Swedish Register of Cardiac Intensive Care (RIKS-HIA). Early Statin Treatment Following Acute Myocardial Infarction and 1-Year Survival. JAMA. 2001;285(4):430–436. doi:10.1001/jama.285.4.430
Aronow HD, Topol EJ, Roe MT et al. Effect of lipid-lowering therapy on early mortality after acute coronary syndromes: an observational study. Lancet. 2001;357:1063–1068.
Giugliano RP, Antman EM, Thompson SL et al. Lipid lowering drug therapy initiated during hospitalization for acute MI is associated with lower postdischarge 1-year mortality. J Am Coll Cardiol. 2001;37 (suppl A):316A. Abstract.
Fonarow GC, Wright RS, Spencer FA et al. Effect of statin use within the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am J Cardiol .2005; 96:611–616.
Han X, Zhang Y, Yin L et al. Statin in the treatment of patients with myocardial infarction: a meta-analysis. Medicine/ 2018, vol. 97;12(2018):e0167. doi:10.1097/MD.0000000000010167
Navarese EP, Kowalewski M, Andreotti F, van Wely M, Camaro C, Kolodziejczak M, et al. Meta-analysis of time-related benefits of statin therapy in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Am J Cardiol 2014; 113:1753–1764. https://doi.org/10.1016/j.amjcard.2014.02.034
Nusca A, Melfi R, Patti G, Sciascio GD. Statin loading before percutaneous coronary intervention: proposed mechanisms and applications. Future Cardiol. 2010 Sep;6(5):579-89. doi: 10.2217/fca.10.77. PMID: 20932108.
Winchester DE, Wen X, Xie L, Bavry AA. Evidence of pre-procedural statin therapy a meta-analysis of randomized trials. J Am Coll Cardiol. 2010; 56:1099–1109. doi:10.1016/j.jacc.2010.04.023
Benjo AM, El-Hayek GE, Messerli F et al. High dose statin loading prior to percutaneous coronary intervention decreases cardiovascular events: a meta-analysis of randomized controlled trials. Catheter Cardiovasc Interv. 2015;85:53–60. doi:10.1002/ccd.25302
Yu XL, Zhang HJ, Ren SD et al. Effects of loading dose of atorvastatin before percutaneous coronary intervention on periprocedural myocardial injury. Coron Artery Dis. 2011;22:87–91. doi:10.1097/MCA. 0b013e328341baee
Liu Y, Su Q, Li L. Efficacy of short-term high-dose atorvastatin pretreatment in patients with acute coronary syndrome undergoing percutaneous coronary intervention: a meta-analysis of nine randomized controlled trials. Clin Cardiol. 2013 Dec; 36(12): E41–48. Epub 2013, Aug 27.
Ma Y ,Xiang C, Zhang B. Efficacy Evaluation of high-dose atorvastatin pretreatment in patients with acute coronary syndrome: a meta-analysis of randomized controlled trials. Med Sci Monit. 2018 Dec 23;24:9354–9363. doi: 10.12659/MSM.912544.
Ma M, Bu L, Shi L, Guo R, Yang B, Cao H, Luo L, Lu L. Effect of loading dose of atorvastatin therapy prior to percutaneous coronary intervention in patients with acute coronary syndrome: a meta-analysis of six randomized controlled trials. Drug Design, Development and Therapy. 2019;13:1233–1240.
Burgos LM, Battioni L, Costabel JP, Trivi M. Effect of high-dose statin pretreatment in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention: meta-analysis of randomized controlled trials. Presented on ESC 2019 (P831), 31 Aug 2019. https://academic.oup.com/eurheartj/article/40/Supplement_1/ehz747.0430/5594604
Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, Joyal SV, Hill KA, Pfeffer MA, Skene AM, Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004;350(15):1495–1504.
Cannon ChP, Blazing MA, Giugliano RP, McCagg A, B.S., White JA, M.S., Theroux P, Darius H, Lewis BS, Ophuis TO, Jukema JW, de Ferrari GM, Ruzyllo W, de Lucca P, Im KA, Bohula EA, PhD, Reist C, Wiviott SD, Tershakovec AM, Musliner T, Braunwald E, Califf RM, for the IMPROVE-IT Investigator Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015; 372:2387–2397.
Cholesterol Treatment Trialists C, Fulcher J, O’Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, Simes J, Collins R, Kirby A, Colhoun H, Braunwald E, La Rosa J, Pedersen TR, Tonkin A, Davis B, Sleight P, Franzosi MG, Baigent C, Keech A. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet 2015;385(9976):1397–1405.
Schwartz GG, Steg PG, Szarek M, Bhatt DL, and ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med. 2018;379:2097–2107.
Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, Kuder JF, Wang H, Liu T, Wasserman SM, Sever PS, Pedersen TR, FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376(18):1713–1722.
Schwartz GG, MD, Steg G, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM, Goodman ShG, Hanotin C, Harrington RA, Jukema JW, Lecorps G, for the ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018; 379:2097–2107.
Jukema JW et al. ODYSSEY OUTCOMES Committees and Investigators. Alirocumab in patients with polyvascular disease and recent acute coronary syndrome: ODYSSEY OUTCOMES trial // J Am Coll Cardiol. 2019. Vol. 74. №. 9. P. 1167–1176.
Mach F, Baigent C, Catapano A.L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2019. Doi:10.1093/eurheartj/ehz455
Koskinas KC et al. Evolocumab for early reduction of LDL cholesterol levels in patients with acute coronary syndromes (EVOPACS) // Journal of the American College of Cardiology. 2019. Vol. 74. №. 20. P. 2452–2462.
Trankle CR et al. Alirocumab in acute myocardial infarction: results from the Virginia commonwealth university alirocumab response trial (VCU-AlirocRT) // Journal of cardiovascular pharmacology. 2019. Vol. 74. №. 3. P. 266–269.
Mehta SR, et al. Effects of routine early treatment with PCSK9 inhibitors in patients undergoing primary percutaneous coronary intervention for ST-segment elevation myocardial infarction: a ayesian d, double-blind, sham-controlled trial. EuroIntervention. 2022 Dec 2;18(11):e888-e896. Doi: 10.4244/EIJ-D-22-00735.
Räber L, et al. Effect of Alirocumab Added to High-Intensity Statin Therapy on Coronary Atherosclerosis in Patients With Acute Myocardial Infarction: The PACMAN-AMI Randomized Clinical Trial. JAMA. 2022 May 10;327(18):1771-1781. Doi: 10.1001/jama.2022.5218
Ray KK, Wright RS, Khaled D, Koenig W, Leiter LA, Raal FJ, Bisch JA, Richardson T, Jaros M, Wijngaard PLJ, Kastelein JJP; ORION-10 and ORION-11 Investigators. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020 Apr 16;382(16):1507–1519. Doi:10.1056/NEJMoa1912387.
Lee J, Egolum U, Parihar H, Cooley M, Ling H. Effect of Ezetimibe Added to High-Intensity Statin Therapy on Low-Density Lipoprotein Cholesterol Levels: A Meta-Analysis. Cardiol Res. 2021 Apr;12(2):98–108. Doi:10.14740/cr1224.
Wang X, Wen D, Chen Y, Ma L, You C. PCSK9 inhibitors for secondary prevention in patients with cardiovascular diseases: a bayesian network meta-analysis. Cardiovasc Diabetol. 2022 Jun 15;21(1):107. Doi:10.1186/s12933-022-01542-4.
Ray KK, Reeskamp LF, Laufs U, Banach M, Mach F, Tokgözoğlu LS, Connolly DL, Gerrits AJ, Stroes ESG, Masana L, Kastelein JJP. Combination lipid-lowering therapy as first-line strategy in very high-risk patients. Eur Heart J. 2022 Feb 22;43(8):830–833. Doi:10.1093/eurheartj/ehab718.
Burnett H, Fahrbach K, Cichewicz A, Jindal R, Tarpey J, Durand A, Di Domenico M, Reichelt A, Viljoen A. Comparative efficacy of non-statin lipid-lowering therapies in patients with hypercholesterolemia at increased cardiovascular risk: a network meta-analysis. Curr Med Res Opin. 2022 May;38(5):777–784. Doi:10.1080/03007995.2022.2049164.
Malmberg K, Ryden L, Efendic S, Herlitz J, Nicol P, Waldenstrom A, Wedel H, Welin L. Randomized trial of insulin-glucose infusion followed by subcutaneous insulin treatment in diabetic patients with acute myocardial infarction (DIGAMI study): effects on mortality at 1 year. J Am Coll Cardiol 1995;26:57–65.
Malmberg K. Prospective randomised study of intensive insulin treatment on long term survival after acute myocardial infarction in patients with diabetes mellitus. DIGAMI (Diabetes Mellitus, Insulin Glucose Infusion in Acute Myocardial Infarction) Study Group. BMJ. 1997;314:1512–1515.
Ritsinger V, Malmberg K, Martensson A, Ryden L, Wedel H, Norhammar A. Intensified insulin-based glycaemic control after myocardial infarction: mortality during 20 year follow-up of the randomised Diabetes Mellitus Insulin Glucose Infusion in Acute Myocardial Infarction (DIGAMI 1) trial. Lancet Diabetes Endocrinol 2014;2:627–633.
American Association of Cardiovascular and Pulmonary Rehabilitation. Guidelines for Cardiac Rehabilitation and Secondary Prevention Programs, 5th ed. Champaign, IL: Human Kinetics, 2013.
Piepoli MF, Corra U, Benzer W. Secondary prevention through cardiac rehabilitation: Physical activity counselling and exercise training: key components of the position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation. Eur Heart J Suppl. 2010;31:1967–197.
Mezzani A, Hamm LF, Jones AM, McBride PE, Moholdt T, Stone JA, Williams MA. Aerobic exercise intensity assessment and prescription in cardiac rehabilitation: a joint position statement of the European Association for Cardiovascular Prevention and Rehabilitation, the American Association of Cardiovascular and Pulmonary Rehabilitation and the Canadian Association of Cardiac Rehabilitation. Eur J Prev Cardiol. 2013;20(3);442–467.
Wallert J, Mitchell A, Held C, Hagström E, Leosdottir M, Olsson EMG. Cardiac rehabilitation goal attainment after myocardial infarction with versus without diabetes: a nationwide registry study. Int J Cardiol 2019;292:19–24. https://doi.org/10.1016/j.ijcard. 2019.04.049
Piepoli MF, Corrà U, Adamopoulos S, Benzer W, Bjarnason-Wehrens B, Cupples M., … Giannuzzi P. Secondary prevention in the clinical management of patients with cardiovascular diseases. Core components, standards and outcome measures for referral and delivery: A Policy Statement from the Cardiac Rehabilitation Section of the European Association for Cardiovascular Prevention & Rehabilitation. Endorsed by the Committee for Practice Guidelines of the European Society of Cardiology. Eur J Prev Cardiol. 2014;21(6):664–681. https://doi.org/10.1177/2047487312449597
Gislason GH, Jacobsen S, Rasmussen JN et al. Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal antiinflammatory drugs after acute myocardial infarction. Circulation. 2006;113:2906–2913.
Kearney PM, Baigent C, Godwin J et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ. 2006;332:1302–1308.
The Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002;346:549–556. https://doi.org/10.1056/NEJMoa012689
Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002;346:557–563. https://doi.org/10.1056/NEJMoa003289
Belliard G, Catez E, Charron C, Caille V, Aegerter P, Dubourg O, et al. Efficacy of therapeutic hypothermia after out-of-hospital cardiac arrest due to ventricular fibrillation. Resuscitation 2007;75:252–259. https://doi.org/10.1016/j.resuscitation.2007.04.014
Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et al. Targeted temperature management at 33°C versus 36°C after cardiac arrest. N Engl J Med 2013;369:2197–2206. https://doi.org/10.1056/NEJMoa1310519
Dankiewicz J, Cronberg T, Lilja G, et al. Hypothermia versus Normothermia after Out-of-Hospital Cardiac Arrest. N Engl J Med. 2021;384(24):2283-2294. doi:10.1056/NEJMoa2100591
Wolfrum S, Roedl K, Hanebutte A, Pfeifer R, Kurowski V, Riessen R, et al. Temperature control after in-hospital cardiac arrest: a randomized clinical trial. Circulation 2022;146:1357–1366. https://doi.org/10.1161/circulationaha.122.060106
Vaahersalo J, Hiltunen P, Tiainen M, Oksanen T, Kaukonen K-M, Kurola J, et al. Therapeutic hypothermia after out-of-hospital cardiac arrest in Finnish intensive care units: the FINNRESUSCI study. Intensive Care Med 2013;39:826–837. https://doi.org/10.1007/s00134-013-2868-1
Okazaki T, Hifumi T, Kawakita K, Kuroda Y; Japanese Association for Acute Medicine out-of-hospital cardiac arrest (JAAM-OHCA) registry. Targeted temperature management guided by the severity of hyperlactatemia for out-of-hospital cardiac arrest patients: a post hoc analysis of a nationwide, multicenter prospective registry. Ann Intensive Care. 2019;9(1):127. Published 2019 Nov 19. doi:10.1186/s13613-019-0603-y
Callaway CW, Coppler PJ, Faro J, et al. Association of Initial Illness Severity and Outcomes After Cardiac Arrest With Targeted Temperature Management at 36 °C or 33 °C. JAMA Netw Open. 2020;3(7):e208215. Published 2020 Jul 1. doi:10.1001/jamanetworkopen.2020.8215
Nishikimi M, Ogura T, Nishida K, et al. Outcome Related to Level of Targeted Temperature Management in Postcardiac Arrest Syndrome of Low, Moderate, and High Severities: A Nationwide Multicenter Prospective Registry. Crit Care Med. 2021;49(8):e741-e750. doi:10.1097/CCM.0000000000005025
Lascarrou JB, Merdji H, Le Gouge A, et al. Targeted Temperature Management for Cardiac Arrest with Nonshockable Rhythm. N Engl J Med. 2019;381(24):2327-2337. doi:10.1056/NEJMoa190666
Perkins GD, Graesner JT, Semeraro F, Olasveengen T, Soar J, Lott C, et al. European Resuscitation Council Guidelines 2021: executive summary. Resuscitation 2021;161: 1–60. https://doi.org/10.1016/j.resuscitation.2021.02.003
Nolan JP, Sandroni C, Andersen LW, Böttiger BW, Cariou A, Cronberg T, et al. ERC-ESICM guidelines on temperature control after cardiac arrest in adults. Resuscitation 2022;172:229–236. https://doi.org/10.1016/j.resuscitation.2022.01.009
Hassager C, Schmidt H, Møller JE, Grand J, Mølstrøm S, Beske RP, et al. Duration of device-based fever prevention after cardiac arrest. N Engl J Med 2023;388:888–897. https://doi.org/10.1056/NEJMoa2212528 385. Wolfrum S, Roedl K, Hanebutte A, Pfeifer R, Kurowski V, Riessen R, et al. Temperature control after in-hospital cardiac arrest: a randomized clinical trial. Circulation 2022;146: 1357–1366. https://doi.org/10.1161/circulationaha.122.060106
Bonnefoy-Cudraz E, Bueno H, Casella G, De Maria E, Fitzsimons D, Halvorsen S, et al. Editor’s Choice – acute cardiovascular care association position paper on intensive cardiovascular care units: an update on their definition, structure, organisation and function. Eur Heart J Acute Cardiovasc Care 2018;7:80–95. https://doi.org/10.1177/ 2048872617724269
Killip T, Kimball J. T. Treatment of myocardial infarction in a coronary care unit Am. J. Cardiol 1967;20(4):457–464.
Khot UN, Jia G, Moliterno DJ et al. Prognostic importance of physical examination for heart failure in non-ST-elevation acute coronary syndromes: the enduring value of Killip classification. JAMA. 2003; Vol.290(16):2174–2181.
Masip J, Peacock WF, Price S, Cullen L, Martin-Sanchez FJ, Seferovic P, Maisel AS, Miro O, Filippatos G, Vrints C, Christ M, Cowie M, Platz E, McMurray J, DiSomma S, Zeymer U, Bueno H, Gale CP, Lettino M, Tavares M, Ruschitzka F, Mebazaa A, Harjola VP, Mueller C, Acute Heart Failure Study Group of the Acute Cardiovascular Care Association and the Committee on Acute Heart Failure of the Heart Failure Association of the European Society of Cardiology. Indications and practical approach to non-invasive ventilation in acute heart failure. Eur Heart J 2018;39:1725.
Weng CL, Zhao YT, Liu QH, Fu CJ, Sun F, Ma YL, Chen YW, He QY. Meta-analysis: non-invasive ventilation in acute cardiogenic pulmonary edema. Ann Intern Med 2010;152(9):590–600.
Gray A, Goodacre S, Newby DE, Masson M, Sampson F, Nicholl J, 3CPO Trialists. Noninvasive ventilation in acute cardiogenic pulmonary edema. N Engl J Med. 2008;359(2):142–151.
McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure [published correction appears in Eur Heart J. 2021 Oct 14;:]. Eur Heart J. 2021;42(36):3599-3726. doi:10.1093/eurheartj/ehab368
Mullens W, Damman K, Harjola VP, Mebazaa A, Brunner-La Rocca HP, Martens P, et al. The use of diuretics in heart failure with congestion—a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2019;21:137–155. https://doi.org/10.1002/ejhf.1369
Publication Committee for the VMAC Investigators (Vasodilatation in the Management of Acute CHF). Intravenous nesiritide vs nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial. JAMA 2002;287:15311540.
Cotter G, Metzkor E, Kaluski E, Faigenberg Z, Miller R, Simovitz A, Shaham O, Marghitay D, Koren M, Blatt A, Moshkovitz Y, Zaidenstein R, Golik A. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet 1998;351:389393.
Levy P, Compton S, Welch R, Delgado G, Jennett A, Penugonda N, Dunne R, Zalenski R. Treatment of severe decompensated heart failure with high-dose intravenous nitroglycerin: a feasibility and outcome analysis. Ann Emerg Med 2007;50:144152.
Kozhuharov N, Goudev A, Flores D, Maeder MT, Walter J, Shrestha S, et al. Effect of a strategy of comprehensive vasodilation vs usual care on mortality and heart failure rehospitalization among patients with acute heart failure: the GALACTIC randomized clinical trial. JAMA 2019;322:22922302.
Freund Y, Cachanado M, Delannoy Q, Laribi S, Yordanov Y, Gorlicki J, Chouihed T, Feral-Pierssens AL, Truchot J, Desmettre T, Occelli C, Bobbia X, Khellaf M, Ganansia O, Bokobza J, Balen F, Beaune S, Bloom B, Simon T, Mebazaa A. Effect of an emergency department care bundle on 30-day hospital discharge and survival among elderly patients with acute heart failure: the ELISABETH randomized clinical trial. JAMA 2020;324:19481956.
Peacock WF, Hollander JE, Diercks DB, Lopatin M, Fonarow G, Emerman CL. Morphine and outcomes in acute decompensated heart failure: an ADHERE analysis. Emerg Med J 2008;25:205209.
Gil V, Dominguez-Rodriguez A, Masip J, Peacock WF, Miro O. Morphine use in the treatment of acute cardiogenic pulmonary edema and its effects on patient outcome: a systematic review. Curr Heart Fail Rep 2019;16:8188
Miro O, Gil V, Martin-Sanchez FJ, Herrero-Puente P, Jacob J, Mebazaa A, Harjola VP, Rios J, Hollander JE, Peacock WF, Llorens P, ICA-SEMES Research Group. Morphine use in the ED and outcomes of patients with acute heart failure: a propensity score-matching analysis based on the EAHFE registry. Chest 2017;152:821832.
Caspi O, Naami R, Halfin E, Aronson D. Adverse dose-dependent effects of morphine therapy in acute heart failure. Int J Cardiol 2019;293:131136.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies: This statement was endorsed by the American College of Cardiology (ACC), American College of Emergency Physicians (ACEP), American Heart Association (AHA), European Society of Cardiology (ESC) Association for Acute Cardiovascular Care (ACVC), International Society for Heart and Lung Transplantation (ISHLT), Society of Critical Care Medicine (SCCM), and Society of Thoracic Surgeons (STS) in December 2021. J Am Coll Cardiol. 2022;79(9):933-946. doi:10.1016/j.jacc.2022.01.018
Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019;40:87–165. https://doi.org/10.1093/eurheartj/ehy394
Hochman JS, Sleeper LA, Webb JG, Dzavik V, Buller CE, Aylward P, et al. Early revascularization and long-term survival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006;295:2511–2515.
Maack C, Eschenhagen T, Hamdani N, Heinzel FR, Lyon AR, Manstein DJ, Metzger J, Papp Z, Tocchetti CG, Yilmaz MB, Anker SD, Balligand JL, Bauersachs J, Brutsaert D, Carrier L, Chlopicki S, Cleland JG, de Boer RA, Dietl A, Fischmeister R, Harjola VP, Heymans S, Hilfiker-Kleiner D, Holzmeister J, de Keulenaer G, Limongelli G, Linke WA, Lund LH, Masip J, Metra M, Mueller C, Pieske B, Ponikowski P, Ristic A, Ruschitzka F, Seferovic PM, Skouri H, Zimmermann WH, Mebazaa A. Treatments targeting inotropy. Eur Heart J 2019;40:36263644.
Mebazaa A, Yilmaz MB, Levy P, Ponikowski P, Peacock WF, Laribi S, Ristic AD, Lambrinou E, Masip J, Riley JP, McDonagh T, Mueller C, deFilippi C, Harjola VP, Thiele H, Piepoli MF, Metra M, Maggioni A, McMurray J, Dickstein K, Damman K, Seferovic PM, Ruschitzka F, Leite-Moreira AF, Bellou A, Anker SD, Filippatos G. Recommendations on pre-hospital & early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergency Medicine. Eur J Heart Fail 2015;17:544558.
Mebazaa A, Motiejunaite J, Gayat E, Crespo-Leiro MG, Lund LH, Maggioni AP, Chioncel O, Akiyama E, Harjola VP, Seferovic P, Laroche C, Julve MS, Roig E, Ruschitzka F, Filippatos G, ESC Heart Failure Long-Term Registry Investigators. Long-term safety of intravenous cardiovascular agents in acute heart failure: results from the European Society of Cardiology heart failure long-term registry. Eur J Heart Fail 2018;20:332341.
De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, Brasseur A, Defrance P, Gottignies P, Vincent JL, SOAP II Investigators. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010;362(9):779–789.
Levy B, Clere-Jehl R, Legras A, Morichau-Beauchant T, Leone M, Frederique G, Quenot JP, Kimmoun A, Cariou A, Lassus J, Harjola VP, Meziani F, Louis G, Rossignol P, Duarte K, Girerd N, Mebazaa A, Vignon P, Collaborators. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2018;72:173182.
Leopold V, Gayat E, Pirracchio R, Spinar J, Parenica J, Tarvasmaki T, Lassus J, Harjola VP, Champion S, Zannad F, Valente S, Urban P, Chua HR, Bellomo R, Popovic B, Ouweneel DM, Henriques JPS, Simonis G, Levy B, Kimmoun A, Gaudard P, Basir MB, Markota A, Adler C, Reuter H, Mebazaa A, Chouihed T. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Med 2018;44:847856.
Kim Y, Shapero K, Ahn SS, Goldsweig AM, Desai N, Altin SE. Outcomes of mechanical circulatory support for acute myocardial infarction complicated by cardiogenic shock. Catheter Cardiovasc Interv 2022;99:658–663. https://doi.org/10.1002/ccd.29834
Ostadal P, Rokyta R, Karasek J, Kruger A, Vondrakova D, Janotka M, et al. Extracorporeal membrane oxygenation in the therapy of cardiogenic shock: results of the ECMO-CS randomized clinical trial. Circulation 2022;147:454–464. https://doi. org/10.1161/circulationaha.122.062949
Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich H-G, Hausleiter J, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367:1287–1296. https://doi.org/10.1056/NEJMoa1208410
Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich H-G, Hausleiter J, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, openlabel trial. Lancet 2013;382:1638–1645. https://doi.org/10.1016/s0140-6736(13) 61783-3
Unverzagt S, Buerke M, de Waha A, Haerting J, Pietzner D, Seyfarth M, et al. Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock. Cochrane Database Syst Rev 2015;2015:Cd007398. https://doi.org/10.1002/14651858.CD007398.pub3
Thiele H, Zeymer U, Thelemann N, Neumann F-J, Hausleiter J, Abdel-Wahab M, et al. Intraaortic balloon pump in cardiogenic shock complicating acute myocardial infarction: long-term 6-year outcome of the randomized IABP-SHOCK II trial. Circulation 2018;139:395–403. https://doi.org/10.1161/circulationaha.118.038201
Chioncel O, Parissis J, Mebazaa A, Thiele H, Desch S, Bauersachs J, Harjola VP, Antohi EL, Arrigo M, Gal TB, Celutkiene J, Collins SP, DeBacker D, Iliescu VA, Jankowska E, Jaarsma T, Keramida K, Lainscak M, Lund LH, Lyon AR, Masip J, Metra M, Miro O, Mortara A, Mueller C, Mullens W, Nikolaou M, Piepoli M, Price S, Rosano G, Vieillard-Baron A, Weinstein JM, Anker SD, Filippatos G, Ruschitzka F, Coats AJS, Seferovic P. Epidemiology, pathophysiology and contemporary management of cardiogenic shock – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2020;22:13151341
Dumas F, Cariou A, Manzo-Silberman S, Grimaldi D, Vivien B, Rosencher J, Empana JP, Carli P, Mira JP, Jouven X, Spaulding C. Immediate percutaneous coronary intervention is associated with better survival after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv. 2010;3(3):200–207.
Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut J-FA, et al. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med 1997;336:1629–1633. https://doi.org/10.1056/nejm199706053362302
Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death Developed by the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) Endorsed by the Association for European Paediatric and Congenital Cardiology (AEPC). European Heart Journal. 2022. 43, 3997–4126
Nademanee K, Taylor R, Bailey WE, Rieders DE, Kosar EM. Treating electrical storm: sympathetic blockade versus advanced cardiac life support-guided therapy. Circulation 2000;102:742–747. https://doi.org/10.1161/01.cir.102.7.742
Kudenchuk PJ, Cobb LA, Copass MK, Cummins RO, Doherty AM, Fahrenbruch CE, et al. Amiodarone for resuscitation after out-of-hospital cardiac arrest due to ventricular fibrillation. N Engl J Med 1999;341:871–878. https://doi.org/10.1056/ nejm199909163411203
Levine JH, Massumi A, Scheinman MM, Winkle RA, Platia EV, Chilson DA, et al. Intravenous amiodarone for recurrent sustained hypotensive ventricular tachyarrhythmias. J Am Coll Cardiol 1996;27:67–75. https://doi.org/10.1016/0735-1097(95) 00427-0.
Jacobsen RM, Jabbari R, Glinge C, Stampe KN, Butt JH, Blanche P, et al. Potassium disturbances and risk of ventricular fibrillation among patients with ST-segment-elevation myocardial infarction. J Am Heart Assoc 2020;9:e014160.
Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, Daubert JP, Higgins SL, Brown MW, Andrews ML, Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346(12):877–883.
Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH, Sudden Cardiac Death in Heart Failure Trial Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005;352(3):225–237.
Deedwania PC, Singh BN, Ellenbogen K, Fisher S, Fletcher R, Singh SN. Spontaneous conversion and maintenance of sinus rhythm by amiodarone in patients with heart failure and atrial fibrillation: observations from the veterans affairs Congestive Heart failure Survival Trial of Antiarrhythmic Therapy (CHF-STAT). Circulation 1998;98: 2574–2579. https://doi.org/10.1161/01.cir.98.23.2574 608.
Hofmann R, Steinwender C, Kammler J, Kypta A, Wimmer G, Leisch F, et al. Intravenous amiodarone bolus for treatment of atrial fibrillation in patients with advanced congestive heart failure or cardiogenic shock. Wien Klin Wochenschr 2004; 116:744–749. https://doi.org/10.1007/s00508-004-0264-0 609.
Hindricks G., Potpara T., Dagres N., et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS) The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC). European Heart Journal (2020) 42, 373-498.
Hou ZY, Chang MS, Chen CY, Tu MS, Lin SL, Chiang HT, et al. Acute treatment of recent-onset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone: a randomized, digoxin-controlled study. Eur Heart J 1995;16:521–528.
Segal JB, McNamara RL, Miller MR, Kim N, Goodman SN, Powe NR, et al. The evidence regarding the drugs used for ventricular rate control. J Fam Pract 2000;49:47–59.
Schmitt J, Duray G, Gersh BJ, Hohnloser SH. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J 2009;30:1038–1045. https://doi.org/10.1093/eurheartj/ehn579
Batra G, Svennblad B, Held C, Jernberg T, Johanson P, Wallentin L, et al. All types of atrial fibrillation in the setting of myocardial infarction are associated with impaired outcome. Heart 2016;102:926–933. https://doi.org/10.1136/heartjnl-2015-308678
Siu CW, Jim MH, Ho HH, Miu R, Lee SWL, Lau CP, et al. Transient atrial fibrillation complicating acute inferior myocardial infarction: implications for future risk of ischemic stroke. Chest 2007;132:44–49. https://doi.org/10.1378/chest.06-2733
Feigl D, Ashkenazy J, Kishon Y. Early and late atrioventricular block in acute inferior myocardial infarction. J Am Coll Cardiol 1984;4:35–38. https://doi.org/10.1016/s0735- 1097(84)80315-0
Brady WJ, Swart G, DeBehnke DJ, Ma OJ, Aufderheide TP. The efficacy of atropine in the treatment of hemodynamically unstable bradycardia and atrioventricular block: prehospital and emergency department considerations. Resuscitation 1999;41: 47–55. https://doi.org/10.1016/s0300-9572(99)00032-5
Glikson M., Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). European Heart Journal (2021). 00, 1-94
Singh SM, FitzGerald G., Yan AT, Brieger D, et al. High-grade atrioventricular block in acute coronary syndromes: insights from the Global Registry of Acute Coronary Events. European Heart Journal (2015) 36, 976–983 doi:10.1093/eurheartj/ehu357
Gang UJ, Hvelplund A, Pedersen S, Iversen A, Jons C, Abildstrom SZ, et al. High-degree atrioventricular block complicating ST-segment elevation myocardial infarction in the era of primary percutaneous coronary intervention. Europace 2012;14:1639–1645. https://doi.org/10.1093/europace/eus161
Matteucci M, Fina D, Jiritano F, Meani P, Raffa GM, Kowalewski M, et al. The use of extracorporeal membrane oxygenation in the setting of postinfarction mechanical complications: outcome analysis of the Extracorporeal Life Support Organization Registry. Interact Cardiovasc Thorac Surg 2020;31:369–374. https://doi.org/10.1093/ icvts/ivaa108
Damluji AA, van Diepen S, Katz JN, Menon V, Tamis-Holland JE, Bakitas M, et al. Mechanical complications of acute myocardial infarction: a scientific statement from the American Heart Association. Circulation 2021;144:e16–e35. https://doi.org/10. 1161/cir.0000000000000985
Gong FF, Vaitenas I, Malaisrie SC, Maganti K. Mechanical complications of acute myocardial infarction: a review. JAMA Cardiol 2021;6:341–349. https://doi.org/10.1001/ jamacardio.2020.3690
Haddadin S, Milano AD, Faggian G. et al. Surgical treatment of postinfarction left ventricular free wall rupture. J Card Surg. 2009;24:624–631.
Ronco D, Matteucci M, Ravaux JM, Marra S, Torchio F, Corazzari C, et al. Mechanical circulatory support as a bridge to definitive treatment in post-infarction ventricular septal rupture. JACC Cardiovasc Interv 2021;14:1053–1066. https://doi.org/10.1016/j. jcin.2021.02.046
Fasol R, Lakew F, Wetter S. Mitral repair in patients with a ruptured papillary muscle. Am Heart J 2000; 139: 549–554.
Alajaji WA, Akl EA, Farha A, Jaber WA, AlJaroudi WA. Surgical versus medical management of patients with acute ischemic mitral regurgitation: a systematic review. BMC Res Notes 2015; 8: 712.
Kilic A, Sultan I, Chu D, Wang Y, Gleason TG. Mitral valve surgery for papillary muscle rupture: outcomes in 1342 patients from the society of thoracic surgeons database. Ann Thorac Surg 2020;110:1975–1981. https://doi.org/10.1016/j.athoracsur.2020.03. 097
Valle JA, Miyasaka RL, Carroll JD. Acute mitral regurgitation secondary to papillary muscle tear: is transcatheter edge-to-edge mitral valve repair a new paradigm? Circ Cardiovasc Interv 2017;10:e005050. https://doi.org/10.1161/circinterventions.117. 005050 572.
Adler Y, Charron P, Imazio M, Badano L, Barón-Esquivias G, Bogaert J, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: the Task Force for the diagnosis and management of pericardial diseases of the European Society of Cardiology (ESC) endorsed by: the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2015;36:2921–2964. https://doi.org/10.1093/eurheartj/ ehv318
Gevaert SA, Halvorsen S, Sinnaeve PR, Sambola A, Gulati G, Lancellotti P, et al. Evaluation and management of cancer patients presenting with acute cardiovascular disease: a Consensus Document of the Acute CardioVascular Care (ACVC) association and the ESC Council of Cardio-Oncology-Part 1: acute coronary syndromes and acute pericardial diseases. Eur Heart J Acute Cardiovasc Care 2021;10:947–959. https://doi.org/10.1093/ehjacc/zuab056
Verma BR, Montane B, Chetrit M, Khayata M, Furqan MM, Ayoub C, et al. Pericarditis and post-cardiac injury syndrome as a sequelae of acute myocardial infarction. Curr Cardiol Rep 2020;22:127. https://doi.org/10.1007/s11886-020-01371-5.
Abdelnabi M, Saleh Y, Fareed A, Nossikof A, Wang L, Morsi M, et al. Comparative study of oral anticoagulation in left ventricular thrombi (no-LVT trial). J Am Coll Cardiol 2021; 77:1590–1592. https://doi.org/10.1016/j.jacc.2021.01.049
Lopez-Sendon J, Coma-Canella I, Alcasena S, Seoane J, Gamallo C. Electrocardiographic findings in acute right ventricular infarction: sensitivity and specificity of electrocardiographic alterations in right precordial leads V4R, V3R, V1, V2, and V3. J Am Coll Cardiol 1985;6:1273–1279. https://doi.org/10.1016/s0735-1097(85) 80213
Kosuge M, Kimura K, Ishikawa T, Hongo Y, Shigemasa T, Sugiyama M, et al. Implications of the absence of ST-segment elevation in lead V4R in patients who have inferior wall acute myocardial infarction with right ventricular involvement. Clin Cardiol 2001;24: 225–230. https://doi.org/10.1002/clc.4960240310
Dou Q, Wang W, Wang H, Ma Y, Hai S, Lin X, Liu Y, Zhang X, Wu J, Dong B. Prognostic value of frailty in elderly patients with acute coronary syndrome: a systematic review and meta-analysis. BMC Geriatr. 2019 Aug 15;19(1):222. doi: 10.1186/s12877-019-1242-8.
Man C, Xiang S, Fan Y. Frailty for predicting all-cause mortality in elderly acute coronary syndrome patients: A meta-analysis. Ageing Res Rev. 2019 Jul;52:1-6. doi: 10.1016/j.arr.2019.03.003
Reiter M, Twerenbold R, Reichlin T, Haaf P, Peter F, Meissner J, et al. Early diagnosis of acute myocardial infarction in the elderly using more sensitive cardiac troponin assays. Eur Heart J 2011;32:1379–1389. https://doi.org/10.1093/eurheartj/ehr033
Bueno H, Betriu A, Heras M, Alonso JJ, Cequier A, Garcia EJ, et al. Primary angioplasty vs. fibrinolysis in very old patients with acute myocardial infarction: TRIANA (TRatamiento del Infarto Agudo de miocardio eN Ancianos) randomized trial and pooled analysis with previous studies. Eur Heart J 2011;32:51–60. https://doi.org/10. 1093/eurheartj/ehq375
Cholesterol Treatment Trialists’ Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials. Lancet 2019;393:407–415. https://doi.org/10.1016/s0140-6736(18) 31942-1
Bach RG, Cannon CP, Giugliano RP, White JA, Lokhnygina Y, Bohula EA, et al. Effect of simvastatin-ezetimibe compared with simvastatin monotherapy after acute coronary syndrome among patients 75 years or older: a secondary analysis of a randomized clinical trial. JAMA Cardiol 2019;4:846–854. https://doi.org/10.1001/jamacardio.2019.23
Savonitto S, Ferri LA, Piatti L, Grosseto D, Piovaccari G, Morici N, et al. Comparison of reduced-dose prasugrel and standard-dose clopidogrel in elderly patients with acute coronary syndromes undergoing early percutaneous revascularization. Circulation 2018;137:2435–2445. https://doi.org/10.1161/circulationaha.117.032180
Roe MT, Armstrong PW, Fox KA, White HD, Prabhakaran D, Goodman SG, et al. Prasugrel versus clopidogrel for acute coronary syndromes without revascularization. N Engl J Med 2012;367:1297–1309. https://doi.org/10.1056/NEJMoa1205512
Xu W, Cai Y, Liu H, Fan L, Wu C. Frailty as a predictor of all-cause mortality and readmission in older patients with acute coronary syndrome : A systematic review and meta-analysis. Wien Klin Wochenschr. 2020 Jun;132(11-12):301-309. doi: 10.1007/s00508-020-01650-9
Damluji AA, Forman DE, Wang TY, Chikwe J, Kunadian V, Rich MW, Young BA, Page RL 2nd, DeVon HA, Alexander KP; American Heart Association Cardiovascular Disease in Older Populations Committee of the Council on Clinical Cardiology and Council on Cardiovascular and Stroke Nursing; Council on Cardiovascular Radiology and Intervention; and Council on Lifestyle and Cardiometabolic Health. Management of Acute Coronary Syndrome in the Older Adult Population: A Scientific Statement From the American Heart Association. Circulation. 2023 Jan 17;147(3):e32-e62. doi: 10.1161/CIR.0000000000001112
Клинические рекомендации МЗ РФ «Старческая астения» https://cr.minzdrav.gov.ru/recomend/613_1
Клинические рекомендации МЗ РФ «Недостаточность питания (мальнутриция) у пациентов пожилого и старческого возраста» https://cr.minzdrav.gov.ru/recomend/615_2
Richter D, Guasti L, Walker D, Lambrinou E, Lionis C, Abreu A, et al. Frailty in cardiology: definition, assessment and clinical implications for general cardiology. A consensus document of the Council for Cardiology Practice (CCP), Association for Acute Cardio Vascular Care (ACVC), Association of Cardiovascular Nursing and Allied Professions (ACNAP), European Association of Preventive Cardiology (EAPC), European Heart Rhythm Association (EHRA), Council on Valvular Heart Diseases (VHD), Council on Hypertension (CHT), Council of Cardio-Oncology (CCO), Working Group (WG) Aorta and Peripheral Vascular Diseases, WG e-Cardiology, WG Thrombosis, of the European Society of Cardiology, European Primary Care Cardiology Society (EPCCS). Eur J Prev Cardiol 2022;29:216–227. https://doi.org/10. 1093/eurjpc/zwaa167
Ambrosetti M., Abreu A., Corrà U., et al. Secondary prevention through comprehensive cardiovascular rehabilitation: From knowledge to implementation. 2020 update. A position paper from the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology. Eur J Prev Cardiol. 2021;28(5):460-495. doi: 10.1177/2047487320913379.
Salzwedel A, Jensen K, Rauch B, et al.. Effectiveness of comprehensive cardiac rehabilitation in coronary artery disease patients treated according to contemporary evidence based medicine: update of the Cardiac Rehabilitation Outcome Study (CROS-II). Eur J Prev Cardiol 2020;27:1756–1774. doi: 10.1177/2047487320905719.
Santiago de Araújo Pio C, Marzolini S, Pakosh M, Grace SL. Effect of cardiac rehabilitation dose on mortality and morbidity: a systematic review and meta-regression analysis. Mayo Clin Proc 2017;92:1644–1659. https://doi.org/10.1016/j.mayocp.2017.07.019.
van Halewijn G, Deckers J, Tay HY, van Domburg R, Kotseva K, Wood D. Lessons from contemporary trials of cardiovascular prevention and rehabilitation: a systematic review and meta-analysis. Int J Cardiol 2017;232:294–303. https://doi.org/10.1016/j.ijcard.2016.12.125.
Аронов Д.М., Красницкий В.Б., Бубнова М.Г. и др. Влияние физических тренировок на физическую работоспособность, гемодинамику, липиды крови, клиническое течение и прогноз у больных ишемической болезнью сердца после острых коронарных событий при комплексной реабилитации и вторичной профилактике на амбулаторно-поликлиническом этапе (Российское кооперативное исследование) Кардиология. 2009; 3: 49-56. eLIBRARY ID: 16768461.
Приказ Министерства здравоохранения РФ от 31 июля 2020 г. N 778н "О Порядке организации медицинской реабилитации взрослых" Зарегистрировано в Минюсте РФ 25 сентября 2020 г. Регистрационный № 60039 https://www.garant.ru/products/ipo/prime/doc/74581688/.
Frederix I, Vanhees L, Dendale P, Goetschalckx K. A review of telerehabilitation for cardiac patients. J Telemed Telecare 2015;21:45–53. https://doi.org/10.1177/1357633x14562732.
Thomas R.J., Beatty A.L., Beckle T.M., et al. Home-based cardiac rehabilitation: a scientific statement from the American Association of Cardiovascular and Pulmonary Rehabilitation, the American Heart Association, and the American College of Cardiology. Circulation. 2019;140:e69-e89. doi: 10.1161/CIR.0000000000000663
Anderson L., Sharp G.A., Norton R.J., et al. Home-based versus centre-based cardiac rehabilitation. Cochrane Database Syst Rev. 2017;6:CD007130. doi: 10.1002/14651858.CD007130.pub4.
Федеральный закон от 29.07.2017 N 242-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья" https://www.garant.ru/products/ipo/prime/doc/716328 44/.
Moulson N, Bewick D, Selway T, et al. Cardiac Rehabilitation During the COVID-19 Era: Guidance on Implementing Virtual Care. Can J Cardiol. 2020;36(8):1317-1321. doi: 10.1016/j.cjca.2020.06.006. PMID: 32553606; PMCID: PMC7293761.
Abreu A, Frederix I, Dendale P, Janssen A, Doherty P, Piepoli MF, et al. Standardization and quality improvement of secondary prevention through cardiovascular rehabilitation programmes in Europe: the avenue towards EAPC accreditation programme: a position statement of the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology (EAPC). Eur J Prev Cardiol 2020;28: 496–509. https://doi.org/10.1177/2047487320924912.
Dibben G, Faulkner J, Oldridge N, Rees K, Thompson DR, Zwisler AD, et al. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database Syst Rev 2021;11:Cd001800. https://doi.org/10.1002/14651858.CD001800.pub4
Иванова Г.Е., Мельникова Е.В., Шмонин А.А., Вербицкая Е.В., Аронов Д.М., Белкин А.А., Беляев А.Ф., Бодрова Р.А., Бубнова М.Г., Буйлова Т.В., Мальцева М.Н., Мишина И.Е., Нестерин К.В., Никифоров В.В., Прокопенко С.В., Сарана А.М., Стаховская Л.В., Суворов А.Ю., Хасанова Д.Р., Цыкунов М.Б. и др. Применение международной классификации функционирования в процессе медицинской реабилитации. Вестник восстановительной медицины. 2018. № 6 (88). С. 2-77. eLIBRARY ID: 36486374.
Бубнова М.Г., Аронов Д.М. Кардиореабилитация: этапы, принципы и международная классификация функционирования. Профилактическая медицина. 2020: 23(5): 40–49. doi:10.17116/profmed20202305140.
Guazzi M., Adams V., Conraads V., et al. European Association for Cardiovascular Prevention & Rehabilitation; American Heart Association. EACPR/AHA Scientific Statement. Clinical recommendations for cardiopulmonary exercise testing data assessment in specific patient populations. Circulation. 2012;126(18):2261-74. doi: 10.1161/CIR.0b013e31826fb946.
Fletcher G.F., Ades P.A., Kligfield P., et al.; American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee of the Council on Clinical Cardiology, Council on Nutrition, Physical Activity and Metabolism, Council on Cardiovascular and Stroke Nursing, and Council on Epidemiology and Prevention. Exercise standards for testing and training: a scientific statement from the American Heart Association. Circulation. 2013;128(8):873-934. doi: 10.1161/CIR.0b013e31829b5b44
Long L, Anderson L, He J, et al. Exercise-based cardiac rehabilitation for stable angina: Systematic review and meta-analysis. Open Heart 2019; 6: e000989
Fidalgo ASF, Farinatti P, Borges JP, de Paula T, Monteiro W. Institutional Guidelines for Resistance Exercise Training in Cardiovascular Disease: A Systematic Review. Sports Med 2019; 49: 463-475.
Lawler, PR, Filion, KB, Eisenberg, MJ. Efficacy of exercise-based cardiac rehabilitation post-myocardial infarction: A systematic review and meta-analysis of randomized controlled trials. Am Heart J 2011; 162: 571–584
Аронов Д.М., Бубнова М.Г., Барбараш О.Л., Долецкий А.А., Красницкий В.Б., Лебедева Е.В., Лямина Н.П., Репин А.Н., Свет А.В., Чумакова Г.А., Аронов Д.М., Абдуллаев А.А., Арутюнов Т.П., Барбараш О.Л., Бойцов С.А., Болдуева С.А., Бузиашвили Ю.И., Галявич А.С., Гарганеева А.А., Герасименко М.Ю., Гуляева С.Ф., Довгалевский П.Я., Журавлева А.И., Задионченко В.С., Зайцев В.П., Закирова А.Н., Иванова Г.Е., Иоселиани Д.Г., Калинина А.М., Карпов Р.С., Козиолова Н.А., Куликов А.Г., Кухарчук В.В., Лядов К.В., Мазаев В.П., Мартынов А.И., Мисюра О.Ф., Парнес Е.Я., Перепеч Н.Б., Репин А.Н., Руда М.Я., Староверов И.И., Смулевич А.Б., Сыркин А.Л., Терещенко С.Н., Фомин И.В., Чазов Е.И., Чазова И.Е., Шлык С.В., Шляхто Е.В., Шульман В.А. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы: реабилитация и вторичная профилактика. Российский кардиологический журнал. 2015;(1):6-52. https://doi.org/10.15829/1560-4071-2015-1-6-52.
Бубнова М.Г., Аронов Д.М., Красницкий В.Б. и др. Программа домашних физических тренировок после острого коронарного синдрома и/или эндоваскулярного вмешательства на коронарных артериях: эффективность и проблема мотивации больных. Терапевтический Архив. 2014; 86(1): 23-32 https://ter-arkhiv.ru/0040-3660/article/view/31419
Hansen D, Bonné K, Alders T, Hermans A, Copermans K, Swinnen H, Maris V, Jansegers T, Mathijs W, Haenen L, Vaes J, Govaerts E, Reenaers V, Frederix I, Dendale P. Exercise training intensity determination in cardiovascular rehabilitation: Should the guidelines be reconsidered? Eur J Prev Cardiol. 2019;26(18):1921-1928. doi: 10.1177/2047487319859450. PMID: 31219704
Borg G. Psychophysical scaling with applications in physical work and the perception of exertion. Scand J Work Environ Health. 1990;16(Suppl 1):55–58
Hannan AL, Hing W, Simas V, Climstein M, Coombes JS, Jayasinghe R, Byrnes J, Furness J. High-intensity interval training versus moderate-intensity continuous training within cardiac rehabilitation: a systematic review and meta-analysis. Open Access J Sports Med. 2018;9:1-17. doi: 10.2147/OAJSM.S150596. PMID: 29416382; PMCID: PMC5790162.
Conraads VM, Pattyn N, De Maeyer C, Beckers PJ, Coeckelberghs E, Cornelissen VA, Denollet J, Frederix G, Goetschalckx K, Hoymans VY, Possemiers N, Schepers D, Shivalkar B, Voigt JU, Van Craenenbroeck EM, Vanhees L. Aerobic interval training and continuous training equally improve aerobic exercise capacity in patients with coronary artery disease: the SAINTEX-CAD study. Int J Cardiol. 2015;179:203-10. doi: 10.1016/j.ijcard.2014.10.155. PMID: 25464446.
Pattyn N, Vanhees L, Cornelissen VA, Coeckelberghs E, De Maeyer C, Goetschalckx K, Possemiers N, Wuyts K, Van Craenenbroeck EM, Beckers PJ. The long-term effects of a randomized trial comparing aerobic interval versus continuous training in coronary artery disease patients: 1-year data from the SAINTEX-CAD study. Eur J Prev Cardiol. 2016;23(11):1154-64. doi: 10.1177/2047487316631200. PMID: 26858279.
Sommaruga M., Angelino E., Della Porta P., et al. Best practice in psychological activities in cardiovascular prevention and rehabilitation: Position Paper. Monaldi Arch Chest Dis. 2018;88:966. doi: 10.4081/monaldi.2018.966.
Pogosova N, Saner H, Pedersen SS, Cupples ME, McGee H, Höfer S, Doyle F, Schmid JP, von Känel R; Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation of the European Society of Cardiology. Psychosocial aspects in cardiac rehabilitation: From theory to practice. A position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation of the European Society of Cardiology. Eur J Prev Cardiol. 2015;22(10):1290-306. doi: 10.1177/2047487314543075.
Бойцов С.А., Погосова Н.В., Бадтиева В.А., Балахонова Т.В., Барбараш О.Л., Васюк Ю.А., Гамбарян М.Г., Голицын С.П., Драпкина О.М., Дроздова Л.Ю., Еганян Р.А., Ежов М.В., Ершова А.И., Жиров И.В., Карпов Ю.А., Кобалава Ж.Д., Концевая А.В., Литвин А.Ю., Лукьянов М.М., Марцевич С.Ю., Мацкеплишвили С.Т., Метельская В.А., Мешков А.Н., Мишина И.Е., Панченко Е.П., Сергиенко И.В., Смирнова М.Д., Смирнова М.И., Соколова О.Ю, Стародубова А.В., Сухарева О.Ю., Терновой С.К., Ткачева О.Н., Шальнова С.А., Шестакова М.В. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. РКЖ 023;28(5):5452].
Aldcroft SA, Taylor NF, Blackstock FC, O’Halloran PD. Psychoeducational rehabilitation for health behavior change in coronary artery disease: a systematic review of controlled trials. J Cardiopulm Rehabil Prev 2011;31:273_281.
Rutledge T, Redwine LS, Linke SE, Mills PJ. A meta-analysis of mental health treatments and cardiac rehabilitation for improving clinical outcomes and depression among patients with coronary heart disease. Psychosom Med 2013;75:335-349.
Ambrosetti M., Abreu A., Cornelissen V., et al. Delphi consensus recommendations on how to provide cardiovascular rehabilitation in the COVID-19 era. Eur J Prev Cardiol. 2021;28(5):541-557. doi: 10.1093/eurjpc/zwaa080
Visseren F.L.J., Mach F., Smulders Y.M., et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42(34):3227-3337. doi: 10.1093/eurheartj/ehab484.
Hartmann-Boyce J, Chepkin SC, Ye W, Bullen C, Lancaster T. Nicotine replacement therapy versus control for smoking cessation. Cochrane Database Syst Rev 2018;5: CD000146. https://doi.org/10.1002/14651858.CD000146.pub5.
Howes S, Hartmann-Boyce J, Livingstone-Banks J, Hong B, Lindson N. Antidepressants for smoking cessation. Cochrane Database Syst Rev 2020;4:CD000031. https://doi.org/10.1002/14651858.CD000031.pub5.
Cahill K, Lindson-Hawley N, Thomas KH, Fanshawe TR, Lancaster T. Nicotine receptor partial agonists for smoking cessation. Cochrane Database Syst Rev 2016;2016: CD006103. https://doi.org/10.1002/14651858.CD006103.pub7]
Delgado-Lista J, Alcala-Diaz JF, Torres-Peña JD, Quintana-Navarro GM, Fuentes F, Garcia-Rios A, et al. Long-term secondary prevention of cardiovascular disease with a Mediterranean diet and a low-fat diet (CORDIOPREV): a randomised controlled trial. Lancet 2022;399:1876–1885. https://doi.org/10.1016/s0140-6736(22)00122-2
de Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation 1999;99:779–785.https://doi.org/10.1161/01.cir.99.6.779
Ekelund U, Tarp J, Steene-Johannessen J, Hansen BH, Jefferis B, Fagerland MW, et al.Dose-response associations between accelerometry measured physical activity andsedentary time and all cause mortality: systematic review and harmonisedmeta-analysis. BMJ 2019;366:l4570. https://doi.org/10.1136/bmj.l4570
Patterson R, McNamara E, Tainio M, de Sá TH, Smith AD, Sharp SJ, et al. Sedentarybehaviour and risk of all-cause, cardiovascular and cancer mortality, and incident type 2 diabetes: a systematic review and dose response meta-analysis. Eur J Epidemiol 2018;33:811–829. https://doi.org/10.1007/s10654-018-0380-1
Holmes MV, Dale CE, Zuccolo L, Silverwood RJ, Guo Y, Ye Z, et al. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individual participant data. BMJ 2014;349:g4164. https://doi.org/10.1136/bmj.g4164]
Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension. 1. Overview, meta-analyses, and metaregression analyses of randomized trials. J Hypertens 2014; 32: 2285-2295.
SPRINT Research Group, Wright JT, Jr, Williamson JD, Whelton PK, Snyder JK, Sink KM, Rocco MV, Reboussin DM, Rahman M, Oparil S, Lewis CE, Kimmel PL, Johnson KC, Goff DC, Jr, Fine LJ, Cutler JA, Cushman WC, Cheung AK, Ambrosius WT. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med 2015; 373: 2103-2116.
Ettehad D, Emdin CA, Kiran A, Anderson SG, Callender T, Emberson J, Chalmers J, Rodgers A, Rahimi K. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016; 387: 957-967.
Fox KM. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003;362:782–788. https://doi.org/10.1016/s0140-6736(03)14286-9.
Yusuf S, Sleight P, Pogue Bosch J, Davies R, et al. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000;342: 145–153. https://doi.org/10.1056/nejm200001203420301.
UK Prospective Diabetes Study (UKPDS) Group. Intensive Blood-Glucose Control With Sulphonylureas or Insulin Compared With Conventional Treatment and Risk of Complications in Patients With Type 2 Diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837–853.
Skyler J.S., Bergenstal R., Bonow R.O., Buse J., Deedwania P., Gale E.A.M., Howard B.V., Kirkman M. S., Kosiborod M., Reaven P., Sherwin R.S. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE, and VA Diabetes Trials. Diabetes Care 2009; 32: 187-192.
Fröbert O, Götberg M, Erlinge D et al. Influenza vaccination after myocardial infarction: a randomized, double-blind, placebo- controlled, multicenter trial. Circulation 2021;144:1476–1484.
Yedlapati SH, Khan SU, Talluri S, Lone AN, Khan MZ, Khan MS, et al. Effects of influenza vaccine on mortality and cardiovascular outcomes in patients with cardiovascular disease: a systematic review and meta-analysis. J Am Heart Assoc 2021;10:e019636. https://doi.org/10.1161/jaha.120.019636.
Fonseca HAR, Furtado RHM, Zimerman A, Lemos PA, Franken M, Monfardini F, Pedrosa RP, Patriota RLS, Passos LCS, Dall"Orto FTC, Hoffmann Filho CR, Nascimento BR, Baldissera FA, Pereira CAC, Caramori PRA, de Andrade PB, Esteves C, Salim EF, da Silva JH, Pedro IC, Silva MCR, de Pedri EH, Carioca ACRD, de Piano LPA, Albuquerque CSN, Moia DDF, Momesso RGRAP, Machado FP, Damiani LP, Soares RVP, Schettino GP, Rizzo LV, Nicolau JC, Berwanger O.Influenza vaccination strategy in acute coronary syndromes: the VIP-ACS trial. Eur Heart J. 2022 Nov 1;43(41):4378-4388. doi: 10.1093/eurheartj/ehac472
Tardif JC, Kouz S, Waters DD, Bertrand OF, Diaz R, Maggioni AP, et al. Efficacy аnd safety of low-dose colchicine after myocardial infarction. N Engl J Med 2019;381:2497–2505. https://doi.org/10.1056/NEJMoa1912388.
Nidorf SM, Fiolet ATL, Mosterd A, Eikelboom JW, Schut A, Opstal TSJ, et al. Colchicine in patients with chronic coronary disease. N Engl J Med 2020;383:1838–1847. https://doi.org/10.1056/NEJMoa2021372.
Thom S, Poulter N, Field J, Patel A, Prabhakaran D, Stanton A, Grobbee DE, Bots ML, Reddy KS, Cidambi R, Bompoint S, Billot L, Rodgers A, UMPIRE Collaborative Group. Effects of a fixed-dose combination strategy on adherence and risk factors in patients with or at high risk of CVD: the UMPIRE randomized clinical trial. JAMA. 2013;310:918–929.
Castellano JM, Sanz G, Penalvo JL, Bansilal S, Fernandez-Ortiz A, Alvarez L, Guzman L, Linares JC, Garcia F, D’Aniello F, Arnaiz JA, Varea S, Martinez F, Lorenzatti A, Imaz I, Sanchez-Gomez LM, Roncaglioni MC, Baviera M, Smith SC, Jr, Taubert K, Pocock S, Brotons C, Farkouh ME, Fuster V. A polypill strategy to improve adherence: results from the FOCUS project. J Am Coll Cardiol. 2014;64:2071–2082.
Astin F, Stephenson J, Probyn J, Holt J, Marshall K, Conway D. Cardiologists’ and patients’views about the informed consent process and their understanding of the anticipated treatment benefits of coronary angioplasty: a survey study. Eur J Cardiovasc Nurs 2020;19:260–268. https://doi.org/10.1177/1474515119879050.
Scott JT, Thompson DR. Assessing the information needs of post-myocardial infarction patients: a systematic review. Patient Educ Couns 2003;50:167–177. https://doi.org/10.1016/s0738-3991(02)00126-x.
Slater DK, Hlatky MA, Mark DB, Harrell FE Jr, Pryor DB et al. Outcome in suspected acute myocardial infarction with normal or minimally abnormal admission electrocardiographic findings. Am Journal Cardiol. 1987;60:766–770.
Lev EI, Battler A, Behar S, Porter A, Haim M et al. Frequency, characteristics, and outcome of patients hospitalized with acute coronary syndromes with undetermined electrocardiographic patterns. American Journal Cardiol. 2003;91:224–227.
Ganovska E, Arrigo M, Helanova K et al. Natriuretic peptides in addition to Zwolle score to enhance safe and early discharge after acute myocardial infarction: a prospective observational cohort study. Int J Cardiol. 2016;215:527–531.
Schellings DA, Adiyaman A, Giannitsis E. et al. Early discharge after primary percutaneous coronary intervention: the added value of N-terminal pro-brain natriuretic peptide to the Zwolle Risk Score. J Am Heart Assoc. 2014;3(6):e001089.
Ferreira TAM, Madeira S et al. Applicability of the Zwolle risk score for safe early discharge after primary percutaneous coronary intervention in ST segment elevation myocardial infarction. Rev Port Cardiol. 2015;34(9):535–541.
Grines CL, Marsalese DL, Brodie B, et al. Safety and costeffectiveness of early discharge after primary angioplasty in low risk patients with acute myocardial infarction. PAMI-II Investigators. Primary Angioplasty in Myocardial Infarction. J Am Coll Cardiol 1998; 31: 967–972.
Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями" (с изменениями и дополнениями от 21.02.2020 г.).
Приказ Министерства здравоохранения Российской Федерации от 15 марта 2022 г. №168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми".
Shirakabe A, Hata N, Kobayashi N, Shinada T, Tomita K, Tsurumi M, Matsushita M, Okazaki H, Yamamoto Y, Yokoyama S, Asai K, Mizuno K. Clinical significance of acid-base balance in an emergency setting in patients with acute heart failure. J Cardiol. 2012 Oct;60(4):288-94. https://doi.org/10.1016/j.jjcc.2012.06.004.
Maciejewski P, Bednarz B, Chamiec T, Górecki A, Łukaszewicz R, Ceremuzyński L. Acute coronary syndrome: potassium, magnesium and cardiac arrhythmia. Kardiol Pol. 2003 Nov;59(11):402-7.
Дроздов Д.В., Макаров Л.М., Баркан В.С., Газашвили Т.М., Ефимова В.П., Жук М.Ю., Иртюга О.Б., Калинин Л.А., Ковалёв И.А., Комолятова В.Н., Пармон Е.В., Рогоза А.Н., Стручков П.В., Татаринова А.А., Терегулов Ю.Э., Трешкур Т.В., Шутов Д.В. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023. Методические рекомендации. Российский кардиологический журнал. 2023;28(10):5631. https://doi.org/10.15829/1560-4071-2023-5631.
Mareev Yu.V., Dzhioeva O.N., Zorya O.T., Pisaryuk A.S., Verbilo S.L., Skaletsky K. et al. Focus ultrasound for cardiology practice. Russian consensus document. Kardiologiia. 2021;61(11):4–23. [Russian: Мареев Ю.В., Джиоева О.Н., Зоря О.Т., Писарюк А.С., Вербило С.Л., Скалецкий К. и др. Фокусное ультразвуковое исследование в практике врача–кардиолога. Российский согласительный документ. Кардиология. 2021;61(11):4–23]
Çitaku H, Miftari R, Stubljar D, Krasniqi X. Size of Acute Myocardial Infarction Correlates with Earlier Time of Initiation of Reperfusion Therapy with Cardiac Perfusion Scintigraphy: A National Single-Center Study. Med Sci Monit Basic Res. 2021 Sep 13;27:e933214.
James O, Borges-Neto S. Scintigraphic outlook of patients and regions with myocardial necrosis at myocardial perfusion scintigraphy. J Nucl Cardiol. 2018 Apr;25(2):506-507. doi: 10.1007/s12350-017-0796-0. Epub 2017 Feb 7. Erratum in: J Nucl Cardiol. 2018 Apr;25(2):508. https://doi.org/10.1007/s12350-017-0861-8.
O"Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA, et al.; American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Jan 29;127(4):e362-425. https://doi.org/10.1161/CIR.0b013e3182742cf6.
Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC); Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, van "t Hof A, Widimsky P, Zahger D. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012 Oct;33(20):2569-619. https://doi.org/10.1093/eurheartj/ehs215.
Подметин П.С., Бурак Т.Я., Кочанов И.Н., Каледин А.Л. Аугментация гиперемии введением дополнительного гиперемирующего агента при пограничных значениях фракционного резерва кровотока. Эндоваскулярная хирургия. 2019; 6 (1): 13–9. https://doi.org/10.24183/2409-4080-2019-6-1-13-19 601.
De Bruyne B., Pijls N.H., Barbato E., Bartunek J., Bech J.W., Wijns W., Heyndrickx G.R. Intracoronary and intravenous adenosine 5′-triphosphate, adenosine, papaverine, and contrast medium to assess fractional flow reserve in humans. Circulation. 2003; 107 (14): 1877–83. https://doi.org/10.1161/01.CIR.0000061950. 24940.88
Van der Voort P.H., van Hagen E., Hendrix G., van Gelder B., Bech J.W., Pijls N.H. Comparison of intravenous adenosine to intracoronary papaverine for calculation of pressure- 177 derived fractional flow reserve. Cathet. Cardiovasc. Diagn. 1996; 39 (2): 120–5. https://doi.org/10.1002/(SICI)1097-0304(199610)39:2 3.0.CO;2-H 19.
Nishi T., Kitahara H., Iwata Y., Fujimoto Y., Nakayama T., Takahara M. et al. Efficacy of combined administration of intracoronary papaverine plus intravenous adenosine 5′- triphosphate in assessment of fractional flow reserve. J. Cardiol. 2016; 68 (6): 512–6. https://doi.org/10.1016/j.jjcc.2015.12.005
One-Year Outcomes after PCI Strategiesin Cardiogenic ShockH. Thiele, I. Akin, M. Sandri, S. de Waha‑Thiele, R. Meyer‑Saraei, G. Fuernau,I. Eitel, P. Nordbeck, T. Geisler, U. Landmesser, C. Skurk, A. Fach, A. Jobs,H. Lapp, J.J. Piek, M. Noc, T. Goslar, S.B. Felix, L.S. Maier, J. Stepinska,K. Oldroyd, P. Serpytis, G. Montalescot, O. Barthelemy, K. Huber, S. Windecker,L. Hunziker, S. Savonitto, P. Torremante, C. Vrints, S. Schneider, U. Zeymer,and S. Desch, for the CULPRIT-SHOCK Investigators* E Engl J Med 2018; https://doi.org/10.1056/NEJMoa1808788
Farhan S, Vogel B, Montalescot G, Barthelemy O, Zeymer U, Desch S, de Waha-Thiele S, Maier LS, Sandri M, Akin I, Fuernau G, Ouarrak T, Hauguel-Moreau M, Schneider S, Thiele H, Huber K. Association of Culprit Lesion Location With Outcomes of Culprit-Lesion-Only vs Immediate Multivessel Percutaneous Coronary Intervention in Cardiogenic Shock: A Post Hoc Analysis of a Randomized Clinical Trial. JAMA Cardiol. 2020 Dec 1;5(12):1329-1337. https://doi.org/10.1001/jamacardio.2020.3377.
Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, Breithardt G, Halperin JL, Hankey GJ, Piccini JP, Becker RC, Nessel CC, Paolini JF, Berkowitz SD, Fox KA, Califf RM; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011 Sep 8;365(10):883-91. https://doi.org/10.1056/NEJMoa1009638.
Gibson CM, Pride YB, Aylward PE, Col JJ, Goodman SG, Gulba D, Bergovec M, Kunadian V, Zorkun C, Buros JL, Murphy SA, Antman EM. Association of non-steroidal anti-inflammatory drugs with outcomes in patients with ST-segment elevation myocardial infarction treated with fibrinolytic therapy: an ExTRACT-TIMI 25 analysis. J Thromb Thrombolysis. 2009 Jan;27(1):11-7. https://doi.org/10.1007/s11239-008-0264-4.
Hess PL, Laird A, Edwards R, Bardy GH, Bigger JT, Buxton AE, Moss AJ, Lee KL, Hall WJ, Steinman R, Dorian P, Hallstrom A, Cappato R, Kadish AH, Kudenchuk PJ, Mark DB, Al-Khatib SM, Piccini JP, Inoue LY, Sanders GD. Survival benefit of primary prevention implantable cardioverter-defibrillator therapy after myocardial infarction: does time to implant matter? A metaanalysis using patient-level data from 4 clinical trials. Heart Rhythm. 2013 Jun;10(6):828–835.
Alerhand S, Adrian RJ, Long B, Avila J. Pericardial tamponade: A comprehensive emergency medicine and echocardiography review. Am J Emerg Med. 2022 Aug;58:159-174. https://doi.org/10.1016/j.ajem.2022.05.001.
Montalescot G, Zeymer U, Silvain J, Boulanger B, Cohen M, Goldstein P, et al.; ATOLL Investigators. Intravenous enoxaparin or unfractionated heparin in primary percutaneous coronary intervention for ST-elevation myocardial infarction: the international randomised open-label ATOLL trial. Lancet. 2011 Aug 20;378(9792):693-703. https://doi.org/10.1016/S0140-6736(11)60876-3.
Montalescot G, White HD, Gallo R, Cohen M, Steg PG, Aylward PE, Bode C, Chiariello M, King SB 3rd, Harrington RA, Desmet WJ, Macaya C, Steinhubl SR; STEEPLE Investigators. Enoxaparin versus unfractionated heparin in elective percutaneous coronary intervention. N Engl J Med. 2006 Sep 7;355(10):1006-17. https://doi.org/10.1056/NEJMoa052711.
Martin J.L., Fry E.T.A., Sanderink G.-J.C.M., Atherley T.H., Guimart C.M., Chevalier P.J., Ozoux M.-L., Pensyl C.E., Bigonzi F. Reliable anticoagulation with enoxaparin in patients undergoing percutaneous coronary intervention: The pharmacokinetics of enoxaparin in PCI (PEPCI) study. Cardiovasc Interv 2004; 61: 163-170. https://doi.org/10.1002/ccd.10726.
Kuno T, Watanabe A, Shoji S, Fujisaki T, Ueyama H, Takagi H, Deharo P, Cuisset T, Bangalore S, Mehran R, Stone GW, Kohsaka S, Bhatt DL. Short-Term DAPT and DAPT De-Escalation Strategies for Patients With Acute Coronary Syndromes: A Systematic Review and Network Meta-Analysis. Circ Cardiovasc Interv. 2023 Sep;16(9):e013242. doi: 10.1161/CIRCINTERVENTIONS.123.013242.
Wang W, Huang Q, Pan D, Zheng W, Zheng S. The optimal duration of triple antithrombotic therapy in patients with atrial fibrillation and acute coronary syndrome or undergoing percutaneous coronary intervention: A network meta-analysis of randomized clinical trials. Int J Cardiol. 2022 Jun 15;357:33-38. doi: 10.1016/j.ijcard.2022.03.047.
Kuno T, Ueyama H, Takagi H, Bangalore S. The risk of stent thrombosis of dual antithrombotic therapy for patients who require oral anticoagulant undergoing percutaneous coronary intervention: insights of a meta-analysis of randomized trials. Scand Cardiovasc J. 2022 Feb;56(1):1-3. doi: 10.1080/14017431.2021.2025264.
Gupta R, Malik AH, Gupta R, Ranchal P, Yandrapalli S, Patel B, Frishman WH, Aronow WS, Garg J. Dual Versus Triple Therapy in Patients with Acute Coronary Syndrome and an Anticoagulation Indication: A Systematic Review with Meta-Analysis and Trial-Sequential Analysis. Cardiol Rev. 2021 Sep-Oct 01;29(5):245-252. doi: 10.1097/CRD.0000000000000320.
Agarwal N, Mahmoud AN, Mojadidi MK, Golwala H, Elgendy IY. Dual versus triple antithrombotic therapy in patients undergoing percutaneous coronary intervention-meta-analysis and meta-regression. Cardiovasc Revasc Med. 2019 Dec;20(12):1134-1139. doi: 10.1016/j.carrev.2019.02.022.
Zhang J, Wang Z, Sang W, Wei M, Xu F, Chen Y. Omission of aspirin in patients taking oral anticoagulation after percutaneous coronary intervention: a systematic review and meta-analysis. Coron Artery Dis. 2019 Mar;30(2):109-115. doi: 10.1097/MCA.0000000000000698.
Shah R, Khan SA, Khan B, Latham SB. Short-term versus long-term triple antithrombotic therapy for patients with coronary stents and requiring oral anticoagulation: a meta-analysis of randomized clinical trials. Coron Artery Dis. 2019 Mar;30(2):116-123. doi: 10.1097/MCA.0000000000000690.
Shin D, Mohanty BD, Lee ES. Dual versus triple antithrombotic therapy after percutaneous coronary intervention or acute coronary syndrome in patients with indication for anticoagulation: an updated meta-analysis. Coron Artery Dis. 2018 Dec;29(8):670-680. doi: 10.1097/MCA.0000000000000660.
Beygui F, Cayla G, Roule V, Roubille F, Delarche N, Silvain J, Van Belle E, Belle L, Galinier M, Motreff P, Cornillet L, Collet JP, Furber A, Goldstein P, Ecollan P, Legallois D, Lebon A, Rousseau H, Machecourt J, Zannad F, Vicaut E, Montalescot G; ALBATROSS Investigators. Early Aldosterone Blockade in Acute Myocardial Infarction: The ALBATROSS Randomized Clinical Trial. J Am Coll Cardiol. 2016 Apr 26;67(16):1917-27. doi: 10.1016/j.jacc.2016.02.033.
Xu Y., Qiu Z., Yang R., Wu Y., Cheng X. Efficacy of mineralocorticoid receptor antagonists in postmyocardial infarction patients with or without left ventricular dysfunction. A meta-analysis of randomized controlled trials. Medicine 2018; 97: 51(e13690). doi: 10.1097/MD.0000000000013690.
Carter NJ, Plosker GL. Rivaroxaban: a review of its use in the prevention of stroke and systemic embolism in patients with atrial fibrillation. Drugs. 2013 May;73(7):715-39. doi: 10.1007/s40265-013-0056-9.
Babes EE, Zaha DC, Tit DM, Nechifor AC, Bungau S, Andronie-Cioara FL, et al. Value of Hematological and Coagulation Parameters as Prognostic Factors in Acute Coronary Syndromes. Diagnostics (Basel). 2021 May 9;11(5):850. doi: 10.3390/diagnostics11050850.
Su H, Cao Y, Chen Q, Ye T, Cui C, Chen X, et al. The association between fibrinogen levels and severity of coronary artery disease and long-term prognosis following percutaneous coronary intervention in patients with type 2 diabetes mellitus. Front Endocrinol (Lausanne). 2023 Nov 29;14:1287855. doi: 10.3389/fendo.2023.1287855.
Shi Y, Wu Y, Bian C, Zhang W, Yang J, Xu G. Predictive value of plasma fibrinogen levels in patients admitted for acute coronary syndrome. Tex Heart Inst J. 2010;37(2):178-83.
Perelló R, Calvo M, Miró O, Castañeda M, Saubí N, Camón S, et al. Clinical presentation of acute coronary syndrome in HIV infected adults: a retrospective analysis of a prospectively collected cohort. Eur J Intern Med. 2011 Oct;22(5):485-8. doi: 10.1016/j.ejim.2011.02.017.
Seecheran VK, Giddings SL, Seecheran NA. Acute coronary syndromes in patients with HIV. Coron Artery Dis. 2017 Mar;28(2):166-172. doi: 10.1097/MCA.0000000000000450.
Žvirblytė R, Ereminienė E, Montvilaitė A, Jankauskas A, Ivanauskas V. Syphilitic coronary artery ostial stenosis resulting in acute myocardial infarction. Medicina (Kaunas). 2017;53(3):211-216. doi: 10.1016/j.medici.2017.06.001.
Fu Y, Chen M, Sun H, Guo Z, Gao Y, Yang X, et al. Blood group A: a risk factor for heart rupture after acute myocardial infarction. BMC Cardiovasc Disord. 2020 Nov 3;20(1):471. doi: 10.1186/s12872-020-01756-y.
Scudiero F, Valenti R, Marcucci R, Sanna GD, Gori AM, Migliorini A, et al. Platelet Reactivity in Hepatitis C Virus-Infected Patients on Dual Antiplatelet Therapy for Acute Coronary Syndrome. J Am Heart Assoc. 2020 Sep 15;9(18):e016441. doi: 10.1161/JAHA.120.016441.
Kuo PL, Lin KC, Tang PL, Cheng CC, Huang WC, Chiang CH, et al. Contribution of Hepatitis B to Long-Term Outcome Among Patients With Acute Myocardial Infarction: A Nationwide Study. Medicine (Baltimore). 2016 Feb;95(5):e2678. doi: 10.1097/MD.0000000000002678.