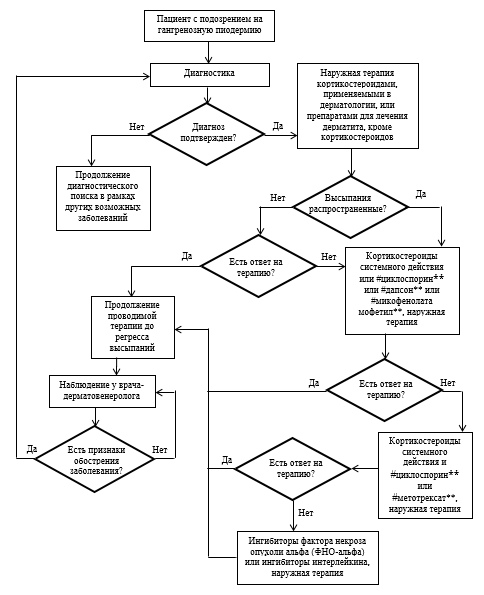
Основой терапии пациентов с гангренозной пиодермией является консервативное лечение, для которого используются лекарственные препараты для системной и наружной терапии. Консервативное лечение направлено на регресс поражения кожи, предупреждение развития или устранение осложнений (в первую очередь, вторичного инфицирования или интенсивных болей в области очагов поражения кожи), и при его назначении должно учитываться отсутствие или наличие ассоциированных с гангренозной пиодермией заболеваний, которые могут повлиять на выбор терапии. Кроме того, несмотря на возможность проявления феномена патергии, пациентам с гангренозной пиодермией может потребоваться хирургическое лечение.
Терапия гангренозной пиодермии часто занимает длительное время, может потребовать смены лекарственных препаратов, что делает уместным сразу формировать у пациентов реалистичные ожидания в отношении проводимой терапии. По данным, полученным в результате анализа течения болезни у 86 пациентов, до выздоровления пациентов с гангренозной пиодермией, получающих терапию, проходит в среднем 12 месяцев [65].
3.1 Консервативное лечение
Пациентам с гангренозной пиодермией назначается как системная, так и наружная терапия. Наружная терапия проводится всем пациентам с гангренозной пиодермией – как с единичными, ограниченными поражениями кожи, так и при распространенных высыпаниях. Для наружной терапии при гангренозной пиодермии могут использоваться кортикостероиды, применяемые в дерматологии, а также препараты для лечения дерматита, кроме кортикостероидов (#такролимус**, #пимекролимус**). Эти лекарственные препараты следует наносить на воспаленный край язвы, но не на ее дно [55]. Однако имеется сообщение о нанесении крема #пимекролимуса** на язву после устранения бактериальной инфекции и ее очищения от гнойного отделяемого [87]. Возможно проведение только наружной терапии пациентам с единичными, ограниченными поражениями кожи, например, при перистомальной гангренозной пиодермии, но при ее недостаточной эффективности или пациентам с распространенным поражением кожи необходима системная терапия.
Основными препаратами для системной терапии пациентов с гангренозной пиодермией являются кортикостероиды системного действия, которые могут назначаться перорально или внутривенно в виде пульс-терапии. Пульс-терапия кортикостероидами системного действия проводится кратковременным курсом, и если эффект ее недостаточен, то может быть продолжена пероральная терапия кортикостероидами системного действия, #циклоспорином**, #дапсоном** или #микофенолата мофетилом**. При неэффективности проводимой монотерапии возможно назначение комбинированной терапии с использованием кортикостероидов системного действия и #метотрексата** или #циклоспорина**. При ее неэффективности могут быть назначены иммунодепрессанты – ингибиторы фактора некроза опухоли альфа (ФНО-альфа) или ингибиторы интерлейкина.
Пациентам с гангренозной пиодермией может потребоваться терапия для устранения осложнений заболевания (вторичное инфицирование) и симптоматическая терапия в случае появления у пациента болей в очагах поражения кожи. В случае наличия вторичной инфекции с гнойным отделяемым для лечения пациентов с гангренозной пиодермией могут использоваться антибиотики и противомикробные препараты, применяемые в дерматологии, вместе с которыми могут применяться антисептики и дезинфицирующие средства или прочие антибактериальные препараты. При наличии обильного гнойного отделяемого или при распространенном поражении кожи, сопровождающемся гнойным отделяемым, требуется назначение антибактериальных препаратов системного действия. При появлении у пациента болей в области очагов поражения кожи назначаются нестероидные противовоспалительные и противоревматические препараты.
Важным компонентом терапии пациентов с гангренозной пиодермией является адекватный уход за язвенными поражениями кожи, так как их заживление может замедляться бактериальной суперинфекцией, отеком, недостаточностью кровообращения [88, 89]. В связи с этим необходимы регулярные перевязки с обеспечением адекватной компрессии [89].
- Рекомендуются для наружной терапии пациентов с гангренозной пиодермией кортикостероиды, применяемые в дерматологии, и препараты для лечения дерматита, кроме кортикостероидов:клобетазол 0,05% мазь, крем для наружного применения взрослым пациентам наносить тонким слоем и осторожно втирать, покрывая весь пораженный участок, 1-2 раза в сутки [94]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: В проспективном когортном исследовании, в которое включали взрослых пациентов, отмечено заживление 43,8% язв через 6 месяцев наружной терапии клобетазолом, а медиана времени до заживления язв составила 145 дней, однако у 15% пациентов развился рецидив [94].
- иликлобетазол 0,05% мазь, крем для наружного применения пациентам детского возраста наносить тонким слоем и осторожно втирать, покрывая весь пораженный участок, 1-2 раза в сутки [95]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: У ребенка в возрасте 1 года терапия клобетазолом привела к значительному улучшению уже на вторые сутки терапии [95]. Противопоказанием к назначению 0,05% крема и мази клобетазола является детский возраст до 1 года.
- или#такролимус** 0,1% мазь для наружного применения наносят тонким слоем на пораженные участки кожи 2 раза в сутки. После улучшения состояния или после заживления эрозивно-язвенных очагов поражения возможен переход на более редкие аппликации мази 1 раз в сутки в течение 2 месяцев и после этого 2 раза в неделю в течение 6-12 месяцев или на использование 0,03% мази #такролимуса** для наружного применения [96–99]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Показано, что лечение #такролимусом** пяти пациентов с гангренозной пиодермией с поражением не более 5% поверхности кожи и имеющих не более 3 очагов поражения привело к достижению полной ремиссии в среднем через 6 недель от начала лечения [96]. Описан случай парастомальной гангренозной пиодермии, когда у пациентки с язвой диаметром 3 см уменьшение размеров язвенного поражения кожи было отмечено через 2 месяца после начала терапии 0,1% мазью #такролимуса**, после чего были начаты аппликации 0,03% мази #такролимуса** [97].
- или#пимекролимус** 1% крем для наружного применения взрослым пациентам 2 раза в сутки наносить тонким слоем на пораженную поверхность и осторожно втирать до полного впитывания [87]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Описан случай, когда эффект терапии 1% кремом #пимекролимуса** стал заметен через 15 дней от начала лечения (уменьшение эритемы, размеров язвы, болевых ощущений), а полное заживление двух имевшихся у пациента язв произошло через 8 и 12 недель соответственно [87]. Противопоказанием к назначению мази #пимекролимуса** является детский возраст до 3 месяцев.
- Рекомендуются пациентам с гангренозной пиодермией при выраженном обострении заболевания, проявляющимся появлением новых множественных высыпаний, быстрым ростом и изъязвлением имеющихся поражений кожи кортикостероиды системного действия в виде пульс-терапии:#метилпреднизолон** 10–20 мг/кг массы тела внутривенно капельно 1 раз в сутки в течение 3-5 дней [100]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- илидексаметазон 2-5 мг/кг массы тела взрослым пациентам внутривенно капельно 1 раз в сутки в течение 3-5 дней [100]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- или#дексаметазон 2-5 мг/кг массы тела пациентам детского возраста внутривенно капельно 1 раз в сутки в течение 3-5 дней [100]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- или#метилпреднизолон** 1 г в 150 мл 5% раствора декстрозы** взрослым пациентам внутривенно в виде инфузий продолжительностью 60-90 минут в течение 1-5 дней [53, 101–103]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: Улучшение состояния пациентов в виде уменьшения яркости эритемы, образования гноя, уменьшения боли в области очагов поражения кожи, прекращения появления новых высыпаний может быть отмечено уже через 24-48 часов после начала пульс-терапии кортикостероидами системного действия [100]. После ее окончания необходимо продолжить терапию кортикостероидами системного действия перорально.
- Рекомендуются пациентам с гангренозной пиодермией с ограниченными высыпаниями при неэффективности наружной терапии и пациентам с диссеминированным многоочаговым поражением кожи для системной терапии кортикостероиды системного действия:#преднизолон** перорально 0,5-1,0 мг/кг массы тела в сутки [37, 52, 55, 96, 104–107]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: В группе из 53 пациентов с гангренозной пиодермией, получавших лечение #преднизолоном** в суточной дозе 0,75 мг/кг массы тела, которую при необходимости повышали до 1 мг/кг массы тела в сутки, полное заживление язв через 6 недель терапии было отмечено у 21% пациентов, а через 6 месяцев – у 47% пациентов [105].
- или#метилпреднизолон** перорально 0,5-1,0 мг/кг массы тела в сутки [53, 55, 108]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: После достижения эффекта в виде рубцевания язв терапию кортикостероидами системного действия необходимо продолжить, постепенно уменьшая суточную дозу используемого лекарственного препарата на протяжении нескольких месяцев. Во время лечения кортикостероидами системного действия возможно развитие нежелательных явлений, что требует контроля безопасности терапии (Приложение А3).
- или#циклоспорин** 3-5 мг/кг массы тела в сутки взрослым пациентам перорально 2 раза в сутки [105, 109–112]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В сравнительном исследовании показано, что эффективность #циклоспорина** в лечении пациентов с гангренозной пиодермией сопоставима с эффективностью #преднизолона** [105]. В группе из 59 пациентов с гангренозной пиодермией, получавших лечение #циклоспорином** в суточной дозе 4 мг/кг массы тела, полное заживление язв через 6 недель терапии было отмечено у 15% пациентов, а через 6 месяцев – у 47% пациентов [105]. #Циклоспорин** может иметь преимущество перед #преднизолоном** при выборе терапии для пациентов с гангренозной пиодермией и сопутствующим сахарным диабетом [112].
Во время лечения #циклоспорином** возможно развитие нежелательных явлений, что требует контроля безопасности терапии (Приложение А3).
- или#дапсон** 50-200 мг в сутки взрослым пациентам перорально [55, 113, 114]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Имеются лишь единичные описания случаев, демонстрирующие эффективность #дапсона** при гангренозной пиодермии [113, 114]. В этих случаях до полного заживления язв проходило от 4 недель до 2 месяцев терапии #дапсоном** [113, 114].
Во время лечения #дапсоном** возможно развитие нежелательных явлений, что требует контроля безопасности терапии (Приложение А3).
- или#микофенолата мофетил** взрослым пациентам перорально в начальной дозе 0,5-1 г в сутки, и максимальной дозе – от 0,5 г 4 раза в сутки до 1,5 г 2 раза в сутки [115]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Описаны результаты терапии 7 пациентов с гангренозной пиодермией #микофенолата мофетилом**, согласно которым терапевтический эффект препарата становится заметным через 4-12 недель от начала терапии [115]. Улучшение состояние отмечалось у 6 из 7 пациентов, а полное заживление язв – у 4 пациентов [115].
- Рекомендуется при недостаточной эффективности терапии кортикостероидами системного действия или #циклоспорином** или #дапсоном** комбинированная терапия кортикостероидами системного действия и иммунодепрессантами или кортикостероидами системного действия и #метотрексатом**:#преднизолон** 0,8-1 мг/кг массы тела перорально в сочетании с #циклоспорином** 3,5-5 мг/кг массы тела перорально 2 раза в сутки [96]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- или#преднизолон** 0,6 мг/кг в сутки перорально в сочетании с #циклоспорином** 3 мг/кг в сутки перорально и #миноциклином 100 мг в сутки мг перорально, взрослым пациентам [116]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- или#преднизолон** 40 мг в сутки перорально в сочетании с #метотрексатом** 15 мг 1 раз в неделю перорально, подкожно или внутримышечно взрослым пациентам [117]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- Рекомендуются в случае недостаточной эффективности терапии кортикостероидами системного действия, #циклоспорином**, #дапсоном**, #микофенолата мофетилом**, #метотрексатом** пациентам с гангренозной пиодермией ингибиторы фактора некроза опухоли альфа (ФНО-альфа) и ингибиторы интерлейкина:#инфликсимаб** лиофилизат для приготовления раствора для инфузий 5 мг/кг массы тела взрослым пациентам внутривенно по графику введений: недели 0, 2, 6 и далее – каждые 8 недель [118–122]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
Комментарии: #Инфликсимаб** вводят внутривенно в течение 2 ч. Если инфузионных реакций не происходит, его также можно вводить в течение 1 ч. Во время инфузии и в течение 1 ч после нее необходим мониторинг пациентов на наличие инфузионных реакций. При увеличении интервалов между инфузиями возрастает вероятность образования антител к #инфликсимабу** и снижения эффективности терапии.
В рандомизированном исследовании показано, что через 2 недели после первой инфузии #инфликсимаба** уменьшение тяжести состояния и/или размера язв наблюдалось у 46% пациентов с гангренозной пиодермией. К 6-й неделе терапии улучшение было отмечено у 20 из 29 (69%) пациентов, получавших лечение #инфликсимабом**, причем у 6 из 29 (21%) пациентов наступил полный регресс высыпаний [118]. Лечение #инфликсимабом** было неэффективным у 31% пациентов [118].
Терапия #инфликсимабом** может сопровождаться развитием нежелательных явлений, в связи с чем до и во время лечения инфликсимабом** следует контролировать безопасность проводимой терапии (Приложение А3).
#инфликсимаб** лиофилизат для приготовления раствора для инфузий 5 мг/кг массы тела пациентам детского возраста внутривенно по графику введений: недели 0, 2 и 10 [123, 150]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Противопоказанием к назначению #инфликсимаба** является детский возраст до 18 лет (за исключением болезни Крона и неспецифического язвенного колита, при которых #инфликсимаб** противопоказан до 6 лет). В связи с этим #инфликсимаб** может быть назначен пациентам детского возраста с гангренозной пиодермией, если у них также диагностированы болезнь Крона или неспецифический язвенный колит.
- или#адалимумаб** раствор для подкожного введения взрослым пациентам подкожно 80 мг или 160 мг в первый день, 80 мг – через 2 недели, далее – по 40 мг 1 раз в 1-2 недели [124–127]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Описаны случаи заживления язвы у пациентов с гангренозной пиодермией через 2 месяца после начала терапии #адалимумабом** [125, 126].
Терапия адалимумабом** ассоциируется с развитием нежелательных явлений, в связи с чем до и во время лечения #адалимумабом** следует контролировать безопасность проводимой терапии (Приложение А3).
- или#этанерцепт** подкожно взрослым пациентам 25-50 мг 2 раза в неделю или 50 мг 1 раз в неделю [128–132]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: В группе из 7 пациентов с гангренозной пиодермией, у которых имелось 11 язв, лечение #этанерцептом** в дозе 25-50 мг 2 раза в неделю привело к разрешению 8 из 11 язвенных поражений в среднем за 12,5 недель, а у остальные 3 язвы значительно уменьшились в размерах [128]. Описаны случаи заживления язв через 8 недель и через 4 месяца после начала терапии #этанерцептом** 25 мг 2 раза в неделю [129, 130]. Лечение #этанерцептом** противопоказано пациентам в возрасте младше 12 лет и с массой тела менее 62,5 кг.
Терапия #этанерцептом** ассоциируется с развитием нежелательных явлений, в связи с чем до и во время лечения #этанерцептом** следует контролировать безопасность проводимой терапии (Приложение А3).
- или#устекинумаб** раствор для подкожного введения взрослым пациентам 45 мг для пациентов с массой тела не более 100 кг или 90 мг для пациентов с массой тела более 100 кг подкожно по графику инъекций – недели 0, 4 и далее каждые 12 недель [14, 133]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Описан случай наступления полной ремиссии у пациента с гангренозной пиодермией через 14 недель после начала лечения #устекинумабом** [14]. У другого пациента почти полный регресс высыпаний наблюдался через 22 недели после первой инъекции #устекинумаба** [133].
Терапия #устекинумабом** ассоциируется с развитием нежелательных явлений, в связи с чем до и во время лечения #устекинумабом** следует контролировать безопасность проводимой терапии (Приложение А3).
- или#канакинумаб** раствор для подкожного введения подкожно взрослым пациентам на неделе 0 – в дозе 150 мг, далее на неделе 2 (если терапевтический ответ недостаточен) – в дозе 150 мг, далее на неделе 8 – в дозе 150 мг или 300 мг [12]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: В группе из 5 пациентов с гангренозной пиодермией, которым в течение 8 недель были проведены 2 или 3 инъекции #канакинумаба**, при оценке терапевтического эффекта на 16-ой неделе от начала лечения (через 8 недель после последней инъекции) у 3 пациентов наступила полная ремиссия, а еще у одного – улучшение состояния [12].
Терапия #канакинумабом** ассоциируется с развитием нежелательных явлений, в связи с чем до и во время лечения #канакинумабом** следует контролировать безопасность проводимой терапии (Приложение А3).
3.2 Хирургическое лечение
Пациентам с гангренозной пиодермией может потребоваться хирургическое лечение, целью которого может быть удаление некротической ткани или ускорение заживления имеющихся язвенных дефектов кожи с использованием методов трансплантации тканей. Хирургическое лечение при гангренозной пиодермии должно использоваться с осторожностью в связи с возможным проявлением характерного для этого заболевания феномена патергии – возникновением типичных высыпаний на месте травмы. Следовательно, хирургическая травма может служить пусковым фактором для появления очагов поражения гангренозной пиодермии [6, 90, 135, 136]. Любое хирургическое вмешательство должно быть выполнено на фоне иммуносупрессивной терапии и только у тех больных, у которых остановлено прогрессирование заболевания [136]. Иммуносупрессивную терапию следует продолжать до полного заживления язв и донорской зоны, если проводилась аутодермопластика [137].
- Рекомендуется хирургическая обработка раны или инфицированной ткани пациентам с наличием некротической ткани для удаления некротических тканей [6, 136]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Необходимо учитывать возможность появления у пациентов в гангренозной пиодермией новых высыпаний на месте травмы, в том числе хирургической.
- Рекомендуется некрэктомия пациентам с наличием некротической ткани для удаления некротической ткани [136, 138]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Описан случай, когда пациенту проводили хирургическую обработку раны с удалением некротических тканей под общим обезболиванием [138]
- Рекомендуется аутодермопластика пациентам с гангренозной пиодермией с язвенными дефектами кожи большой площади для восстановления кожного покрова [139, 140, 151]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Необходимым условием эффективности аутодермопластики у пациентов с гангренозной пиодермией является местная и/или системная иммуносупрессивная терапия [140].
3.3 Иное лечение
Для предупреждения вторичного инфицирования очагов поражения гангренозной пиодермии могут использоваться антисептики и дезинфицирующие средства или прочие антибактериальные препараты (гидроксиметилхиноксалиндиоксид), которые могут также назначаться вместе с антибиотиками и противомикробными препаратами, применяемыми в дерматологии, в случае развития вторичного инфицирования очагов поражения, проявляющегося увеличением количества гнойного отделяемого, усилением интенсивности эритемы и отека. В случае вторичного инфицирования очагов поражения гангренозной пиодермии с развитием бактериального поражения тканей (лимфангит, флегмона) или распространенного поражения кожи пациенту назначаются антибактериальные препараты системного действия с учетом чувствительности микроорганизмов к ним. Если высыпания сопровождаются болью, необходимо назначение нестероидных противовоспалительных и противоревматических препаратов.
- Рекомендуются для наружной терапии пациентам с гангренозной пиодермией для предупреждения развития вторичного инфицирования и в случае наличия выраженного гнойного отделяемого с целью устранения вторичной инфекции антисептики и дезинфицирующие средства или прочие антибактериальные препараты:водорода пероксид** 3% раствор для местного и наружного применения – поврежденные участки кожи обрабатывают ватным или марлевым тампоном, смоченным раствором препарата (тампоны следует держать пинцетом), возможно струйное орошение раневой поверхности [52]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Нет ограничений по применению водорода пероксида** у детей.
- иливодорода пероксид 3% спрей для наружного применения – поврежденные участки кожи орошают нажатием на распылитель в количестве, достаточном для их тщательного увлажнения [52]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Нет ограничений по применению водорода пероксида** у детей.
- илигидроксиметилхиноксалиндиоксид 5 мг/мл (0,5%), 10 мг/мл (1%) раствор для внутриполостного введения, местного и наружного применения взрослым пациентам – для лечения поверхностных инфицированных гнойных ран на рану накладывают салфетки, смоченные 0,5%-1% раствором препарата. Глубокие раны после обработки рыхло тампонируют тампонами, смоченными 1% раствором препарата, а при наличии дренажной трубки в полость вводят от 20 до 100 мл 0,5% раствора препарата. [141].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- илигидроксиметилхиноксалиндиоксид 5% мазь для наружного применения взрослым пациентам тонким слоем накладывают непосредственно на пораженный участок, предварительно очищенный от гнойно-некротических масс, или предварительно смазывают ею салфетки толщиною 2-3 мм. Процедуры проводят ежедневно или через день [141].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- Рекомендуются для наружной терапии пациентам с гангренозной пиодермией в случае выраженного гнойного отделяемого с целью устранения вторичной инфекции антибиотики и противомикробные препараты, применяемые в дерматологии:мупироцин 2% мазь для наружного применения – небольшое количество мази наносят на пораженную поверхность кожи 2-3 раза в сутки с помощью ватного или марлевого тампона инфицированные очаги поражения кожи 3 раза в сутки в течение 7 дней. Затем на область нанесения мази может быть наложен стерильный бандаж или марлевая повязка [55]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Мупироцин эффективен в отношении грамположительных бактерий, включая метициллин-резистентные стафилококки [55]. Частота нанесения и длительность лечения зависит от динамики клинической картины. Не следует применять препарат более 10 дней. Нет ограничений по применению у детей.
- илиДиоксометилтетрагидропиримидин+Хлорамфеникол 40 мг/г+7,5 мг/г мазь для наружного применения взрослым пациентам – препаратом пропитывают стерильные марлевые салфетки, которыми рыхло заполняют рану. Перевязки производят ежедневно, 1 раз в сутки [141]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Противопоказанием к назначению препарата является детский возраст до 1 года.
- илисульфадиазин серебра 1% крем для наружного применения взрослым и детям старше 2 лет поврежденную поверхность после очистки раны смазывают слоем крема толщиной 2 мм 2 раза в сутки; большие поврежденные поверхности кожи закрываются стерильной повязкой, сменяемой 2 раза в сутки, в серьезных случаях – до 4 раз [55, 142].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Перед каждой повторной аппликацией необходимо удалить предыдущие слой препарата струей воды или антисептическим раствором (антисептики и дезинфицирующие средства). Сульфадиазин серебра эффективен в отношении большинства бактерий, включая грамотрицательные бациллы [55]. Противопоказанием для назначения 1% крема сульфадиазина серебра является детский возраст до 2 лет.
- илисульфатиазол серебра 2% крем для наружного применения взрослым пациентам наносят на дефект кожи после очищения и хирургической обработки с соблюдением условий стерильности и толщиной 2-3 мм 2-3 раза в сутки [143]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Дефект кожи во время лечения должен быть весь покрыт кремом. Если часть дефекта кожи откроется, необходимо дополнительно нанести крем. Наложение окклюзионной повязки – возможно, но не является обязательным. Противопоказанием для назначения сульфатиазола серебра являются недоношенность и детский возраст до 2 месяцев (риск развития «ядерной» желтухи).
- Рекомендуются пациентам с гангренозной пиодермией, сопровождающейся бактериальным поражением тканей и развитием лимфангита или флегмоны, антибактериальные препараты системного действия:миноциклин 200-300 мг в сутки перорально взрослым пациентам в течение нескольких недель [55, 144, 145]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- илиминоциклин 200-300 мг в сутки перорально пациентам детского возраста в течение нескольких недель [55]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием для назначения миноциклина является детский возраст до 8 лет.
- илиАмоксициллин+[Клавулановая кислота]** взрослым пациентам перорально [141]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Режим дозирования устанавливается индивидуально в зависимости от возраста, массы тела и степени тяжести инфекции.
- илиКо-тримоксазол [Сульфаметоксазол+Триметоприм]** таблетки 400 мг + 80 мг 2 раза в сутки взрослым пациентам перорально [127]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- Рекомендуются пациентам с гангренозной пиодермией при болях в очагах поражения нестероидные противовоспалительные и противоревматические препараты (Приложение А3, таблица 1) [2, 3, 18]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Боли в области язвенных очагов поражения являются часто встречающимся признаком гангренозной пиодермии. В активный период появления и роста очагов поражения в размерах боли могут усиливаться и быть крайне интенсивными, что требует обезболивания. Уменьшение интенсивности боли может быть первым признаком заживления еще до появления признаков реэпителизации язвы [55]