3.1. Общие положения и тактика лечения ТГВ
Основными задачами при лечении ТГВ является предотвращение прогрессирования тромботического процесса и развития симптоматической, включая фатальную, ТЭЛА в остром периоде заболевания, а также снижение риска развития ПТБ и рецидива ВТЭО в отдаленном периоде. Базовыми методами лечения ТГВ являются антикоагулянтная терапия и эластичная компрессия. Дополнительно могут быть использованы хирургические методы дезобструкции венозного русла.
3.1.1. Показания к госпитализации
- Рекомендуется госпитализация пациентов с ТГВ, имеющих высокий риск развития осложнений и/или показания к хирургическому вмешательству для лечения ТГВ [85, 262].
УДД 4 УУР С
Комментарий: состояния, исключенные из РКИ по амбулаторному лечению ТГВ, и которые клиницист может рассматривать как дополнительные факторы риска амбулаторного лечения ТГВ: рецидив ТГВ, наличие или высокая вероятность развития ТЭЛА, беременность, наличие противопоказаний к введению антикоагулянтов (АТХ группа: антитромботические средства, В01А), сопутствующие заболевания, являющиеся показанием к госпитализации сами по себе, низкая доступность медицинской помощи (невозможность динамического наблюдения и экстренной госпитализации в случае возникновения осложнений), социальные факторы, затрудняющие амбулаторное лечение (например, одинокое проживание, отсутствие семейной поддержки, вероятная низкая комплаентность и пр.) [85]. Существуют специальные шкалы для оценки риска развития осложнений при амбулаторном лечении ТГВ (Приложение Г11) [262].
- Рекомендуется лечение в амбулаторных условиях для пациентов с низким риском осложнений и отсутствием необходимости в хирургическом лечении ТГВ [85, 263].
УДД 1 УУР А
Комментарий: ранние РКИ по сравнению амбулаторного лечения с помощью НМГ и стационарного лечения с помощью НФГ** (АТХ группа: Группа гепарина B01AB, гепарин натрия**) с последующим переходом на АВК (АТХ B01AA – Антагонисты витамина K) продемонстрировали снижение риска рецидива ВТЭО на 48% при отсутствии влияния на риск больших и малых кровотечений или общую летальность при амбулаторном использовании НМГ (АТХ группа: антитромботические средства, В01А) [263]. Подобный подход был признан эффективным и безопасным, а также способным дополнительно улучшить качество жизни больных. Полученные результаты РКИ были подтверждены данными реальной клинической практики: по сведениям регистра RIETE 90-дневная частота развития ТЭЛА при амбулаторном лечении ТГВ составляет 0,83%, а больших кровотечений – 0,88% [264]. Более поздние исследования показали возможность применения ПОАК (АТХ группа: антитромботические средства, В01А) в амбулаторных условиях для лечения ТГВ и ТЭЛА [265, 266].
3.1.2. Выбор стратегии: ранняя дезобструкция (раннее удаление тромбов) или консервативная терапия
Консервативное лечение, включающее адекватный режим антикоагулянтной терапии и эластичную компрессию, является базовым для пациентов с ТГВ. Стратегия ранней хирургической дезобструкции может быть использована у отдельных пациентов с целью быстрого купирования симптомов при протяженном ТГВ и снижения риска развития посттромботической болезни (ПТБ) в отдаленном периоде. Ранняя хирургическая дезобструкция не должна рассматриваться в качестве альтернативы стандартной антикоагулянтной терапии или в качестве метода профилактики ТЭЛА.
- Пациентам с подвздошно-бедренным ТГВ и давностью симптомов до 28 дней (в зависимости от метода пособия) рекомендуется выполнение ранней хирургической дезобструкции с целью снижения риска развития ПТБ в отдаленном периоде [85, 267–270].
УДД 1 УУР А
Комментарий: в рамках последнего мета-анализа, объединяющего результаты применения системного, локального и регионарного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) при ТГВ было показано, что стратегия ранней дезобструкция ассоциируется со снижением риска формирования ПТБ на 22% через 5 лет и на 44% при длительности наблюдения более 5 лет ценой увеличения риска развития геморрагических осложнений в 2,5 раза [267]. При анализе исследований, включавших катетер-управляемый (локальный) тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), механическую и фармако-механическую дезобструкцию отмечено снижение риска формирования любой формы ПТБ на 33-35% и тяжелой формы ПТБ на 34-41% ценой увеличения риска развития больших кровотечений в 2,4-5,7 раз [85, 268]. Среди возможных предикторов эффективности катетер-управляемого тромболизиса ((локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011)) максимальную предсказательную ценность демонстрирует давность симптомов ТГВ не более 14 дней, увеличивая шанс на благоприятный исход вмешательства в 2,8 раз [269]. С учетом наличия взаимосвязи между техническим успехом дезобструкции и тяжестью последующей ПТБ [271] целесообразно выполнять раннюю хирургическую дезобструкцию на базе клинических центров, имеющих достаточный опыт ее проведения, а также дополнять вмешательство венозным стентированием при обнаружении признаков резидуальной обструкции [272, 273].
- Пациентам с бедренно-подколенным ТГВ не рекомендуется выполнение хирургической дезобструкции в связи с отсутствием влияния на риск развития ПТБ [85, 267, 274, 275].
УДД 2 УРР В
Комментарий: в рамках мета-анализа, объединяющего результаты применения системного, локального и регионарного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) при ТГВ не выявлено различий по эффективности вмешательства между подколенно-бедренным и подвздошно-бедренным тромбозом [267]. Между тем, в рамках крупного исследования ATTRACT выполнение хирургической дезобструкции ассоциировалось со снижением риска развития среднетяжелых форм ПТБ только в подгруппе пациентов с подвздошно-бедренным ТГВ [274], но не среди больных с подколенно-бедренным ТГВ [275].
- Пациентам с ТГВ в случае выполнения ранней хирургической дезобструкции в сочетании с имплантацией венозного стента (установка стента в сосуд (A16.12.028)) или без него рекомендуется проводить антикоагулянтную терапию в стандартном режиме, определяемом характеристиками первичного эпизода тромбоза [85].
УДД 5 УРР С
Комментарий: на сегодняшний день отсутствуют исследования по сравнению режимов антикоагулянтной терапии (АТХ группа: антитромботические средства, В01А) после ранней дезобструкции венозного русла. При выполнении венозного стентирования описаны разнообразные схемы использования антитромботических средств (АТХ группа: В01А) без достоверного влияния на исходы [276]. По данным одного регистрового исследования длительность терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) не влияет на проходимость вен после хирургической дезобструкции со стентированием (установка стента в сосуд (A16.12.028)) [277].
3.2. Медикаментозная (антикоагулянтная) терапия
3.2.1. Цели медикаментозной (антикоагулянтной) терапии
Основными целями антикоагулянтной терапии (АТХ группа: антитромботические средства, В01А) ТГВ являются остановка процесса патологического тромбообразования, что ассоциируется со снижением риска прогрессирования и раннего рецидива венозного тромбоза, риска развития ТЭЛА, в том числе фатальной, а также создание благоприятных условий для реализации эндогенных возможностей по восстановлению проходимости сосуда (плазминовый лизис, фиброз, контракция и ретракция, неоангиогенез), что ассоциируется со снижением вероятности развития ПТБ. При этом важно сохранение возможности физиологического тромбообразования с целью остановки кровотечения. Следует иметь в виду, что современные антикоагулянты (АТХ группа: антитромботические средства, В01А) напрямую не влияют на процесс реканализации сосуда, поэтому оценка эффективности лечения не должна строиться на изменении характеристик тромба (проксимальная граница, протяженность, флотация, эхогенность и пр.), полученных при инструментальных методах исследования.
3.2.2. Фазы антикоагулянтной терапии
Фазы антикоагулянтной терапии выделяют, основываясь на риске прогрессирования и рецидива ТГВ в разные временные промежутки.
- У пациента с ТГВ с целью систематизации АКТ рекомендуется выделять три фазы: 1. начальная фаза/терапия (до 21 дня от начала лечения); 2. основная фаза/терапия (до 3-6 месяцев от начала лечения в зависимости от клинической ситуации); 3. продленная фаза/терапия или вторичная профилактика (после окончания основной фазы, т.е., спустя 6 мес от начала лечения) [92].
УДД 5 УРР С
Комментарий: фазы антикоагулянтной терапии следует отсчитывать от момента начала лечения (введение первой дозы препарата), но не от момента появления первых симптомов или верификации диагноза. Фазы антикоагулянтной терапии в большей степени коррелируют с риском прогрессирования тромбоза и в меньшей степени с морфологическими изменениями в тромбе, хронология которых у человека изучена недостаточно. Известно, что риск прогрессирования тромбоза максимален в течение первой недели заболевания (29 случаев на 100 пациенто-лет), сохраняется высоким в течение первого месяца заболевания (19 случаев на 100 пациенто-лет) и снижается на втором (5 случаев на 100 пациенто-лет) и третьем (2 случая на 100 пациенто-лет) месяце заболевания [278]. Также известно, что в течение первой недели заболевания тромб у человека содержит преимущественно эритроциты и тромбоциты, которые к 7-й неделе замещаются фибрином, нейтрофилами и макрофагами, а к 54-й неделе – коллагеном, макрофагами, фибробластами и гладкомышечными клетками [27]. Таким образом, первая неделя заболевания несет в себе не только максимальную угрозу прогрессирования тромботического процесса, но и предоставляет широкие возможности по восстановлению проходимости сосуда.
3.2.3. Тактика лечения и длительность антикоагулянтной терапии
3.2.3.1. Общие положения, по индивидуальной оценке, баланса между риском рецидива ВТЭО и риском кровотечения.
Длительность антикоагулянтной терапии следует определять на основании расчета индивидуального баланса пользы (снижение вероятности рецидива ВТЭО) и риска (повышение вероятности больших, в особенности фатальных, геморрагических осложнений) продолжения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А). Продленная терапия должна использоваться в тех случаях, когда индивидуальная польза достоверно превышает риск.
- При проведении антикоагулянтной терапии у пациента с ТГВ по завершении минимально необходимого 3-месячного курса лечения рекомендуется осуществлять регулярную, каждые 6-12 месяцев, оценку пользы и риска от продолжающегося лечения [84, 85, 279].
УДД 5 УРР С
3.2.3.2. Оценка риска рецидива ВТЭО после завершения антикоагулянтной терапии
Вероятность рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) определяется тем, что спровоцировало ТГВ, а также наличием у пациента дополнительных факторов риска. Относительный риск рецидива ВТЭО в зависимости от различных дополнительных факторов представлен в таблице 6. На сегодняшний день принято выделять тромбозы, спровоцированные большим транзиторным фактором риска, спровоцированные малым транзиторным фактором риска; спровоцированные малым персистирующим фактором риска, персистирующим фактором риска, неспровоцированные тромбозы [83]. Комбинации различных факторов риска рецидива ВТЭО входят в состав различных прогностических моделей: HERDOO-2 [180], Vienna, DASH [177] (Приложение Г9).
Таблица 6. Влияние различных факторов риска на вероятность рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) [280].
Фактор риска | Относительный риск рецидива ВТЭО |
|---|
Большой транзиторный фактор/неспровоцированный эпизод | 0,2 |
Малый транзиторный фактор/неспровоцированный эпизод | 0,5 |
Онко-ассоциированный тромбоз/неспровоцированный эпизод | 1,5-3,0 |
Малый персистирующий фактор/неспровоцированный эпизод | 1,5-2,0 |
Дистальный ТГВ/проксимальный ТГВ | 0,2-0,5 |
Проксимальный ТГВ/изолированная ТЭЛА без проксимального ТГВ | 1,4 |
Личный анамнез ВТЭО/отсутствие анамнеза | 1,5 |
Мужской пол/женский пол (неспровоцированное ВТЭО) | 1,75 |
Повышенный уровень Д-димера (неспровоцированное ВТЭО)/нормальный уровень Д-димера | 1,5-2,5 |
АФС/его отсутствие | 1,5-3,0 |
Наследственная тромбофилия | 1,2-2,0 |
Азиатская раса/белые и чернокожие | 0,8 |
Резидуальная венозная обструкция (РВО)/реканализация | 1,4 |
- Индивидуальную оценку риска рецидива ВТЭО у пациента с ТГВ после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) рекомендуется проводить на основании оценки клинической провокации первичного эпизода ТГВ [65, 84, 85, 89, 279, 280].
УДД 2 УРР А
Комментарий: по данным мета-анализа, тромбоз, спровоцированный большим транзиторным фактором риска, характеризуется минимальной вероятностью рецидива после завершения антикоагулянтной терапии (<1% в год); тромбоз, спровоцированный малым транзиторным фактором риска, характеризуется умеренной вероятностью рецидива после завершения антикоагулянтной терапии (4,2% в год); неспровоцированный тромбоз характеризуется высокой вероятностью рецидива после завершения антикоагулянтной терапии (7,4% в год) [89]. По данным другого мета-анализа, риск рецидива ВТЭО после завершения антикоагулянтной терапии при неспровоцированном ТГВ достигает 10,3% в год в течение первого года наблюдения, 6,3% в год в течение второго года наблюдения, 3,8% в год в течение 3-5 лет наблюдения и 3,1% в год в течение 6-10 лет наблюдения [65]. В рамках объединенного анализа исследований, изучавших эффективность и безопасность применения ПОАК (АТХ группа: антитромботические средства, В01А) в составе продленной терапии ВТЭО, было показано, что риск рецидива после завершения терапии первичного эпизода, спровоцированного малым персистирующим фактором, не отличается от такового при неспровоцированном тромбозе, и достигает 10,7% в год [87]. Риск рецидива ВТЭО при онкоассоциированном тромбозе может достигать 20% в год, вне зависимости от того продлена или завершена антикоагулянтная терапия [281].
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) у пациента с клинически неспровоцированным ТГВ рекомендуется учитывать уровень Д-димера [85, 282].
УДД 2 УРР В
Комментарий: ассоциация между уровнем Д-димера и вероятностью рецидива была изучена только для первичных эпизодов клинически неспровоцированного ВТЭО. По данным мета-анализа повышение Д-димера, зарегистрированное в момент завершения или в любой срок после завершения антикоагулянтной терапии клинически неспровоцированного ВТЭО, ассоциируется с увеличением риска рецидива в 2,6 (95% ДИ, 1,9-3,5) раз [282]. В то же время нормальные значения показателя не гарантируют низкий риск рецидива ВТЭО. По данным одного когортного исследования частота рецидива у пациентов с клинически неспровоцированным ВТЭО, которые завершили терапию антитромботическими средствами при условии негативного Д-димера, зарегистрированного в момент и через 1 месяц после прекращения лечения, достигала 6,7% в год [283]. Таким образом, уровень Д-димера имеет высокую положительную предсказательную способность (повышенный уровень ассоциируется с увеличенным риском рецидива), но низкую отрицательную предсказательную способность (нормальный уровень не всегда ассоциируется с низким риском рецидива). Определение концентрации Д-димера в крови целесообразно для индивидуальной оценки риска рецидива ВТЭО при решении вопроса о завершении терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А). Показатель может измеряться как до прекращения лечения, так и через 1-3-6-9-12 мес. после его завершения. Повышенный уровень Д-димера, в особенности при серийном измерении, является дополнительным аргументом в пользу продолжения или возобновления лечения. Определение концентрации Д-димера в крови (A09.05.051.001) нецелесообразно в том случае, когда польза продленной терапии объективно превышает риски на основании клинической оценки факторов риска. Показатель входит в состав всех известных шкал для индивидуальной оценки риска рецидива ВТЭО.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) у пациента с клинически неспровоцированным ТГВ рекомендуется учитывать наличие резидуальной венозной обструкции (РВО) [284].
УДД 3 УРР В
Комментарий: ассоциация между наличием РВО и вероятностью рецидива была изучена только для первичных эпизодов неспровоцированного ВТЭО. Было предложено считать неполностью реканализированными такие вены, толщина стенки которых при максимальной компрессии УЗ-датчиком превышает 2,0 мм при однократном измерении или 3,0 мм при двух последовательных измерениях [285], толщина стенки которых при максимальной компрессии УЗ-датчиком превышает 4,0 мм [286], резидуальные тромботические массы, которые занимают 40% и более от поперечного диаметра сосуда [287], резидуальные тромботические массы, которые занимают 20% и более от поперечного диаметра сосуда [288]. По данным мета-анализа наличие резидуальной венозной обструкции, выявленной через 3 месяца от начала терапии антикоагулянтами, повышает риск рецидива ВТЭО после завершения терапии в 2,2 (95% ДИ, 1,1-4,3) раза [284]. Названный эффект теряет свою достоверность, если РВО оценивается через 3-6 месяцев (ОР, 1,5; 95% ДИ, 1,0-2,2) и спустя более 6 месяцев (ОР, 1,2; 95% ДИ, 0,9-1,6). Следует отметить, что данные характеризуются высокой гетерогенностью вследствие отсутствия общепринятых критериев для диагностики РВО. В исследовании DACUS наличие РВО, определяемой, как тромботические массы, занимающие более 40% от поперечного диаметра сосуда, повышало риск рецидива ВТЭО в 25 раз [287].
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) у пациента с ТГВ рекомендуется учитывать наличие дополнительных индивидуальных факторов риска рецидива [84, 85, 280].
УДД 5 УУР С
Комментарий: к дополнительным факторам риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) следует относить: мужской пол, проксимальную локализацию ТГВ, наличие ТЭЛА в комбинации с ТГВ, антифосфолипидный синдром, активный рак, ожирение, хроническую сердечную недостаточность, хроническую болезнь почек, хроническую обструктивную болезнь легких [85, 280, 289, 290]. Часть из перечисленных факторов позволяют отнести первичный тромбоз в категорию, спровоцированного малым персистирующим фактором риска.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) у пациента с ТГВ не рекомендуется учитывать наличие наследственной тромбофилии [194, 289, 291–293].
УДД 2 УУР В
Комментарий: наследственная тромбофилия существенным образом увеличивает риск развития первичного эпизода ВТЭО, в особенности на фоне гормональной контрацепции и во время беременности [194, 294, 295]. По данным систематических обзоров и мета-анализов вероятность повторного тромбоза у носителей наследственной тромбофилии увеличена в 1,5-2,0 раза, что соответствует таковой у носителей не-0-группы крови и требует реализации сходных подходов [194, 293, 296]. Следует иметь в виду, что наиболее важным фактором, определяющим риск рецидива ВТЭО вне зависимости от наличия известной наследственной тромбофилии, служит то, является эпизод спровоцированным или нет.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами (АТХ В01А) у пациента с неспровоцированным ТГВ рекомендуется использовать шкалы HERDOO-2, Vienna, DASH (Приложение Г9) [85, 176].
УДД 3 УУР В
Комментарий: подробно предложенные шкалы представлены в разделе «2.8. Шкалы риска развития/рецидива ВТЭО и геморрагических осложнений», пункты 2.8.1.5-2.8.1.7. Все предложенные модели были разработаны для оценки риска рецидива после завершения антикоагулянтной терапии неспровоцированного эпизода ВТЭО. В то же время между исследованиями имеются разногласия по оценке тромбозов, спровоцированных оральными контрацептивами (G03A: гормональные контрацептивы системного действия) и беременностью. Так, при создании модели Vienna названные тромбозы не включали в исследование, при разработке модели HERDOO-2 эпизоды, ассоциированные с гормональными контрацептивами системного действия, считали неспровоцированными и включали, а шкала DASH содержит упоминание тромбозов, спровоцированных приемом оральными контрацептивов (G03A: гормональные контрацептивы системного действия), но исключает осложнения беременности. Все шкалы прошли внешнюю ретроспективную (Vienna) [297] и (DASH) [178] или проспективную (HERDOO-2) [180]) валидацию и продемонстрировали умеренную предсказательную ценность. Среди работ наибольшей методологической силой обладает исследование RIVERSE II, подтвердившее валидность применения шкалы HERDOO-2. Риск рецидива ВТЭО после завершения терапии в группе высокого риска (мужчины и женщины с наличием ≥2 баллов) составил 8,1% в год против 3,0% в год в группе низкого риска (женщины ≤1 балла) [180].
3.2.3.3. Оценка риска геморрагических осложнений при продолжении антикоагулянтной терапии
Геморрагические осложнения возникают вследствие угнетения физиологического тромбообразования и являются типичным осложнением терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А). Наибольшее значение имеют большие кровотечения, которые включают в себя фатальные случаи. Именно их следует принимать в расчет при оценке пользы и риска продленной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А). Небольшие, но клинически значимые кровотечения (НКЗК), как правило, не несут непосредственной угрозы жизни, но могут вызывать долгосрочные последствия (анемия), снижать качество жизни (повторные обращения за медицинской помощью) и влиять на приверженность лечению. При оценке риска продленной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) вклад НКЗК следует оценивать индивидуально на основании частоты их возникновения, влияния на качество жизни больного и наличия долгосрочных последствий. В большинстве случаев такие кровотечения связаны с контролируемыми факторами риска, которые необходимо выявлять и корригировать.
Индивидуальный риск кровотечения определяется наличием сопутствующих заболеваний и приемом других лекарственных средств, в особенности дезагрегантов (АТХ группа: антиагреганты кроме гепарина, В01АС) и нестероидных противовоспалительных препаратов (АТХ группа: нестероидные противовоспалительные и противоревматические препараты, М01А). Для его оценки было предложено несколько шкал, среди которых при ВТЭО чаще всего используются ACCP [279], VTE-BLED [188], RIETE [190], HAS-BLED [181]. (Приложение Г10).
- Рекомендуется учитывать индивидуальный риск развития больших кровотечений у пациентов с ТГВ, получающих продленную терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А) [85, 279].
УДД 5 УУР С
- При оценке индивидуального риска развития больших кровотечений у пациентов с ТГВ, получающих продленную терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А), рекомендуется использовать шкалы ACCP, VTE-BLED, RIETE, HAS-BLED [279, 298, 299].
УДД 1 УУР С
Комментарий: на сегодняшний день ни одна из названных шкал не прошла валидацию в рамках специально спланированных исследований. Все они использовались в работах, основной целью которых была оценка эффективности и безопасности применения отдельных антитромботических средств, в большинстве случаев, АВК (АТХ B01AA – Антагонисты витамина K). При этом наиболее изученной в разных клинических ситуациях считается шкала VTE-BLED [298]. Следует иметь в виду, что риск больших кровотечений был рассчитан преимущественно при использовании АВК (АТХ B01AA – Антагонисты витамина K). Согласно шкале АССР частота больших кровотечений при низком, умеренном и высоком риске составляет 1,6%, 3,2% и 12,8% в год в течение первых 3 мес. терапии и 0,8%, 1,6% и ≥6,5% в год спустя 3 мес. и более [279]. Между тем при анализе данных реальной клинической практики частота больших кровотечений в группе низкого и умеренного риска по АССР составила 1,3% в год, а в группе высокого риска – 1,7% в год. При этом в течение первых 3 мес. лечения не было отмечено существенных различий между ПОАК (АТХ группа: антитромботические средства, В01А) и АВК (АТХ B01AA – Антагонисты витамина K) (3,3% в год и 2,9% в год), но при продленной терапии ПОАК (АТХ группа: антитромботические средства, В01А) оказались безопаснее АВК (АТХ B01AA – Антагонисты витамина K) (0,5% в год против 1,4% в год) [191].
- У пациента с ТГВ, получающего продленную терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А), рекомендуется своевременно выявлять и корригировать факторы риска кровотечения [300, 301].
УДД 5 УУР С
3.2.3.4. Градация степени тяжести геморрагических осложнений
На сегодняшний день все геморрагические осложнения, возникающие на фоне лечебных или профилактических доз антикоагулянтов (АТХ группа: антитромботические средства, В01А), принято разделять на большие кровотечения, небольшие, но клинически значимые кровотечения и малые кровотечения. Также принято выделять отдельно кровотечения, связанные с хирургическим вмешательством.
Под большим кровотечением, не связанным с хирургическим вмешательством, понимают фатальное кровотечение; и/или симптоматическое кровотечение в критическую анатомическую область или орган (внутричерепное, интраспинальное, внутриглазное, ретроперитонеальное, внутрисуставное, перикардиальное, внутримышечное с развитием компартмент-синдрома); и/или кровотечение, ассоциированное с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред [302].
Под большим кровотечением, связанным с хирургическим вмешательством, понимают фатальное кровотечение; и/или симптоматическое кровотечение в критическую анатомическую область или орган (внутричерепное, интраспинальное, внутриглазное, ретроперитонеальное, внутрисуставное, перикардиальное, внутримышечное с развитием компартмент-синдрома); и/или кровотечение вне зоны хирургического вмешательства, ассоциированное с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред в течение 24-48 часов от момента манифестации; и/или кровотечение в зоне хирургического вмешательства, требующее повторной открытой, эндоскопической или эндоваскулярной интервенции, или гемартроз достаточного объема, чтобы повлиять на процесс мобилизации и реабилитации, или задерживающее заживление раны, что ассоциируется с удлинением времени пребывания в стационаре или развитием глубокой хирургической инфекции; и/или кровотечение в зоне хирургического вмешательства, которое возникает неожиданно и длится долго или приводит к развитию гемодинамической нестабильности (по оценке врача-хирурга), а также ассоциируется с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред в течение 24 часов от момента манифестации [303].
Под небольшим, но клинически значимым кровотечением (НКЗК) понимают кровотечение, не подпадающее под критерии большого, но требующее медицинского вмешательства, и/или госпитализации или увеличения уровня оказания медицинской помощи (например, перевод из профильного отделения в ОРИТ), и/или очной консультации врача [304].
Под малым кровотечением понимают любое другое кровотечение, не попадающее под критерии большого или НКЗК кровотечения.
- При клинической и инструментальной оценке кровотечения, возникшего на фоне антикоагулянтной терапии у пациента с ТГВ рекомендуется соотносить его с критериями большого кровотечения, небольшого, но клинически значимого кровотечения и малого кровотечения [302–304].
УДД 5 УУР С
3.3.3.5. Баланс пользы и риска при начальной и длительной антикоагулянтной терапии
Начальная и длительная терапия на протяжении 3 месяцев является базовой для всех пациентов с ТГВ вне зависимости от, того спровоцирован тромбоз или нет, наличия факторов риска рецидива ВТЭО и опасности развития больших кровотечения. При наличии противопоказаний к антикоагулянтам (АТХ группа: антитромботические средства, В01А) или прогрессировании тромботического процесса вопреки адекватной терапии обсуждается вопрос хирургической профилактики ТЭЛА. Тактика лечения дистального ТГВ может отличаться и обсуждается отдельно.
- Всем пациентам с ТГВ, которым показана терапия антикоагулянтами (АТХ группа: антитромботические средства, В01А), рекомендуется проводить лечение на протяжении 3 месяцев [84, 85, 279, 305].
УДД 3 УУР В
Комментарий: в рамках мета-анализа было показано, что более короткие курсы антикоагулянтной терапии ассоциируются с увеличением риска рецидива ВТЭО после окончания лечения в 1,5 (95% ДИ, 1,1-2,0) раза [305]. Преждевременное завершение терапии проксимального ТГВ даже при наличии объективных причин ассоциируется с 8-кратным увеличением риска неблагоприятного исхода (фатальная ТЭЛА, внезапная смерть, рецидив ВТЭО) в течение последующих 30 дней наблюдения [306].
3.2.3.6. Баланс пользы и риска при продленной терапии
Продление терапии свыше 3 мес. (вторичная профилактика ВТЭО) показана в тех случаях, когда польза от снижения вероятности рецидива ВТЭО превышает опасность, связанную с большими кровотечениями. При этом в расчет берутся преимущественно фатальные осложнения. Так, продленная терапия АВК (АТХ B01AA – Антагонисты витамина K) ассоциируется с 5-кратным снижением риска рецидива ВТЭО ценой 3-кратного увеличения опасности больших кровотечений [307]. В тоже время летальность при кровотечениях на АВК (АТХ B01AA – Антагонисты витамина K) колеблется в пределах 9-11% и достигает 45% при внутричерепных кровоизлияниях [308, 309]. Было рассчитано, что на фоне продленной до 1 года терапии АВК (АТХ B01AA – Антагонисты витамина K) от фатальных кровотечений погибает 23 из 1000 пациентов, при том, что отказ от продленной терапии приводит к гибели от рецидива ВТЭО только 11 из 1000 пациентов [310]. ПОАК (АТХ группа: антитромботические средства, В01А) обладают лучшим профилем безопасности и при продленной терапии не увеличивают угрозу больших кровотечений в сравнении с плацебо, что позволяет отдавать им предпочтение в большинстве случаев [311, 312]. Также для отдельных ПОАК (АТХ группа: антитромботические средства, В01А) (апиксабан**, ривароксабан**) была показана эффективность применения редуцированной (профилактической) дозировки при рамках продленной терапии (Таблица 12) [313, 314]. Расчетные цифры для определения баланса пользы и риска продленной антикоагулянтной терапии приведены в Таблице 7.
Таблица 7. Расчетные величины по снижению риска рецидива ВТЭО и развитию большого кровотечения (с ассоциированными летальными исходами) в течение 5 лет продленной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) [280].
Характер ВТЭО | Исход | Риск кровотечения |
|---|
Низкий | Умеренный | Высокий |
Спровоцированное большим транзиторным фактором | ВТЭО | ↓2,6 (0,1) | +0,2* | ↓2,6 (0,1) | +0,4* | ↓2,6 (0,1) | +2,1* |
БК | ↑2,4 (0,3) | ↑4,9 (0,5) | ↑19,6 (2,2) |
Спровоцированное малым транзиторным фактором | ВТЭО | ↓13,2 (0,5) | -0,2* | ↓13,2 (0,5) | +0,0* | ↓13,2 (0,5) | +1,7* |
БК | ↑2,4 (0,3) | ↑4,9 (0,5) | ↑19,6 (2,2) |
Неспровоцированное | ВТЭО | ↓26,4 (1,0) | -0,7* | ↓26,4 (1,0) | -0,5* | ↓26,4 (1,0) | +1,2* |
БК | ↑2,4 (0,3) | ↑4,9 (0,5) | ↑19,6 (2,2) |
Рецидив без клинической провокации | ВТЭО | ↓39,6 (1,4) | -1,1* | ↓39,6 (1,4) | -0,9* | ↓39,6 (1,4) | +0,6* |
БК | ↑2,4 (0,3) | ↑4,9 (0,5) | ↑19,6 (2,2) |
Примечания. БК – большое кровотечение; величины представляют число предотвращенных (↓) или спровоцированных (↑) случаев на 100 пациентов за 5 лет терапии; в скобках указано число фатальных эпизодов; *звездочкой обозначено число спровоцированных (знак «+») или предотвращенных (знак «-») летальных исходов в течение 5 лет антикоагулянтной терапии (чистая клиническая выгода)
Помимо антикоагулянтов (АТХ группа: антитромботические средства, В01А) при продленной терапии ВТЭО изучена возможность применения прочих антитромботических средств, в частности #ацетилсалициловой кислоты** (АСК) (АТХ группа: антиагреганты, кроме гепарина, B01AC06) в дозе 100 мг. [279, 315, 316] и сулодексида (АТХ группа: группа гепарина, B01AB11) (Таблица 14). Расчетные данные о снижении риска рецидива ВТЭО и повышения угрозы большого кровотечения могут быть использованы для выбора препарата на основании индивидуальной оценки пользы и риска.
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ рекомендуется проводить ее на бессрочной основе с регулярной оценкой пользы и риска [84, 85, 279, 305, 315, 317, 318].
УДД 3 УУР В
Комментарий: ранее существовали рекомендации о целесообразности проведения продленной, но ограниченной по времени терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) (6, 12, 24 мес.). Проведенный мета-анализ продемонстрировал, что риск рецидива ВТЭО после завершения лечения не зависит от длительности, предшествующей антикоагуляции, если она превышает стандартные 3 мес. [305]. В период приема препарата вероятность рецидива минимальна, но после завершения лечения она увеличивается и достигает определенного уровня, определяемого характеристиками первичного эпизода и наличием дополнительных факторов риска. Т.о., при высоком риске рецидива ВТЭО терапию следует продолжать неопределенно долго до тех пор, пока польза превышает риск.
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ рекомендуется отдавать предпочтение ПОАК (АТХ группа: антитромботические средства, В01А) вместо АВК (АТХ B01AA – Антагонисты витамина K) [84, 85, 311].
УДД 1 УУР В
Комментарий: в отличие от терапии АВК (АТХ B01AA – Антагонисты витамина K) продленная терапия ПОАК (АТХ группа: антитромботические средства, В01А) не только не повышает риск больших кровотечений, но снижает общую смертность на 61% [311, 319]. АВК (АТХ B01AA – Антагонисты витамина K) остаются препаратами выбора при наличии противопоказаний к ПОАК (АТХ группа: антитромботические средства, В01А) или их недоступности. В частности, ПОАК (АТХ: антитромботические средства, В01А) противопоказаны при клапанной фибрилляции предсердий, наличии механического сердечного клапана, тяжелых нарушениях функции почек (КлКр <15 мл/мин), во время лактации, при наличии подтвержденного тройно-позитивного АФС и/или АФС с анамнезом артериальных и микроциркуляторных тромбозов [84, 85, 301]. В названных случаях рекомендуется применение АВК (АТХ B01AA – Антагонисты витамина K).
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ без высокого риска рецидива ВТЭО рекомендуется отдавать предпочтение редуцированным дозам ПОАК (АТХ группа: антитромботические средства, В01А) (апиксабан** 2,5 мг 2 раза в сутки, ривароксабан** 10 мг 1 раз в сутки) [84, 85, 320].
УДД 1 УУР В
Комментарий: в рамках проведенных исследований эффективность и безопасность редуцированных и полных лечебных доз ПОАК (АТХ группа: антитромботические средства, В01А) достоверно не отличались, но абсолютное число кровотечений было ниже при использовании профилактической дозы, что определяет целесообразность ее применения в большинстве случаев [313, 314]. Следует иметь в виду, что пациенты с высоким риском рецидива ВТЭО не включались в названные исследования, поэтому данная рекомендация не может быть распространена на них. К высокому риску рецидива ВТЭО следует относить наличие активного злокачественного новообразования, повторный тромбоз, возникший на фоне применения редуцированной дозы антикоагулянта (АТХ группа: антитромботические средства, В01А), а также другие факторы на усмотрение клинициста. Следует обратить внимание на официальную инструкцию к препарату, где указаны сроки, возможность и необходимость снижения дозы в рамках продленной терапии.
- При решении в пользу вторичной профилактики ВТЭО у пациента с ТГВ и высоким риском кровотечения или при отказе от использования оральных антикоагулянтов (АТХ группа: антитромботические средства, В01А) рекомендуется применение #сулодексида (АТХ группа: группа гепарина, B01AB11) в дозе 500 ЛЕ 2 раза в сутки [84, 85, 321].
УДД 2 УУР А
Комментарий: вторичная профилактика ВТЭО #сулодексидом характеризуется максимальной безопасностью. В рамках мета-анализа не было зарегистрировано ни одного большого кровотечения, при этом риск рецидива ВТЭО был снижен на 49% [321]. Следует иметь в виду, что эффективность и безопасность #сулодексида в рамках вторичной профилактики ВТЭО не изучена у больных с высоким риском рецидива ВТЭО, которых не включали в соответствующие исследования.
- Для вторичной профилактики ВТЭО у пациента с ТГВ рутинное применение ацетилсалициловой кислоты** (АТХ группа: антиагреганты, кроме гепарина, B01AC06) не рекомендуется [85, 320].
УДД 1 УУР В
Комментарий: объединенный анализ данных исследований WARFASA и ASPIRE (INSPIRE) показал, что использование ацетилсалициловой кислоты** (АТХ группа: антиагреганты, кроме гепарина, B01AC06) для вторичной профилактики позволяет снизить риск рецидива ВТЭО на 32% ценой недостоверной тенденции к увеличению опасности кровотечения (ОР, 1,50; 95% ДИ, 0,72-3,14) [318]. Между тем в исследовании EINSTEIN Choice было продемонстрировано, что полная лечебная и редуцированная дозировки ривароксабана** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) по сравнению с ацетилсалициловой кислотой** (АТХ группа: антиагреганты, кроме гепарина, B01AC06) обладают сходной безопасностью при значительном преимуществе по эффективности [314]. Т. о., при наличии более эффективных средств следует признать нецелесообразным использование ацетилсалициловой кислоты** (АТХ группа: антиагреганты, кроме гепарина, B01AC06) для вторичной профилактики ВТЭО. Исключением могут являться случаи недоступности прочих препаратов или категорического отказа пациента от их использования при наличии объективных показаний к продленной терапии.
3.3.3.7. Тактика лечения и длительность антикоагулянтной терапии в зависимости от индивидуального баланса пользы и риска
Длительность терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) в зависимости от риска рецидива ВТЭО после ее завершения обобщена в таблице 8. Большинство рекомендаций относятся к проксимальной локализации ТГВ. Традиционно в России не принято разделять тактику лечения проксимальных и дистальных тромбозов. Между тем, существует доказательная база об эффективности и безопасности динамического наблюдения и выполнения повторного УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) через 5-7 дней при дистальной локализации тромбоза. При этом антикоагулянтную терапию назначают в случае выявления признаков прогрессирования тромботического процесса при контрольном осмотре [93]. Названный подход может быть использован у отдельных пациентов с низким риском ВТЭО. Между тем, проведение антикоагулянтной терапии при дистальном ТГВ ассоциируется со снижением риска ВТЭО на 50%, снижением риска ТЭЛА на 52% без увеличения опасности кровотечений [322].
Таблица 8. Длительность антикоагулянтной терапии в зависимости от фактора риска первичного эпизода ТГВ
Риск рецидива ВТЭО | Факторы риска | Длительность терапии |
|---|
Низкий (<3% в год) | Большой транзиторный фактор | Хирургическое вмешательство под наркозом >30 мин Госпитализация по поводу острого терапевтического заболевания с постельным режимом ≥3 дней Травма с переломом | Завершить через 3 мес. |
Малый транзиторный фактор | Терапия эстрогенами, прием комбинированными оральными контрацептивами (КОК) (АТХ группа: гормональные контрацептивы системного действия, G03AA: гестагены и эстрогены фиксированные комбинации, G03AB: гестагены и эстрогены, секвенциальные препараты (для последовательного приема)) Беременность, роды и послеродовый период |
Умеренный (3-8% в год) | Малый транзиторный фактор | Хирургическое вмешательство под наркозом <30 минут Госпитализация по поводу острого терапевтического заболевания с постельным режимом <3 дней, Острое терапевтическое заболевание с постельным режимом ≥3 дней вне стационара Травма конечности с ограничением подвижности в течение ≥3 дней, Длительный авиаперелет | Рассмотреть продленную терапию при невысоком риске кровотечения |
Малый персистирующий фактор | Воспалительное заболевание толстой кишки Активное аутоиммунное заболевание |
Неспровоцированный |
|
Высокий риск (>8% в год) |
| Активный рак Рецидив ТГВ в отсутствие большого транзиторного фактора риска АФС | Продлить терапию |
- Рекомендуется завершить антикоагулянтную терапию у пациента с ТГВ, спровоцированным большим транзиторным фактором риска через 3 месяца [84, 85, 89, 279, 305].
УДД 3 УУР В
Комментарий: при высокой настороженности в отношении исхода ТГВ при условии низкого риска кровотечения антикоагулянтная терапия может быть продлена до 6 месяцев. Следует иметь в виду, что такой подход не влияет на риск рецидива ВТЭО после завершения лечения. Также нет оснований полагать, что продлённая антикоагуляция способна повлиять на реканализацию сосуда и риск развития ПТБ [323].
- Рекомендуется рассмотреть возможность завершения антикоагулянтной терапии у пациента с ТГВ, спровоцированным беременностью, родами, послеродовым периодом, приемом комбинированных оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA: гестагены и эстрогены фиксированные комбинации, G03AB: гестагены и эстрогены, секвенциальные препараты (для последовательного приема)) и других средств, содержащих половые стероиды (АТХ группа: андрогены, G03B; эстрогены G03C; гестагены G03D) через 3 месяца [85, 279, 324, 325].
УДД 4 УУР С
Комментарий: риск рецидива ВТЭО, спровоцированного беременностью, на 40% ниже такового при неспровоцированном тромбозе, и преимущественно связан с повторной беременностью [325]. Риск рецидива ВТЭО, спровоцированного гормонозависимыми состояниями, в частности приемом гормональных контрацептивов системного действия, в ранних исследованиях был расценен, как эквивалентный таковому при неспровоцированном эпизоде [326]. Более поздние работы показали, что искомый риск ниже такового при клинически неспровоцированном тромбозе на 60% и составляет 1,1% в год (0,4% в год при балле HERDOO-2 <2 и 3,5% при балле HERDOO-2 ≥2), что позволяет отнести названные тромбозы к группе низкого риска рецидива [324]. Возобновление приема гормональных контрацептивов системного действия после перенесенного ВТЭО, спровоцированного названным фактором, увеличивает риск рецидива тромбоза в 8,2 (95% ДИ, 2,1-32,2) раза [327]. При наличии показаний к продолжению или возобновлению лечения гормональными контрацептивами системного действия целесообразно продлить антикоагулянтную терапию свыше 3 месяцев на весь период приема гормональных средств (АТХ группа: андрогены, G03B; эстрогены G03C; гестагены G03D). Показано, что сочетание АВК и ривароксабана** с половыми стероидами (АТХ группа: G03: Половые гормоны и модуляторы функции половых органов) не увеличивает риск рецидива ВТЭО в период антикоагулянтной терапии [328].
- Антикоагулянтную терапию у пациента с ТГВ, спровоцированным малым транзиторным фактором риска за исключением беременности, родов, приема комбинированных оральных контрацептивов (G03A: Гормональные контрацептивы системного действия) рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84, 85, 87, 329].
УДД 2 УУР А
Комментарий: по отдельным сведениям, риск рецидива ВТЭО, спровоцированного малым транзиторным фактором риска, не отличается от такового при неспровоцированном ТГВ и достигает 7,1% в год. При этом продленная терапия с помощью ПОАК (АТХ группа: антитромботические средства, В01А) позволяет существенным образом уменьшить этот риск [87, 329].
- Антикоагулянтную терапию у пациента с ТГВ, спровоцированным малым персистирующим фактором риска, рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84, 85, 87].
УДД 2 УУР А
Комментарий: по отдельным сведениям, риск рецидива ВТЭО, спровоцированного малым персистирующим фактором риска, не отличается от такового при неспровоцированном тромбозе и достигает 10,7% в год. При этом продленная терапия с помощью ПОАК (АТХ группа: антитромботические средства, В01А) позволяет существенным образом уменьшить этот риск [87].
- Антикоагулянтную терапию у пациента с неспровоцированным ТГВ рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84, 85, 279, 311, 330–332].
УДД 1 УУР А
Комментарий: несмотря на то, что мета-анализ не обнаружил достоверного влияния продленной антикоагулянтной терапии на риск фатального рецидива ВТЭО (ОР, 0,98; 95% ДИ, 0,14-6,98), любого рецидива ВТЭО (ОР, 0,63; 95% ДИ, 0,38-1,03), большого кровотечения (ОР, 1,84; 95% ДИ, 0,87-3,85), НКЗК (ОР, 1,78; 95% ДИ, 0,59-5,33) и общей смертности (ОР, 1,00; 95% ДИ, 0,63-1,57) [332], расчетные величины чистой клинической выгоды предполагают спасение 7 и 5 жизней на 1000 человек в группе низкого и умеренного риска кровотечения соответственно в течение 5 лет продленной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) (Таблица 2) [280]. С учетом улучшенного профиля безопасности ПОАК (АТХ группа: антитромботические средства, В01А), который определяет снижение общей смертности на фоне продленной терапии, чистую клиническую выгоду следует считать более очевидной при использовании последних [311].
- Лечение пациента с рецидивом ТГВ, возникшим в отсутствие большого транзиторного фактора риска, рекомендуется продлить сверх 3 месяцев [84, 85, 279, 333].
УУД 2 УУР В
Комментарий: неопределённо долгая терапия антитромботическими средствами в сравнении с лечением в течение 6 месяцев при повторном эпизоде ВТЭО ассоциируется со снижением шанса на рецидив на 88% ценой недостоверного тренда к увеличению риска большого кровотечения в 3,3 раза (95% ДИ, 0,90-10,0) [333].
- Антикоагулянтную терапию у пациента с ТГВ, возникшим на фоне злокачественного новообразования, рекомендуется проводить в течение 6 месяцев и продлевать до момента излечения рака [84, 85, 88, 279, 334, 335].
УУД 1 УУР А
Комментарий: сведения о продленной терапии онкоассоциированных ТГВ на сегодняшний день ограничены. По данным мета-анализа, частота рецидива ВТЭО за год наблюдения колеблется от 2,7% до 8,0% при использовании ПОАК (АТХ группа: антитромботические средства, В01А), составляет 4,0% при использовании АВК (АТХ группа: антагонисты витамина К, B01AA) и достигает 11,6% на фоне НМГ (B01AB: группа гепарина). Риск больших кровотечений при составляет 2,7-7,0% ПОАК (АТХ группа: антитромботические средства, В01А), 3,5% АВК (АТХ группа: антагонисты витамина К, B01AA), 4,1% НМГ (B01AB: группа гепарина) [334]. Под излечением рака следует понимать отсутствие отдаленных метастазов, прогрессирования или рецидива опухоли, а также потребности в специфическом лечении [335].
- Антикоагулянтную терапию у пациента с ТГВ, возникшим на фоне верифицированного АФС рекомендовано проводить в течение неопределённо долгого времени с помощью АВК (АТХ группа: антагонисты витамина К, B01AA) [84, 85, 211, 336, 337].
УДД 1 УУР А
Комментарий: по данным мета-анализа применение ПОАК (АТХ группа: антитромботические средства, В01А) при верифицированном АФС ассоциируется с 5-кратным увеличением риска развития артериальных тромботических событий преимущественно у лиц с анамнезом артериальных тромбозов, микроциркуляторных нарушением и тройно-позитивным АФС [336].
- При дистальном ТГВ рекомендуется терапия антикоагулянтами (АТХ группа: антитромботические средства, В01А) на протяжении 3 мес. [85, 322, 337, 338].
УДД 1 УУР А
Комментарий: длительность терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) может быть увеличена у пациентов с высоким риском рецидива ВТЭО и низким риском кровотечения на основании индивидуальной оценки [338]. У отдельных больных с низким риском ВТЭО возможно динамическое наблюдение с выполнением повторного УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) и назначением антитромботических средств в случае прогрессирования тромбоза [93]. К повышенному риску ВТЭО при дистальном ТГВ следует относить: положительный Д-димер, протяженность тромба >5 см, вовлечение в патологический процесс нескольких вен, диаметр пораженной вены >7 мм, близость тромба к проксимальным венам, отсутствие обратимого провоцирующего фактора, активный рак, ВТЭО в анамнезе, диагностика ТГВ в период стационарного лечения [279].
3.2.4. Лекарственные препараты для антикоагулянтной (антитромботической) терапии при ТГВ (общие положения)
В качестве антитромботических средств при ВТЭО в зависимости от фазы терапии могут быть использованы различные препараты (гепарин натрия** (АТХ группа: Группа гепарина B01AB), НМГ (АТХ группа: Группа гепарина B01AB: далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07), фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05), антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA), ПОАК, ацетилсалициловая кислота**, #сулодексид, относящиеся к АТХ группе B01 «Антикоагулянты» (АТХ группа: антитромботические средства, В01А). Для описания лечения применимы термины «антикоагулянтная терапия», «антитромботическая терапия». В зарубежной и отечественной литературе принято использовать термин «антикоагулянтная терапия» при выборе препаратов: гепарин натрия** (АТХ группа: Группа гепарина B01AB), НМГ, фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX), антагонисты витамина К, ПОАК (АТХ группа: антитромботические средства, В01А), и термин «антитромботическая терапия» при использовании дезагрегантов (АТХ группа: антиагреганты кроме гепарина, В01АС) (ацетилсалициловая кислота**) и #сулодексида. Ниже представлены рекомендации по использованию отдельных препаратов при ТГВ с целью профилактики прогрессирования ТГВ и/или развития ТЭЛА с учетом фазы антитромботической терапии.
3.2.5. Лекарственные препараты для начальной и длительной антикоагулянтной (антитромботической) терапии
3.2.5.1. Рекомендуемые лекарственные препараты для начальной и длительной терапии
- У пациентов с ТГВ для начальной и длительной терапии рекомендуется использование лечебных доз НФГ**, НМГ (АТХ группа: Группа гепарина B01AB, фондапаринукса натрия (АТХ группа: другие антитромботичиские средства, B01AX), АВК (АТХ группа: антагонисты витамина К, B01AA), ПОАК (АТХ группа: антитромботические средства, В01А; дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) [84, 85, 279, 339, 340].
УДД 5 УУР С
Комментарий: НФГ**, НМГ, фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX), АВК, ПОАК (АТХ группа: антитромботические средства, В01А; дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) разрешены и рекомендованы для терапии ТГВ. При этом формулировки показаний к применению антикоагулянтов (АТХ группа: антитромботические средства, В01А) имеют различия. Поэтому при выборе лекарственного средства необходимо убедиться, что препарат рекомендован производителем к применению у данной категории больных. При назначении антитромботического средства следует придерживаться дозировок и методики использования, изложенных в официальной инструкции.
3.2.5.2. Сравнение лекарственных препаратов для начальной и длительной терапии
При выборе антикоагулянта (АТХ группа: антитромботические средства, В01А) необходимо учитывать множество факторов: тяжесть состояния пациента и особенности коморбидного фона, путь введения препарата и биодоступность, скорость достижения эффекта, соотношение эффективности и безопасности, возможность и необходимость лабораторного мониторинга, фармакодинамическое и фармакокинетическое взаимодействие препаратов, опыт и результаты применения того или иного препарата у определенных групп пациентов и в особых клинических ситуациях, стоимость лечения. Прямые сравнительные исследования лекарственных средств, применяемых для лечения ВТЭО, по каждому из этих параметров не проводились, однако тех данных, которые опубликованы к настоящему времени достаточно для общих рекомендаций.
- У пациентов с ТГВ в рамках начальной и длительной терапии рекомендуется применение ПОАК [85, 148, 279, 310, 341].
УДД 3 УУР В
Комментарий: эта рекомендация не применяется в следующих случаях: при оказании экстренной помощи пациентам с ТГВ, осложненным ТЭЛА высокого риска смерти; при лечении пациентов в критическом состоянии; пациентов с почечной недостаточностью (КлКр <15 мл/мин – для апиксабана**, ривароксабана** и эдоксабана <30 мл/мин – для дабигатрана этексилата**), умеренным или тяжелым заболеванием печени, антифосфолипидным синдромом; пациентов, которым требуются препараты, являющиеся ингибиторами или индукторами Р-гликопротеина, или сильными ингибиторами или индукторами ферментов цитохрома Р450 3А4 (CYP3A4), а также при других заболеваниях и состояниях, которые могут влиять на всасывание и метаболизм ПОАК (АТХ группа: антитромботические средства, В01А). Согласно фармакокинетическим данным, пероральный прием апиксабана** и ривароксабана** обеспечивает столь же быстрый антикоагулянтный эффект, как и подкожное введение НФГ** (подкожное введение лекарственных препаратов (A11.01.002)) или НМГ, поэтому ингибиторы Ха-фактора (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) могут быть рекомендованы для начальной терапии ТГВ с момента подтверждения диагноза. В то же время, назначение дабигатрана этексилата** и эдоксабана предполагает предварительное введение НМГ или НФГ** в течение не менее чем 5 дней. При длительной терапии превосходство над НМГ с переходом на АВК по безопасности доказано для всех ПОАК (апиксабана**, дабигатрана этексилата**, ривароксабана**, эдоксабана). В РКИ, мета-анализах и регистрах показано, что назначение ПОАК в сравнении с НМГ и АВК при лечении ВТЭО не влияет на общую смертность (ОР, 0,99; 95% ДИ, 0,85-0,15), риск ТЭЛА (ОР, 0,97; 95% ДИ, 0,77-1,23; ОР) и ТГВ (ОР, 0,80; 95% ДИ, 0,59-1,09), но снижает риск развития больших кровотечений на 37% (ОР, 0,63; 95% ДИ, 0,47-0,84) [148, 302, 310, 341–345]. Кроме того, ПОАК (АТХ группа: антитромботические средства, В01А) не требуют частой корректировки дозы, мониторинга МНО или диетических ограничений, что повышает приверженность пациентов терапии, особенно на начальных этапах приема антикоагулянтов. При назначении антикоагулянтов (АТХ группа: антитромботические средства, В01А) следует учитывать стоимость лечения для пациентов. В большинстве опубликованных к настоящему времени исследований, сравнивающих стоимость лечения ВТЭО с помощью ПОАК и АВК показано, что лечение ПОАК (АТХ группа: антитромботические средства, В01А) в целом является менее затратным или аналогичным по цене в сравнении с АВК, однако, если принимать в расчет только цену препарата, то для ряда пациентов разница в цене может оказаться основной причиной досрочного прекращения терапии [346–348].
- При выборе ПОАК для начальной и длительной терапии у пациентов с ТГВ рекомендуется считать все препараты эквивалентными по эффективности и безопасности [280, 349].
УДД 5 УУР С
Комментарий: отсутствие данных о преимуществах того или иного препарата не исключает отличий между ними, важных при выборе лекарственного средства в конкретных ситуациях. Такие факторы, как необходимость введения парентеральных антикоагулянтов (АТХ группа: антитромботические средства, В01А), функция почек, онкологическое заболевание, сопутствующая лекарственная терапия (например, потребность в лекарственном средстве, изменяющем активность ферментов CYP3A4 или Р-гликопротеина), сроки госпитализации, однократный или двукратный режим приема и стоимость могут повлиять на выбор конкретного ПОАК (АТХ группа: антитромботические средства, В01А). Для пациентов, которым планируется назначить дабигатрана этексилат** или эдоксабан, начальная терапия должна включать НФГ** или НМГ в течение не менее 5 дней. Для получающих апиксабан** или ривароксабан** нет необходимости в предварительном лечении парентеральными антитромботическими средствами. При этом начальную более высокую суточную дозу ривароксабана** пациент должен принимать в течение первых 3 трех недель терапии, апиксабана** – в течение первой недели. Эти различия могут быть особенно важны при определении сроков госпитализации и оценке возможности продолжения лечения в амбулаторных условиях [349].
- При лечении ТГВ, осложненного ТЭЛА высокого риска раннего летального исхода, при которой показано выполнение реперфузионного вмешательства, для начальной антикоагулянтной терапии рекомендуется использовать внутривенную инфузию НФГ** (внутривенное введение лекарственных препаратов (A11.12.003) в подобранной по массе тела дозе [84].
УДД 5 УУР С
Комментарий: при лечении пациента с ТГВ, осложненным ТЭЛА высокого риска смерти с нестабильной гемодинамикой, быстрая и эффективная гипокоагуляция может быть достигнута только при внутривенном введении препарата (внутривенное введение лекарственных препаратов (A11.12.003). Единственным антикоагулянтом (АТХ группа: антитромботические средства, В01А), предназначенным для внутривенного введения (внутривенное введение лекарственных препаратов (A11.12.003) при начальной терапии ТЭЛА высокого риска смерти, является НФГ** (гепарин натрия**). Внутривенное введение (внутривенное введение лекарственных препаратов (A11.12.003) ассоциируется со снижением 30-дневной смертности от ТЭЛА [122, 350]. Выполненные мета-анализы указывают на отсутствие преимуществ внутривенного введения НФГ (внутривенное введение лекарственных препаратов (A11.12.003) перед подкожным введением (подкожное введение лекарственных препаратов (A11.01.002)) НМГ (B01AB: Группа гепарина) в рамках инициальной терапии тромбоза глубоких вен, осложненного ТЭЛА, а также на повышенную эффективность и безопасность подкожных инъекций НМГ в сравнении с внутривенным и подкожным введением НФГ** (гепарин натрия**) в рамках начальной терапии ВТЭО [351–353]. Между тем, большинство включенных в мета-анализы исследований исключали массивную ТЭЛА, требующую активной реперфузии. С учетом фармакокинетических особенностей, возможности быстрой инактивации, совместимости с тактикой активной реперфузии внутривенная инфузия НФГ** (гепарин натрия**) (внутривенное введение лекарственных препаратов (A11.12.003) в подобранной по массе тела дозе остается методом выбора при лечении тромбоза глубоких вен, осложненного ТЭЛА высокого риска смерти [84].
- При лечении пациента с ТГВ, осложненным ТЭЛА высокого и промежуточного риска смерти при стабильных показателях гемодинамики, когда не показано реперфузионное вмешательство, для начальной терапии рекомендуются подкожные инъекции НМГ (B01AB: Группа гепарина) (подкожное введение лекарственных препаратов (A11.01.002)) или фондапаринукса натрия (АТХ группа: другие антитромботичиские средства, B01AX ) в подобранных по массе тела дозах [84, 351, 352].
УДД 5 УУР С
Комментарий: НМГ и фондапаринукс натрия предпочтительнее НФГ** для начальной антикоагулянтной терапии при ТЭЛА промежуточного и высокого риска смерти, поскольку они ассоциированы с более низким риском кровотечения, гепарин-индуцированной тромбоцитопении и не требуют регулярного мониторинга показателей коагулограммы и уровня анти-Ха активности [351, 352, 354, 355]. Следует иметь в виду, что эффективность и безопасность реперфузионных вмешательств на фоне продолжающегося приема ПОАК (АТХ группа: антитромботические средства, В01А) не изучена, поэтому при наличии признаков ТЭЛА промежуточного и высокого риска смерти у пациентов с тромбозом глубоких вен,, когда есть вероятность ухудшения состояния и возникновения потребности в реперфузии, следует избегать применения ПОАК (АТХ группа: антитромботические средства, В01А) до окончательной стабилизации состояния больного (обычно 2-3 дня) [356].
- При лечении пациента с ТГВ в случае наличия показаний и возможностей для хирургической дезобструкции венозного русла для начальной антикоагулянтной терапии рекомендуется использовать внутривенную инфузию НФГ** (гепарин натрия**) (внутривенное введение лекарственных препаратов (A11.12.003) или подкожные инъекции НМГ (B01AB: Группа гепарина) (подкожное введение лекарственных препаратов (A11.01.002)) в подобранных по массе тела дозах [357–359].
УДД 4 УУР С
Комментарий: при наличии показаний и возможностей для хирургической дезобструкции целесообразно использовать наиболее управляемый и совместимый с вмешательством вид антикоагулянтной терапии, к которой относится внутривенная инфузия НФГ** (внутривенное введение лекарственных препаратов (A11.12.003) и подкожные инъекции НМГ (B01AB: Группа гепарина) (подкожное введение лекарственных препаратов (A11.01.002)) [357–359]. На сегодняшний день отсутствуют исследования, позволяющие выбрать оптимальную тактику антикоагулянтной терапии у пациентов, подвергающихся хирургической дезобструкции.
3.2.5.3. Начальная и длительная терапия – режим применения антитромботических препаратов (АТХ группа: антитромботические средства, В01А).
В разделах 3.2.4.4-3.2.4.9 рассмотрены режимы применения антитромботических средств при проведении начальной и длительной антитромботической терапии.
3.2.5.4. Гепарин натрия** (АТХ группа: Группа гепарина B01AB, гепарин натрия**)
Гепарин натрия** (АТХ группа: Группа гепарина B01AB), вводимый подкожно (подкожное введение лекарственных препаратов (A11.01.002)) или внутривенно (внутривенное введение лекарственных препаратов (A11.12.003) в течение многих лет оставался основным средством лечения ВТЭО. В последние годы, однако, отношение к этому препарату, как к средству лечения ВТЭО существенно изменилось. Установлено, в частности, что при подкожном введении (подкожное введение лекарственных препаратов (A11.01.002)) целевые значения времени свертывания крови или АЧТВ удается поддерживать не более, чем у 30% больных. В остальных случаях эффект введения гепарина натрия** оказывается недостаточным, что увеличивает относительный риск рецидива ВТЭО в 4-5 раз [360] и вероятность летального исхода в ближайшие 30 дней в 2,6 раз [350].
Оптимальным режимом использования НФГ** служит внутривенная инфузия (внутривенное введение лекарственных препаратов (A11.12.003) первичным болюсом в подобранной по массе тела дозе с последующей постоянной инфузией со скоростью, обеспечивающей поддержание АЧТВ на уровне, превышающем верхнюю границу нормы в 1,5-2,3 раза (таблицы 9, 10). Такой вариант антитромботической терапии позволяет поддерживать состояние гипокоагуляции на необходимом для лечения уровне у 70% больных. У остальных пациентов отмечают значительные колебания АЧТВ от нормо- до чрезмерной гипокоагуляции. Поэтому назначение НФГ** предполагает обязательное многократное определение АЧТВ. Кроме АЧТВ, до начала терапии НФГ** и через 1, 3, 5, 7, 9, 11-14 дней ее проведения необходимо исследование уровня тромбоцитов в крови (A12.05.120); а при появлении признаков несоответствия изменений АЧТВ дозе вводимого препарата определять уровень антитромбина, определение тромбинового времени в крови (A12.05.028) до и после сорбции из нее гепарина сорбентом, тромбин-гепариновое время в бедной тромбоцитами плазме, анти-Ха активность [128].
Таблица 9. Рекомендуемая начальная дозировка НФГ** при ТГВ
Введение | Начальная доза | Поддерживающая доза |
|---|
Внутривенно (внутривенное введение лекарственных препаратов (A11.12.003) |
Без коррекции по массе тела | 5000 ЕД | 1250-1280 ЕД/ч |
Скорректированная по массе тела | 80 ЕД/кг | 18 ЕД/кг/ч |
Подкожно (подкожное введение лекарственных препаратов (A11.01.002)) |
Фиксированная доза | 333 ЕД/кг | 250 ЕД/кг каждые 12 ч |
Доза, подбираемая по АЧТВ | 5000 ЕД | 17500 ЕД каждые 12 ч с коррекцией по АЧТВ |
Таблица 10. Протокол (номограмма) подбора дозы при внутривенной инфузии НФГ** (внутривенное введение лекарственных препаратов (A11.12.003)
АЧТВ во время внутривенной инфузии гепарина натрия (внутривенное введение лекарственных препаратов (A11.12.003) | Изменение дозы (ЕД/кг/ч) | Дополнительные действия | Следующее определение АЧТВ |
|---|
Увеличение менее чем в 1,2 раза от контрольной величины | +4 | Болюс 80 ЕД/кг | Через 6 ч |
Увеличение в 1,2-1,5 раза от контрольной величины | +2 | Болюс 40 ЕД/кг | Через 6 ч |
Увеличение в 1,5-2,3 раза от контрольной величины | 0 | 0 | Через 6 ч |
Увеличение в 2,3-3,0 раза от контрольной величины | –2 | 0 | Через 6 ч |
Увеличение более чем в 3,0 раза от контрольной величины | –3 | Прекращение на 1 ч | Через 6 ч |
Примечание. АЧТВ – активированное частичное тромбопластиновое время; контрольная величина – верхняя граница нормы для конкретной лаборатории.
Большое число противопоказаний, высокая вероятность геморрагических осложнений и обязательный лабораторный мониторинг при использовании лечебных доз НФГ** привели к тому, что этот препарат постепенно вытесняется другими антитромботическими средствами. Подкожные инъекции НФГ** (подкожное введение лекарственных препаратов (A11.01.002)) с лечебной целью целесообразно ограничить случаями, когда внутривенное введение (внутривенное введение лекарственных препаратов (A11.12.003) невозможно, а другие антитромботические средства противопоказаны или недоступны. Внутривенное введение (болюс с последующей инфузией) НФГ** (внутривенное введение лекарственных препаратов (A11.12.003) целесообразно применять только при лечении больных, находящихся в критическом состоянии, а также пациентов, которым может потребоваться экстренное оперативное вмешательство, травматичная процедура, тромболизис. В таких случаях, короткий период полувыведения, возможность оценки степени гипокоагуляции по АЧТВ и возможность нейтрализации протамина сульфатом** (АТХ группа: антидоты, V03AB14) делают НФГ** средством выбора. Кроме того, инфузия НФГ** в качестве начальной терапии ТГВ, осложненного ТЭЛА, может применяться у больных с недавно перенесенным кровотечением и высоким риском рецидива, у пациентов с высокой вероятностью дефицита антитромбина (например, в случае, если ТГВ развился на фоне специфической профилактики НМГ (B01AB: Группа гепарина), а также у больных, перенесших массивную, более 50% ОЦК, кровопотерю) и у пациентов с олиго- и анурией. У остальных пациентов более безопасным и эффективным следует считать использование НМГ (B01AB: Группа гепарина) или ПОАК (B01A: Антитромботические средства).
3.2.5.5. Гепарины низкомолекулярные (B01AB: Группа гепарина; далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07)
В сравнении с НФГ**, низкомолекулярные гепарины (B01AB: Группа гепарина) имеют высокую биодоступность (более 90%) при подкожном введении (подкожное введение лекарственных препаратов (A11.01.002)), более длительный период полувыведения (190-270 мин против 40-90 мин) и продолжительность антитромботической активности (17-24 ч против 8-12 ч), в меньшей степени связываются с белками плазмы крови, что позволяет им сохранять свой эффект на фоне эндогенной интоксикации, обладают более предсказуемым дозозависимым антикоагулянтным эффектом, не стимулируют, а ослабляют агрегацию тромбоцитов, реже (менее 0,5%) вызывают тромбоцитопению. Эти свойства обусловлены химическим составом препаратов. Короткоцепочечные молекулы гепарина, содержащие специфическую пентасахаридную последовательность и менее 18 олигомеров (с молекулярной массой менее 5400 Да), не способны образовывать тройной комплекс тромбин-антитромбин-гепарин и подавлять активность тромбина, но сохраняют способность к антитромбин-зависимой инактивации Xa фактора. Поскольку состав каждого из коммерческих НМГ (B01AB: Группа гепарина) различен, они отличаются друг от друга по физико-химическим, биологическим и фармакокинетическим свойствам и не являются взаимозаменяемыми. Рекомендуемые для лечения ВТЭО дозы НМГ (B01AB: Группа гепарина) представлены в Таблице 11. В большинстве случаев назначение рекомендуемых доз НМГ (B01AB: Группа гепарина) не требует рутинного лабораторного мониторинга.
Мониторирование анти-Ха активности (A09.05.052 Исследование уровня гепарина в крови) при подкожном введении (подкожное введение лекарственных препаратов (A11.01.002)) антитромботических средств целесообразно использовать для подбора дозы у больных с очень низкой или очень высокой массой тела, выраженным нарушением функции почек, высоким риском кровотечения, при беременности. Целевые значения для лечебных доз составляют 0,6-1,0 ЕД/мл при двукратном режиме введения или 0,8-1,3 МЕ/мл при однократном режиме введения и зависят от наименования препарата [122]. При использовании НМГ (B01AB: Группа гепарина) кровь для определения анти-Ха активности (A09.05.052 Исследование уровня гепарина в крови) берут через 4-6 ч после введения препарата (оптимально после 3-4-х инъекций).
Таблица 11. Рекомендуемые дозы НМГ (B01AB: Группа гепарина) при начальной и длительной терапии ВТЭО
Препарат | Доза при двукратном введении | Доза при однократном введении |
|---|
Далтепарин натрия (АТХ: Группа гепарина, B01AB04) | 100 МЕ/кг | 200 МЕ/кг |
Надропарин кальция (АТХ: Группа гепарина, B01AB06) | 86 анти-Ха МЕ/кг | 171 антиХа МЕ/кг |
Эноксапарин натрия** (АТХ: Группа гепарина, B01AB05) | 1 мг/кг | 1,5 мг/кг |
#Бемипарин натрия [361, 362] (АТХ: Группа гепарина, B01AB12) | нет | 3500 МЕ |
Парнапарин натрия** (АТХ: Группа гепарина, B01AB07) | 6,400 МЕ 2 раза в сутки в течение 7-10 дней, далее 6,400 МЕ или 4,250 МЕ 1 раз в сутки |
Примечание. *Бемипарин натрия может применяться только для длительной терапии ТГВ с ТЭЛА или без нее на протяжении не более 3 месяцев.
3.2.5.6. Фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX)
Фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX) представляет собой синтетический пентасахарид, обладающий антитромбин-зависимой способностью к селективной инактивации Ха фактора свертывания. Препарат вводят под кожу живота один раз в сутки без контроля показателей системы гемостаза. Является предпочтительным в сравнении с НФГ** при начальной антикоагулянтной терапии ВТЭО из-за низкого риска больших кровотечений и гепарин-индуцированной тромбоцитопении [354, 355, 363–366]. Фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX) при лечении ВТЭО вводят в стандартной лечебной дозе 7,5 мг 1 раз в сутки, пациенты с массой тела <50 кг получают 5 мг, а пациенты с массой тела >100 кг – 10 мг. Из-за своей низкой молекулярной массы фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX) может накапливаться при почечной недостаточности, поэтому его не следует применять у пациентов с КлКр <30 мл/мин [153]. В связи с отсутствием потенциального вовлечения в иммунные механизмы формирования ГИТ II типа, фондапаринукс натрия может использоваться при развитии указанного осложнения [364, 367–374].
3.2.5.7. Прямые ингибиторы фактора Xa (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03)
Апиксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF02) – прямой ингибитор Xa фактора, обратимо и селективно блокирующий активный центр фермента. Характеризуется высокой биодоступностью при приеме внутрь, не зависящей от приема пищи. Метаболизируется в печени, частично (27%) выводится почками в неизменном виде. Не требует лабораторного мониторинга активности, хотя это возможно с помощью специальных калиброванных тестов на анти-Ха активность. В рамках начальной и длительной терапии ВТЭО препарат используется в дозе 10 мг два раза в сутки в течение 7 дней, затем 5 мг 2 раза в сутки. Лечение начинают без предварительной парентеральной терапии (Таблица 12). В отличие от лечения фибрилляции предсердий, при ТГВ у пациента с почечной недостаточностью коррекцию дозы не проводят. Тем не менее, при КлКр 15-29 мл/мин апиксабан** следует применять с осторожностью, а при КлКр <15 мл/мин – препарат не рекомендуется.
Ривароксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) – прямой ингибитор фактора Ха, обладающий высокой биодоступностью при приеме внутрь, которая зависит от приема пищи при дозировке более 10 мг. Метаболизируется в печени, частично (36%) выводится почками в неизменном виде. Не требует лабораторного мониторинга активности, хотя это возможно с помощью калиброванного протромбинового времени Neoplastin и с помощью калиброванных тестов на анти-Ха активность. Для начальной и длительной терапии ВТЭО применяют в дозе 15 мг 2 раза в сутки в течение первых 3 недель с последующим переходом на 20 мг 1 раз в сутки. Лечение начинают без предварительной парентеральной терапии (Таблица 12). В отличие от лечения фибрилляции предсердий, не требует обязательной корректировки дозы у пациентов с КлКр <50 мл/мин, но инструкцией предусмотрено снижение дозы с 20 мг до 15 мг 1 раз в сутки при индивидуально высоком риске кровотечения. Следует отметить, что рекомендации даны на основании фармакокинетического моделирования, а дозировка не изучалась в рамках клинических исследований у пациентов с ВТЭО. Между тем, данные реальной клинической практики показывают, что необоснованное снижение дозы ПОАК может увеличивать риск рецидива ВТЭО [343]. Ривароксабан** не рекомендуется использовать при КлКр <15 мл/мин.
Эдоксабан (АТХ группа: прямые ингибиторы фактора Xa B01AF03) ингибирует свободный фактор Xa и характеризуется быстрым развитием фармакодинамических эффектов – в течение 1-2 часов после приема. Прием пищи минимально влияет на общую экспозицию. Метаболизируется в печени путем гидролиза, а также с участием CYP3A45 (<10%). Около 50% препарата выводится почками. Рекомендуемая доза эдоксабана составляет 60 мг один раз в сутки после первоначального введения парентеральных антитромботических средств в течение по крайней мере 5 дней. Доза эдоксабана может быть снижена до 30 мг 1 раз в сутки у отдельных групп пациентов (Таблица 12). Эдоксабан и первоначальное парентеральное антитромботическое средство не следует применять одновременно. Эдоксабан не рекомендуется при клиренсе креатинина (КлКр) <15 мл/мин.
3.2.5.8. Прямые ингибиторы тромбина (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07)
Дабигатрана этексилат** (АТХ группа: ингибиторы тромбина прямые B01AE07) является низкомолекулярным, не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь быстро всасывается и путем гидролиза печеночными и плазменными эстеразами превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина (фактора IIa). Около 85% активного вещества выводится почками. Не требует лабораторного мониторинга активности, но оно возможно с помощью специально калиброванных экаринового времени свертывания и разведенного тромбинового времени. При начальной и длительной терапии ВТЭО используют в дозе 150 мг два раза в сутки, которую начинают принимать после не ранее, чем через 5 дней начальной парентеральной антикоагуляции с использованием НМГ (B01AB: Группа гепарина) или НФГ**. Для больных старше 80 лет, или при сопутствующем приеме верапамила** (АТХ группа: блокаторы кальциевых каналов, C08DA01) доза должна быть уменьшена до 110 мг два раза в день. Такое же уменьшение дозы может быть рассмотрено у больных в возрасте 75-80 лет, при КлКР 30-50 мл/мин, при наличии эзофагита, гастрита, ГЭРБ, а также при наличии других факторов риска кровотечения. При КлКр <30 мл/мин применение дабигатрана этексилата** не рекомендуется (Таблица 12). Следует отметить, что рекомендации даны на основании фармакокинетического моделирования, а дозировка не изучалась в рамках клинических исследований у пациентов с ВТЭО.
Таблица 12. Режимы применения ПОАК в рамках инициальной, длительной и продленной терапии ВТЭО
Препарат | Инициальная терапия | Длительная терапия | Продленная терапия | Снижение дозы у отдельных групп пациентов |
|---|
Апиксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF02) | 10 мг 2 раза в сутки в течение 7 дней | 5 мг 2 раза в сутки | 2,5 мг 2 раза в сутки через 6 мес. | Не требуется; не рекомендуется использование при КлКр <15 мл/мин |
Ривароксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) | 15 мг 2 раза в сутки в течение 21 дня | 20 мг 1 раз в сутки | 20 мг или 10 мг 1 раз в сутки через 6 мес. | Возможно снижение с 20 мг до 15 мг 1 раз в сутки при КлКр <50 мл/мин; не рекомендуется использование при КлКр <15 мл/мин |
Эдоксабан (АТХ группа: прямые ингибиторы фактора Xa, B01AF03) | Не используется, требуется введение НМГ (B01AB: Группа гепарина) в течение 5 дней | 60 мг 1 раз в сутки | 60 мг 1 раз в сутки | 30 мг 1 раз в сутки при умеренном или тяжелом нарушении функции почек (КлКр 15-50 мл/мин), низкой массе тела (≤60 кг), сопутствующей терапии следующими ингибиторами Р-гликопротеина (L04AD: Ингибиторы кальциневрина): циклоспорином**, эритромицином или кетоконазолом. Не рекомендуется использование при КлКр <15 мл/мин |
Дабигатрана этексилат** (АТХ группа: ингибиторы тромбина прямые, B01AE07) | Не используется, требуется введение НМГ (B01AB: Группа гепарина) в течение 5 дней | 150 мг 2 раза в сутки | 150 мг 2 раза в сутки | Рекомендовано снижение дозы до 110 мг 2 раза в сутки у пациентов старше 80 лет, при сопутствующем приёме верапамила** (АТХ группа: блокаторы кальциевых каналов, C08DA01); возможно снижение доза до 110 мг 2 раза в сутки у пациентов 75-80 лет, при КлКр 30-50 мл/мин, при наличии эзофагита, гастрита, ГЭРБ, при наличии других факторов риска кровотечения; не рекомендуется использование при КлКр <30 мл/мин. |
3.2.5.9. Антагонисты витамина К (АТХ: антагонисты витамина К, B01AA)
Антагонисты витамина К (АВК) – антикоагулянты непрямого действия, которые подавляют синтез активных форм витамин К-зависимых факторам свертывания крови (II, VII, IX и X) и антикоагулянтных протеинов C и S в печени. Эффект АВК проявляется медленно (в течение нескольких суток), поэтому они не подходят для раннего лечения ВТЭО, а также в случаях, когда необходимо быстрое антикоагулянтное действие. Кроме того, из-за медленного прекращения антитромботического эффекта препараты этой группы не следует использовать для краткосрочной дооперационной профилактики венозного тромбоза. Предпочтение следует отдавать варфарину** (АТХ группа: антагонисты витамина К, B01AA03). При недоступности варфарина** следует использовать другие антагонисты витамина К (в частности, аценокумарол). Подбор дозы варфарина** начинают одновременно с парентеральным введением антитромботических средств. Эффективную дозу АВК подбирают таким образом, чтобы поддерживать значения МНО (в пределах от 2,0 до 3,0 (лабораторный контроль за терапией лекарственными препаратами (непрямыми антикоагулянтами) (B03.005.008)). Чувствительность больных к АВК не одинакова, зависит от множества врожденных и приобретенных факторов и может меняться со временем. Поэтому эффективная доза колеблется в широких пределах.
Чтобы поддерживать терапевтический уровень гипокоагуляции во время перехода с парентеральных антитромботических средств на варфарин**, необходимо строго соблюдать два условия:
Длительность одновременного парентерального введения лечебных доз антикоагулянтов НФГ**, НМГ (B01AB: Группа гепарина), фондапаринукса натрия и приема варфарина** должна составлять не менее 5 сут.
Парентеральное введение антитромботических средств можно прекратить не ранее, чем после двух последовательных анализов, взятых с интервалом примерно в сутки (два последовательных дня), демонстрирующих значение МНО в терапевтическом диапазоне 2,0-3,0.
Согласно иснтрукции к лекарственному препарату в первые 4 суток следует использовать дозы 5 мг. варфарина**. На 5 сутки возможно применение варфарина** в дозах 7,5 мг. У пациентов, ранее принимавших данный препарат, возможно его применение в дозе 10 мг. У лиц пожилого возраста, истощенных, с хронической сердечной недостаточностью, заболеванием печени, недавней большой операцией или принимающих препараты, повышающие чувствительность к варфарину**, начальная доза не должна превышать 5 мг. Аналогичного подхода разумно придерживаться у больных с неизвестной врожденной чувствительностью к варфарину** (полиморфизмы генов цитохрома Р450 2С9 и VCORK1), особенно при повышенном риске кровотечений. В дальнейшем дозу варфарина** подбирают в зависимости от МНО, которое следует определить после приема двух или трех начальных доз препарата. В последующем МНО необходимо определять ежедневно или один раз в несколько дней до получения стабильных терапевтических значений показателя, затем 2-3 раза в неделю на протяжении 1-2 нед. После достижения стабильных терапевтических значений МНО следует определять каждые 4 нед, а в последующем при отсутствии существенных изменений состояния пациента, характера питания и сопутствующего лечения – каждые 3 мес. Более частая оценка целесообразна у больных со значительными колебаниями показателя. Если требуется коррекция (увеличение или уменьшение) дозы препарата, следует повторить цикл более частого определения МНО, пока снова не будут достигнуты стабильные значения показателя. Общие принципы подбора дозы варфарина** приведены в Таблице 13.
Таблица 13. Алгоритм подбора дозы АВК на примере варфарина**[1, 375–377]
Первые 2 дня: 5-10 мг однократно |
|---|
3-й день | Определить МНО |
МНО <1,5 | Увеличить суточную дозу на ½ таблетки, определить МНО через 1-2 дня |
МНО 1,5-2,0 | Увеличить суточную дозу на ¼ таблетки, определить МНО через 1-2 дня |
МНО 2,0-3,0 | Оставить суточную дозу без изменений, определить МНО через 1-2 дня |
МНО 3,0-4,0 | Уменьшить суточную дозу на ¼ таблетки, определить МНО через 1-2 дня |
МНО >4,0 | Пропустить 1 прием, далее суточную дозу уменьшить на ½ таблетки, определить МНО через 1-2 дня |
4-5-й день | Определить МНО, действовать по алгоритму 3-го дня. Если подбор дозы занимает более 5 дней, то следует определять МНО 1 раз в 2 дня и следовать алгоритму 3-го дня. |
Важнейший показатель, характеризующий эффективность и безопасность длительного использования АВК – время нахождения МНО в границах целевого диапазона, которое должно превышать 60-70%. Для более успешного поддержания стабильного уровня антикоагуляции при длительном использовании АВК следует выполнить: определение МНО самим пациентом (при наличии у него портативного прибора), определение МНО в антикоагулянтном кабинете или клинике, внедрение компьютерных систем централизованного мониторинга пациентов, принимающих АВК, а также формирование приверженности пациентов к терапии АВК в виде обучения в Школах варфаринотерапии [375–377]. Если у больных с подобранной дозой АВК МНО выходит за границы терапевтического диапазона, необходимо выявить и по возможности устранить возможные причины (неточность определения МНО, интеркуррентные заболевания, выраженные изменения в диете, употребление алкоголя, прием препаратов, влияющих на эффективность варфарина**, недостаточная приверженность к лечению). Если при регулярном приеме варфарина** МНО не достигает нижней границы терапевтического диапазона, обычно достаточно увеличить совокупную недельную дозу на 10-20% и чаще контролировать МНО, пока оно не стабилизируется. В отдельных случаях более высокая доза варфарина** может быть дана однократно с последующими более частыми определениями МНО и изменением общей недельной дозы или без него.
3.2.6. Лекарственные препараты для продленной антикоагулянтной терапии
3.2.6.1. Рекомендуемые лекарственные препараты для продленной антитромботической терапии
- В качестве лекарственных средств для продленной антикоагулянтной терапии предпочтение рекомендуется отдавать прямым оральным антикоагулянтам (АТХ группа: антитромботические средства, В01А) [320].
УДД 1 УУР В
Комментарий: для продленного лечения (вторичной профилактики) ТГВ могут быть использованы АВК, дабигатрана этексилат**, ривароксабан**, апиксабан**. В качестве альтернативы пероральным антикоагулянтам (АТХ группа: антитромботические средства, В01А) может применяться сулодексид и #ацетилсалициловая кислота** в дозе 100 мг. [315, 317, 318, 320].
3.2.6.2. Сравнение лекарственных препаратов для продленной антитромботической терапии
Предложенные для продленной терапии ВТЭО антитромботические препараты (АТХ группа: антитромботические средства, В01А) в рамках проведенных клинических исследований сравнивали преимущественно с отсутствием терапии или плацебо: АВК против плацебо [378, 379], апиксабан** против плацебо [313], ривароксабан** против плацебо [343], эдоксабан против плацебо [380], дабигатрана этексилат** против плацебо [381], #ацетилсалициловой кислоты** против плацебо [315], сулодексид против плацебо [382] или между собой: различные режимы. По результатам исследований были опубликованы мета-анализы, демонстрирующие, что использование оральных антикоагулянтов (АТХ группа: антитромботические средства, В01А) (АВК и ПОАК (АТХ группа: антитромботические средства, В01А)) снижает риск рецидива ВТЭО в среднем на 80%, в тоже время применение сулодексида ассоциируется со снижением риска только на 50%, #ацетилсалициловой кислоты** – на 30% (Таблица 14) [320]. Важно отметить, что применение АВК с заниженным целевым диапазоном МНО (1,5-2,0) ассоциируется с умеренным снижением риска рецидива ВТЭО на 60% наряду с увеличением угрозы большого кровотечения в 3 раза, что соответствует таковой при использовании полной лечебной дозы с достижением целевого диапазона МНО 2,0-3,0. Эти данные можно использовать с целью индивидуального подбора препарата для продленной терапии на основании личной оценки пользы и риска.
Таблица 14. Риск развития рецидива ВТЭО и большого кровотечения при использовании антитромботических средств при сравнении с плацебо (отсутствием лечения) в рамках продленной терапии [320].
Препарат | Риск рецидива ВТЭО (95% ДИ) | Риск большого кровотечения (95% ДИ) |
|---|
АВК при МНО 2,0-3,0 | 0,16 (0,10-0,26) | 3,13 (1,37-7,16) |
АВК при МНО 1,5-2,0 | 0,39 (0,23-0,65) | 3,23 (1,16-8,99) |
Апиксабан** 5 мг | 0,20 (0,11-0,34) | 0,25 (0,03-2,27) |
Апиксабан** 2,5 мг | 0,19 (0,11-0,34) | 0,50 (0,09-2,72) |
Дабигатрана этексилат** 150 мг | 0,18 (0,09-0,35) | 1,71 (0,61-4,75) |
Ривароксабан** 20 мг | 0,22 (0,14-0,36) | 1,77 (0,27-11,44) |
Ривароксабан** 10 мг | 0,18 (0,10-0,34) | 1,29 (0,17-9,78) |
Сулодексид | 0,50 (0,28-0,91) | н/д |
#Ацетилсалициловая кислота** | 0,71 (0,55-0,91) | 0,61 (0,11-3,31) |
Примечания. н/д – риск не рассчитан, т.к. в исследованиях по изучению сулодексида не было зарегистрировано больших кровотечений
3.2.6.3. Продленная терапия - режим применения антитромботических препаратов (АТХ группа: антитромботические средства, В01А)
3.2.6.4. Гепарин натрия** (АТХ группа: группа гепарина B01AB)
Нефракционированный гепарин** (АТХ группа: группа гепарина B01AB, гепарин натрия**) является наиболее непредсказуемым среди всех антикоагулянтов (АТХ группа: антитромботические средства, В01А), поэтому назначается в терапевтической дозе только при возможности регулярного лабораторного мониторинга свертываемости крови (через 4-6 часов после каждой инъекции) при начальной и длительной терапии, но не используется на этапе продленного лечения. При внутривенном (внутривенное введение лекарственных препаратов (A11.12.003) применении оптимальная длительность лечения НФГ** не установлена, так как пациентов с ТГВ, осложненным ТЭЛА высокого риска смерти или находящиеся в критическом состоянии, исключали из большинства исследований. В исследовании PEITHO в группе пациентов с ТЭЛА промежуточного и высокого риска смерти, получавших только НФГ**, среднее время между рандомизацией и летальным исходом или декомпенсацией кровообращения составило 1,79±1,60 дня [356]. Поэтому представляется разумным использовать у таких пациентов инфузии НФГ** до стабилизации состояния, но не менее, чем на 2-3 дня, после чего они могут быть переведены на оральные антикоагулянты (АТХ группа: антагонисты витамина К, B01AA; АТХ группа: прямые ингибиторы фактора Xa, B01AF; АТХ группа: ингибиторы тромбина прямые, B01AE). Если планируется перевод на АВК, то оральный антикоагулянт (АТХ группа: антитромботические средства, В01А) назначают сразу после стабилизации состояния, а введение гепарина натрия** прекращают после достижения устойчивого значения МНО в пределах целевого диапазона 2,0-3,0 (т.е. когда при определении МНО с периодичностью 1 раз в сутки будут получены подряд два одинаковых результата).
3.2.6.5. Гепарины низкомолекулярные (B01AB: Группа гепарина; далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07)
- Низкомолекулярные гепарины (B01AB: Группа гепарина) рекомендуется рассмотреть в качестве основных лекарственных препаратов для продленной антикоагулянтной терапии у пациентов с ограничениями к применению прямых оральных антикоагулянтов [92, 215, 383–385].
УДД 1 УУР А
Комментарий: до настоящего времени назначение НМГ (B01AB: Группа гепарина) остается приемлемым вариантом продленной антикоагулянтной терапии ВТЭО [92, 215]. Препараты вводят в полных лечебных или редуцированных (50-75% от полной лечебной) дозах (Таблица 11), лечение ими не требует рутинного лабораторного мониторинга, что позволяет продолжать использование после выписки из стационара. По данным мета-анализов, продленное применение НМГ (B01AB: Группа гепарина) в сравнении с АВК ассоциируется c тенденцией к снижению риска рецидива ВТЭО и развития большого кровотечения [384], а также позволяет улучшить реканализацию пораженных вен и уменьшить вероятность развития ПТБ, в том числе венозной трофической язвы [385]. Следует учитывать, что при длительном применении НМГ (B01AB: Группа гепарина) увеличивается вероятность развития таких осложнений как остеопороз и ГИТ [386, 387]. Поэтому общепринятой тактикой является перевод пациентов, нуждающихся в длительной терапии, на оральные антикоагулянты (B01A: Антитромботические средства). НМГ ((B01AB: Группа гепарина) остаются предпочтительными при лечении пациентов с ТГВ и онкологическими заболеваниями желудочно-кишечного тракта, внутрипросветными опухолями мочеполовой системы, при наличии тромбоцитопении, клинически значимой печеночной или почечной недостаточности, при использовании химиотерапевтических препаратов (L01: Противоопухолевые препараты), влияющих на активность Р-гликопротеина и/или ферментов цитохрома Р450 3А4 (CYP3A4), а также при других заболеваниях и состояниях, которые могут влиять на всасывание и метаболизм ПОАК (B01A: Антитромботические средства). В таких ситуациях НМГ ((B01AB: Группа гепарина) могут применяться в качестве основного средства для продленной терапии или в качестве временной альтернативы оральным антикоагулянтам (B01A: Антитромботические средства) на период, когда использование последних ограничено.
3.2.6.6. Прямые ингибиторы фактора Xa (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) и прямые ингибиторы тромбина (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07).
- Прямые оральные антикоагулянты (B01A: Антитромботические средства) рекомендуется в качестве основных лекарственных препаратов для продленной антикоагулянтной терапии [148, 313, 314, 343, 381].
УДД 1 УУР В
Комментарий: для продленной антикоагулянтной терапии апиксабан** применяется в редуцированной дозе 2,5 мг 2 раза в день спустя 6 мес. от момента начала лечения. Исследование AMPLIFY Extension показало, что использование апиксабана** в редуцированной дозировке снижает вероятность рецидива ВТЭО на 81% без увеличения опасности развития больших кровотечений и НКЗК в сравнении с плацебо [313].
Для продленной терапии ривароксабан** может применяться в дозе 20 мг или 10 мг 1 раз в сутки спустя 6 мес. от момента начала лечения. Исследование EINSTEIN Extension показало, что ривароксабан** в дозировке 20 мг снижает вероятность рецидива ВТЭО на 82% без увеличения опасности развития больших кровотечений в сравнении с плацебо [343]. В исследовании EINSTEIN Choice обе дозировки ривароксабана**, 20 мг и 10 мг, снизили риск рецидива ВТЭО на 66% и 74% соответственно без увеличения опасности развития больших кровотечений и НКЗК в сравнении с #ацетилсалициловой кислотой** в дозе 100 мг [314].
Для продленной терапии эдоксабан может применяться в дозе 60 мг 1 раз в сутки с возможностью ее снижения до 30 мг 1 раз в сутки у отдельных групп пациентов (Таблица 12). В исследовании Hokusai VTE у пациентов с ТГВ и/или ТЭЛА (n=8292) эдоксабан продемонстрировал «не меньшую эффективность» по сравнению с варфарином** в качестве препарата для профилактики рецидивов венозных тромбоэмболических осложнений при значимо меньшей частоте больших и клинически значимых кровотечений на 55% [339].
Следует иметь в виду, что пациентов с высоким риском кровотечения и рецидива ВТЭО не включали в исследования продленной антикоагулянтной терапии.
Для продленной терапии оральный ингибитор тромбина дабигатрана этексилат** (АТХ группа: ингибиторы тромбина прямые, B01AE07) применяется в полной лечебной дозировке 150 мг 2 раза в сутки с возможностью ее снижения до 110 мг 2 раза в сутки у отдельных подгрупп пациентов (Таблица 12). Исследования RE-MEDY и RE-SONATE показали, что дабигатрана этексилат** обладает не меньшей эффективностью в сравнении с АВК, но характеризуется улучшенным профилем безопасности, снижая риск развития комбинации больших кровотечений и НКЗК на 46% [381]. В сравнении с плацебо дабигатрана этексилат** снизил риск рецидива ВТЭО на 92% без увеличения угрозы развития больших кровотечений.
3.2.6.7. Антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA)
- При выборе лекарственных препаратов для продленной антикоагулянтной терапии рекомендуется отдавать предпочтение прямым оральным антикоагулянтам (B01A: Антитромботические средства дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07 апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03), а не антагонистам витамина К [84, 85, 320].
УДД 1 УУР В
Комментарий: при продленной терапии применяют стандартные дозировки АВК с достижением целевого диапазона МНО 2,0-3,0. Следует особо отметить, что заведомое снижение целевого диапазона не рекомендуется, т.к. подобный подход не влияет на риск развития больших кровотечений, но существенным образом уменьшает эффективность вторичной профилактики ВТЭО (Таблица 14) [320].
3.2.6.8. Салициловая кислота и ее производные (АТХ группа: антиагреганты, кроме гепарина, B01AC)
- Препараты ацетилсалициловой кислоты** (АТХ группа: антиагреганты, кроме гепарина, B01AC) не рекомендуются в качестве средств для продленной антитромботической терапии у пациентов с ВТЭО [314, 315, 317, 318, 320].
УДД 1 УУР В
Комментарий: еще с 1980-х годов #ацетилсалициловая кислота** рассматривали, как альтернативный препарат для вторичной профилактики ВТЭО благодаря низкой стоимости, благоприятному профилю побочных эффектов, удобной дозировке и относительно низкому риску кровотечения. Эта возможность была изучена в исследовании WARFASA. Всего 402 пациента с первым неспровоцированным эпизодом ВТЭО, завершившие терапию антитромботическими средствами, через 6-18 месяцев, были рандомизированы на группы для приема #ацетилсалициловой кислоты** 100 мг однократно в сутки или плацебо с периодом наблюдения в течение двух лет. Рецидивы ВТЭО отмечали реже в группе #ацетилсалициловой кислоты** (6,6% против 11,2%; ОР, 0,58; 95% ДИ, 0,36-0,93). В каждой группе у одного пациента развилось большое кровотечение [315]. В другое исследование ASPIRE, оценившее влияние #ацетилсалициловой кислоты** на риск рецидива ВТЭО, было включено 822 пациента с первым неспровоцированным тромботическим эпизодом, которые завершили курс антикоагулянтной терапии и были рандомизированы на группы для приема #ацетилсалициловой кислоты** в дозе 100 мг или плацебо 1 раз в сутки с последующим наблюдением до 4 лет. У пациентов в группе #ацетилсалициловой кислоты** частота рецидива ВТЭО составила 4,8% в год, тогда как в группе плацебо – 6,5% (ОР, 0,74; 95% ДИ, 0,52-1,05). Таким образом, применение #ацетилсалициловой кислоты** в сравнении с плацебо не уменьшило вероятность повторного венозного тромбоза, но снизило шанс возникновения больших сердечно-сосудистых осложнений (ВТЭО, инфаркт миокарда, инсульт и смерть от сердечно-сосудистых осложнений) на 34% без влияния на опасность больших кровотечений [317]. Данные исследований WARFASA и ASPIRE были объединены в самостоятельный анализ INSPIRE, который показал, что #АСК** снижает риск рецидива ВТЭО на 32% (5,1% против 7,5%; ОР, 0,68; 95% ДИ, 0,51-0,90) и риск больших сердечно-сосудистых осложнений на 34% (5,7% против 8,7%; ОР, 0,66; 95% ДИ, 0,50-0,86) без увеличения угрозы больших кровотечений [318]. Между тем, в рамках исследования EINSTEIN Choice обе дозы ривароксабана** (20 мг и 10 мг) продемонстрировали эквивалентную безопасность по частоте развития больших кровотечений и НКЗК, но существенное преимущество по эффективности в сравнении со 100 мг #ацетилсалициловой кислоты** [314]. Т.о., при вторичной профилактике ВТЭО преимущество #ацетилсалициловой кислоты** в виде относительно невысокого числа больших кровотечений продемонстрировано не было. Поэтому рутинное применение препарата следует признать нецелесообразным в связи с наличием более эффективной альтернативы.
3.2.6.9. Сулодексид (АТХ группа: группа гепарина, B01AB11)
- У пациентов с высоким риском геморрагических осложнений и сохраняющимся риском рецидива ВТЭО или отказе от продолжения применения ПОАК (B01A: Антитромботические средства) для продленной антикоагулянтной терапии рекомендуется применение сулодексида [321, 382, 388].
УДД 2 УУР А
Комментарий: сулодексид является альтернативным средством продленной терапии и вторичной профилактики ВТЭО. Он представляет собой природный гликозаминогликан с антитромботическими и профибринолитическими свойствами, в меньшей степени воздействующий на систему гемостаза, что определяет минимальный риск геморрагических осложнений. Антитромботический эффект сулодексида связан с эндотелиопротективным действием. Эффективность и безопасность препарата для вторичной профилактики ВТЭО изучена в исследовании SURVET, включившего 615 пациентов с неспровоцированным ТГВ, получавших терапию антитромботическими средствами в течение 3-12 месяцев. Пациентов рандомизировали в группы для получения сулодексида по 500 ЛЕ дважды в день или плацебо в течение 2 лет. Рецидив ВТЭО развился у 15 из 307 пациентов, получавших сулодексид (4,9%, 95% ДИ, 2,9-8,1), и у 30 из 308 пациентов, получавших плацебо (9,7%, 95% ДИ 6,8–13,7), что соответствует снижению риска на 51% (ОР, 0,49; 95% ДИ, 0,27-0,92). При этом больших кровотечений не было ни в одной из групп. Следует отметить, что только у 8% пациентов в этом исследовании имелась ТЭЛА [382]. В рамках мета-анализа были оценены данные по сулодексиду для вторичной профилактики ВТЭО, учитывая исследование SURVET и три других работы, в которых суммарно включили 1461 пациента. Было установлено, что сулодексид снижает риск рецидива ВТЭО на 49% (ОР, 0,51; 95% ДИ, 0,35-0,74) и риск тромбоза поверхностных вен на 59% (ОР, 0,41; 95% ДИ, 0,22-0,76). Общая частота кровотечений в группе сулодексида составила 0,28%, в контрольной группе – 1,60% [321]. По результатам другого сетевого мета-анализа (18 РКИ и 7 наблюдательных исследований) было установлено, что пролонгированная терапия сулодексидом существенно снижает риск большого кровотечения в сравнении с применением #ацетилсалициловой кислоты**. Также сулодексид является наиболее безопасным препаратом в отношении риска развития клинически значимого кровотечения, по сравнению с АСК**, ПОАК (B01A: Антитромботические средства) и АВК. Более того, применение сулодексида ассоциируется с минимальным риском смерти от любой причины и смерти от ВТЭО, ТЭЛА, инфаркта миокарда и ОНМК. Было установлено, что сулодексид более эффективен в отношении риска развития рецидива ТГВ и ТЭЛА по сравнению с #ацетилсалициловой кислотой**. Использование ПОАК (B01A: Антитромботические средства) является эффективным в плане снижения рецидива ВТЭО, тем не менее, терапия сулодексидом показала сопоставимые данные с АВК в отношении первичных и вторичных исходов [388]. Представляет интерес тот факт, что сулодексид не увеличивает риск кровотечения, уменьшает смертность, а по частоте развития побочных эффектов сопоставим с плацебо. На сегодняшний день применение сулодексида в рамках продленной терапии ВТЭО изучено для дозы 500 ЛЕ (2 таб. по 250 ЛЕ) 2 раза в сутки, которую следует использовать по названным показаниям не ранее, чем через 3 месяца терапии антитромботическими средствами.
3.3. Хирургические и эндоваскулярные вмешательства при ТГВ – общие положения
Целями хирургических и эндоваскулярных вмешательств при ТГВ являются профилактика тромбоэмболии легочных артерий и/или профилактика развития посттромботической болезни (ПТБ) тяжелой степени [1, 389, 390]. Хирургические и эндоваскулярные вмешательства являются дополнением к антикоагулянтной терапии. При рассмотрении методов хирургического лечения ТГВ необходимо учитывать механизм тромбообразования: восходящий из глубоких вен голени с проксимальным распространением, и нисходящий, который на фоне экстра- или интравазальной компрессии нижней полой или подвздошных вен носит противоположный по направлению характер с вторичным вовлечением более дистальных вен [1, 389, 390].
Хирургические методы должны применяться в условиях стационара с палатой интенсивной терапии, врачами-сердечно-сосудистыми хирургами или врачами по рентгенэндоваскулярной диагностике.
3.3.1. Инструментальные методы диагностики перед хирургическим лечением ТГВ
- Пациентам с тромбозом глубоких вен перед хирургическим лечением рекомендуется дополнительно выполнить дуплексное или триплексное сканирование нижней полой вены ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное))) или КТ-флебографию (компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.053) или МР-флебографию (магнитно-резонансная венография (одна область) (A05.12.005)) для определения уровня и характера проксимальной границы тромба [391–394].
УУР 1 УУД В
Комментарий: по сравнению с МСКТ-флебографией (A06.12.053), ультразвуковое сканирование имеет среднюю чувствительность и специфичность 97% и 94% со средними положительными и отрицательными прогностическими значениями 97% и 98% для симптоматического проксимального ТГВ [391]. К сожалению, при ультразвуковом осмотре адекватная визуализация подвздошных вен снижена у тучных пациентов и у неподготовленных больных из-за пневматизации кишечника. Проксимальную границу тромба при поражении подвздошных вен удается выявить лишь в 23% случаев [392]. Объединенный анализ 13 исследований, сравнивающих МСКТ с УЗИ или венографией, показал общую чувствительность и специфичность 95,9% и 95,2% для выявления ТГВ соответственно [394]. МР-флебография (A06.12.053) также продемонстрировала свою точность при диагностике ТГВ. Мета-анализ 14 исследований с использованием различных методов МРТ (магнитно-резонансная венография (A05.12.005)) по сравнению с венографией или ультразвуковой визуализацией продемонстрировал чувствительность и специфичность 95,7% и 92,9% соответственно [393].
3.3.2. Профилактика ТЭЛА во время хирургического или эндоваскулярного лечения ТГВ
- Рутинная установка кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) или баллонная окклюзия нижней полой вены (эндоваскулярная окклюзия сосуда с помощью баллона (A16.12.041.003)) перед эндоваскулярным лечением ТГВ пациентов с тромбозом глубоких вен дистальнее нижней полой вены не рекомендуется [267, 395–400].
УДД 1 УУР А
Комментарий: по данным систематического обзора, включившего 19 РКИ, 1943 пациентов с острым проксимальным ТГВ, объединенные результаты катетерного тромболизиса (КТЛ) (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и фармакомеханической тромбэктомии (ФМТ) (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) не продемонстрировали увеличение частоты ТЭЛА (ОР 1,01; 95% ДИ, 0,33-3,05) и летального исхода (ОР 0,76; 95% ДИ, 0,31-1,89) [267]. Частота ТЭЛА во время катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011)) не превышает таковую при стандартной антикоагулянтной терапии [395, 397, 398, 400, 401]. В двух исследованиях, сравнивающих результаты лечения 103 пациентов, которым выполняли только КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), и 69 пациентов, у которых КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) дополняли другими методами дезобструкции, не было выявлено никаких симптомов ТЭЛА [396, 402]. Среди 473 пациентов, включенных в Национальный венозный регистр США, у пациентов без имплантации кава фильтра, ТЭЛА возникла только у 1%. Примечательно, что 71% процедур КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) выполнялось при распространении тромба на подвздошно-бедренный сегмент, а 15% – на НПВ [403]. Эти риски аналогичны рискам, наблюдаемым у пациентов, получающих обычную антикоагулянтную терапию, и не требует рутинной установки фильтра НПВ.
- Рекомендуется рассмотрение целесообразности установки кава-фильтра временного/постоянного*** (установка венозного фильтра (A16.12.027)) или проведения баллонной окклюзии (эндоваскулярная окклюзия сосуда с помощью баллона (A16.12.041.003)) нижней полой вены у пациентов со сниженным кардиопульмонарным резервом перед эндоваскулярным или хирургическим лечением ТГВ [402, 404–407].
УДД 4 УУР С
Комментарий: пациенты с тромбом в НПВ, подвергающиеся КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) часто считаются подверженными более высокому риску ТЭЛА и требуют рассмотрения возможности установки кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) [402, 404–406] К сожалению, имеется мало достоверных данных, подтверждающих или опровергающих эту гипотезу. В одном исследовании среди 68 пациентов, перенесших различные фармакологические (40%), механические (17%) и фармакомеханические процедуры не было симптоматической перипроцедурной ТЭЛА, несмотря на то, что только у 20% из них был установлен кава-фильтр*** [402]. При этом нельзя исключить напрасное установление кава-фильтров*** даже если учитывать, что 30% пациентов имели распространение ТГВ на НПВ. В другой небольшой серии, состоящей из 85 пациентов, сообщалось о наличии бессимптомных эмболов, попавших в фильтр НПВ, на фоне проведенного КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) или ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) с вовлечением НПВ и без него. Однако также очевидно, что симптоматическая ТЭЛА может редко, но существенно осложнять эти процедуры, омрачая результаты общей выборки [407]. Учитывая, что имеется мало достоверных данных о риске ТЭЛА при использовании относительно новых катетерных методов венозной дезобструкции, представляется разумным считать этот вопрос нерешенным и, по крайней мере, рассмотреть относительную баланс пользы и риска в ситуациях потенциально высокого риска.
3.4. Хирургическая и эндоваскулярная дезобструкция венозного русла
3.4.1. Цель дезобструкции глубоких вен
- Основной целью дезобструкции венозного русла при ТГВ рекомендуется считать предупреждение развития тяжелых форм ПТБ [84, 85, 390, 408–410].
УДД 1 УУР В
Комментарий: дезобструкцию при проксимальных ТГВ применяют в рамках стратегии раннего удаления тромба, которая была разработана и внедрена в начале XXI века [85, 390, 408]. Ее целью служит профилактика тяжелых форм ПТБ. В последние 10-15 лет ведущие специализированные хирургические сообщества рекомендовали раннее удаление тромба, при этом уровни доказательности в зависимости были различными. В настоящий момент отношение к этому подходу сдержано и максимально индивидуализировано [85]. Необходимым условием для дезобструкции является соответствующая техническая и методологическая база медицинского учреждения: наличие рентген-операционной с возможностью выполнения флебографического контроля на всех этапах вмешательств, использование внутрисосудистого ультразвукового исследования (внутрисосудистое ультразвуковое исследование сосудистой стенки A04.12.004)) при необходимости; наличие опытных врачей по рентгенэндоваскулярной диагностике, специальной аппаратуры и расходного материала, позволяющих эффективно и безопасно выполнять как саму процедуру дезобструкции глубоких вен, так и устранять остаточные стенозы магистральных вен с помощью ангиопластики и венозного стентирования (установка стента в сосуд (A16.12.028)), необходимость в проведении которых возникает у 17-80% больных [84,85,390,408,409].
3.4.2. Показания к дезобструкции венозного русла
- Пациентам с подвздошно-бедренным ТГВ и давностью симптомов до 28 дней (в зависимости от метода пособия) рекомендуется выполнение ранней хирургической дезобструкции с целью снижения риска развития ПТБ в отдаленном периоде [85, 267–269, 274, 331, 397–401].
УДД 1 УУР А
Комментарий: несмотря на очевидные преимущества ранней дезобструкции при илиофеморальном ТГВ, одним из ключевых факторов, ограничивающих более широкое ее применение, служит достаточно высокая частота больших кровотечений. По данным мета-анализа 4 РКИ (TORPEDO, CaVenT, ATTRACT, CAVA) высок кумулятивный риск больших кровотечений (ОР 5,68, 95% ДИ, 1,27-25,33; p = 0,02) [85]. С другой стороны, имеются данные об эффективности в отношении предотвращения средних и тяжелых форм ПТБ (ОР 0,59, 95% ДИ, 0,44-0,80; p <0,001). Поэтому дезобструкцию оптимально предлагать пациентам с высоким риском развития ПТБ (протяженное тромботическое поражение, локализация проксимальной части тромба), с высокими шансами на успех, ранними сроками заболевания (до 28 суток с момента начала тромбообразования), при низком риске кровотечений [269].
- При наличии технических условий, квалифицированного персонала, владеющего соответствующими методами у пациентов с синей флегмазией, с развитием ишемических расстройств в нижней конечности рекомендуется рассмотреть методы хирургической дезобструкции [267, 274, 331, 397–401, 411, 412].
УДД 1 УУР А
Комментарий: распространенный тромбоз с практически полной обструкцией венозного кровотока, который получил название синяя флегмазия, сопровождается массивным отеком, цианозом кожных покровов, интенсивным болевым синдромом. В наиболее тяжелых случаях синей флегмазии при тромбозе всех коллатеральных путей оттока и сосудов микроциркуляторного русла развивается гангрена нижней конечности.
- Пациентам с бедренно-подколенным тромбозом и дистальным тромбозом глубоких вен хирургическая или эндоваскулярная дезобструкция не рекомендуется [275, 331].
УДД 2 УУР В
Комментарий: в дополнительном анализе подгруппы РКИ ATTRACT, которая включила 300 пациентов с бедренно-подколенным ТГВ в период от 6 до 24 месяцев между группами ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) и без ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) не было различий по частоте развития и тяжести проявлений ПТБ (шкала Виллальта (Villalta) (Приложение Г12) ≥5: ОР = 0,97; 95% ДИ, 0,75-1,24); по частоте развития среднетяжелой ПТБ (шкала Виллальта ≥10: ОР = 0,93; 95% ДИ 0,57-1,52; по частоте развития тяжелых форм ПТБ; согласно неспецифическим и веноспецифическим опросникам качества жизни (p >0,5 для всех сравнений). Так же через 10 дней и через 30 дней не было разницы в уменьшении боли или отека в ногах между группами лечения. В период до 10 дней лечения большое кровотечение произошло у трех пациентов в группе ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001), в группе антикоагулянтной терапии таковых не было (p = 0,06). В этот же период любое кровотечение произошло в восьми случаях против двух в группе без ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) (p = 0,032). По частоте рецидива ВТЭО межгрупповых различий не получено (p = 0,24) [275].
В дополнительном анализе качества жизни по общей выборке исследования ATTRACT у пациентов с ТГВ бедренно-подколенного сегмента показатели изменений качества жизни по сравнению с исходным уровнем по всем опросникам были одинаковыми в группах c ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) и без ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) [331].
3.4.3. Стратегия раннего удаления тромба
- В качестве первой линии хирургического лечения пациентов с ТВГ рекомендовано применять эндоваскулярные катетерные вмешательства, такие как катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), фармакомеханическая или механическая тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) [85, 411, 413, 414].
УДД 1 УУР В
Комментарий: по результатам мета-анализа, включающего 4 РКИ (TORPEDO, CaVenT, ATTRACT, CAVA) эффективность стратегии раннего удаления тромба методами чрескожного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и фармакомеханической тромбэктомией (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) очевидна, что подтверждается снижением относительного риска развития тяжелых форм ПТБ (ОР 0,59, 95% ДИ, 0,44- 0,80; p <0,001), так же из-за широкого доверительного интервала показана лишь тенденция снижения частоты любой ПТБ (ОР 0,67, 95% ДИ, 0,45-1,0; p = 0,005). Риск больших кровотечений так же увеличивается в группе тромболитической терапии (ОР 5,68, 95% ДИ, 1,27-25,33; p = 0,02) [85].
- В качестве второй линии хирургического лечения пациентов с ТВГ рекомендовано применять открытые хирургические вмешательства [411].
УДД 1 УУР B
Комментарий: по данным систематического обзора открытая хирургическая тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)) в сравнении с терапией антикоагулянтами (B01A: Антитромботические средства) ассоциируется со снижением риска ПТБ на 33% (ОР, 0,67;4 95% ДИ, 0,52-0,87), снижением риска формирования рефлюкса по глубоким венам на 32% (ОР, 0,68; 95% ДИ, 0,46-0,99) и тенденцией к уменьшению риска сохранения резидуальной венозной обструкции (ОР, 0,844; 95% ДИ, 0,60-1,19) [411]. Качественные исследования, касающиеся эффективности и безопасности открытой хирургии у больных с ТГВ весьма ограничены по объему. В шведском РКИ сравнивались результаты лечения 13 пациентов, которым выполнена открытая тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)), с последующим назначением антикоагулянтных препаратов (B01A: Антитромботические средства) и 17 пациентов с острым подвздошно-бедренным ТГВ, которые в качестве лечения использовали только АКТ. Проходимость вен через 10 лет была значительно лучше в хирургической группе по сравнению с консервативной (83% против 41% соответственно). Кроме того, в группе пациентов, перенесших оперативное пособие, наблюдалось уменьшение отека нижних конечностей (71% против 46%) и частоты развития трофических язв (18% против 8%) С целью предупреждения ретромбоза – объем оперативного вмешательства включал формирование артериовенозной фистулы [413]. Имеется всего одно небольшое прямое сравнительное исследование открытых хирургических вмешательств и чрескожных манипуляций, в котором продемонстрирована сопоставимая эффективность хирургической тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) с тромболизисом (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), при том, что стентирование (установка стента в сосуд (A16.12.028)) выполнялось во всех случаях. Через два года у 85% пациентов в группе хирургической тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) и у 87% больных в группе тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) не развилась ПТБ [414].
- У пациентов с тромбозом подвздошного сегмента при наличии противопоказаний к тромболитической терапии рекомендуется выполнение механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) или открытой хирургической тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) [413, 415–422]
УДД 2 УУР В
Комментарий: доказательства эффективности катетерной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) в отношении илиофеморального ТГВ ограничены по качеству. В мета-анализе, в который включены 16 ретроспективных исследований, в общей сложности сообщается о результатах лечения проксимального ТГВ у 481 пациента. Применяли различные тромболитические препараты (АТХ группа: ферментные препараты, В01AD), дозировки и устройства. Восстановление 82-100% просвета вены (степень II или III) произошло у 83-100% пациентов. Все различные устройства оказались безопасными, не было зарегистрировано случаев смерти или инсультов, связанных с процедурами. Частота симптоматической ТЭЛА была <1%. О кровотечениях сообщалось в 6 из 16 исследований, гемотрансфузия (A18.05.012) потребовалась 4-14% пациентов [415]. По данным другого мета-анализа, применение механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) в сравнении с КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) ассоциировалось со значительным снижением риска геморрагических осложнений параллельно с улучшенным сохранением проходимости вен через 6 мес. наблюдения [422]. Несмотря на свою травматичность, открытая тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)) восстанавливает проходимость вен и, возможно, снижает частоту развития ПТБ в сравнении с АКТ. Данное вмешательство применимо у тщательно отобранных пациентов с илиофеморальным и илиокавальным ТГВ [413, 416–421].
- У пациентов с тромбозом илиокавального сегмента при невозможности проведения эндоваскулярных методов дезобструкции рекомендуется рассмотреть целесообразность открытой хирургической тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) [411, 413, 416–421].
УДД 1 УУР В
- Пациентам с тромбозом глубоких вен для оценки эффективности технического результата хирургического лечения ТГВ рекомендуется рассмотреть целесообразность использования шкал оценки тромботической нагрузки (Приложения Г13-Г17) [403, 423].
УДД 4 УУР С
Комментарий: изменение тромботической нагрузки в результате хирургического лечения острого тромбоза глубоких вен позволяет объективизировать результаты.
Система оценки Marder: субстрат оценки – флебография (флебография нижней полой вены (A06.12.021), анализ 7 анатомических сегментов, максимальный счет 40 баллов, сокращенная версия 28 баллов. Оценка объема тромбоза базируется на отношении площади проекции тени тромба к площади венозного сегмента, баллы в сегменте от 4 до 10. Недостатки: субъективности оценки площади проекций, отсутствие оценки нижней полой вены (НПВ), объединение подвздошных вен в один сегмент, отсутствие глубокой бедренной вены (ГБВ), мышечных и берцовых вен голени. Приложение Г13.
Система оценки Arnesen H, субстрат оценки – флебография (флебографии нижней полой вены (A06.12.021)), анализ 7 анатомических сегментов, максимальный счет 30 баллов. Оценка одно сегмента по длине тромба, степени стеноза или окклюзии. В сегменте возможно от 0 до 3х баллов. Недостатки: отсутствие оценки НПВ, ГБВ, мышечных и берцовых вен, объединение подвздошных вен в один сегмент, субъективность оценки длины тромба. Приложение Г14.
Система счета тромботической нагрузки группы специалистов из нескольких научных сообществ под председательством John M. Porter «Scoring system of a subcommittee of venous disease». Субстрат оценки – флебография, анализ 17 сегментов, объединенных в 6 анатомических областей глубоких вен и 2 сегмента поверхностных вен. Оценка венозного сегмента основана на двух переменных – длина тромба и степень стеноза или окклюзия. Максимальный счет в полной версии 24 балла, сокращенной 18. Недостатки: объединение подвздошных вен, бедренных вен, вен голени, субъективность оценки длины тромба. Приложение Г15.
Система Björgell О., субстрат оценки – флебография, рекомендована авторами для оценки УЗИ, ВСУЗИ, МРТ (магнитно-резонансная венография (A05.12.005)) или КТ. Максимальный счет 42 балла. Включает оценку 14 венозных сегментов глубоких вен. Оценка сегмента базируется только на длине тромба по отношению к длине сегмента от 0 до 3х баллов. Парная или двойная вена оценивается как один сегмент. Разработан коэффициент перевода баллов из шкалы Marder. Недостаток: не учитываются поверхностные вены, наличие полной окклюзии, субъективность оценки длины тромба. Приложение Г16.
Система Protack C., субстрат оценки – флебография (флебография нижней полой вены (A06.12.021). Максимальный счет 14 баллов. Оценка сегмента по 3-х бальной шкале - полное открытие вены, частичное открытие вены, полная окклюзия. Недостатки: не оценивается ГБВ, вены дистальнее подколенной вены. Приложение Г17.
Наиболее полная по охвату венозных сегментов является система Björgell О., наиболее легкая в воспроизведении оценки тромботического распространения в одном анатомическом сегменте является Система Protack C, которую легко воспроизводить в рутинной хирургической практике.
3.4.4. Способы эндоваскулярной дезобструкции венозного русла
- У пациентов с ТГВ при наличии показаний к эндоваскулярной дезобструкции рекомендуется использовать следующие методики: катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), фармакомеханическая (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) или механическая катетерная тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) [85, 413, 414].
УДД 2 УРР В
Комментарий: КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) проводят, установив катетер с множественными отверстиями для высвобождения тромболитического препарата непосредственно в тромб [85, 269, 390, 408, 409, 424]. Доступ может быть осуществлен как прямым способом, так и под контролем УЗИ через подколенную или берцовые вены. Внутритромботическое введение лекарственного препарата может осуществляться как постоянной инфузией, так и пульсирующим способом («спрей»-методика). В качестве тромболитических препаратов используют тканевой активатор плазминогена, #алтеплаза** (АТХ группа: ферментные препараты, B01AD02) Доза #алтеплазы** (АТХ группа: ферментные препараты, B01AD02) составляет 1-2 мг/ч, но не должна превышать 2 мг /ч. [407, 428, 441]. Препарат разводится на 100 мл 0,9% раствора натрия хлорида** (АТХ группа: солевые растворы, B05CB), а скорость введения составляет 100 мл в час. Общая длительность КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) варьирует от 24-72 часов, в зависимости от объема тромботического поражения, скорости лизиса. Флебографию повторяют каждые 12 часов, меняя позицию катетера по мере лизиса тромбов. Контрольное исследование по окончании КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) осуществляют для оценки результата и выявления остаточных стенозов магистральных вен, с проведением их ангиопластики и стентирования при необходимости [85, 390, 408, 409].
Усиленный ультразвуком катетерный тромболизис основан на комбинации ультразвукового мини-трансдьюсера (27750 катетер к системе для ультразвукового разрушения тромбов, для периферических артерий) с инфузионным катетером для тромболизиса [85, 390, 425]. При этом ультразвуковые волны, генерируемые вовремя тромболизиса увеличивают площадь соприкосновения литического агента с фибрином и ускоряют процесс тромболизиса. По результатам отдельных исследований преимущества ультразвукового усиления при катетрном тромболизисе неочевидны, так как результаты сопоставимы с обычным КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [425].
В основе фармакомеханической тромбэктомии (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) заложена комбинация механического разрушения тромба и введение локально литического агента в зону воздействия. При реолитической фармакомеханической тромбэктомии (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) механическое воздействие осуществляется по принципу Бернулли (за счет высокой скорости поступления раствора в катетер создается зона низкого давления и вакуума) с последующей эвакуацией тромбов и введением тромболитического препарата. Процедура занимает значительно меньше времени, чем КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и сопровождается применением меньших дозировок тромболитических препаратов. По мнению многих авторов именно за ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) будущее [85, 390, 409, 426].
Общим принципом чрескожной катетерной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) является применение устройств (153950 система для эмболэктомии/тромбэктомии), использующих только механические способы разрушения с или без экстракции тромба и без применения тромболитических препаратов (АТХ группа: ферментные препараты, B01AD02). Предложено достаточно большое количество устройств, которые находятся на разной стадии внедрения в практику. Исследования, изучавшие механические методы ограничены по качеству, но демонстрируют убедительные результаты [415].
3.4.5. Особенности различных методов эндоваскулярной дезобструкции венозного русла
3.4.5.1. Фармакологический тромболизис
- У пациентов с ТГВ не рекомендуется выполнять системный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) [267, 427, 428].
УДД 1 УУР А
Комментарий: системный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) при остром ТГВ рутинно не применяется вследствие низкой эффективности и высокой вероятности больших кровотечений. Объединенный анализ шести рандомизированных сравнительных исследований показал, что системное введение стрептокиназы в бинарной системе оценки (лучше/не лучше) в 3,7 раза эффективнее гепарина натрия** при увеличении вероятности большого кровотечения в 2,9 раза [427]. Количественный анализ тромболитических исходов при лечении подвздошно-бедренного тромбоза методом системного введения тканевого активатора плазминогена, #алтеплаза** (АТХ группа: ферментные препараты, B01AD02) (доза #алтеплазы** (АТХ группа: ферментные препараты, B01AD02) составляет 1-2 мг/ч, но не должна превышать 2 мг/ч. [407, 428, 441]. Препарат разводится на 100 мл 0,9% раствора натрия хлорида** (АТХ группа: солевые растворы, B05CB), а скорость введения составляет 100 мл в час) продемонстрировал полный тромболизис всего у 8,9% и отсутствие эффективности у 33,8% пациентов [428].
- У пациентов с ТГВ не рекомендуется выполнять регионарный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) [267, 427–429].
УДД 1 УУР А
Комментарий: под этим видом подразумевается введение тромболитического препарата (АТХ группа: ферментные препараты, B01AD02) в свободный от тромбоза венозный сегмент, без установки катетера в тромботические массы. Данные хорошего качества по регионарному тромболизису (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) существенно ограничены. Результаты Кокрейновского обзора свидетельствуют, что регионарный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) в сравнении с антикоагулянтной терапией улучшает реканализацию вены (ОР 10; 95% ДИ, 1,33-75,23), по результатам двух исследований регионарный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) не увеличивает риск кровотечений (ОР 4; 95% ДИ, 0,46-34,75). В сроках 6-60 месяцев регионарный тромболизис (внутривенное введение лекарственных препаратов для тромболитической терапии (A11.12.003.002) не изменяет риск развития ПТБ (ОР 0,65; 95% ДИ, 0,4-1,04), не изменяет относительный риск развития трофических язва (ОР 1; 95% ДИ, 0,07-15) [429].
- Катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется выполнять при отсутствии противопоказаний отобранным пациентам соответствующим следующим критериям: вовлечение подвздошного сегмента, продолжительность симптомов ТГВ не более 21 дня, физическая активность пациента с приемлемой прогнозируемой продолжительностью жизни [398, 411, 429].
УДД 1 УУР В
Комментарий: в РКИ CaVenT рандомизированы 209 пациентов с впервые возникшим илиофеморальном ТГВ и длительностью симптомов 21 день. Продемонстрировано существенно меньшая частота развития ПТБ в группе, где применен катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) в сравнении со стандартной антикоагулянтной терапией в сроке наблюдения 24 месяца (ОР 41,1%; 95% ДИ, 31,5-51,4; и 55·6%; 95% ДИ, 45,7-65,0, p = 0,047 соответственно). Полное открытие просвета илиофеморального сегмента глубоких вен через 6 месяцев зафиксировано у 65,9% пациентов в группе, где использовали катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) в сравнении 47,4% группы контроля (p = 0,012). В общей сложности катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) осложнился кровотечениями у 20 больных, из которых 3 больших кровотечения (гематома передней брюшной стенки, кровотечение в глубокий компартмент голени, и гематома в месте паховой пункции) и 4 клинически значимых кровотечения. При этом риск ТЭЛА, инсульта и интракраниального кровотечения не увеличивался [398].
По результатам систематического обзора ранние результаты КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) превосходят стандартную АКТ в сроке до 1 месяца по критерию «любое уменьшение тромботической нагрузки» (ОР 35,05; 95% ДИ, 2,28-539,63), не превосходят по критерию «полное растворение тромба» (ОР 21,79; 95% ДИ, 1,38-343,26), уступают по критерию «риск кровотечений» (малые кровотечения), в основном за счет кровотечения места пункции (ОР 7,69 95% ДИ, 0,4-146,9), сопоставимы по риску развития ТЭЛА (ОР 0,32; 95% ДИ, 0,01-7,26); среднесрочные результаты (6-60 месяцев) сопоставимы по риску формирования ПТБ (ОР 0,74; 95% ДИ, 0,55-1), превосходят по полному открытию просвета вены (ОР 2,52; 95% ДИ, 0,52-12,17), превосходят по критерию «отсутствие рефлюкса» (ОР 2,98; 95% ДИ, 1,75-5,08), эквивалентны по риску рецидива ВТЭО (ОР 0,61; 95% ДИ, 0,3-1,25); поздние результаты (более 60 месяцев) превосходят по риску наступления ПТБ (ОР 0,6; 95% ДИ, 0,45-0,79), эквивалентны по критерию «полное открытие просвета вены» (ОР 1,11; 95% ДИ, 0,94-1,33), эквивалентны по риску развития ВТЭО (ОР 0,63; 95% ДИ, 0,34-1,18), сопоставимы по летальности (ОР 0,36; 95% ДИ, 0,1-1,3) [429].
Результаты другого систематического обзора свидетельствуют, что КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) по сравнению со стандартной АКТ снижает риск развития ПТБ (ОР 0,19; 95% ДИ, 0,07-0,48), формирования венозного рефлюкса (ОР 0,21; 95% ДИ, 0,09-0,53) и венозной обструкции (ОР 0,35; 95% ДИ, 0,17-0,34) [411].
- Перед КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется рассмотреть возможность выполнения следующих лабораторных тестов: общий анализ крови (общий (клинический) анализ крови развернутый (B03.016.003)), исследование уровня креатинина в крови (A09.05.020), АЧТВ (коагулограмма (ориентировочное исследование системы гемостаза) (B03.005.006), антитромбин III (определение активности антитромбина III в крови A09.05.047), фибриноген (исследование уровня фибриногена в крови (A09.05.050)), провести тест на беременность (исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови (A09.05.090)) [204, 398, 400, 430–434].
УДД 5 УУР С
Наиболее опасным осложнением катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) является внутричерепное кровотечение или кровотечение, требующее хирургического вмешательства, прекращения терапии или переливания крови. Частота больших кровотечений при КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) колеблется от 2,2% до 3,3% и зависит от соответствия с показаниями и противопоказаниями к проведению тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [398, 400, 431].
Абсолютные противопоказания к КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) включают: активное внутреннее кровотечение или ДВС-синдром, цереброваскулярные события, включая транзиторные ишемические атаки, нейрохирургические вмешательства (интракраниальные, спинальные) или травма головы в течение последних 3 месяцев, известные внутричерепные опухоли, аневризмы и/или сосудистые мальформации противопоказания к антикоагулянтной терапии.
Относительные противопоказания включают: сердечно-легочная реанимация, большая операция, родоразрешение, большая травма, биопсия органа, операции на глазах в течение последних 10 дней, неконтролируемая гипертензия (систолическое давление >180 мм рт. ст., диастолическое >110 мм рт. ст.), большое желудочно-кишечное кровотечение в течение последних 3 месяцев, известная, тяжелая аллергия на контрастные средства, антикоагулянт (B01A: Антитромботические средства) или тромболитический препарат (B01AD: Ферментные препараты), тяжелая тромбоцитопения, известный право-левый сердечный шунт или тромб левых отделов сердца, подозрение на инфицированный венозный тромб, средней тяжести или тяжелая почечная недостаточность, беременность или лактация, тяжелые нарушения функции печени, бактериальный эндокардит, диабетическая ретинопатия, геморрагический диатез [398, 430, 433, 434].
- Во время катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется динамический контроль уровня гемоглобина, тромбоцитов (общий (клинический) анализ крови развернутый (B03.016.003) исследование уровня тромбоцитов в крови (A12.05.120)) и концентрации фибриногена (исследование уровня фибриногена в крови (A09.05.050)), не реже 1 раза в 24 часа [430, 432].
УДД 5 УУР С
Комментарий: лабораторный контроль необходим для динамической оценки риска кровотечения. При снижении уровня фибриногена менее 1,5 г/л рекомендуется уменьшение скорости введения тромболитического препарата (АТХ группа: ферментные препараты, В01AD) в 2 раза, при снижении уровня фибриногена менее 1 г/л рекомендуется прекращение тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [430].
- Непрерывно проводить катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется не более 96 часов [398, 404, 435].
УДД 1 УУР А
Комментарий: по результаты систематического обзора средняя продолжительность проведения катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) составляет 53,4 часа. Увеличение продолжительности манипуляции приводит к повышению частоты кровотечений [398, 404, 435].
- При выполнении катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) пункционный доступ в целевые вены рекомендуется выполнять под УЗИ контролем [397, 436].
УДД 2 УУР А
- Для проведения катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется применять фармакологические препараты из группы тромболитических препаратов (АТХ группа: ферментные препараты, В01AD) [398, 431, 437–443].
УДД 2 УУР В
Комментарий: в одном сравнительном исследовании, где применялись тканевые активаторы плазминогена, #алтеплаза** (АТХ группа: ферментные препараты, B01AD02) в дозировке 1 мг/час в лечении ТГВ 24 конечностей, было продемонстрировано более короткое время лечения для достижения приемлемого эффекта (24 часа против 33 часов, p <0,011) [437].
В другом сравнительном исследовании тканевые активаторы плазминогена (АТХ группа: ферментные препараты, B01AD02) применялись в дозировке 0,5 мг/ч в лечении ТГВ 32 конечностей в лечении ТГВ 38 конечностей при этом не было продемонстрировано различий в отношении времени инфузии, частоты успеха, частоты осложнений, но использование тканевых активаторов плазминогена (АТХ группа: ферментные препараты, B01AD02) было менее дорогостоящим [438].
Доза #алтеплазы** (АТХ группа: ферментные препараты, B01AD02) составляет 1-2 мг/ч, но не должна превышать 2 мг/ч. [409, 430, 443]. Препарат разводится на 100 мл 0,9% раствора натрия хлорида** (АТХ группа: солевые растворы, B05CB), а скорость введения составляет 100 мл в час.
- Во время катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) рекомендуется применять НФГ (гепарин натрия**) и НМГ (B01AB: Группа гепарина) [396, 439].
УДД 4 УУР С
Комментарий: антикоагулянтная терапия при проведении КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) обязательна. После окончания тромболитической инфузии показано продолжение антикоагулянтной терапии [396, 439]. Антикоагулянты (АТХ группа: антитромботические средства, В01А) возможно использовать в составе литической смеси через катетер для проведения тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) или отдельно через периферический венозный катетер [432]. Подкожное введение нефракционированного гепарина натрия** (подкожное введение лекарственных препаратов (A11.01.002)) исключено из-за сложности дозирования препарата и это может привести к обширным подкожным кровоизлияниям. Начальная дозировка гепарина натрия** составляет 1000 МЕ в час с последующей коррекцией дозы для достижения АЧТВ в диапазоне 1,5-2,5 раза выше стартового значения (50-90 сек) [396, 398, 439]. Дозировка НМГ (B01AB: Группа гепарина) рассчитывается по актуальной массе тела пациента в соответствии с официальной инструкцией [396, 398]. На сегодняшний день отсутствует убедительные данные в отношении оптимального препарата, его дозы и режима введения вовремя КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011). Предлагается применение терапевтических доз НФГ(гепарин натрия**) или субтерапевтических доз НФГ (гепарин натрия**) при использовании #алтеплазы** (АТХ группа: ферментные препараты, B01AD02).
- Рекомендуется рассмотреть целесообразность применения прерывистой пневмокомпрессии нижних конечностей (A15.12.002.001) (ППК (перемежающаяся пневмокомпрессия (A21.12.002)) во время проведения КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [444].
УДД 3 УУР В
Комментарий: в небольшом проспективном исследовании, включившем пациентов с подвздошно-бедренным ТГВ, доказана эффективность перемежающейся пневмокомпрессии, как адъювантного метода лечения к КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011). ППК (перемежающаяся пневмокомпрессия (A21.12.002)) обеспечивала более полноценное восстановление просвета вен, снижения частота развития ПТБ [444].
3.4.5.2. Фармакомеханическая тромбэктомия (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001))
- Фармакомеханическая тромбэктомия (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) рекомендуется у пациентов с продолжительностью симптомов ТГВ не более 14 дней с целью сокращения времени тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и суммарной дозы тромболитического препарата (АТХ группа: ферментные препараты, B01AD02) при наличии соответствующего оборудования [398, 404, 410, 426, 435, 445–448].
УДД 1 УУР А
Комментарий: общим принципом всех методов чрескожной фармакомеханической тромбэктомии (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) является комбинация механического разрушения и удаления тромба и локальное введение тромболитического препарата (АТХ группа: ферментные препараты, B01AD02) в зону воздействия. Основными аргументами в пользу ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) служат более короткие сроки лечения, меньшее количество тромболитического препарата и, связанная с этим, меньшая частота геморрагических осложнений, чем при КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [404, 445–447].
Исследование PEARL с применением реолитической тромбэктомии (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) с участием 329 пациентов из 32 центров в США, показало, что в 73% случаях процедура ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) длилась в течение 24 часов, а 36% – 6 часов [426]. Это гораздо меньше, чем при КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), где длительность может достигать 72 и даже 96 часов [398, 404, 435]. Вместе с тем убедительных данных о превосходстве ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) перед КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) в эффективности нет. В ретроспективном сравнительном исследовании эффективность ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) (с помощью технологии реолитической тромбэктомии) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) не имели статистически значимых различий. Частота полного лизиса составила 70% против 75%, частичного лизиса 30% против 25% соответственно. Так же потребность в баллонной ангиопластике и стентировании (установка стента в сосуд (A16.12.028)) существенно не отличались (78% и 82%). Клиническое улучшение достигнуто в 72% при ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) и 81% при КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [404]. Систематический обзор и мета-анализ по изучению эффективности различных методик эндоваскулярной дезобструкции не продемонстрировал различий между ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) по влиянию на риск развития ПТБ, на проходимость вен, риск развития геморрагических осложнений и общую смертность [448]. В рамках другого мета-анализа было показано, что применение усиленного ультразвуком тромболизиса в сравнении с КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) ассоциируется с улучшенной проходимостью вен (ОР, 4,67; 95% ДИ, 1,58-13,81) [410].
В РКИ ATTRACT представлены сравнительные результаты лечения острого проксимального ТГВ у 692 пациентов с длительностью симптомов не более 14 дней методами ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), группу контроля составили пациенты, получавшие стандартную антикоагулянтную терапию. Хотя в период 6-24 месяца по факту наступления ПТБ межгрупповые различия не получены (47% в группе ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и 48% в контрольной группе; ОР 0,96; 95% ДИ, 0,82-1,11; р = 0,56), ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) позволили уменьшить риск среднетяжелой и тяжелой ПТБ с 24% в контрольной группе до 18% в группе ФМТ+КТЛ (ОР 0,73; 95% ДИ 0,54-0,98; P = 0,04). При этом риск кровотечений увеличился в сравнении с АТ (1,7% против 0,3%, р = 0,049), а частота рецидивов ВТЭО в ближайшие 24 месяца 12% в группе наблюдения против 8% в группе контроля р = 0,09) [400].
При применении реолитической ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001)) следует учитывать вероятность развития гемолиза и острой почечной недостаточности [449, 450]. После процедуры требуется тщательное наблюдение и меры по предотвращению развития почечной недостаточности [451].
3.4.5.3. Механическая тромбэктомия
- Механическая тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) рекомендуется качестве альтернативы катетерному тромболизису (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и фармакомеханической тромбэктомии (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) у пациентов с повышенным риском кровотечений и давностью ТГВ более 14 дней [422, 452–460].
УДД 4 УУР С
Комментарий: на сегодняшний день существует большое количество разнообразных устройств для чрескожной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)). Самое изученное устройство подобного типа (17740 система аспирационная для тромбэктомии) предполагает тромбэкстракцию через боковые отверстия рабочего наконечника, при которой используется высокоскоростная вращающаяся спираль внутри гибкого атравматического катетера. Катетер устанавливается по проводнику, проходящему внутри спирали. Таким образом, всасывание тромба происходит за счет вихревых потоков при скорости вращения 40000 оборотов (эффект Бернулли), а продвижение внутри катетера происходит по принципу работы архимедовой спирали [452].
В регистр по данному устройству вошли 56 пациентов, с разным сроком ТГВ. Длительность симптомов менее 14 дней диагностирована у 40 пациентов (71%), длительность симптомов ТГВ более 14 дней у 13 (23%), длительность более 28 дней – 3 (6 %). Технический успех составил 100%. Никаких осложнений или неисправностей, связанных с устройством, не зафиксировано. Средняя длительность лечения составила 94,2 мин (27-238 минут). В 4 случаях выполнен КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) глубокой бедренной вены. Связанные с процедурой тяжелые осложнения (повторная окклюзия целевой вены, длительная госпитализация из-за необходимости наложения артериовенозной фистулы) наблюдались у 8 (14%) пациентов. Незначительные побочные эффекты в виде гематомы места пункции произошли в 20%. Больших кровотечений не было. Всем пациентам выполнили стентирование (установка стента в сосуд (A16.12.028)), при этом, в среднем имплантировано 1,9 венозных стента на одно поражение. Проходимость стентов, определенная с применением транскутанного ультразвукового дуплексного сканирования, как >50% через 1 месяц составили 95%, через 6 месяцев 94%, через 12 месяцев 87%. Посттромботическая болезнь в легкой форме через 12 месяцев зафиксирована у 64% пациентов, среднетяжелая ПТБ наблюдалась у 36% пациентов. Тяжелая ПТБ зафиксировано не было [453].
Похожие результаты получены в ретроспективном исследовании, в котором 30 пациентам с подвздошно-бедренным ТГВ выполнена ротационная тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) таким же устройством. Успешное удаление тромба и восстановление проходимости вен достигнуто у всех пациентов (100%). Частота стентирования составила 100%. Среднее время процедуры – 107,3 ± 33,9 мин. Никаких серьезных осложнений не произошло. Постпроцедурное течение пациентов во всех случаях протекало без осложнений, в 83,3% случаев выписка из больницы состоялась в течение 2 дней. Ранний ретромбоз стента произошел в течение 1 недели у 3 пациентов. Уровень стента в сроке наблюдения 22,3 ± 14,2 месяца по оценке с помощью ультразвукового дуплексного сканирования составил 86,7%. Авторы делают заключение о высокой безопасности и эффективности механической тромбэктомии этим устройством [454].
- Механическая катетерная тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) рекомендуется при невозможности тромболитической терапии [85, 422, 452–463].
УДД 2 УУР B
Комментарий: в ряде исследований тромболитический препарат (АТХ группа: ферментные препараты, B01AD02) не применяли вовсе, при этом первичный успех находился в пределах 60-100%. При невозможности проведения тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) механическая тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) может рассматриваться как альтернатива открытой тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) [85, 452–463].
В шести исследованиях проведено сравнение результатов лечения 195 пациентов которым проведена механическая тромбэктомия (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) с КТЛ (МТ+КТЛ) и 193 пациентов, которым выполнен только КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011). Частота частичного лизиса тромба была выше в группе МТ+КТЛ (ОР 2,64; 95% ДИ, 1,34-5,21; р = 0,005), тогда как частота полного лизиса не была статистически значима в обеих группах (ОР 1,38; 95% ДИ. 0,87-2,18; р = 0,17). Разница сумм баллов по шкале Villalta (приложение Г.12) в двух группах во время последующего наблюдения не имела статистической значимости (ОР, 0,50; 95% ДИ, 0,34-1,34; р = 0,24). Доза тромболитического препарата (АТХ: ферментные препараты, B01AD02) в группе МТ+КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) была намного ниже, чем в группе КТЛ (стандартная средняя разница -0,98; 95% ДИ, -1,59 до -0,38; P = 0,001), а время проведения процедуры было короче в группе МТ+КТЛ (средняя разница - 16,94; 95% ДИ, от -22,38 до -11,50; р <0,001). Не было значимой разницы в риске больших кровотечений (ОР, 1,20; 95% ДИ, 0,50-2,90; р=0,24) или легочной эмболии (ОР, 1,18; 95% ДИ, 0,16-8,73; P =0,87) [385].
По результатам систематического обзора с мета-анализом, объединившего результаты 17 исследований с участием 117 пациентов, применение механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) в сравнении с КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) не отличалось по показателям технического успеха, риску развития ПТБ и рецидива ВТЭО. Между тем, первичная проходимость сосуда была выше, а риск развития больших кровотечений ниже при использовании механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)). Следует отметить, что механические методы ассоциировались с увеличенным риском развития гематурии [422]. В другом мета-анализе, объединяющем данные из 16 исследований с участием 1170 пациентов также было выявлено снижение риска развития больших кровотечений, а также уменьшение риска развития ПТБ при использовании механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) в сравнении с КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) [422].
- При неудовлетворительном техническом результате механической катетерной тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) (резидуальный стеноз более 50%) рекомендуется дополнительно выполнить катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) (при отсутствии показаний), баллонную ангиопластику и стентирование (установка стента в сосуд (A16.12.028)) [464].
УДД 2 УУР В
Комментарий: в мета-анализ были включены 35 исследований, 1323 пациента, которым выполнены различные методики механической тромбэктомии/тромбодеструкции с/или без дополнительного катетерного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011). В объединенном анализе доля пациентов, перенесших успешный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) с частичным или полным лизисом, составила 93,4% (95% ДИ, 90,1-95,6) и 67,0% (95% ДИ, 59,1-76,4), соответственно. Суммарная доля 30-дневного ретромбоза составила 11,9% (95% ДИ, 6,7-20,3). Смертность, связанная с 30-дневным ТГВ, составила 2,4% (95% ДИ, 1,6-3,7%). Периоперационная частота больших кровотечений и тромбоэмболии легочной артерии составила 4,6% (95% ДИ, 2,9-7,3%) и 3,8% (95% ДИ, 2,5-6,7%), соответственно. За время наблюдения частота поздних ретромбозов составила 10,7% (95% ДИ, 8,7-13,0); средний период наблюдения составил от 2,8 до 32,1 мес). У примерно 15,1% (95% ДИ, 9,6-22,9%) пациентов развился посттромботический синдром во время наблюдения (средний период наблюдения варьировал от 3,8 до 29,6 месяцев).
3.4.5.4. Дезобструкция при тромбозах НПВ
Принципы и методы внутрисосудистой дезобструкции при тромбозе НПВ в целом аналогичны таковым при проксимальных ТГВ. Используются указанные выше катетерные методики тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) или фармакомеханической тромбэктомии [390, 465–467]. Более чем, у половины пациентов после эндоваскулярных методов дезобструкции при тромбозе илиокавального сегмента, в т.ч., при тромбозе кава-фильтров***, требуется выполнение ангиопластики и стентирования (установка стента в сосуд (A16.12.028)) [390, 465, 466, 468].
- Эндоваскулярная дезобструкция при тромбозах НПВ рекомендуется только при исключении опухолевого поражения НПВ, в срок до 14 суток с момента начала заболевания, у активных больных при длительной ожидаемой продолжительности жизни [390, 465–468].
УДД 4 УУР С
- Рекомендуется рассмотреть целесообразность имплантации кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) с последующим его удалением у пациентов, которым планируется катетерный тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) при тромбозе илиокавального сегмента с целью уменьшения вероятности развития ТЭЛА [469].
УДД 2 УУР В
Комментарий: использование кава-фильтра, временного/постоянного*** при КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) у пациентов с тромбозом НПВ служит предметом дискуссии [402, 465, 466, 469–474]. В исследовании FILTER-PEVI (Filter Implantation to Lower Thromboembolic Risk in Percutaneous Endovenous Intervention) частота симптомной ТЭЛА оказалась в 8 раз ниже в группе пациентов с предварительно имплантированными КФ (1,4% против 11,3%, р = 0.048) [469]. Вместе с тем, это не оказало влияния на летальность и общую частоту осложнений. В других подобных исследованиях было показано, что отдаленные результаты дезобструкции при эмболоопасных илиофеморальных и илиокавальных тромбозах значительно улучшились при использовании ангиопластики и стентирования (установка стента в сосуд (A16.12.028)), а также своевременного съема кава-фильтров*** [402, 470, 471, 474]. В реальной клинической практике большинство специалистов склоняются к имплантации съемных КФ*** перед КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) при высоком риске ТЭЛА, в том числе при «нестабильных» тромбах НПВ [465, 466, 471]. Дополнительным показанием для установки КФ*** является исходная массивная симптомная ТЭЛА с дисфункцией правых камер сердца, или случаи низкого кардиопульмонального резерва у пациентов с тяжелой сопутствующей патологией или перенесенных ранее ВТЭО [470].
- Пациентам с тромбозом дистальнее нижней полой вены перед эндоваскулярным лечением не рекомендуется рутинная имплантация кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) [267, 395–400].
УДД 2 УУР А
Комментарий: по данным систематического обзора, включившего 19 РКИ (1943 пациентов) КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и ФМТ (эндоваскулярная тромбэктомия аспирационная (A16.12.003.001) не ассоциируются с увеличением частоты ТЭЛА, в т.ч., летальной [267]. Частота ТЭЛА во время КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) не превышает таковую при АКТ [395, 397–400]. В двух исследованиях (103 и 69 пациентов), после КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) и других способов дезобструкции не было выявлено никаких симптомов ТЭЛА [396, 402].
- Любые методы дезобструкции нижней полой вены рекомендуется выполнять в специализированных стационарах, в условиях рентген-операционных, при наличии соответствующего расходного материала, в том числе для ангиопластики и стентирования НПВ (установка стента в сосуд (A16.12.028)) при остаточных стенозах [1, 85, 390, 402, 459, 460, 465–468, 470–472, 474, 475].
УДД 3 УУР В
3.4.6. Открытая тромбэктомия
- Открытую тромбэктомию (тромбэктомия из магистральных вен (A16.12.035)) при окклюзивных илиофеморальных ТГВ с целью дезобструкции рекомендуется выполнять только при длительности симптомов ТГВ до 14 дней, угрозе потери конечности или крайней выраженности симптомов и проявлений ТГВ, невозможности проведения эндоваскулярных методов дезобструкции и при условии наличия у врача-хирурга опыта выполнения таких оперативных вмешательств [365, 411, 430].
УДД 1 УУР В
Комментарий: открытая тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)) при окклюзивных илиофеморальных ТГВ является одним из вмешательств в рамках так называемой стратегии раннего удаления тромба [390, 408, 476], что позволяет снизить риск развития ПТБ [411]. Однако показания к ее выполнению сегодня сильно сужены, прежде всего, в результате развития методов эндоваскулярной дезобструкции. Вмешательство может быть выполнено у отдельных пациентов при наличии противопоказаний к тромболизису (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) или невозможности выполнения внутрисосудистых вмешательств, в том числе у пациентов с флегмазией и угрозой потери нижней конечности, когда важно быстро восстановить проходимость глубоких вен подвздошно-бедренного сегмента [411, 430, 476]. Как и другие методы дезобструкции вмешательство следует выполнять в рентген- или гибридной операционной с выполнением рентгенэндоваскулярного контроля на всех этапах операции, и при необходимости – ангиопластики и стентирования для восстановления адекватного оттока по подвздошным венам.
Тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)) эффективна в остром периоде ТГВ для быстрого устранения обструкции подвздошно-бедренного сегмента глубоких вен и способствует сохранению функции клапанов вен. Результаты прямого сравнения с антикоагулянтной терапией представлены в 10 исследованиях [477–486], только одно из которых было проспективным рандомизированным исследованием [483]. Все исследования были небольшими, от 15 до 192 пациентов с периодом наблюдения от 6 месяцев до 10 лет.
В систематический обзор и мета-анализ, в котором сравнивалась эффективность стандартной АКТ, хирургической тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) и КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) в лечения острого подвздошно-бедренного ТГВ, вошло 15 исследований. По сравнению с АКТ, тромбэктомия (тромбэктомия из магистральных вен (A16.12.035)) была связана со статистически значимым снижением риска развития ПТБ (ОР 0,67; 95% ДИ, 0,52-0,87), венозного рефлюкса (ОР 0,68; 95% ДИ, 0,46-0,99) и тенденция к снижению риска венозной обструкции (ОР 0,84; 95% ДИ, 0,60-1,19). Как и во всех методах раннего удаления тромба, при планировании тромбэктомии (тромбэктомия из магистральных вен (A16.12.035)) из подвздошно-бедренного сегмента требуется уделить тщательное внимание отбору пациентов и индивидуальной оценке рисков и преимуществ, а также предпочтений самого пациента [411].
3.4.7. Антикоагулянтная терапия при дезобструкции венозного русла
- После применения любого метода дезобструкции, со стентированием (установка стента в сосуд (A16.12.028)) или без него, рекомендуется АКТ по общим принципам определения дозировок и продолжительности [275, 487, 488].
УДД 2 УУР В
- При определении характера и длительности АКТ после дезобструкции проксимальных вен в сочетании с ангиопластикой и стентированием (установка стента в сосуд (A16.12.028)) рекомендуется ориентироваться на характер тромботического процесса (спровоцированный/неспровоцированный), наличие его осложнений (ТЭЛА), наличие других факторов риска (тромбофилии, злокачественные новообразования и др.), а также на опыт оперирующего врача-хирурга [85, 276, 472, 489–492].
УДД 3 УУР В
Комментарий: после стентирования магистральных вен АКТ не должна отличаться от таковой, использующейся при изолированном консервативном лечении проксимальных ТГВ [85, 471]. По результатам Дельфийского консенсуса 106 экспертов по стентированию магистральных вен (с ежегодным опытом не менее 100 вмешательств) отмечено, что АКТ необходима на срок 6-12 месяцев после стентирования, НМГ (B01AB: Группа гепарина) являются препаратами выбора в первые 2-6 недель после стентирования, АКТ на неопределенно долгий срок (пожизненно) показана пациентам с рецидивным ТГВ, отмена АКТ после 6-12 месяцев ее проведения может быть рассмотрена у пациентов с единственным эпизодом проксимального ТГВ [491]. Относительно роли антиагрегантной терапии после венозного стентирования консенсуса достичь не удалось, хотя 55% экспертов выступили за длительную антиагрегантную терапию у пациентов со стенозами подвздошных вен экстравазального характера [491]. В систематическом обзоре указано, что лишь в 26% исследований пациентам назначали дополнительную антиагрегантную терапию [492].
3.4.8. Стентирование после дезобструкции венозного русла
- Пациентам с ТГВ рекомендуется рассмотреть целесообразность дополнительного выполнения баллонной ангиопластики и/или стентирование остаточных тромботических или обструктивных поражений илиокавального сегмента непосредственно после дезобструкции с целью повышения эффективности дезобструкции и снижения риска ретромбоза (установка стента в сосуд (A16.12.028)) [433, 489, 492–497].
УДД 2 УУР А
Комментарий: стентирование вен илиокавального сегмента после их дезобструкции высокоэффективно и безопасно (установка стента в сосуд (A16.12.028)) [85, 390, 492, 496, 497]. По данным мета-анализов эффективность стентирования остаточных стенозов подвздошно-бедренного сегмента после дезобструкции при острых проксимальных ТГВ достигает 94,5% и более, при низкой частоте развития осложнений менее 1% [492, 496, 497].
Показаниями к адъювантному стентированию после выполнения различных методов дезобструкции являются: остаточный стеноз, ограничивающий кровоток (в различных исследованиях величина такого стеноза обычно расценивается как 50% по данным ВСУЗИ или многопроекционной флебографии); видимый застой контрастного средства; контрастирование венозных коллатералей; сохранение дефекта контрастирования в просвете сосуда; визуализируемая внешняя компрессия вены [453, 464, 471, 498].
По данным различных РКИ ангиопластика или стентирование илиокавального сегмента после дезобструкции ассоциированы с меньшей частотой ретромбозов (установка стента в сосуд (A16.12.028)) [492]. При этом технический успех этой манипуляции составляет 94%, а проходимость стента через 12 месяцев достигает 87% [496]. Общепринятыми показаниями для ангиопластики и стентирования после дезобструкции проксимальных вен при острых ТГВ являются резидуальные стенозы подвздошных вен или НПВ (50% и более) [390, 433, 489, 493, 495]. При проведении ангиопластики и стентирования пункционный доступ осуществляют через бедренную или подколенную вены, а в случае необходимости дополнительно выполняют трансюгулярный доступ. В ходе стентирования производят предилятацию стенозов, оценивают диаметр и число необходимых стентов. Для НПВ обычно используют стенты 18-24 мм, для общей подвздошной вены – 14-18 мм, для наружной подвздошной вены – 12-16 мм [490,493]. Вмешательство проводят, как правило, без общей анестезии, в ряде случаев требуется тотальная внутривенная анестезия (B01.003.004.009). При имплантации двух стентов необходим «перехлест» между ними на 1,5-2 см для профилактики рестеноза. Используют специальные приемы для точной установки венозных стентов при высоких поражениях илиофеморального сегмента, а также при стентировании НПВ через имплантированный ранее кава-фильтр [472, 490]. Осуществляют постдилятацию перед контрольной флебографией или внутрисосудистым УЗИ. Критериями эффективности стентирования при контрольной флебографии служат спонтанный кровоток в стенозированном участке, отсутствие контрастирования коллатералей [69, 125].
Есть мнение о том, что одним из недостатков проведенных рандомизированных клинических исследований ATTRACT и CaVenT, является именно низкий процент проведения стентирования после внутрисосудистой дезобструкции проксимальных глубоких вен (выполнены у 28% и 18% пациентов в этих исследованиях, соответственно), что не позволило продемонстрировать преимущества внутрисосудистой дезобструкции над изолированной АКТ [489].
Одной из частых причин резидуальной экстраорганной обструкции после удаления тромба из подвздошного сегмента глубоких вен является синдромы Мей-Тернера и Коккета [499, 500]. Так же стенотическое поражение может быть также связано как с экстравазальным сдавлением (новообразованиями различного генеза, кистами, пакетами лимфатических узлов и т.п.), так и с интравазальными препятствиями кровотоку (резидуальные тромботические массы, посттромботические изменения стенки вен при рецидивирующем ТГВ, имплантированные кава-фильтры) [489, 493, 495, 501].
По данным РКИ у пациентов с выполненной дезобструкцией в сочетании со стентированием (установка стента в сосуд (A16.12.028)) первичная проходимость при последнем контрольном визите через 24 месяца составили 87,5% против 29,6% и показателем проходимости через год 86,0% против 54,8% соответственно [494].
По результатам мета-анализа, выполненного Razavi et al. (2015), технический успех стентирования (установка стента в сосуд (A16.12.028)) после дезобструкции глубоких вен при острых ТГВ составляет 94%, первичная проходимость через 12 месяцев – 87%, вторичная проходимость через 12 месяцев – 89% [496]. По данным одного из систематических обзоров, выполненного Taha et al., (2018), средний уровень проходимости стентов в данных ситуациях составляет 87,8% с частотой ретромбозов 8% при сроке наблюдения в отдаленном периоде 12-19,7 месяцев [492]. Частота развития посттромботической болезни вен нижних конечностей после успешной дезобструкции с последующим стентированием (установка стента в сосуд (A16.12.028)) остаточных стенозов составляет лишь 14,6%. Необходимость реинтервенций вследствие рестенозов в самих стентах или в результате их экстравазальной компрессии требуется, по данным различных авторов, у 2-25% пациентов в отдаленном периоде [492, 495–497, 501].
- Для стентирования глубоких вен илиофеморального и илиокавального сегментов (установка стента в сосуд (A16.12.028)) после их дезобструкции рекомендуется использование универсальных стентов (167760, стент для подвздошно-бедренного венозного сегмента) или специальных венозных самораскрывающихся стентов [85, 489, 492–497, 501].
УДД 2 УУР А
Комментарий: в настоящий момент широко используются универсальные артериальные стенты для имплантации в магистральных венах, Также разработаны специфические модели стентов для применения в венозной позиции [489, 495, 496]. По результатам систематического обзора и мета-анализа, достоверных различий по эффективности при использовании специальных венозных и универсальных стентов не выявлено [502]. Следует иметь в виду, что до сих пор не опубликованы финальные результаты многих регистрационных исследований по изучению эффективности и безопасности специальных венозных стентов.
- Не рекомендуется проводить стентирование глубоких вен бедренно-подколенного сегмента (установка стента в сосуд (A16.12.028)) [403, 503].
УДД 5 УРР С
Комментарий: стентирование (установка стента в сосуд (A16.12.028)) в бедренно-подколенном сегменте по эффективности не отличается от стандартной АКТ [403].
3.5. Хирургическая и эндоваскулярная профилактика ТЭЛА
3.5.1. Способы хирургической и эндоваскулярной профилактики ТЭЛА
Методом, направленным исключительно на профилактику ТЭЛА является имплантация кава-фильтра временного/постоянного*** (установка венозного фильтра (A16.12.027)). Методы хирургической дезобструкции глубоких вен (открытая и эндоваскулярная тромбэктомия) направлены на предотвращение ТЭЛА и профилактику тяжелых форм ПТБ.
3.5.1.1. Эндоваскулярная профилактика ТЭЛА
Имплантация кава-фильтра временного/постоянного*** является эффективным методом хирургической профилактики ТЭЛА [1, 390]. Имплантация кава-фильтра временного/постоянного*** характеризуется рисками развития осложнений во время оперативного пособия (кровотечение, гематома), так и осложнениями в отдаленном периоде (тромбозы кава-фильтров, перфорации стенки НПВ, тяжелые формы ПТБ нижних конечностей) [1 ,85, 279, 390, 467, 504, 505]. Поэтому, показания к имплантации кава-фильтра временного/постоянного*** должны быть строго определены и документированы, а выбор конкретного кава-фильтра для имплантации, по возможности, должен учитывать его конструктивные особенности.
- У пациентов с ТГВ, получающих полноценную антикоагулянтную терапию, использование кава-фильтра временного/постоянного*** не рекомендуется [1, 85, 279, 390, 467, 473, 504, 506–509].
УДД 1 УУР А
Комментарий: рандомизированные клинические исследования PREPIC и PREPIC II, сравнившие имплантацию кава-фильтра (установка венозного фильтра (A16.12.027)) в дополнение к полноценной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) у пациентов с ТГВ и ТЭЛА не выявили достоверного влияния интервенции на риск рецидива ВТЭО или общую смертность [473, 510, 511]. В исследовании PREPIC у пациентов с проксимальным ТГВ и высокой вероятностью легочной эмболии наблюдалось достоверное снижение риска рецидива ТЭЛА (преимущественно бессимптомной) в течение первых 12 суток лечения на фоне имплантации кава-фильтра (1,1% против 4,8%). При 2-летнем сроке наблюдения достоверность этих различий исчезала (3,4% против 6,3%). При наблюдении за пациентами в течение 8 лет было обнаружено статистически значимое снижение риска рецидива ТЭЛА (6,2% против 15,1%) параллельно с увеличением риска рецидива ТГВ (35,7% против 27,5%) без отличий по общему числу ВТЭО, ТЭЛА-ассоциированной и общей летальности. В исследовании PREPIC II у пациентов с тяжелой легочной эмболией имплантация съемного кава-фильтра*** в дополнение к терапии антитромботическими средствами не оказала влияния на риск рецидива ВТЭО в течение 3 месяцев наблюдения (3,0% против 1,5%). Таким образом, авторами обеих работ был сделан вывод об отсутствии пользы от имплантации кава-фильтра временного/постоянного*** у пациентов, получающих полноценную терапию антитромботическими средствами. По данным мета-анализа 7 рандомизированных клинических исследований с участием 127 пациентов имплантация кава-фильтра временного/постоянного*** снижает риск рецидива ТЭЛА в течение 3 мес. (ОР, 0,17 95% ДИ, 0,04-0,65) и всего периода наблюдения (ОР, 0,42; 95% ДИ, 0,25-0,71), но не влияет на общую или ТЭЛА-ассоциированную смертность [506].
- Имплантацию кава-фильтра временного/постоянного*** (установка венозного фильтра (A16.12.027)) рекомендуется рассмотреть у пациентов с проксимальным тромбозом глубоких вен при наличии абсолютных противопоказаний к антикоагулянтной терапии [469, 506, 512].
УРР 1 УДД А
Комментарий: на сегодняшний день отсутствуют данные рандомизированных клинических исследований по оценке эффективности и безопасности имплантации кава-фильтров временных/постоянных*** у пациентов, имеющих противопоказания к терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А). Принимая во внимание относительную эффективность имплантации кава-фильтра временного/постоянного*** для снижения риска развития ТЭЛА в остром периоде, пациенты с противопоказаниями к антитромботическим средствам могут иметь преимущество от интервенции [506]. По данным ретроспективного анализа страховых заявок, имплантация кава-фильтра, временного/постоянного**, у пациентов с активным кровотечением ассоциировалась со снижением 30-дневной смертности на 32% [512]. При этом следует отдавать предпочтение съемным моделям с максимально быстрым их удалением после возобновления адекватной терапии антитромботическими средствами.
- Имплантацию кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) на фоне проведения терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) рекомендуется рассмотреть у пациентов с ТГВ и индивидуально высоким риском развития фатальной ТЭЛА [84, 85, 126, 279, 467, 513].
УРР 5 УДД С
Комментарий: на сегодняшний день отсутствуют инструменты для определения риска ТЭЛА и вероятности летального исхода при ее развитии у пациента с ТГВ. Чаще всего в международных клинических рекомендациях обсуждается вопрос имплантации кава-фильтра временного/постоянного*** при прогрессировании или рецидиве ВТЭО на фоне введения лечебных доз антикоагулянтов (АТХ группа: антитромботические средства, В01А); при массивной ТЭЛА, низком кардиопульмонарным резерве и резидуальном ТГВ, при наличии крупного флотирующего тромба в проксимальных венах [84, 85, 126, 279, 467, 513]. Для всех описанных ситуаций абсолютная польза интервенции не была доказана, поэтому адекватная терапия антитромботическими средствами является приоритетной. Прогрессирование и рецидив ТГВ на фоне введения антитромботических средств обсуждают в соответствующем разделе. При наличии достоверных сведений за прогрессирование или рецидив тромбоза с возникновением угрозы развития фатальной ТЭЛА имплантация кава-фильтра, временного/постоянного*** может быть рассмотрена на период оптимизации терапевтических подходов. Следует иметь в виду, что имплантация фильтра не решает проблем антикоагуляции. Определенная польза в виде увеличения шанса на эмболию в кава-фильтра, временного/постоянного*** была показана у пациентов с проксимальным ТГВ и низким кардиопульмонарным резервом при систолическом давлении в легочной артерии более 50 мм рт. ст. [514]. В отношении флотирующего тромбоза проведенные ранее исследования показали отсутствие дополнительного риска развития ТЭЛА в сравнении с окклюзивным поражением вены той же локализации [91]. В связи с этим современные международные рекомендации не поддерживают имплантацию кава-фильтра, временного/постоянного*** по причине флотации. Взаимосвязь между риском развития симптоматической или фатальной ТЭЛА и длиной флотирующей верхушки не была доказана. В единственном ретроспективном анализе результатов лечения ТГВ у 78 пациентов было продемонстрировано повышение частоты развития ТЭЛА при наличии флотирующего тромбоза с длиной головки >5 см в сравнении с отсутствием флотации (3 случая эмболии на 5 флотирующих тромбозов против 4 случаев эмболии на 73 не флотирующих тромбоза) [515]. При ретроспективном анализе медицинских записей было выявлено, что факт наличия флотирующей головки длиной до 7 см, 7-10 см и более 10 см не увеличивает вероятность эмболии в кава-фильтр, временного/постоянного*** в сравнении с фильтрами, установленными по другим показаниям (противопоказания и неэффективность антитромботических средств) [514]. Таким образом, на протяжении многих лет имплантация кава-фильтра, временного/постоянного*** при флотирующей тромбозе с длиной верхушки более 5 см поддерживалась только авторами рекомендаций Американского венозного форума при отсутствии какой-либо серьезной доказательной базы [390]. На сегодняшний день флотирующий тромбоз вне зависимости от длины верхушки не может рассматриваться в качестве показания к хирургической профилактике ТЭЛА. Но в отдельных ситуациях на основании комплексной оценки всех факторов риска, когда вероятность фатальной ТЭЛА в результате отрыва и миграции флотирующей верхушки тромба расценивается чрезвычайно высоко, может быть рассмотрен вопрос об имплантации кава-фильтра, временного/постоянного***. При этом следует помнить, что методика не обладает абсолютной эффективностью, риск фатальной ТЭЛА после имплантации фильтра составляет 0,9-1,7% [516], его фильтрующая способность зависит от размера сгустка [517], а для развития симптоматической окклюзии ветвей легочной артерии может быть достаточно микроэмболов и микроагрегатов [518].
- При определении показаний к имплантации кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) рекомендуется индивидуальная оценка ожидаемой пользы и возможного вреда от вмешательства с учетом риска рецидива ВТЭО, кардиопульмонального статуса (резерва) больного, возможности проведения/эффективности проводимой АКТ [467, 508, 519, 520].
УДД 5 УУР С
Комментарий: Общество по Интервенционной Радиологии (Society of Interventional Radiology – SIR) представило детальный анализ большинства из упомянутых выше показаний к имплантации кава-фильтра, временного/постоянного***, ключевой точкой которого является индивидуальная оценка пользы и риска от его установки [467]. В частности, такие абсолютные показания к имплантации кава-фильтра, временного/постоянного***, как противопоказания к антикоагулянтной терапии, ее неэффективность или осложнения, должны быть тщательно уточнены в конкретной клинической ситуации. Большинству пациентов при наличии противопоказаний к АКТ, возникшим в первые недели после течение первых 4 недель после манифестации ТГВ и/или ТЭЛА, целесообразно имплантировать кава-фильтр, временный постоянный***. Напротив, при возникновении противопоказаний к АКТ на фоне ее продленного характера, имплантация КФ*** в подавляющем большинстве случаев нецелесообразна. Ситуации, связанные с осложнениями и неэффективностью, назначенной АКТ, в том числе при рецидивах ВТЭО, требуют ревизии ранее назначенной терапии – многие подобные случаи могут быть потенциально скорректированы медикаментозно (неправильные дозировки препаратов, межлекарственные взаимодействия и т.п.).
- Рекомендуется имплантировать съемные модели КФ***, которые могут быть удалены при исчезновении высоких рисков рецидива ВТЭО [1, 85, 390, 467, 509, 520].
УДД 5 УУР С
Комментарий: в отличие от постоянных КФ***, извлекаемые фильтры можно удалить, как только снизится риск тромбоэмболии у пациента [521]. Существует противоречивые данные о связи съемного или постоянного типа КФ*** с более высоким уровнем осложнений [521, 522]. Перспективными представляются конвертируемые кава-фильтр, временный/постоянный***. В одном варианте такой фильтр вместо удаления может быть активно «преобразован» в открытую, не фильтрующую конфигурацию, подобную сосудистому стенту. Другие типы конструкции конвертируемых кава-фильтр, временный/постоянный*** подразумевают «самопревращение» примерно через 60 дней, когда снижается риск развития ТЭЛА [523]. Конвертируемые кава-фильтр,временный/постоянного*** разрабатываются с целью ограничения потребности в инвазивных методах извлечения [524].
- В ситуациях, когда при флотирующих тромбозах НПВ не остается места (площадки) для безопасной имплантации кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) в инфраренальный отдел, рекомендуется выполнить внутрисосудистую механическую тромбэктомию (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)), либо открытое вмешательство [1, 390, 459, 460, 525–532].
УДД 3 УУР А
Комментарий: в РФ достаточно широкое применение получила методика эндоваскулярной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) с помощью специального устройства (тромбоэкстрактора) с рабочей частью по типу «капюшона» (153950 система для эмболэктомии/тромбэктомии) [1, 459, 460]. Тромбоэкстрактор вводят яремным доступом, «капюшон» открывают над флотирующим тромбом НПВ, «надевая» затем устройство на всю длину тромба. Далее специальной режущей нитью-петлей срезают тромб у его основания (131720, устройство для удаления тромбов из нижней полой вены "ТРЭКС" по ТУ 9437-006-26448947-2011). Завершением эндоваскулярной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) является, как правило, имплантация кава-фильтра временного/постоянного*** в освобожденный инфраренальный отдел НПВ. Технически вмешательство успешно в 94% случаев и более [460]. В подобных ситуациях также применяют систему для эндоваскулярной аспирационной механической тромбэктомии (эндоваскулярная катетерная тромбэктомия из нижней полой и подвздошных вен A16.12.035.001)) [390, 467, 526, 531, 532]. Вмешательство проводят под общей анестезий, вводя две канюли, аспирационную и для реинфузии при осуществлении вено-венозного шунтирования. Наконечник аспирационной канюли имеет воронку, которая приводится в действие баллоном, расширяется для увеличения площади аспирации, и производит непосредственно аспирацию флотирующего тромба. Тромботические массы аккумулируются в специальном фильтре. В конце процедуры, как правило, устанавливается кава-фильтр, временный/постоянный***. Технически процедура успешна в 73-100% случаев.
- У пациентов с имплантированным кава-фильтром, временным/постоянным*** характер, длительность и режим терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) рекомендуется определять по общим правилам, как при отсутствии кава-фильтра, временного/постоянного*** [84, 85, 126, 279, 467, 533]
УДД 2 УУР B
Комментарий: на сегодняшний день отсутствуют сведения, подтверждающие излишнюю тромбогенность кава-фильтров, временного/постоянного*** [534], которая требовала бы изменения режима или длительности терапии антитромботическими средствами. По результатам мета-анализа 9 исследований с участием 1369 пациентов применение антитромботических средстви после имплантации кава-фильтра, временного/постоянного*** не оказывало влияния на риск рецидива ВТЭО [533].
- У пациентов с ТГВ хирургические методы с целью профилактики ТЭЛА (перевязка, клипирование, пликация вен (перевязка сосуда (A16.12.014)), помимо имплантации кава-фильтра, временного/постоянного***, не рекомендуются для применения в рутинной клинической практике [84, 85, 126, 279, 513]
УДД 5 УУР С
Комментарий: на сегодняшний день отсутствуют достоверные сведения об эффективности и безопасности применения подобных методов. Следует иметь в виду, что односторонняя парциальная окклюзия вен (перевязка поверхностной бедренной вены, пликация подвздошных вен (перевязка сосуда (A16.12.014) не может защитить пациента от легочной эмболии с источником на контрлатеральной конечности или в венах таза. Подобные вмешательства могут быть рассмотрены при чрезвычайно высокой угрозе развития фатальной ТЭЛА и при наличии объективных показаний к имплантации кава-фильтра, но отсутствии технических возможностей для этого.
3.6. Диагностика и лечение рецидива ТГВ
Под рецидивом ТГВ следует понимать повторное возникновение тромбоза прежней или отличной от прежней локализации, сопровождающееся появлением характерных симптомов, после лечения первичного эпизода ВТЭО в острую фазу, т.е. в течение первых 2-х недель от момента начала заболевания [535]. При этом под успешным лечением следует понимать, в первую очередь, симптоматическое улучшение. Усиление старых симптомов, появление новых симптомов и признаков дальнейшего ухудшения состояния в течение первых 2 недель терапии принято называть прогрессированием ВТЭО (см. соответствующий раздел). При этом отсутствие клинического улучшения без прогрессирования старых, появления новых симптомов и без признаков поражения ранее интактных венозных сегментов в остром периоде заболевания не следует трактовать, как прогрессирование. Выделяют ранний и поздний рецидивы, развивающиеся, соответственно, в течение первых 3 мес. и более чем через 3 мес. от начала лечения. Таким образом, ранний рецидив ВТЭО развивается в период обязательной длительной терапии антикоагулянтами (АТХ группа: антитромботические средства, В01А) (рецидив на антикоагулянтах (АТХ группа: антитромботические средства, В01А)), а поздний рецидив может регистрироваться, как в период продленной терапии, так и после ее завершения.
- К ранним рецидивам ТГВ рекомендуется относить повторное возникновение симптоматического тромбоза прежней (повторная окклюзия ранее реканализованной вены) или отличной (окклюзия ранее интактной вены) локализации в течение первых 3 месяцев у пациента, уже получающего терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А) по поводу ранее выявленного ТГВ [535].
УУД 5 УУР С
Комментарий: следует критически относиться к результатам повторных инструментальных исследований, валидность которых в рамках оценки эффективности антикоагулянтной терапии окончательно не изучена. Так по данным ряда работ при выполнении повторного УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) в период от 7 дней до 6 месяцев признаки увеличения протяженности тромбоза могут быть обнаружены в 3-38% случаев, что не всегда отражает неэффективность проводимой терапии [536]. Изменения эхографической структуры тромба в процессе естественной его эволюции (изменение эхогенности, протяженности, появление флотации) достоверно не описаны и не могут использоваться для верификации рецидива ТГВ в отсутствии клинического подозрения. Таким образом, результаты повторных инструментальных исследований следует трактовать в контексте наличие клинических признаков рецидива и личного риска ВТЭО.
- К поздним рецидивам ТГВ рекомендуется относить повторное возникновение симптоматического тромбоза прежней (повторная окклюзия ранее реканализованной вены) или отличной (окклюзия ранее интактной вены) локализации спустя 3 месяца и более у пациента, продолжающего или завершившего терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А) по поводу ранее выявленного ТГВ [535].
УУД 5 УУР С
- Для диагностики рецидива ТГВ у пациента с наличием клинического подозрения рекомендуется использовать дуплексное или триплексное сканирование ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)), определение концентрации Д-димера в крови (A09.05.051.001), КТ-ангиографию (компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.053)) и МР-флебографию (магнитно-резонансная венография (одна область) (A05.12.005)) [85, 535, 537–539].
УУД 5 УУР С
Комментарий: диагностика рецидива ТГВ представляет собой непростую задачу, так как его симптомы могут быть невыраженными и походить на симптомы ПТБ. Информативность Д-димера у пациентов с предполагаемым рецидивом ТГВ ограничена высокой вероятностью сохранения его повышенных значений после прекращения антикоагуляции. Так, в одном исследовании частота повышения уровня Д-димера у 396 больных с ВТЭО составила 15,5% сразу после отмены антикоагулянтов и 46,2% через 3 мес. [187]. При этом сохранение повышенного уровня Д-димера после прекращения антикоагулянтной терапии ассоциируется с двукратным увеличением риска рецидива ВТЭО. По данным мета-анализа 26 исследований с участием 10725 пациентов частота рецидива ВТЭО составила 16,1% при повышенном Д-димере и 7,4% при нормальных показателях (ОР, 2,1; 95% ДИ, 1,7-2,8) [275]. Определение концентрации Д-димера в крови (A09.05.051.001) нецелесообразно при высокой клинической вероятности наличия рецидива ТГВ (яркие клинические проявления, ≥2 баллов по шкале Уэллса (Wells)), в таких случаях рекомендуется выполнять УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) [535,539]. При низкой клинической вероятности наличия рецидива ТГВ (стертая симптоматика, <2 баллов по шкале Уэллса (Wells)) нормальный уровень Д-димера позволяет исключить повторный тромбоз. Между тем, риск ложноотрицательного результата при таком подходе может достигать 6-7% [540]. Применение МР-флебографии по технологии прямой визуализации тромба (MRDTI) позволяет исключить рецидив ТГВ даже у пациентов с наличием резидуальных изменений при УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)), риск ложноотрицательного результата при этом составляет 1,7% (95% ДИ, 0,2-5,9%) [538].
- У пациента с подозрением на рецидив ТГВ к ультразвуковым признакам повторного тромбоза рекомендуется относить: окклюзию ранее интактного венозного сегмента, окклюзию ранее реканализованного венозного сегмента, увеличение степени резидуальной венозной обструкции на ≥4 мм в сравнении с предыдущим исследованием [535].
УУД 5 УУР С
Комментарий: при отсутствии возможности сравнения с данными предыдущего УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) результаты исследования следует трактовать индивидуально в соответствии с клинической вероятностью наличия рецидива ТГВ и степенью риска рецидива ВТЭО у конкретного больного. По данным одной работы результаты УЗАС невозможно трактовать у 32% больных с подозрением на рецидив ТГВ в связи с отсутствием предыдущего заключения (11%) или невозможностью сравнения динамики изменения резидуальной венозной обструкции (21%) [541]. При оценке степени изменения резидуальной венозной обструкции следует иметь в виду высокую ее вариабельность при повторных измерениях. Рецидив ТГВ можно исключить, в случае если диаметр вены при максимальной компрессии изменился не более, чем на 2 мм. В случае увеличения диаметра вены при максимальной компрессии на 2-4 мм рекомендуется повторить исследование через 5-7 дней или начать лечение рецидива ТГВ. В случае увеличения диаметра вены при максимальной компрессии на ≥4 мм рекомендуется начать лечение рецидива ТГВ.
- У пациента с ранним рецидивом ТГВ рекомендуется установить возможную причину неэффективности проводимого лечения, а также изменить или усилить терапию антикоагулянтами (АТХ группа: антитромботические средства, В01А) [85, 279, 542].
УДД 5 УУР С
Комментарий: если рецидив ТГВ развился на фоне АКТ, то следует в первую очередь установить причину ее неэффективности (низкая приверженность терапии, прием сопутствующих препаратов, которые могут взаимодействовать с антикоагулянтами (АТХ группа: антитромботические средства, В01А), неадекватные дозы ПОАК (АТХ группа: антитромботические средства, В01А), несоответствие МНО целевому диапазону при приеме АВК, недиагностированный рак, антифосфолипидный синдром и т.д. При рецидиве ТГВ, возникшем в период приема орального антитромботического средства, целесообразно перевести пациента на полные лечебные дозы НМГ (АТХ группа: группа гепарина, В01АВ) на один месяц с последующей заменой орального антикоагулянта (АТХ группа: антитромботические средства, В01А) на другой с отличным механизмом действия (переход с ПОАК на АВК), увеличением дозы орального антикоагулянта (АТХ группа: антитромботические средства, В01А) (переход с редуцированной на полную лечебную дозу ПОАК), увеличением целевого диапазона МНО (от 2,0-3,0 до 2,5-3,5), устранением возможных причин рецидива ТГВ (Таблица 15) [85, 279, 542]. При рецидиве ТГВ на фоне терапии пониженными дозами НМГ (АТХ группа: группа гепарина, В01АВ) целесообразен переход на полные лечебные дозы, при возникновении рецидива ТГВ на фоне применения полных лечебных доз НМГ (АТХ группа: группа гепарина, В01АВ) целесообразно их увеличение на 20-25% на период 1 месяца [31, 543, 544]. Также целесообразен подбор индивидуальной дозы НМГ (АТХ группа: группа гепарина, В01АВ) под контролем анти-Ха активности.
Таблица 15. Возможные причины рецидива ТГВ и способы их коррекции
Возможная причина | Тактика лечения |
|---|
Онкологическое заболевание | Переход на НМГ (АТХ группа: группа гепарина, В01АВ), возможно, увеличение дозы; при миелопролиферативном заболевании рекомендуется циторедуктивная терапия и антиагреганты (АТХ группа: антиагреганты, кроме гепарина, B01AC) |
Антифосфолипидный синдром | Переход на АВК, возможно использование повышенного целевого диапазона МНО |
Гепарин-индуцированная тромбоцитопения | Фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX) [545] |
Беременность | Контроль анти-Ха активности, увеличение дозы НМГ (АТХ группа: группа гепарина, В01АВ), /НФГ |
Болезнь Бехчета | Специфическая иммуносупрессивная терапия |
Сосудистые аномалии | Декомпрессия, стентирование (установка стента в сосуд (A16.12.028)), эскалация режима терапии |
Редуцированная доза ПОАК (АТХ группа: антитромботические средства, В01А) | Увеличение до лечебной |
Масса тела >120 кг | Переход с ПОАК (АТХ группа: антитромботические средства, В01А) на АВК |
Лекарственные взаимодействия | Переход с ПОАК (АТХ группа: антитромботические средства, В01А) на АВК |
Прием ривароксабана** без пищи | Инструктаж |
Низкая приверженность | Переход с ПОАК (АТХ группа: антитромботические средства, В01А) на АВК |
3.7. Осложнения антикоагулянтной терапии
3.7.1. Кровотечение
При лечении любыми антитромботическими средствами (АТХ В01А) могут развиться геморрагические осложнения, к факторам риска которых относят пожилой возраст, кровотечения или инсульт в анамнезе, злокачественные опухоли, почечную и печеночную недостаточность, сахарный диабет, недавно выполненное хирургическое вмешательство, анемию, тромбоцитопению, частые падения, злоупотребление алкоголем, прием антитромбоцитарных средств (АТХ группа: В01А) или нестероидных противовоспалительных и противоревматических препаратов (АТХ M01A) [279]. При наличии одного фактора риска вероятность большого кровотечения увеличивается по крайней мере в 2 раза, а при наличии двух и более факторов риска – в 8 раз. Значительное увеличение частоты геморрагических осложнений может наблюдаться и при наличии одного фактора риска, например, в течение первых дней после большого хирургического вмешательства или при наличии тяжелой тромбоцитопении. В зависимости от количества факторов риска (0,1 или ≥2) пациенты могут быть разделены на группы низкого, среднего и высокого риска с соответствующей ежегодной частотой больших кровотечений на уровне 0,8%, 1,6% и ≥6,5%, соответственно [279]. Необходимо отметить, что предсказательная ценность этой стратификации в условиях реальной клинической практики оказалась недостаточно высокой [191]. Существуют и другие шкалы, предназначенные для оценки риска кровотечений при АКТ (Приложение Г10). Несмотря на ограниченную валидацию в исследованиях, эти шкалы могут быть использованы для определения индивидуального риска больших кровотечений на фоне длительной и продленной АКТ.
Указанные цифры риска геморрагических осложнений относятся, в первую очередь, к начальной терапии гепаринами (АТХ группа: группа гепарина, В01АВ) с переходом на АВК. Длительное применение АВК ассоциируется с высокой частотой угрожающих жизни больших кровотечений, летальность при которых составляет 9-11% и достигает 45% при внутричерепной локализации [308, 309]. При начальной терапии применение НМГ (АТХ группа: группа гепарина, В01АВ), и фондапаринукса натрия (АТХ группа: B01AX: Другие антитромботические средства)) в качестве альтернативы НФГ (гепарин натрия**) позволяет снизить угрозу геморрагических осложнений [351, 353–355]. Максимальную безопасность при начальной и длительной терапии ВТЭО демонстрируют ПОАК. По данным мета-анализа регистрационных исследований, включивших более 27000 пациентов с ВТЭО, лечение ПОАК (АТХ группа: антитромботические средства, В01А) сопровождается снижением риска больших кровотечений на 39% (ОР, 0,61, 95% ДИ, 0,45-0,83) по сравнению с АВК [546, 547]. Кроме того, при использовании ПОАК было выявлено снижение риска внутричерепных кровоизлияний на 63% (ОР, 0,37; 95% ДИ, 0,21-0,68) и летальных кровотечений на 64% (ОР, 0,36; 95% ДИ, 0,15-0,84). Увеличения частоты желудочно-кишечных кровотечений, которое наблюдали на фоне ПОАК (АТХ группа: антитромботические средства, В01А) у пациентов с неклапанной фибрилляцией предсердий, у больных с ВТЭО отмечено не было. Преимущество ПОАК по безопасности перед АВК сохранялось у пациентов в возрасте ≥75 лет и при КлКр 30-49 мл/мин.
- У пациента с ТГВ, длительно получающего лечение с помощью АВК, рекомендуется проводить активное выявление, контроль и коррекцию факторов риска геморрагических осложнений [376, 548, 549].
УДД 5 УУР С
Комментарий: наиболее часто кровотечения возникают в желудочно-кишечном и мочеполовом трактах, поэтому во время применения АВК целесообразен контроль общего (клинического) анализа мочи (B03.016.006) для исключения микрогематурии и исследование кала на скрытую кровь (A09.19.001). У больных с анамнезом язвенной болезни желудка, двенадцатиперстной кишки, принимающих АВК, целесообразно проводить ЭГДС на регулярной основе. Внеочередное обследование показано при появлении жалоб, подозрительных в отношении обострения заболевания. При нестойкой ремиссии, а также если АВК приходится сочетать с антиагрегантами, кроме гепарина, следует рассмотреть целесообразность лекарственной профилактики кровотечений из верхних отделов желудочно-кишечного тракта. У пациентов с артериальной гипертензией требуется подбор эффективной гипотензивной терапии. При внезапных повышениях АД необходима его скорейшая нормализация. При носовом кровотечении на фоне высокого АД быстрый дополнительный прием больным гипотензивных препаратов (АТХ группа: антигипертензивные средства, С02) часто способствует прекращению кровотечения. Необходимо проинформировать пациента, что при кровотечении ему необходимо срочно связаться с врачом и воздержаться от приема очередной дозы АВК как минимум до определения МНО.
После отмены антикоагулянтное действие варфарина** прекращается примерно через 5 дней, аценокумарола – через 1-3 дня. Поэтому, если требуется достаточно срочное устранение воздействия АВК, наряду с отменой препарата показано использование фитоменадиона (АТХ: витамин К и другие гемостатические средства, B02BA01), эффект которого ожидается в ближайшие 24 ч. Препарат менадиона натрия бисульфит** (АТХ: витамин К и другие гемостатические средства, B02BA02) не является аналогом пероральной формы витамина К1. Менадиона натрия бисульфит** способствует синтезу витамин К-зависимых факторам свертывания de novo за счет влияния на процессы карбоксилирования, поэтому эффект после его приема наступает медленно, и он бесполезен для быстрого устранения ассоциированной с АВК коагулопатии. Отечественный препарат фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) в капсулах по 0,1 г 10% масляного раствора содержит чрезмерно высокую дозу витамина К1 ((B02BA: Витамин К), способную вызвать длительную невосприимчивость к АВК. Наиболее быстрый, но временный эффект дает внутривенное введение (внутривенное введение лекарственных препаратов (A11.12.003) свежезамороженной плазмы (СЗП) гемотрансфузия (A18.05.012), Факторов свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** (КПК) (B02BD: Факторы свертывания крови), фактора свертывания крови VII** (B02BD: Факторы свертывания крови) (гемотрансфузия (A18.05.012). Свежезамороженная плазма немедленно замещает витамин-К-зависимые факторы свертывания, но лишь частично корригирует коагулопатию и требует длительного времени для восстановления МНО (в течение 30 минут МНО нормализуется лишь в 9,2% случаев) [550]. Быстрая и полная реверсия эффекта варфарина** возможна в течение 10-15 минут после введения Факторов свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**, содержащего высокие концентрации витамин-К-зависимых факторам свертывания (B02BD: Факторы свертывания крови) в различной комбинации: Факторы свертывания крови II, IX и X в комбинации** (трехкомпонентный) , Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** (четырехкомпонентный), Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** (активный четырехкомпонентный). Тактика реверсии антикоагулянтного эффекта АВК (АТХ группа: антагонисты витамина К, B01AA) приведена в Таблице 16.
Таблица 16. Тактика реверсии антикоагулянтного эффекта АВК
Клиническая ситуация | Лечебная тактика |
|---|
Большое кровотечение | Прекратить прием варфарина** Госпитализация пациента в стационар Ввести #фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) 10-20 мг путем медленной в/в инъекции (внутривенное введение лекарственных препаратов (A11.12.003) [132]. Максимальная разовая доза препарата составляет – 20 мг, максимальная суточная доза – 40 мг (независимо от способа (внутривенно или внутримышечно) введения препарата) Ввести концентрат протромбинового комплекса** 25-50 ЕД/кг (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**) или (если нет концентрата) свежезамороженную плазму 15 мл/кг гемотрансфузия (A18.05.012) |
МНО >8,0, нет кровотечения или малое кровотечение | Прекратить прием варфарина** Возобновить прием варфарина** при МНО <5,0 При наличии кровотечения ввести фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) 10-20 мг путем медленной в/в инъекции (внутривенное введение лекарственных препаратов (A11.12.003) Максимальная разовая доза препарата составляет – 20 мг, максимальная суточная доза – 40 мг (независимо от способа (внутривенно или внутримышечно) введения препарата). Повторить введение фитоменадиона, если МНО остается слишком высоким по прошествии 24 часов. |
6,0 <МНО <8,0, нет кровотечения или малое кровотечение | Прекратить прием варфарина** Возобновить прием варфарина** при уровне МНО <5,0 |
МНО <6,0, но >0,5 выше целевого уровня | Снизить дозу или прекратить прием варфарина** Возобновить прием варфарина** при уровне МНО <5,0 |
Неожиданное кровотечение при терапевтическом уровне МНО | Выявить лежащую в основе причину развития кровотечения, например, не предвиденную ранее патологию желудочно-кишечного тракта. |
- У пациентов с ТГВ, получающих антикоагулянтную терапию с помощью АВК, при значениях МНО >4,5 и <10,0 при отсутствии клинически значимого кровотечения не рекомендуется применение фитоменадиона в дополнение к временному прерыванию антикоагулянтной терапии [132].
УДД 5 УУР С
Комментарий: по данным мета-анализа применение фитоменадиона у пациентов с варфариновой коагулопатией при отсутствии клинически значимого кровотечения не влияет на общую смертность, скорость нормализации МНО, риск рецидива ВТЭО, но ассоциируется с незначимой тенденцией к увеличению частоты больших кровотечений (ОР, 2,43; 95% ДИ, 0,81-7,27) [132].
- У пациентов с ТГВ, получающих АВК, при развитии угрожающего жизни кровотечения рекомендуется введение концентрата протромбинового комплекса ((Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]))** (гемотрансфузия (A18.05.012) вместо свежезамороженной плазмы, в дополнение к прерыванию антикоагуляции и внутривенному введению фитоменадиона (внутривенное введение лекарственных препаратов (A11.12.003) [132, 551].
УДД 2 УУР А
Комментарий: по данным мета-анализа применение КПК (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс])** (АТХ группа: факторы свертывания крови, B02BD) в сравнении с СЗП ассоциируется со снижением общей смертности на 44% (ОР, 0,56; 95% ДИ, 0,37-0,84), с более быстрой нормализацией МНО, с уменьшением вероятности объемной перегрузки и сердечной недостаточности без влияния на шанс достижения гемостаза и риск тромботических осложнений [551]. Более того, у пациентов с внутричерепным кровоизлиянием применение КПК (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс])** в отличие от СЗП позволяет стабилизировать гематому [552].
ПОАК (B01A: Антитромботические средства) обладают относительно коротким периодом полувыведения, поэтому не требуют обязательной инактивации. В случае угрожающего жизни кровотечения могут использоваться как специфические антидоты, так и #КПК (#Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс])** [132]. Также не следует забывать о неспецифических средствах гемостаза [85]. К специфическим средствам реверсии ПОАК (B01A: Антитромботические средства) относят идаруцизумаб (АТХ группа: антидоты, V03AB37), который представляет собой моноклональное антитело и активен только в отношении дабигатрана этексилата**. Тактика гемостатической терапии при больших кровотечениях, ассоциированных с применением ПОАК, представлена в таблице 17.
Таблице 17. Тактика гемостатической терапии при большом кровотечении, возникшем на фоне приема ПОАК
Большое кровотечение | Прямые ингибиторы тромбина (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07) | Прямые ингибиторы Ха фактора (B01AF: Прямые ингибиторы фактора Xa) (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) |
|---|
Не угрожающее жизни | Выяснение названия препарата, дозы и времени последнего приема |
Локальный гемостаз |
Восполнение кровопотери (гемотрансфузия (A18.05.012) |
Трансфузия эритроцит-содержащих сред по показаниям (гемотрансфузия (A18.05.012) |
Трансфузия тромбоцитарных сред по показаниям (тромбоцитопения, тромбоцитопатия) (гемотрансфузия (A18.05.012) |
Плазма свежезамороженная (для восполнения ОЦК, но не для реверсии) |
Ожидаемое время нормализации гемостаза: КлКр >80 мл/мин: 12-24 ч КлКр 50-80 мл/мин: 24-36 ч КлКр 30-50 мл/мин: 36-48 ч КлКр <30 мл/мин: >48 ч |
Поддержание диуреза | Ожидаемое время нормализации гемостаза: 12-24 ч |
Рассмотреть идаруцизумаб | Поддержание диуреза |
Все вышеуказанные методы |
|
Угрожающее жизни | Идаруцизумаб | Все вышеуказанные методы |
В качестве альтернативы #факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**: 50 ЕД/кг (дополнительно, 25 ЕД/кг при необходимости) [85] |
|
- У пациентов с ТГВ, получающих дабигатрана этексилат** при развитии угрожающего жизни кровотечения рекомендуется введение идаруцизумаба с целью остановки кровотечения [85, 132, 553, 554].
УДД 2 УУР В
Комментарий: эффективность и безопасность идаруцизумаба для реверсии действия дабигатрана этексилата** была изучена в рамках исследования RE-VERSE AD, включившего 301 больного с большим кровотечением и 202 пациентов с потребностью в экстренном хирургическом вмешательстве. Внутривенное введение (внутривенное введение лекарственных препаратов (A11.12.003) двух болюсов по 2,5 г (50 мл) в течение 15 минут привело к 100% реверсии активности дабигатрана этексилата** по лабораторным данным и достижению эффективного гемостаза через 2,5 часа в 67,7% случаев больших кровотечений. За последующие 30 дней наблюдения рецидив тромбоза был зарегистрирован в 4,8% случаев, а летальный исход – в 13,5% [553].
- У пациентов с ТГВ, получающих ПОАК (B01A: Антитромботические средства), при развитии угрожающего жизни кровотечения рекомендуется введение #концентрата протромбинового комплекса (#факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** (гемотрансфузия (A18.05.012): 50 ЕД/кг (дополнительно, 25 ЕД/кг при необходимости)** при недоступности специфических антидотов [85, 132, 554–556].
УДД 2 УУР В
Комментарий: мета-анализ 10 обсервационных исследований с участием 340 пациентов показал, что #КПК (#факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** в дозе 18-50 ЕД/кг или 2000-3500 ЕД для реверсии эффекта ПОАК (B01A: Антитромботические средства) у пациентов с большими кровотечениями обеспечивал гемостаз в 69-77% случаев. В течение последующих 30 дней наблюдения частота тромботических осложнений составила 4%, а общая смертность – 16% [555,556]. Важно, что обнаруженная летальность на фоне применения КПК** не отличается от таковой в исследовании ANNEXA-4 (14%) [557] и RE-VERSE AD (13,5%) [553]. По данным систематического обзора с мета-анализом, эффективность и безопасность применение #КПК (#факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** у пациентов с внутричерепными кровоизлияниями на фоне терапии ПОАК существенным образом не отличалась от применения специфических антидотов (эффективность – 77%, летальность – 26% и тромботические осложнения – 8%) [554].
- У пациентов с ТГВ, получающих НФГ (гепарин натрия**) и НМГ ((B01AB: Группа гепарина), при развитии угрожающего жизни кровотечения рекомендуется введение протамина сульфата** (АТХ группа: антидоты, V03AB14) [122, 132].
УДД 5 УУР С
Комментарий: эффективность и безопасность протамина сульфата** у пациентов, получающих НФГ (гепарин натрия**) и НМГ ((B01AB: Группа гепарина), была изучена только в рамках реверсии действия препаратов при экстренных оперативных вмешательствах. Мета-анализ обсервационных исследований продемонстрировал снижение риска больших кровотечений на 39% (ОР, 0,61; 95% ДИ, 0,39-0,96) при отсутствии различий по общей смертности и тромботическим осложнениям [132]. Полученные данные условным образом могут быть экстраполированы на больных с угрожающим жизни кровотечением.
- У пациентов с ТГВ, имеющих показания к продленной АКТ, после купирования большого кровотечения и его последствий рекомендуется в течение 90 дней возобновить лечение при условии невысокого риска рецидива геморрагических осложнений [132, 301].
УДД 5 УУР С
Комментарий: мета-анализ 17 обсервационных исследований продемонстрировал, что возобновление АКТ после перенесенного большого желудочно-кишечного кровотечения и внутричерепного кровоизлияния ассоциируется со снижением общей смертности на 38% (ОР, 0,62; 95% ДИ, 0,43-0,89), снижением риска тромбоэмболических осложнений на 55% (ОР, 0,45; 95% ДИ, 0,25-0,83), тенденцией к снижению риска ТЭЛА (ОР, 0,35; 95% ДИ, 0,11-1,11) и ВТЭО (ОР, 0,58; 95% ДИ, 0,26-1,28) без значительного влияния на риск ТГВ (ОР, 0,81; 95% ДИ, 0,31-2,16) параллельно с увеличением угрозы большого кровотечения (ОР, 1,57; 95% ДИ, 1,12-2,21) [132].
В случае перенесенного желудочно-кишечного кровотечения возобновление терапии оральными антикоагулянтами (B01A: Антитромботические средства: апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) (на примере фибрилляции предсердий) рекомендуется как можно раньше у пациентов с низким риском повторного геморрагического осложнения. При этом к факторам риска рецидива кровотечения относятся: отсутствие ясного источника первичного кровотечения, множественные ангиодисплазии пищеварительного тракта, отсутствие обратимой или потенциально излечиваемой причины, кровотечение, возникшее в период прерывания АКТ, злоупотребление алкоголем, старший возраст [301].
В случае перенесенного внутричерепного кровоизлияния возобновление терапии оральными антитромботическими средствами (на примере фибрилляции предсердий) рекомендуется в течение 4-8 недель у пациентов с низким риском повторного геморрагического осложнения. При этом к факторам риска рецидива кровотечения относится отсутствие обратимой или потенциально излечиваемой причины, множественные кровоизлияния, тяжелое внутричерепное кровоизлияние, старший возраст, кровотечение, возникшее в период прерывания АКТ, неконтролируемая артериальная гипертензия, кровотечение на адекватных или пониженных дозах ПОАК (B01A: Антитромботические средства), злоупотребление алкоголем, потребность в двойной антиагрегантной терапии [301].
3.7.2. Прогрессирование тромбоза на фоне АКТ
Под прогрессированием ТГВ понимают распространение или рецидив тромбоза в течение первых 2 недель после начала антикоагулянтной терапии [28]. Следует иметь в виду, что в большинстве случаев такие эпизоды выявляют при повторном инструментальном исследовании и это не всегда ассоциируются с клиническим ухудшением или отсутствием улучшения. Поэтому трактовка подобных находок должна проводиться в индивидуальном порядке с учетом клинической картины и особенностей пациента. Как и при рецидиве ТГВ, в таких случаях следует установить возможные причины неэффективности антикоагулянтной терапии, увеличить ее интенсивность, а также рассмотреть вопросы хирургической профилактики ТЭЛА.
- У пациента с ТГВ с целью диагностики прогрессирования венозного тромбоза рекомендуется учитывать распространение (увеличение проксимальной границы) или рецидив (окклюзия ранее интактной или реканализованной вены) тромбоза в течение первых 2 недель с момента диагностики ТГВ и начала АКТ [535].
УУД 5 УУР С
Комментарий: следует критически относиться к результатам повторных инструментальных исследований, валидность которых в рамках оценки эффективности антикоагулянтной терапии окончательно не изучена. Так по данным ряда работ при выполнении повторного инструментального исследования в течение 5-14 дней от момента начала лечения признаки нарастания тромбоза могут быть обнаружены в 12-39% случаев, что не всегда отражает неэффективность проводимой терапии [558]. Свидетельства новой легочной эмболии (преимущественно бессимптомной) могут быть выявлены у 4-6% пациентов с ТГВ вне зависимости от факта обнаружения флотации первичного тромба [91]. Изменения эхографической структуры тромба в процессе естественной его эволюции (изменение эхогенности, протяженности, появление флотации) достоверно не описаны и не могут использоваться для верификации прогрессирования ТГВ в отрыве от клинических проявлений. Т.о., результаты повторных инструментальных исследований следует трактовать в контексте симптомов заболевания и риска ВТЭО у пациента.
- У пациента с прогрессированием ТГВ на фоне, продолжающейся АКТ рекомендуется рассмотреть целесообразность хирургической профилактики ТЭЛА [85, 279, 542].
УДД 5 УУР С
3.7.3. Гепарин-индуцированная тромбоцитопения (ГИТ)
Гепарин-индуцированная тромбоцитопения (ГИТ) – это парадоксальная реакция тромбоцитов на гепарин натрия** (их агрегация и разрушение), потенциально опасная развитием венозных и артериальных тромбозов, реже кровотечений. Частота развития ГИТ колеблется от 0,5 до 7% [559–561]. Наибольшая вероятность наблюдается у пациентов кардиохирургического профиля из-за частого применения высоких доз гепарина натрия** [562]. Риск ГИТ в 10 раз выше при использовании НФГ (гепарин натрия**) в сравнении с НМГ (B01AB: Группа гепарина) [560, 563]. Пациенты, получающие гепарин натрия** бычьего происхождения, имеют более высокий риск возникновения ГИТ, нежели лица, использующие препарат свиного происхождения [564]. У женщин вероятность развития ГИТ в 2 раза выше, чем у мужчин. Пациенты, получающие гепарин натрия** в течение 30 сут. до операции, попадают в зону высокого риска появления антител и симптомов ГИТ в первые 5 сут. после вмешательства [565]. В группе лиц, у которых выявлены антитела и тромбоцитопения параллельно с тромбозами, смертность в течение первых 30 дней увеличивается на 30% по сравнению с пациентами с тромбоцитопенией, но без тромбозов [566]. Повышенный индекс массы тела, предоперационная сердечная недостаточность, увеличенная интраоперационная доза гепарина натрия**, экстренное хирургическое вмешательство и операции на аорте служат дополнительными независимыми факторами риска в случае наличия антител при ГИТ II типа [567].
3.7.3.1. Виды ГИТ
Различают 2 типа ГИТ. Гепарин-индуцированная тромбоцитопения I типа развивается в результате прямого взаимодействия гепарина натрия** с мембраной тромбоцитов через специфические рецепторы Р2Y12 и IIb/IIIa, которое вызывает активацию и агрегацию тромбоцитов. ГИТ I характеризуется кратковременным снижением числа тромбоцитов на 10-30% в первые 5 суток терапии гепарином натрия** у 10-30% пациентов и обычно не достигает количества ниже 100х109/л, не является клинически значимым событием и не требует дополнительного лечения, кроме отмены гепарина натрия**. Даже при продолжении лечения гепарином натрия** количество тромбоцитов может восстановиться. Тромбозы при этом типе развиваются редко.
Гепарин-индуцированная тромбоцитопения II типа является иммуноспецифической реакцией, развивающейся на 4-15-е сутки от начала фармакотерапии гепарином натрия**, является клинически значимым синдромом, наиболее часто приводящим к тромбозам. Диагноз ГИТ II типа устанавливается в том случае, когда у пациента с тромбоцитопенией развиваются клинические признаки артериального или венозного тромбоза [562].
3.7.3.2. Критерии диагностики ГИТ
Подозрение на развитие ГИТ II типа возникает при уменьшении числа тромбоцитов на 30-50% относительно максимального значения на 4-15-й день терапии гепарином натрия**. У 90% пациентов количество тромбоцитов опускается ниже 150х109/л. Во время острой фазы ГИТ II типа обнаруживаются циркулирующие антитела к комплексу PF-4/гепарин с одновременной тромбоцитопенией, что максимально увеличивает вероятность тромбообразования [568]. Восстановление количества тромбоцитов происходит примерно через одну неделю после прекращения применения гепарина натрия** у 90% пациентов, но может затянуться на несколько недель [565]. ВТЭО, чаще встречаются при ГИТ II типа, чем артериальный тромбоз [569]. Тем не менее у пациентов с ГИТ II типа может развиться артериальный тромбоз, инсульт, инфаркт, некроз надпочечников [569, 570].
Диагностика ГИТ II типа должна начинаться с оценки вероятности данного состояния с использованием балльной шкалы – шкалы 4Т (Таблица 18) [107, 570, 571]. Вторым по важности критерием подтверждения диагноза ГИТ II типа у пациентов с клиническими проявлениями является обнаружение антител к комплексу PF4/гепарин. Все существующие на сегодняшний день лабораторные тесты для диагностики ГИТ основаны на идентификации антител к комплексу PF-4/гепарин и делятся на 2 группы: антигенные (с использованием комплекса PF-4/гепарин в качестве антигена) и функциональные (тесты с активацией тромбоцитов). К антигенным тестам относят твердофазный иммуноферментный анализ и иммунотурбидиметрия; к функциональным – тест на высвобождение серотонина, исследование агрегации тромбоцитов (A12.05.017), гепарин-индуцированная агрегация тромбоцитов. Тесты на обнаружение антител обладают относительно низкой чувствительностью, но быстры в исполнении, поэтому могут использоваться в рамках первичного скрининга. Функциональные тесты характеризуются максимальной чувствительностью и должны использоваться для окончательной верификации диагноза.
Таблица 18. Клиническая балльная система оценки риска ГИТ II типа
Клинический признак | 2 балла | 1 балл | 0 баллов |
|---|
Тромбоцитопения | Снижение Тр более 50% или Тр >20х109/л | Снижение Тр на 30-50% или Тр >10-19х109/л | Снижение Тр менее 30% или Тр <10х109/л |
Время снижения количества тромбоцитов после воздействия гепарина натрия** | 5-10 сут, или в 1-е сут. (с применением гепарина в течение 30 дней в анамнезе) | >10 сут. или >1 дня (с применением гепарина в течение 30-100 дней в анамнезе) | <4 дней без анамнеза применения гепарина |
Тромбоз или другие осложнения | Новый доказанный тромбоз, некроз кожи в местах введения гепарина, острая системная реакция после внутривенного болюса гепарина натрия** (внутривенное введение лекарственных препаратов (A11.12.003) | Прогрессирующий или рецидивирующий тромбоз, эритематозные поражения кожи, подозрение на тромбоз | Отсутствие тромбоза |
Другие причины тромбоцитопении | Нет очевидных причин | Возможные причины | Определённые причины |
Примечание. Вероятность ГИТ II типа до тестирования: высокая = 6-8 баллов, промежуточная = 4-5 баллов, низкая = 0-3 балла.
- Пациентам с ТГВ и подозрением на ГИТ рекомендуется использовать балльную шкалу 4T для оценки вероятности ГИТ с принятием дальнейших решений по лабораторной диагностике и изменению режима антикоагулянтной терапии [107].
УУД 5 УУР С
Комментарий: данная шкала предусматривает подсчет баллов по 4 критериям и 3 степеням, каждой категории присваивается от 0 до 2 баллов, сумма баллов оценивает состояние пациента как: 1) низкая вероятность развития ГИТ – 0-3 балла; 2) промежуточная вероятность – 4-5 баллов и 3) высокая вероятность ГИТ – 6-8 баллов. Тем не менее, положительная прогностическая ценность шкалы не до конца надежна, и диагноз в большей степени требует подтверждения лабораторными тестами. У пациентов с низким баллом (<3) вероятность ГИТ II типа составляет менее 5%, и тестирование на антитела к комплексу PF-4/гепарин не требуется, равно как и изменение режима АКТ. У пациентов с умеренной (4-5 баллов) и высокой (6-8 баллов) клинической вероятностью необходимо выполнить лабораторный анализ на наличие антител к комплексу PF-4/гепарин, а также прекратить введение гепарина натрия** [107].
- Пациентам с ТГВ и средней или высокой вероятностью ГИТ по шкале 4Т рекомендуется прекратить введение гепаринов** (B01AB: Группа гепарина) и провести иммуноферментный анализ с последующим (в случае положительного результата) выполнением функциональных тестов (если доступны) с целью верификации диагноза [107].
УУД 5 УУР С
Комментарий: математическое моделирование на основании данных трех систематических обзоров показало, что подобный подход приведет к правильной диагностике ГИТ у 100 пациентов, к ложно-отрицательному результату на этапе клинической диагностики в 10 случаях и к необоснованному отказу от гепаринов** (B01AB: Группа гепарина) и выполнению лабораторных тестов у 408 больных на каждую 1000 лиц с подозреваемой ГИТ II типа [107].
3.7.3.3. Антикоагулянтная терапия при подозреваемой или подтвержденной ГИТ
При подозреваемой и верифицированной ГИТ II типа не рекомендуется применение гепаринов** (B01AB: Группа гепарина), а также АВК до момента восстановления уровня тромбоцитов ≥150×109/л. Отказ от использования антикоагулянтов (B01A: Антитромботические средства) в остром периоде ассоциируется с прогрессирующим увеличением риска тромботических осложнений и летального исхода [572]. Препаратами выбора служат фондапаринукс натрия, #бивалирудин [545] (АТХ группа: ингибиторы тромбина прямые, B01AE06) (постоянная инфузия: 0,05-0,1 мг/кг/час; подбор дозы по АЧТВ до достижения показателем величины, в 1,5-2,5 раза превышающей верхнюю границу нормы), или ПОАК (B01A: Антитромботические средства) (Таблица 19).
Таблица 19. Режим введения препаратов, рекомендованных к применению при ГИТ II типа
Препарат | Начальная доза | Мониторинг |
|---|
#Бивалирудин [545] (АТХ группа: ингибиторы тромбина прямые, B01AE06 ) | Болюс: не предусмотрен Постоянная инфузия: 0,05-0,1 мг/кг/час При печеночной или почечной недостаточности возможно уменьшение дозы | Подбор дозы по АЧТВ до достижения показателем величины, в 1,5-2,5 раза превышающей верхнюю границу нормы |
Фондапаринукс натрия (АТХ группа: другие антитромботические средства, B01AX) | Стандартный режим | Не предусмотрен |
ПОАК (B01A: Антитромботические средства) | Стандартный режим | Не предусмотрен |
- Пациентам с ТГВ и средней или высокой вероятностью ГИТ по шкале 4Т рекомендуется прекратить введение гепарина натрия** и начать введение альтернативного антикоагулянта (B01A: Антитромботические средства) до момента окончательной верификации или исключения диагноза [107].
УУД 5 УУР С
- Пациентам с ТГВ и подтвержденной ГИТ II типа рекомендуется проводить терапию альтернативными антикоагулянтами (B01A: Антитромботические средства) [107].
УУД 5 УУР С
Комментарий: по данным систематического обзора, включающего данные 8 исследований, по сравнительной оценке, эффективности и безопасности различных подходов к лечению ГИТ II типа, было выявлено, что переход на альтернативные антикоагулянты негепаринового ряда (B01A: Антитромботические средства) ассоциируется со снижением риска прогрессирования и рецидива тромбоза на 12-15% в сравнении с отказом от использования антикоагулянтов (B01A: Антитромботические средства) и на 50% в сравнении с переходом на АВК. В то же время, использование альтернативных антикоагулянтов (B01A: Антитромботические средства) ассоциируется с повышенным риском больших кровотечений (8-35%) преимущественно у критически больных лиц. Фондапаринукс натрия является изученным в рамках лечения ГИТ II типа препаратом, который доступен на территории РФ. По данным систематического обзора, включающего данные 9 исследований с участием 154 пациентов, использование фондапаринукса натрия (ассоциируется с развитием тромботических осложнений в 6,5% случаев, больших кровотечений – в 16,9% наблюдений и летального исхода – у 3,2% пациентов [573]. Все больше сведений накапливается по поводу возможности применения ПОАК (B01A: Антитромботические средства) при верифицированной ГИТ II типа, как у пациентов с тромбозами, так и без них. Отмечается относительно низкий риск развития тромботических и геморрагических осложнений на фоне их использования независимо от исходного уровня тромбоцитов [574–577]. Так, в одном несистематическом обзоре литературы было показано, что применение ПОАК позволяет предотвратить 98% тромботических осложнений ценой кровотечения в 3% случаев [574].
- Пациентам с ТГВ и подтвержденной ГИТ II не рекомендуется имплантация кава-фильтра*** (установка венозного фильтра (A16.12.027)) [107, 578].
УУД 4 УУР С
Комментарий: по отдельным сведениям, частота рецидива тромботических событий у больных с ГИТ II типа после имплантации кава-фильтра, временного/постоянного*** может достигать 90% [578]. Косвенные данные говорят о том, что риск развития тромботических осложнений при ГИТ II типа повышается при наличии инородных тел, например центрального венозного катетера (9,7% против 0%) [579]. По данным мета-анализа у пациентов без ГИТ имплантация кава-фильтра, временного/постоянного*** не снижает смертность от ТЭЛА [506]. Т.о., нет оснований предполагать пользу от имплантации кава-фильтра, временного/постоянного*** у пациента с ГИТ II типа.
- У пациентов с ТГВ и подтвержденной ГИТ II не рекомендуется использование АВК до восстановления уровня тромбоцитов ≥150×109/л [107, 569, 580, 581].
УУД 4 УУР С
Комментарий: у пациентов с ГИТ II типа и уровнем тромбоцитов <150×109/л использование АВК ассоциируется с крайне неблагоприятными исходами: 5 случаев кожных некрозов, 2 случая гангрены конечности и 1 ампутация у 6 пациентов [581]; 8 случаев венозной гангрены у 66 пациентов [580]; 10 случаев тромбоза у 21 пациента [569].
- Пациентам с ТГВ и подтвержденной ГИТ II не рекомендуется рутинное переливание тромбоцитсодержащих сред (гемотрансфузия (A18.05.012) при высоком риске кровотечения [107, 582].
УУД 4 УУР С
Комментарий: по результатам анализа крупной базы данных с включением информации о 6332 больных трансфузия тромбоцитарных сред (гемотрансфузия (A18.05.012) ассоциировалась с увеличением риска артериального тромбоза в 3,4 (95% ДИ, 1,2-9,5) раза и общей смертности в 5,2 (2,6-10,5) раз [582].
3.8. Особые ситуации, влияющие на тактику обследования и лечения
3.8.1. Особенности диагностики, профилактики и лечения ТГВ во время беременности и в послеродовом периоде
Детальное описание диагностики, тактики и особенностей лечения венозных тромбоэмболических осложнений, ассоциированных с беременностью, представлено в Клинических рекомендациях «Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия» (2022 г., утверждены МЗ РФ, ID:723), разработчики Российское общество акушеров-гинекологов (РОАГ), Ассоциация анестезиологов-реаниматологов (ААР), Ассоциация акушерских анестезиологов реаниматологов (АААР)) [583]. Данный раздел дополняет и уточняет указанные рекомендации.
В указанных рекомендациях затрагивается проблематика тромбоза поверхностных вен (тромбофлебита), ассоциированного с беременностью. Детальное описание диагностики, тактики и особенностей лечения тромбоза поверхностных вен (тромбофлебита) во время беременности и в послеродовом периоде представлено в Клинических рекомендациях «Флебит и тромбофлебит поверхностных сосудов» (2021 г., утверждены МЗ РФ, ID: КР668), разработчики Ассоциация флебологов России, Ассоциация сердечно-сосудистых хирургов России, Российское общество хирургов, Российское общество ангиологов и сосудистых хирургов) [584].
3.8.1.1. Формулировка диагноза
- При формулировке диагноза рекомендуется указать ассоциацию ТГВ с беременностью, а также особенности, влияющие на тактику лечения и вторичной профилактики: уровень тромбоза (дистальный/проксимальный); ориентировочную дату или календарный период начала ТГВ; наличие осложнения ТГВ в виде ТЭЛА или сопутствующую ТЭЛА [84, 583–586].
УДД 5 УУР С
Комментарий: при развитии ТГВ во время беременности или послеродового периода без наличия явных провоцирующих факторов необходимо указать ассоциацию с беременностью. При развитии ТГВ во время беременности или послеродового периода при наличии других провоцирующих факторов клиницист вправе выделить и указать ведущий провоцирующий фактор с упоминанием ассоциации тромбоза и беременности. Целесообразно перечисление в диагнозе пораженных венозных сегментов или сокращенное анатомическое обозначение уровня поражения: подвздошно-бедренный (илиофеморальный), бедренно-подколенный (феморопоплитеальный). К послеродовому периоду как фактору повышенного риска ВТЭО относят 6 недель после родов.
Примерные формулировки диагноза:
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 01.02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности в послеродовом периоде от 01.02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности (общая и наружная подвздошные вены, общая бедренная вена, бедренная вена) от 01.02.2021, ТЭЛА от 04.02.2021
- Спровоцированный большим временным фактором риска (перелом костей голени) проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 02.2021
3.8.1.2. Особенности обследования на тромбофилию
- Рекомендуется относить к основным тромбофилическим состояниям: АФС (или выявление АФС-антител), мутация гена фактора V (Лейденская) и мутация гена фактора II G20210A в гетерозиготном или гомозиготном состоянии или их сочетание, врожденный дефицит или снижение активности естественных антикоагулянтов – дефицит антитромбина (АТ), протеинов С и S [583, 586, 587].
УДД 5 УУР C
Комментарий: к факторам риска развития ВТЭО во время беременности и в послеродовом периоде относится постоянное повышение уровня волчаночного антикоагулянта и/или постоянный средний или высокий титр антител к кардиолипину и/или постоянный средний или высокий титр антител к бета-2-гликопротеину без предшествующего тромботического события [586].
Только для перечисленных состояний на сегодняшний день имеются доказательства ассоциации с риском развития ВТЭО. Степень повышения риска ВТЭО зависит от особенностей выявленных нарушений, в связи с чем распространено деление тромбофилических состояний на тромбофилии высокого и низкого риска. Для выявления указанных нарушений используются следующие тесты:
- Выявление мутаций генов факторов V и II (A27.05.018 молекулярно-генетическое исследование мутации G1691A в гене фактора V (мутация Лейдена в V факторе свертывания, A27.05.002. определение полиморфизма G20210A протромбина в гене фактора II свертывания крови)
- Определение активности антитромбина III в крови (A09.05.047 определение активности антитромбина III в крови)
- Определение уровня/активности протеинов С и S (исследование уровня протеина C в крови (A09.05.125)/определение активности протеина S в крови (A09.05.126))
- Выявление волчаночного антикоагулянта, определение содержания антител к кардиолипину и бета-2 гликопротеину в крови (B03.040.001. комплекс исследований для диагностики системной красной волчанки)
Из перечисленных только выявление мутаций генов факторов V и II являются генетическими тестами, результаты которых не зависят от проведения антикоагулянтной терапии и наличия беременности. Генетические тесты определяются 1 раз в жизни. Необходимость повторного выполнения функциональных тестов (определение активности антитромбина III в крови; определение уровня/активности протеинов С и S (исследование уровня протеина C в крови (A09.05.125)/определение активности протеина S в крови (A09.05.126)); выявление волчаночного антикоагулянта (A12.05.043 тест с ядом гадюки Рассела или тайпана), определение содержания антител к кардиолипину и бета-2 гликопротеину в крови (B03.040.001. комплекс исследований для диагностики системной красной волчанки)) определяет клиницист с учетом особенностей анамнеза и клинической ситуации. Гипергомоцистеинемия часто рассматривается как фактор риска развития ВТЭО. В частности, в этом качестве гипергомоцистеинемия включена в рекомендации RCOG [586]. Несколько мета-анализов показали некоторое повышение риска ВТЭО при гипергомоцистеинемии [586]. Однако, данные мета-анализы не позволяют корректно оценить наличие или отсутствие связи ВТЭО и гипергомоцистеинемии по ряду причин: в связи с малыми объёмами включаемых исследований отсутствует корректировка по различным известным и неизвестным параметрам, способным влиять на результат анализа (пол, возраст, прием лекарственных средств и множество других); гетерогенность в определении гипергомоцистеинемии и порогового значения уровня гомоцистеина; в мета-анализах не учитывается возможная предвзятость публикаций с переоценкой рисков; в некоторых исследованиях связь ВТЭО с гипергомоцистеинемией выделялась только в подгруппах, где другие факторы риска ВТЭО отсутствовали. Роль гипергомоцистеинемии в развитии ВТЭО регулярно подвергается сомнению в связи с низким качеством имеющихся доказательств этой роли [586]. Более того, исследования (в том числе РКИ) не показали пользы снижения уровня гомоцистеина в профилактике ВТЭО [586]. В 2018 году опубликованы результаты крупного исследования случай контроль по выявлению связи между гипергомоцистеинемией и первым ВТЭО (ТГВ и/или ТЭЛА) [586]. Анализ включал данные по 1689 пациентам с первым ВТЭО и 1726 субъектов контроля из исследования Multiple Environmental and Genetic Assessment of Risk Factors for Venous Thrombosis (MEGA). Это исследование позволило оценить ассоциации ВТЭО с гипергомоцистеинемией при выборе различных пороговых значений уровня гомоцистеина в различных подгруппах, в которых была проведена корректировка по известным и неизвестным факторам риска (скрытым переменным) за счет сравнения пациентов с «популяционными» группами контроля, сформированными с использованием метода случайного набора номеров (random-digit dialing, RDD). Анализ проведен по 5 интервалам уровня гомоцистеина, для интервала с минимальным уровнем установлено значение <66 мкмоль/л (<1,60 мг/л), для интервала с максимальным ≥94 мкмоль/л (≥2,30 мг/л). Не обнаружена связь между ВТЭО и гипергомоцистеинемией при различных уровнях гомоцистеина как у мужчин, так и у женщин. В рекомендациях ACOG 2018 г., РОАГ 2021 г., не рекомендуется исследование уровня гомоцистеина в крови (A09.05.214) и обследование на наличие полиморфизмов генов метилентетрагидрафолатредуктазы (MTHFR) (определение полиморфизма C677T метилентетрагидрофолат-редуктазы (A27.05.003)), а также не рекомендована антенатальная и постнатальная тромбопрофилактика при наличии указанных полиморфизмов или гипергомоцистеинемии [583, 587].
- При планировании беременности и отсутствии ВТЭО в анамнезе рекомендуется информировать пациентку о целесообразности обследования на основные тромбофилические состояния для определения оптимальной тактики профилактики ВТЭО [586, 587].
УДД 5 УУР C
Комментарий: выявление бессимптомной тромбофилии может повлиять на оценку риска развития ТГВ/ВТЭО при беременности и в послеродовом периоде и тактику тромбопрофилактики. В большинстве рекомендаций зарубежных профессиональных сообществ не рекомендуется скрининг на тромбофилии при планировании беременности, однако под этим понимается рутинный тотальный скрининг за счет средств здравоохранения. Под сомнение ставится именно экономическая целесообразность тотального скрининга, и такая позиция обоснована систематическим обзором с метаанализом [586]. Вместе с тем, во-первых, в клинических руководствах и рекомендациях практически всегда делаются оговорки, что обследование на тромбофилии целесообразно тогда, когда оно может повлиять на тактику тромбопрофилактики, так как снижает риск развития опасных для жизни и здоровья беременной осложнений [586, 587]. Во-вторых, в ряде рекомендаций основные тромбофилические состояния прямо указаны как факторы риска развития ВТЭО и включены в алгоритмы определения тактики тромбопрофилактики при беременности и в послеродовом периоде, то есть их выявление априори признается влияющим на определение этой тактики [586, 587]. Поэтому пациентка должна быть информирована о возможной пользе тестирования на тромбофилию при планировании беременности.
- При планировании беременности, отсутствии ВТЭО в анамнезе и наличии семейного анамнеза (подтвержденный эпизод неспровоцированного или эстроген-ассоциированного ВТЭО у родственника 1 линии в возрасте до 50 лет) для определения оптимальной тактики профилактики ВТЭО рекомендуется обследование на основные тромбофилические состояния [586].
УДД 5 УУР C
Комментарий: наличие семейного анамнеза является одиночным слабым фактором риска развития ВТЭО. Вместе с тем, выявленная тромбофилия может иметь существенно больший «вес» как фактор риска ВТЭО, т.е. результат обследования может повлиять на тактику тромбопрофилактики во время беременности и в послеродовом периоде.
- При планировании беременности и ВТЭО в анамнезе с целью оптимизации тактики профилактики ВТЭО рекомендуется определение активности антитромбина III в крови (A09.05.047) и определение содержания антител к фосфолипидам в крови (A12.06.030) [583, 586, 588–590].
УДД 5 УУР С
Комментарий: наличие ВТЭО в анамнезе автоматически относит пациентку в группу высокого риска развития ВТЭО во время беременности или в послеродовом периоде. На тактику тромбопрофилактики в такой ситуации влияет только выявление АФС или дефицита антитромбина III, когда рекомендуется применение высоких доз НМГ (B01AB: Группа гепарина) в течение всей беременности. Выявление других тромбофилических состояний на тактику тромбопрофилактики не влияет. Обследование на другие виды тромбофилии при ВТЭО в анамнезе может преследовать другие цели (например, определение потребности и объема обследования детей в пациентки) и не привязано к планированию беременности.
- При наступившей беременности и ВТЭО в анамнезе рекомендуется определение активности антитромбина III в крови (A09.05.047) и определение содержания антител к фосфолипидам в крови (A12.06.030) [583, 586].
УДД 5 УУР C
Комментарий: наличие ВТЭО в анамнезе автоматически относит пациентку в группу высокого риска развития ВТЭО во время беременности или в послеродовом периоде. Выявление бессимптомной тромбофилии в такой ситуации не может повлиять на оценку риска развития ТГВ/ВТЭО при беременности и в послеродовом периоде и тактику тромбопрофилактики, за исключением выявления дефицита антитромбина III и АФС-антител (волчаночный антикоагулянт, антитела к кардиолипину, антитела к бета-2-гликопротеину)
- При развитии ТГВ/ВТЭО во время беременности, рекомендуется определение содержания антител к фосфолипидам в крови (A12.06.030), обследование на другие тромбофилии не рекомендуется [583, 586].
УДД 5 УУР C
Комментарий: выявление тромбофилии (например, генетическими тестами) в такой ситуации не влияет на тактику лечения ТГВ/ВТЭО, а большинство функциональных тестов не рекомендуется проводить на фоне антикоагулянтной терапии или беременности [583, 586]. Целесообразным может быть определение содержания антител к фосфолипидам в крови. Согласно рекомендациям РОАГ 2021, при возникновении случая ВТЭО во время беременности не рекомендовано исследование на волчаночный антикоагулянт (A12.05.043 Тест с ядом гадюки Рассела или тайпана), но необходимо выполнить определение содержания антител к кардиолипину и антител к бета-2-гликопротеину в крови, так как это может повлиять на выбор дозы препаратов для тромбопрофилактики, а также длительность проведения антикоагулянтной терапии [583].
- Не рекомендуется использовать Д-димер для диагностики ВТЭО в период беременности и в послеродовом периоде, а также для коррекции антикоагулянтной терапии [583, 586].
УДД 5 УУР C
Комментарий: отрицательный результат (уровень Д-димеров находится в пределах референсного интервала для не беременных) достоверно не исключает текущий венозный тромбоз.
3.8.1.3. Оценка риска развития ВТЭО, порядок лечебно-диагностических мероприятий, показания к госпитализации и особенности инструментального обследования
Тактика профилактики ВТЭО в антенатальном периоде и после родов описана в пункте «5.2.9. Профилактика ВТЭО во время беременности и в послеродовом периоде».
- Рекомендуется оценка врачом-акушером-гинекологом риска развития ВТЭО антенатально (при планировании беременности или при первом посещении врача при наступившей беременности) и постнатально (после родов) [583, 591].
УДД 5 УУР С
Комментарий: оценку риска развития ВТЭО и рекомендации по тактике профилактики ВТЭО во время беременности и в послеродовом периоде по результатам сбора анамнеза, осмотра и дуплексного сканирования вен нижних конечностей вправе дать врач-хирург или врач-сердечно-сосудистый хирург с внесением результатов оценки в протокол врачебного осмотра (клиническое заключение) в произвольной форме.
- Рекомендуется считать симптомами возможной ТЭЛА одышку, кашель, кровохарканье, кратковременную потерю сознания, тахикардию; симптомами возможного ТГВ боль в конечности, отек одной конечности, болезненность при пальпации конечности [84, 365, 585, 586, 588, 592].
УДД 5 УУР С
Комментарий: указанные симптомы наиболее часто описывают в рекомендациях различных профессиональных сообществ по профилактике ВТЭО и в отдельных исследованиях как симптомы, позволяющие заподозрить наличие ТГВ и ТЭЛА. Чувствительность и специфичность этих симптомов, по всей видимости низкая. Вместе с тем выделение нескольких ключевых симптомов необходимо для формализации «клинического подозрения» развития ТГВ или ТЭЛА. Наличие одного или нескольких указанных симптомов может быть обусловлено другими причинами (не ТГВ или ТЭЛА). Трактовка симптомов в совокупности и по отдельности, отнесение или не отнесение их к признакам ТГВ или ТЭЛА является прерогативой и компетенцией клинициста.
- Рекомендуется оценка риска развития ВТЭО у беременной при подозрении на ТГВ или ТЭЛА в соответствии с Приложением Г18 для стратификации по группе риска и определения порядка проведения лечебно-диагностических мероприятий [593].
УДД 5 УУР C
Комментарий: при отсутствии клинического подозрения на ВТЭО госпитализация не требуется. Целесообразно оценить состояние вен нижних конечностей клинически. При неопределенных данных анамнеза и осмотра, подозрении на перенесенный венозный тромбоз необходимо провести ультразвуковое сканирование вен нижних конечностей ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное))
- При клиническом подозрении на ТГВ или ТЭЛА (наличии симптомов возможного ТГВ или ТЭЛА) или при выявлении ТГВ во время беременности или в послеродовом периоде рекомендуется госпитализировать пациента [593].
УДД 5 УУР С
Комментарий: легочная эмболия – одна из основных причин смерти во время беременности. Смертность от не диагностированной легочной тромбоэмболии достигает 30%, своевременная диагностика и лечение снижает смертность от ТЭЛА до 2-8% [594]. В ретроспективном анализе Peter S Heyl с соавт. отношение числа летальных исходов, связанных с беременностью, к числу живорождений (pregnancy-related mortality ratio, PRMR), составило 1,6/100 000. (при кесаревом сечении PRMR = 2,8 (95 % ДИ = 1,8-4,2), при вагинальных родах PRMR = 0,2 (95 % ДИ = 0,1-0,5). Женщины в возрасте 35 лет и старше имели самый высокий PRMR = 2,6 на 100 000 живорождений. Каждая пятая умершая (21,7%) сообщила по крайней мере о двух симптомах, указывающих на легочную эмболию за несколько дней до смерти. Ранняя диагностика тромбоэмболии легочной артерии имеет решающее значение для снижения заболеваемости и смертности от ТЭЛА во время беременности. Тактика диагностики и лечения ТГВ во время беременности должна обеспечивать эффективную профилактику и раннюю диагностику ТЭЛА. Однако многие клинические инструменты диагностики ТЭЛА (например, шкалы вероятности, стратификация пациентов на группы риска, лабораторные показатели) ограничены в применении для беременных и качественные данные оценки их применения отсутствуют. В связи с этим существуют расхождения и противоречия в рекомендациях профессиональных сообществ в отношении алгоритма диагностики ТЭЛА. Сравнительный анализ позиций профессиональных сообществ по диагностике ТЭЛА у беременных представлены в обзорах Wan T. С соавт. 2017 года и Cohen S.L. с соавт. 2020 г. [593,595]. В указанных обзорах рассмотрены рекомендации 7 зарубежных профессиональных сообществ [586,593].
- Australasian Society of Thrombosis and Haemostasis and the Society of Obstetric Medicine of Australia and New Zealand (ASTHSOMANZ)
- American Thoracic Society and Society of Thoracic Radiology (ATSSTR)
- European Association of Nuclear Medicine (EANM)
- European Society of Cardiology (ESC)
- Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH)
- Society of Obstetricians and Gynaecologists of Canada (SOGC)
- Royal College of Obstetricians and Gynaecologists (RCOG).
Ключевая информация, представленная в данных обзорах:
Шкалы вероятности (предиктивные шкалы), такие как шкала Уэллса (Wells score), пересмотренная шкала Женева (Geneva score), широко применяются у небеременных пациентов. Это балльные системы для разделения пациентов на группы риска/вероятности ТЭЛА. Беременные исключались при разработке этих шкал. Соответственно, в них учитываются факторы, важные у небеременных пациентов, но существенно менее значимые у беременных (возраст старше 65 лет, операция или перелом конечности в течение последнего месяца). В пяти из семи рекомендациях ЗПС применение шкал вероятности не рекомендуется. В рекомендациях еще одного применение шкал вероятности вообще не рассматривается. В рекомендациях ESC использование предиктивных инструментов рекомендуется, однако не указано, какую именно шкалу и как следует применять. Стратификация беременных по группам риска. Стратификация беременных по группам риска предлагается в рекомендациях 6 из 7 зарубежных профессиональных сообществ (за исключением EANM). В рекомендациях ASTHSOMANZ, ATSSTR, ESC и GTH предлагается разделение на группы высокого и «не-высокого» риска (high risk, nonhigh risk), RCOG – на группы высокого и низкого риска (high risk, low risk), SOGC – на группы низкого и «не-низкого» риска (low risk, nonlow risk). Стратификация в рекомендациях зарубежных профессиональных сообществ влияет тактику лечения и диагностики, однако, в большинстве из них не дана четкая система отнесения беременной к той или иной группе риска. В частности, рекомендации GTH содержат список факторов риска без системы оценки, рекомендации ROCG предоставляют факторы риска и систему оценки, но в версии, не учитывающей диагностические тесты. В отдельных клинических исследованиях описываются варианты стратификации беременных на группы риска ТЭЛА с использованием различных инструментов с различной точностью. Например, в работе Righini с соавторами использована пересмотренная шкала Женева [596]. В группе низкого риска оказалось 4% пациенток с ТЭЛА (7 из 192), в группе среднего риска - 9% (18 из 200), в группе высокого риска – 100% (3 из 3), при этом при дальнейшем наблюдении не зарегистрированы эпизоды эмболии у пациенток, которым не назначена медикаментозная профилактика. Имеются примеры применения адаптированных к беременности алгоритмов стратификации (алгоритм YEARS) [597]. Однако, учитывая важность стратификации риска, необходимы дальнейшие исследования, чтобы определить оптимальный алгоритм стратификации.
Эмпирическое лечение. Смерть от ТЭЛА может произойти в течение 30 минут, что намного меньше среднего времени проведения диагностических мероприятий. Ранний старт антикоагуляции у небеременных пациенток улучшает частоту развития ТЭЛА, смертность и отдаленные результаты. Таким образом, ранняя эмпирическая антикоагуляция может иметь ключевое значение в защите беременной от ТЭЛА. 4 из 7 рекомендаций зарубежных профессиональных сообществ предлагают эмпирическое лечение (антикоагуляцию) до окончания диагностических мероприятий. RCOG и ESC рекомендуют антикоагуляцию всем беременным с ТГВ при подозрении на ТЭЛА, GTH и ATSSTR – беременным с высоким риском ТЭЛА. В рекомендациях ASTHSOMANZ, EANM и SOGC эмпирическая антикоагуляция не рассматривается. Рекомендации эмпирической антикоагуляции не имеют доказательной базы преимуществ такого подхода. При этом следует учитывать, что применение антикоагулянтов несет определенные риски (геморрагические осложнения, ГИТ, теоретический риск потери плода или преждевременных родов) [598, 599].
Д-димеры. Идея использования определения концентрации Д-димера в крови (A09.05.051.001) в диагностике ТЭЛА у беременных основана на предположении, что «нормальный» уровень Д-димеров позволит надежно исключить ТЭЛА. Однако при наличии ТГВ следует учитывать его влияние на уровень Д-димеров. При отсутствии ТГВ точность отрицательного теста на Д-димеры (например, уровень Д-димеров) также сомнительна. To M.S. описал случай подтверждения ТЭЛА у пациентки после двух отрицательных тестов на Д-димеры [600]. Использование тестирования Д-димеров рекомендуется только в двух руководствах – ESC и GTH. Рекомендации GTH не учитывают степень риска ВТЭО и триместр, по ESC тестирование применимо только для беременных «не-высокого» (nonhigh risk) риска ТЭЛА. Остальные 5 сообществ (ASTHSOMANZ, ATSSTR, EANM, RCOG и SOGC) не рекомендуют использовать определение Д-димеров в комплексе диагностики ТЭЛА при беременности.
Ультразвуковое исследование вен нижних конечностей (УЗИ) до расширенной визуализации. В 2 из 7 зарубежных профессиональных сообществ (ASTHSOMANZ и EANM) не рекомендуется ультразвуковое исследование вен нижних конечностей (далее – УЗИ) до применения методов расширенной визуализации. Остальные пять зарубежных профессиональных сообществ (ATS-STR, ESC, GTH, RCOG и SOGC) предлагают диагностические алгоритмы, в которых УЗИ используется до расширенной визуализации.
Во всех пяти указанных руководствах рекомендуется дополнительное обследование при отрицательных результатах УЗИ. В ATSSTR, ESC и RCOG Узи рекомендуется только при наличии симптомов ТГВ. В GTH и SOGC рекомендуется УЗИ всем беременным при подозрении на ТЭЛА (вне зависимости от наличия симптомов ТГВ) до расширенной визуализации для отсева пациенток, которым не нужна визуализация с применением рентгеновского излучения. Рекомендации зарубежных профессиональных сообществ различаются по порядку применения УЗИ, эмпирического лечения и тестирования на Д-димеры. Из них, рекомендующих УЗИ всем пациенткам: SOGC рекомендует начать диагностические мероприятия с УЗИ; GTH рекомендует для пациенток высокого риска ТЭЛА начать с антикоагуляции с последующим определением концентрации Д-димера в крови (A09.05.051.001) до проведения УЗИ; GTH рекомендует для пациенток «не-высокого» риска начать с определения концентрации Д-димера в крови (A09.05.051.001) до проведения УЗИ. Из зарубежных профессиональных сообществ, рекомендующих УЗИ пациенткам только с симптомами ТГВ: RCOG и пациентки высокого риска по ATSSTR и ESC – начать антикоагуляцию до УЗИ; для пациенток «не-высокого» риска ATSSTR – начать с УЗИ, ESC – Д-димеры и эмпирическая антикоагуляция до УЗИ. ESC рекомендуют МР-венографию, если сохраняется подозрение на ТГВ при отрицательном УЗИ. Расширенная визуализация. Под расширенной визуализаций понимается прямая визуализация ТЭЛА с помощью КТ- ангиопульмонографии, и сцинтиграфия легких (планарная сцинтиграфия легких, вентиляционно-перфузионная сцинтиграфия легких, V/Q сцинтиграфия легких, V/Q-сканирование (сцинтиграфия легких перфузионная легких (A07.09.003)). Текущие рекомендации ЗПС расходятся в оценке необходимости предварительной (до КТ-ангиопульмонографии или сцинтиграфии) рентгенографии грудной клетки, а также в определении основного способа расширенной визуализации. Все рекомендации содержат ремарку: необходимо провести любое доступное исследование расширенной визуализации, чтобы предотвратить задержку лечения.
В описанной выше работе Cohen S.L. с соавт. 2020 г. по сравнительному анализу позиций 7 профессиональных сообществ по диагностике ТЭЛА у беременных (ASTHSOMANZ, ATSSTR, EANM, ESC, GTH, SOGC, RCOG) предлагается авторский тактико-диагностический алгоритм [593]. Особого внимания требует рекомендация авторов при клиническом подозрении на ВТЭО и отрицательных данных УЗИ использовать методы расширенной визуализации ТЭЛА. Это подразумевает, что в описанной ситуации беременная должна быть госпитализирована. Выявление ТГВ также не исключает необходимости выполнения дополнительных исследований (КТ-ангиопульмонографии или рентгенография легких (A06.09.007) с последующей сцинтиграфией легких).
- При подозрении на ТЭЛА (наличии симптомов возможной ТЭЛА) во время беременности и в послеродовом периоде и отнесении пациентки к группе не-низкого риска развития ВТЭО в соответствии с Приложением Г19 рекомендуется до проведения диагностических мероприятий начать терапию лечебными дозами НМГ (B01AB: Группа гепарина) по текущему весу или по весу пациентки на момент наступления беременности [84, 601–605].
УДД 5 УУР С
- При подозрении на на тромбоз глубоких вен, осложнившийся ТЭЛА во время беременности и в послеродовом периоде и отнесении пациентки к группе низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется направить беременную на госпитализацию не начиная терапии антикоагулянтами (B01A: Антитромботические средства [84, 601–605].
УДД 5 УУР С
- При подозрении на ТГВ (наличии симптомов возможного ТГВ) во время беременности и в послеродовом периоде, отсутствии возможности немедленного проведения ультразвукового исследования и отнесении пациентки к группе не-низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется начать терапию лечебными дозами НМГ (B01AB: Группа гепарина) по текущему весу или по весу пациентки на момент наступления беременности и направить беременную на госпитализацию [84, 601–605].
УДД 5 УУР С
- При подозрении на ТГВ во время беременности и в послеродовом периоде, отсутствии возможности немедленного проведения ультразвукового исследования и отнесении беременной к группе низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется направить беременную на госпитализацию не начиная терапию антикоагулянтами (B01A: Антитромботические средства) [84, 601–605].
УДД 5 УУР C
- При подозрении на ТГВ во время беременности и в послеродовом периоде и возможности немедленного проведения ультразвукового исследования рекомендуется выполнить УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) [85, 584, 591].
УДД 5 УРР C
Комментарий: основным методом инструментальной диагностики ТГВ служит ультразвуковое триплексное сканирование вен нижних конечностей. Ультразвуковое исследование вен нижних конечностей для подтверждения диагноза может выполнить любой специалист, занимающийся диагностикой и лечением заболеваний вен и имеющий практический опыт выполнения ультразвукового исследования. Ультразвуковое исследование вен с оформлением заключения (протокола) должно проводиться врачом ультразвуковой диагностики. Врач-хирург, врач-сердечно-сосудистый хирург вправе использовать УЗИ-аппарат при осмотре пациента для сканирования вен с целью уточнения особенностей состояния или поражения венозной системы и определения тактики профилактики и лечения [584]. Запись с интерпретацией и клинической оценкой обнаруженных при сканировании особенностей и характеристик вен конечностей вносится в протокол врачебного осмотра (клиническое заключение) в произвольной форме.
- При подозрении на ТГВ (наличии симптомов возможного ТГВ) во время беременности и в послеродовом периоде и отрицательных данных дуплексного сканирования вен нижних конечностей рекомендуется направить беременную на госпитализацию не начиная терапию антикоагулянтами (B01A: Антитромботические средства) для окончательного исключения ВТЭО [84, 601–605].
УДД 5 УУР С
Комментарий: госпитализация в описанной ситуации призвана обеспечить возможность достоверного исключения изолированного тромбоза подвздошных вен и/или проведения серии ультразвуковых исследований в динамике, а также исключения ТЭЛА. Возможности ультразвукового исследования в диагностике ТГВ подвздошных вен весьма ограничены. По данным Torkzad с соавт., между 23 и 37 неделями беременности с помощью УЗИ выявляется около 42% тромбозов тазовых вен, в то время как с помощью МРТ (магнитно-резонансная венография (A05.12.005)) удалось диагностировать 98,5% [606]. Предпочтительны протоколы МРТ (магнитно-резонансная венография (A05.12.005)) без применения парамагнитных контрастных средств. В приведенной выше работе Cohen S.L. с соавт. 2020 г. по сравнительному анализу позиций 7 профессиональных сообществ по диагностике ТЭЛА у беременных (ASTHSOMANZ, ATSSTR, EANM, ESC, GTH, SOGC, RCOG) особого внимания заслуживает рекомендация авторов при клиническом подозрении на ВТЭО и отрицательных данных УЗИ использовать методы расширенной визуализации ТЭЛА [593]. Окончательно необходимость госпитализации для наблюдения или обследования в условиях стационара определяет врач-хирург или врач-сердечно-сосудистый хирург стационара при поступлении пациентки.
- Не рекомендуется рутинно использовать методы расширенной визуализации с лучевой нагрузкой для оценки состояния проксимального сегмента тромба во время беременности [606, 607].
УДД 4 УУР C
Комментарий: в рекомендациях зарубежных профессиональных сообществ КТ-АПГ и сцинтиграфия легких (планарная сцинтиграфия легких, вентиляционно-перфузионная сцинтиграфия легких, V/Q сцинтиграфия легких, V/Q-сканирование) методы расширенной визуализации предлагаются только для диагностики ТЭЛА. Состояние проксимального сегмента тромба у беременной в большинстве случаев не влияет на тактику лечения. Основные методы визуализации в диагностике ТГВ и тромбоза вен таза во время беременности – неинвазивные и неионизирующие, ультразвуковое сканирование вен ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) и МРТ (магнитно-резонансная венография (A05.12.005)). Лучевые методы могут применяться в особых ситуациях (например, необходимость проведения тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) при угрозе конечности, рассмотрение целесообразности постановки кава-фильтра, временногто/постоянного*** при невозможности проведения антикоагулянтной терапии, необходимость диагностики (подозрение на тромбоз вен таза) при недоступности МРТ (магнитно-резонансная венография (A05.12.005)) и т.п.).
- При отрицательном результате ультразвукового сканирования и сохранении симптомов возможного ТГВ рекомендуется повторение УЗАС вен нижних конечностей ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) [591].
УДД 5 УУР C
Комментарий: при сохранении симптоматики целесообразно провести повторное ультразвуковое сканирование вен нижних ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) также на 7 день от первого исследования [591].
- При отрицательном результате триплексного сканирования, сохранении симптомов возможного ТГВ и возможности амбулаторного наблюдения (доступность проведения дуплексного сканирования вен нижних конечностей в динамике, предпочтение амбулаторного наблюдения пациенткой, доступность неотложной медицинской помощи) рекомендуется наблюдение и повторение триплексного сканирования нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [591].
УДД 5 УУР C
- При выявлении любого ТГВ во время беременности и в послеродовом периоде рекомендуется начать терапию лечебными дозами НМГ (B01AB: Группа гепарина) [591].
УДД 5 УУР C
- Не рекомендуется использовать лабораторные показатели (коагулограмма (ориентировочное исследование системы гемостаза) (B03.005.006), определение концентрации Д-димера в крови (A09.05.051.001)) в оценке риска развития или в диагностике ТГВ при беременности и в послеродовом периоде [591].
УДД 5 УУР C
- Рекомендуется выписка на амбулаторное лечение ТГВ во время беременности или в послеродовом периоде при следующих условиях [591]:- отсутствие угрозы потери конечности- отсутствие прогрессирования ТГВ в период наблюдения на фоне АКТ- отсутствие признаков ТЭЛА в период наблюдения на фоне АКТ- доступность и возможность наблюдения и проведения антикоагулянтной терапии амбулаторно.
УДД 5 УУР C
3.8.1.4. Особенности терапии ТГВ во время беременности и в послеродовом периоде
- При необходимости проведения терапии с помощью НМГ (B01AB: Группа гепарина) рекомендуется подбор дозы по текущему весу или по весу пациентки на момент наступления беременности [592].
УДД 5 УУР C
- При развитии ТГВ /ВТЭО во время беременности рекомендуется антикоагулянтная терапия лечебными дозами НМГ (B01AB: Группа гепарина) до завершения беременности и не менее 6 недель после родов при общей продолжительности терапии не менее 3 месяцев [591].
УДД 5 УУР С
- Не рекомендовано назначать антикоагулянтную терапию при повышении уровня Д-димеров в отсутствие клинических признаков ВТЭО [583, 608, 609].
УДД 3 УУР В
- Рекомендуется для определения показаний к компрессионной терапии при беременности и в послеродовом периоде использовать показания к компрессионной терапии для небеременных (эластическая компрессия нижних конечностей (A15.12.002)) [586, 610].
УДД 5 УУР С
- При развитии во время беременности ТГВ рекомендуется как можно более ранее (немедленное) начало компрессионной терапии (эластическая компрессия нижних конечностей (A15.12.002)) с целью уменьшения боли, ощущения отека, обеспечения ранней активизации беременной и профилактики развития ПТБ [610].
УДД 5 УУР С
- При ТГВ у беременной в анамнезе, рекомендуется применение компрессионной терапии (эластическая компрессия нижних конечностей (A15.12.002)) во время беременности при наличии симптомов и проявлений ПТБ с целью уменьшения/устранения этих симптомов [610].
УДД 5 УУР С
Комментарий: основное назначение компрессионной терапии (эластическая компрессия нижних конечностей (A15.12.002)) при перенесенном ТГВ – уменьшение или устранение симптомов и проявлений ПТБ («венозных» симптомов и отеков). Целесообразность применения компрессионной терапии и ее параметры определяет клиницист с учетом особенностей клинического случая.
3.8.2. Инвазивные вмешательства на фоне антикоагулянтной терапии
Использование антикоагулянтной терапии у пациентов, которым предстоит инвазивное вмешательство, представляет собой сложную задачу: с одной стороны, отмена АКТ временно увеличивает риск ВТЭО, с другой – любое хирургическое пособие увеличивает риск геморрагических осложнений. В случае развития последних потребуется отмена антикоагулянтной терапии на длительный срок, что повлечет за собой увеличение риска ВТЭО. Поэтому необходимо уравновесить эти два возможных события. Для этого необходимо оценить риск ВТЭО (таблица 20), риск геморрагических осложнений (таблица 2), определить время отмены АКТ, решить, использовать мост-терапию, или нет.
Таблица 20. Периоперационный риск ВТЭО
Риск ВТЭО | Показания для АКТ |
|---|
| Механические клапаны сердца | Фибрилляция предсердий | ВТЭО |
Высокий риск | Протезирование митрального клапана Протезирование аортального клапана (шаровой, или дисковый) Недавний (в течение 6 месяцев) ишемический инсульт или транзиторная ишемическая атака | CHA2DS2-VASc – 7-9 баллов (Приложение Г21) Недавний ишемический инсульт (3 месяца) или транзиторная ишемическая атака Ревматическая болезнь сердца | Недавнее ВТЭО (3 месяца) Тяжелые тромбофилии ( дефицит протеина С, протеина S, антитромбина III, антифософлипидный синдром) |
Средний риск | Двустворчатый аортальный клапан в сочетании с: фибрилляцией предсердий, перенесенный инсульт или транзиторная ишемическая атака, гипертонической болезнью, сахарный диабет, ХСН, возраст старше 75 лет | CHA2DS2-VASc – 4-6 баллов | ВТЭО в течение 3-12 месяцев Нетяжелая тромбофилия Рецидив ВТЭО в анамнезе Онкология |
Низкий риск | Двустворчатый аортальный клапан без фибрилляции предсердий и факторов риска для ишемического инсульта | CHA2DS2-VASc – 0-3 баллов | ВТЭО в анамнезе более 12 месяцев Нет других факторов риска ВТЭО |
Таблица 21. Риск геморрагических осложнений [85].
Минимальный риск кровотечения |
|---|
Стоматология | Экстракция 1-3 зубов, парадонтальная хирургия, вскрытие абсцесса (вскрытие и дренирование флегмоны (абсцесса) A16.01.012), имплантация зубного протеза |
Офтальмология | Лечение катаракты или глаукомы |
Эндоскопия | Эндоскопия без биопсии или резекции (пищевод, желудок, кишечник, трахея и бронхи) |
Дерматология и хирургия | Удаление новообразований кожи и подкожной жировой клетчатки, вскрытие абсцесса подкожной жировой клетчатки (вскрытие и дренирование флегмоны (абсцесса) A16.01.012). |
Сердечно-сосудистая хирургия | Эндовенозные вмешательства на поверхностных венах, склерооблитерация поверхностных вен, минифлебэктомия |
Низкий риск кровотечения (низкая частота кровотечений и/или с незначительными последствиями кровотечения) |
Эндоскопия | Эндоскопия с биопсией (пищевод, желудок, кишечник, трахея и бронхи) (биопсия тканей трахеи под контролем трахеоскопического исследования (A11.08.012.001); биопсия трахеи, бронхов при бронхоскопии (A11.09.008); биопсия пищевода с помощью эндоскопии (A11.16.001); биопсия желудка с помощью эндоскопии (A11.16.002); биопсия ободочной кишки эндоскопическая (A11.18.001); биопсия сигмовидной кишки с помощью видеоэндоскопических технологий (A11.19.001); биопсия прямой кишки с помощью видеоэндоскопических технологий (A11.19.002) |
Урология | Биопсия простаты или мочевого пузыря (биопсия предстательной железы под контролем ультразвукового исследования (A11.21.005.001); биопсия мочевого пузыря (A11.28.002) |
Рентгенэндоваскулярные диагностика и лечение | Некоронарная ангиография |
Аритмология | Электрофизиологическое исследование (внутрисердечное электрофизиологическое исследование (A05.10.006.002) или катетерная абляция, имплантация кардиостимулятора или имплантируемого кардиовертера-дефибриллятора (имплантация двухкамерного кардиовертера дефибриллятора (A16.10.014.007)) (кроме сложных анатомических условий, например, врожденный порок сердца). |
Высокий риск кровотечения (частые кровотечения и/или большие клинически значимые кровотечения) |
Эндоскопия | Сложные видеоэндоскопические манипуляции |
Торакальная хирургия | Все вмешательства |
Абдоминальная хирургия | Все вмешательства |
Ортопедия | Большая ортопедическая хирургия |
Урология | Трансуретральная резекция простаты (A16.21.002), экстракорпоральная ударно-волновая литотрипсия (ЭУВЛ) (ударно-волновая терапия (A22.30.015)) |
Любая специальность | Биопсия внутренних органов, поясничная диагностическая пункция (спинномозговая пункция (A11.23.001)) |
Анестезиология и реанимация | Спинальная или эпидуральная анестезия (спинальная анестезия (B01.003.004.007); |
Оценив риск ВТЭО и геморрагических осложнений следует принять решение о дальнейшей АКТ исходя из следующего: высокий риск геморрагических осложнений – отмена антикоагулянтной терапии, в случае высокого риска ВТЭО – рассмотреть возможность мост-терапии; в случае низкого риска геморрагических осложнений – возможно возобновление и дальнейшее продолжение АКТ.
- Рекомендуется не изменять режим приема антикоагулянтов (B01A: Антитромботические средства) у пациентов, которым планируется хирургическое вмешательство с низким риском геморрагических осложнений [611–616].
УДД 3 УУР С
Комментарий: стоматологическая хирургия обычно сопровождается незначительным риском кровотечения и возможностью адекватного местного гемостаза [611]. Однако рекомендации часто основаны на невысоком качестве доказательств фармакологических протоколов и исследований [612]. Удаление зубов обычно безопасно в амбулаторных условиях без прерывания антикоагуляции или прерывание путем однократного пропуска очередной дозы ПОАК (B01A: Антитромботические средства). благодаря возможности обеспечить надежный местный гемостаз [613–616]. Перипроцедурный гемостаз обеспечивается применением окисленной целлюлозы (АТХ группа: гемостатические средства для местного применения, B02BC02) или абсорбирующей желатиновой губки (АТХ группа: гемостатические средства для местного применения, B02BC01), хирургического шва, жидкости для полоскания рта #транексамовой кислотой** или компрессионной марли, пропитанной #транексамовой кислотой** (полоскание полости рта раствором 4,8-10% #транексамовой кислоты** по 1-2 минуте 3-4 раза в день) [617].
3.8.2.1. Мост-терапия
Мост-терапия подразумевает использование парентерального антикоагулянта (B01A: Антитромботические средства) с коротким периодом полувыведения (НФГ (гепарин натрия**) или НМГ (B01AB: Группа гепарина)) в период отмены орального антикоагулянта (АВК или ПОАК (B01A: Антитромботические средства), принимаемого на постоянной основе.
- У всех пациентов, принимающих оральные антикоагулянты (B01A: Антитромботические средства), в период прерывания терапии рекомендуются использовать механические и фармакологические средства профилактики ВТЭО в соответствии с оцененным риском [618–626].
УДД 1 УУР А
Комментарий: подходы к периоперационной профилактике ВТЭО обсуждаются в соответствующем разделе. Механические, фармакологические и комбинированные методы профилактики должны использоваться у всех пациентов на основании индивидуальной оценки риска ВТЭО и кровотечения. Лица с наличием ТГВ/ТЭЛА в анамнезе, как правило, имеют умеренный (малая хирургия) или высокий (большая хирургия) риск ВТЭО, что требует введения профилактических доз антикоагулянтов (B01A: Антитромботические средства). Таким образом, обсуждаемые вопросы о целесообразности использования мост-терапии касаются преимущественно повышенных (промежуточных и лечебных) доз.
- Рекомендуется применение мост-терапии в предоперационном и послеоперационном периодах у пациентов с высоким риском ВТЭО [627–629].
УДД 5 УУР С
- Рекомендуется в качестве мост-терапии использовать низкомолекулярные гепарины (B01AB: Группа гепарина: далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07) [630–632].
УДД 4 УУР С
Комментарий: терапевтическую дозу НМГ (B01AB: Группа гепарина) следует использовать у пациентов с фибрилляцией предсердий, механическими клапанами сердца, ВТЭО в анамнезе в течение предшествующего месяца. Промежуточные дозы применяют в этих же случаях, но у пациентов с высоким риском геморрагических осложнений [630, 633, 634].
- При использовании в качестве мост-терапии НМГ (B01AB: Группа гепарина) рекомендуется прекращение его введения за 24 часа до планируемого инвазивного вмешательства [120, 635, 636].
УДД 4 УУР C
- При использовании в качестве мост-терапии НФГ** рекомендуется прекращение его введения при внутривенной инфузии (внутривенное введение лекарственных препаратов (A11.12.003) за 5 часов до процедуры, при подкожном введении (подкожное введение лекарственных препаратов (A11.01.002)) за 12 часов [120, 627, 637].
УДД 4 УУР C
- У пациента с ТГВ в случае прерывания терапии оральными антикоагулянтами (B01A: Антитромботические средства) решение о возобновлении АКТ после инвазивного вмешательства рекомендуется принимать на основании индивидуальной оценки риска геморрагических осложнений (клиническая оценка гемостаза, количество отделяемого по дренажам и его характер, уровень гемоглобина и пр.) [638].
УДД 2 УУР С
- У пациентов с высоким периоперационным риском геморрагических осложнений рекомендуется начинать введение терапевтических доз НМГ (B01AB: Группа гепарина) или НФГ (гепарин натрия**) не ранее чем через 48-72 часа [639–642].
УДД 2 УУР В
- У пациентов с низким периоперационным риском геморрагических осложнений рекомендуется начинать введение терапевтических доз НМГ (B01AB: Группа гепарина) или НФГ (гепарин натрия**) в течении 24 часов [639–641].
УДД 2 УУР В
3.8.2.2. Инвазивные вмешательства на фоне ПОАК (B01A: Антитромботические средства)
- Для хирургических вмешательств с минимальным риском кровотечения и тех процедур, при которых кровотечение легко контролируется не рекомендуется рутинная отмена ПОАК (B01A: Антитромботические средства) [611–616].
УДД 3 УУР C
- Пациенту, принимающему ПОАК (B01A: Антитромботические средства) на постоянной основе, рекомендуется прервать терапию на период операции или инвазивной процедуры без проведения мост-терапии [639, 643, 644].
УДД 4 УУР C
Комментарий: снижение антикоагулянтного эффекта ПОАК (B01A: Антитромботические средства) предсказуемо, что позволяет спланировать кратковременное прекращение терапии ПОАК (B01A: Антитромботические средства) перед операцией. Вместе с тем доказано, что, использование двух антикоагулянтов (B01A: Антитромботические средства) повышает риск кровотечения [643]. В исследованиях ПОАК (B01A: Антитромботические средства) у пациентов с фибрилляцией предсердий (ROCKET AF, RE-LY) прерывание терапии встречалось в 25-30% случаев и не сопровождалось увеличением риска тромботических осложнений независимо от использования мост-терапии [645, 646]. При этом риск развития больших кровотечений существенным образом увеличивался на фоне периоперационного введения препаратов группы гепарина. По данным Дрезденского регистра, мост-терапия в период прерывания ПОАК (B01A: Антитромботические средства) не приводила к снижению риска развития тромботических осложнений (1,2% против 0,2%), но ассоциировалась с достоверным увеличением риска больших (2,3% против 0,2%) и любых (3,9% против 0,7%) кровотечений [643]. Проспективное когортное исследование PAUSE с участием 3007 пациентов, принимающих ПОАК (B01A: Антитромботические средства) по поводу фибрилляции предсердий, продемонстрировало безопасность отмены препарата за 1-4 дня (в зависимости от риска геморрагических осложнений и КлКр) и возобновление его приема через 1-2 дня после операции [644]. Риск развития тромботических и геморрагических осложнений оказался не увеличен в сравнении с прогнозируемыми величинами. Также было продемонстрировано отсутствие необходимости измерения остаточной активности препарата в плазме крови при своевременной отмене препарата. Таким образом, на сегодняшний день отсутствуют данные о необходимости мост-терапии в период прерывания терапии ПОАК (B01A: Антитромботические средства).
- При низком/среднем риске геморрагических осложнений рекомендуется отмена ПОАК (B01A: Антитромботические средства) за 24 часа до вмешательства и возобновление приема возможно через 24 часа после манипуляции (таблица 22) [647].
УДД 3 УУР В
- При высоком риске геморрагических осложнений рекомендуется отмена приема ПОАК (B01A: Антитромботические средства) за 48 часов до выполнения планового инвазивного вмешательства. Возобновление приема рекомендуется начать через 48 часов после выполнения вмешательства (таблица 22) [647].
УДД 3 УУР В
- У пациентов с клиренсом креатинина ниже 30-50 мл/мин рекомендуется отмена дабигатрана этексилата** за 48 часов при низком риске геморрагических осложнений, и за 72 часа при высоком. При использовании прямых ингибиторов Ха фактора (B01AF: Прямые ингибиторы фактора Xa) нет необходимости ориентироваться на скорость клубочковой фильтрации (таблица 22) [647].
УДД 3 УУР В
Таблица 22. Срок отмены ПОАК (B01A: Антитромботические средства) перед плановым оперативным вмешательством [648].
Препарат | Дабигатран этексилат ** | Апиксабан** | Ривароксабан** |
|---|
Риск кровотечения | Низкий | Высокий | Низкий | Высокий | Низкий | Высокий |
КлКр (мл/мин) | ≥80 | ≥24 ч | ≥48 ч | ≥24 ч | ≥48 ч | ≥24 ч | ≥48 ч |
50-80 | ≥36 ч | ≥72 ч | ≥24 ч | ≥48 ч | ≥24 ч | ≥48 ч |
30-50 | ≥48 ч | ≥96 | ≥24 ч | ≥48 ч | ≥24 ч | ≥48 ч |
15-30 | Противопоказан | ≥36 ч | ≥48 ч | ≥36 ч | ≥48 ч |
<15 | Противопоказан | Противопоказан | Противопоказан |
- Рекомендуется возобновление приема ПОАК (B01A: Антитромботические средства) после планового оперативного вмешательства в течение 24 часов (низкий геморрагический риск) или 48 часов (высокий геморрагический риск) после завершения вмешательства на при условии достижения стабильного гемостаза [644].
УДД 4 УУР C
3.8.2.3. Инвазивные вмешательства на фоне варфарина**
- Рекомендуется отмена варфарина** за пять дней до планируемого вмешательства и контроль МНО за 1 день до манипуляции [637, 639, 641, 649–651].
УДД 4 УУР C
Комментарий: выполнение вмешательства возможно если МНО за день до оперативного вмешательства <1,5 [649, 650]. Возможно более продолжительное время для нормализации МНО у пациентов пожилого возраста, с высоким терапевтическим окном варфарина** (МНО 2,5-3,5) [651].
- Возобновление приема варфарина** после манипуляции рекомендуется через 24 часа [637, 639, 641, 649].
УДД 4 УУР C
Комментарий: после выполнения манипуляции следует использовать ту же дозу варфарина**, что и до вмешательства. Обычно период достижения целевых показаний МНО составляет 5-6 дней, поэтому в этот период необходимо использовать НФГ (гепарин натрия**) или НМГ (B01AB: Группа гепарина) в качестве мост-терапии.
- Для хирургических вмешательств с низким и высоким риском кровотечения у пациентов с низким риском ВТЭО при отмене АВК не рекомендуется мост-терапия [637, 639, 641, 647, 652].
УДД 3 УУР В
3.8.2.4. Экстренные или срочные вмешательства
- При необходимости выполнения экстренного или срочного оперативного вмешательства на фоне терапии АВК рекомендуется переливание свежезамороженной плазмы (СЗП) (гемотрансфузия (A18.05.012) для нормализации системы гемостаза [550, 553, 653].
УДД 3 УУР С
- При необходимости выполнения экстренного или срочного оперативного вмешательства на фоне терапии АВК рекомендуется переливание концентрата протромбинового комплекса (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**) (гемотрансфузия (A18.05.012) для нормализации системы гемостаза [550, 551, 654].
УДД 2 УРР А
Комментарий: трехкомпонентные концентраты протромбинового комплекса** (Факторы свертывания крови II, IX и X в комбинации**) могут потребовать дополнительной инфузии СЗП, в то время как основным осложнением 4-х компонентного КПК (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**) являются тромбозы. Поэтому применение последнего должно быть максимально оправдано. По данным мета-анализа, объединяющего исследования по коррекции системы гемостаза у пациентов, длительно принимающих АВК с развитием угрожающего жизни кровотечения или потребности в экстренном оперативном вмешательстве, применение факторов свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** в сравнении с СЗП ассоциируется со снижением общей смертности и более быстрой нормализацией МНО [550].
- В случае экстренного оперативного вмешательства у пациентов, принимающих прямые оральные антикоагулянты (B01A: Антитромботические средства) рекомендуется рассмотреть возможность применения специфических средств для инактивации [553].
УДД 3 УРР С
Комментарий: эффективность и безопасность применения препаратов при угрожающих жизни кровотечениях обсуждается в соответствующем разделе. Идаруцизумаб изучался у пациентов, длительно принимающих дабигатран этексилата** и требующих экстренного оперативного вмешательства [553, 557].
- В случае экстренного оперативного вмешательства у пациентов, принимающих прямые оральные антикоагулянты (B01A: Антитромботические средства) рекомендуется рассмотреть возможность применения неспецифических антидотов, таких как различные варианты #факторов свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** [85, 132, 555].
УДД 2 УУР В
Комментарий: по данным мета-анализа применение различных видов #факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]** у пациентов, принимающих ПОАК (B01A: Антитромботические средства) с развитием большого кровотечения или потребности в экстренном хирургическом вмешательстве ассоциируется с достижением эффективного гемостаза в 69-77% случаев [555].
3.8.3. Нейроаксиальная анестезия у пациентов, получающих АКТ
Нейроаксиальную анестезию (спинальная анестезия (B01.003.004.007) использует в качестве интраоперационного обезболивания, для купирования болевого синдрома в послеоперационном периоде, в послеродовом периоде, либо для лечения хронической боли. Пациенты, получающие АКТ, подвержены повышенному риску геморрагических осложнений нейроаксиальной анестезии, в первую очередь эпидуральной гематомы позвоночника [655, 656].
- Не рекомендуется выполнять нейроаксиальную анестезию (спинальная анестезия (B01.003.004.007) у пациентов, получающих несколько антитромботических препаратов (B01A: Антитромботические средства) [657].
УУД 5 УРР C
- У пациентов, получающих НФГ (гепарин натрия**) внутривенно (внутривенное введение лекарственных препаратов (A11.12.003), рекомендуется прекращение инфузии за 4-6 часов до применения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) и определение АЧТВ [657–659].
УДД 5 УРР C
- Возобновление внутривенной инфузии НФГ (гепарин натрия**) (внутривенное введение лекарственных препаратов (A11.12.003) рекомендовано не ранее, чем через 1 часа после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) [657, 659].
УДД 5 УРР C
Комментарий: при нейроаксиальной анестезии, выполненной травматично, возобновление инфузии НФГ (гепарин натрия**) необходимо отложить на 24 часа [660].
- У пациентов, получающих НФГ (гепарин натрия**) подкожно (подкожное введение лекарственных препаратов (A11.01.002)), нейроаксиальную анестезию (спинальная анестезия (B01.003.004.007) рекомендовано выполнять не ранее, чем через 6 часов после последней инъекции НФГ** [657, 661, 662].
УДД 5 УРР C
- Возобновлять подкожное введение НФГ (гепарин натрия**) (подкожное введение лекарственных препаратов (A11.01.002)) рекомендуется не ранее, чем через 2 часа после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) [657, 661, 662].
УДД 4 УРР C
- У пациентов, получающих НМГ (B01AB: Группа гепарина) в профилактических дозировках, нейроаксиальную анестезию (спинальная анестезия (B01.003.004.007) рекомендовано выполнять не ранее, чем через 12 часов после последней инъекции НМГ (B01AB: Группа гепарина) [638, 663].
УДД 2 УРР С
- У пациентов, получающих НМГ (B01AB: Группа гепарина) в лечебных дозировках, нейроаксиальную анестезию (спинальная анестезия (B01.003.004.007) рекомендовано выполнять через 24 часа после последнего введения НМГ (B01AB: Группа гепарина) [638, 663].
УДД 2 УРР С
- Возобновлять подкожное введение НМГ (B01AB: Группа гепарина) (подкожное введение лекарственных препаратов (A11.01.002)) рекомендовано не ранее чем 4 часа после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) [657, 664].
УДД 5 УРР C
Комментарий: в случае травматичного выполнения пункции межоболочечных пространств спинного мозга следует воздержаться от возобновления введения НМГ (B01AB: Группа гепарина) на 12 часов [664].
- При использовании фондапаринукса натрия рекомендуется либо воздержаться от выполнения нейроаксиальной анестезии, либо выполнять вмешательство не ранее, чем через 4 дня после последней инъекции [657, 665, 666].
УДД 5 УРР С
- Возобновлять введение фондапаринукса натрия после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) рекомендуется не ранее чем через 6 часов после манипуляции, в случае травматичного выполнения – не ранее чем через 24 часа [665].
УДД 3 УРР В
- Выполнение нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) у пациентов, принимающих ПОАК (B01A: Антитромботические средства), рекомендовано не ранее чем через 5 периодов полувыведения антикоагулянта (B01A: Антитромботические средства) [667, 668].
УДД 5 УРР С
Комментарий: ривароксабан** имеет период полувыведения от 5 до 9 часов, апиксабан** – в среднем 12 часов, эдоксабан от 10 до 14 часов, дабигатрана этексилат** от 12 до 17 часов. Основываясь на этих данных, безопасная пункция межоболочечных пространств спинного мозга возможна через 3-5 дней после последнего приема того или иного препарата. Необходимо оценивать скорость клубочковой фильтрации по формуле CKD-EPI, в случае снижения ее ниже 30 мл/мин – рассматривать иные методы анестезии [668]. В ситуациях, когда у пациента высокий риск рецидива ВТЭО рекомендуется рассмотреть переход на НМГ (B01AB: Группа гепарина), которые можно отменить за более короткий срок до выполнения пункции. Временные выполнения нейроаксиальной анестезии у пациентов, принимающих АКТ представлены в таблице 23.
- Возобновлять прием ПОАК (B01A: Антитромботические средства) рекомендуется не ранее, чем через 24 часа после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) [639, 669, 670].
УДД 5 УРР С
- Рекомендуется прекратить прием АВК за 5 дней до планируемой нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007), выполнение которой будет возможно при нормальных показателях МНО [668].
УДД 5 УРР С
- Возобновлять прием АВК рекомендуется не ранее, чем через 24 часа после выполнения нейроаксиальной анестезии (спинальная анестезия (B01.003.004.007) [668].
УДД 5 УРР С
Таблица 23. Временные интервалы для выполнения нейроаксиальной анестезии у пациентов, получающих АКТ
Антикоагулянт (B01A: Антитромботические средства) | Время от последнего приема препарата до выполнения пункции | Время от выполнения пункции до возобновления приема препарата |
|---|
Варфарин** | 5 дней | 24 часа |
НФГ (гепарин натрия**) в/в (внутривенное введение лекарственных препаратов (A11.12.003) | 4-6 часов | 2 часа |
НФГ (гепарин натрия**) п/к профилактические дозы | 6 часов | 2 часа |
НФГ(гепарин натрия**) (п/к, терапевтические дозы | 12 часов | 2 часа |
НМГ (B01AB: Группа гепарина, профилактические дозы | 12 часов | 4 часа |
НМГ (B01AB: Группа гепарина, терапевтические дозы | 24 часа | 4 часа |
Фондапаринукс натрия | 4 дня | 6 часов, в случае травматичного выполнения манипуляции – 24 часа |
Ривароксабан** | 3 дня | 6 часов |
Апиксабан** | 3 дня | 6 часов |
Эдоксабан | 3 дня | 6 часов |
Дабигатрана этексилат** | 5 дней | 6 часов |
3.8.4. Тактика лечения пациентов онкологического профиля с ТГВ/ТЭЛА
- У пациента с установленным онкологическим диагнозом с активным раком и наличием ТГВ/ТЭЛА рекомендуется проведение антикоагулянтной терапии на протяжении не менее 6 мес. АКТ, до тех пор, пока онкологический процесс не будет излечен, с последующей оценкой баланса риска и пользы продления антикоагуляции [88, 280, 671, 672].
УДД 1 УУР В
Комментарий: под активным раком понимают первичную диагностику рака или любое лечение по поводу рака, начатое в течение 6 мес. до момента диагностики ВТЭО, наличие рецидивного, метастатического рака или заболевания вне ремиссии в момент диагностики ВТЭО [673]. Частота повторных ВТЭО у пациентов со злокачественными новообразованиями в течение 1-го года лечения достигает 20,7% по сравнению с пациентами без онкологических заболеваний, частота больших кровотечений – 12,4% и 4,9%, соответственно [671].
- У пациента с активным раком рекомендуются рассмотреть продление антикоагулянтной терапии сверх 6 мес. до полного излечения заболевания [88, 334].
УДД 1 УУР А
Комментарий: под активным раком через 6 мес. лечения антикоагулянтами (B01A: Антитромботические средства) подразумевают продолжение пациентом специфического лечения (химиотерапия), наличие отдаленных метастазов или местной первичной/рецидивной опухоли [88]. Продленная терапия онко-ассоциированного тромбоза должна проводиться на основании индивидуальной оценки пользы и риска. По данным проведенных исследований и мета-анализов продленная терапия онко-ассоциированного тромбоза характеризуется относительной высокими цифрами рецидива ВТЭО (8-12%) и больших кровотечений (4-7%) [334, 335, 674, 675].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение НМГ (B01AB: Группа гепарина) вместо АВК [86, 215, 672, 676].
УДД 1 УУР В
Комментарий: по результатам сетевого мета-анализа рандомизированных клинических исследований длительное использование НМГ (B01AB: Группа гепарина) в качестве альтернативы АВК для лечения онкоассоциированного тромбоза ассоциируется со снижением риска рецидива ВТЭО на 36% без влияния на риск развития больших кровотечений и общую смертность [672]. В соответствии с базовым исследованием CLOT по сравнению эффективности и безопасности применения далтепарина натрия (АТХ: Группа гепарина, B01AB04) и АВК при онкоассоциированной тромбозе, полную терапевтическую дозу НМГ (B01AB: Группа гепарина) целесообразно использовать на протяжении 1 месяца лечения (далтепарин натрия 200 МЕ/кг в сутки) с последующим переходом на 75% от полной лечебной дозы (далтепарин натрия 150 МЕ/кг в сутки) [677].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение ПОАК (B01A: Антитромботические средства) вместо АВК [86, 215, 672].
УДД 1 УУР В
Комментарий: по данным сетевого мета-анализа рандомизированных клинических исследований длительное использование ПОАК (B01A: Антитромботические средства) в качестве альтернативы АВК для лечения онко-ассоциированного тромбоза ассоциируется со снижением риска рецидива ВТЭО на 54% без влияния на риск развития больших кровотечений и общую смертность [672, 678].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение апиксабану** , ривароксабану**, эдоксабану вместо НМГ (B01AB: Группа гепарина) [86, 215, 672].
УДД 1 УУР В
Комментарий: эффективность и безопасность применения апиксабана** и ривароксабана**, эдоксабана в сравнении с далтепарином натрия при лечении онко-ассоциированного тромбоза была изучена в рамках специализированных рандомизированных исследований [679–682]. Проведенные позднее мета-анализы, объединяющие названные исследования с аналогичной работой по оценке эффективности и безопасности применения эдоксабана продемонстрировали достоверное снижение риска рецидива ВТЭО на 38-41% при отсутствии достоверного влияния на риск большого кровотечения и общей смертности [683–685]. При этом риск развития небольших, но клинически значимых кровотечений был увеличен в 1,45-1,65 раз. В исследованиях ривароксабана** и эдоксабана было отмечено преимущественное увеличение риска желудочно-кишечных кровотечений у пациентов с опухолями желудочно-кишечного тракта. В исследовании апиксабана** риск развития ЖКК не был увеличен в сравнении с терапией далтепарином натрия, но желудочно-кишечные кровотечения заняли около половины всей структуры больших кровотечений. В исследованиях реальной клинической практики было показано, что применение апиксабана** может повышать риск кровотечений при опухолях желудочно-кишечного тракта [686]. Таким образом, у пациентов с полостными опухолями пищеварительного тракта применять ПОАК (B01A: Антитромботические средства) следует с особой осторожностью на основании индивидуальной оценки пользы и риска. Следует также иметь в виду что во всех исследованиях изучалась эффективность и безопасность только полных лечебных доз апиксабана** и ривароксабана**, поэтому применение редуцированных дозировок в рамках продленной терапии онко-ассоциированного тромбоза не рекомендуется до появления новых данных.
3.8.5. Тромбоз глубоких вен у отдельных групп пациентов
3.8.5.1. Лечение ТГВ у пациентов травматолого-ортопедического профиля
- Всем больным травматологического профиля при верифицированном ТГВ рекомендуется АКТ терапевтическими дозами НФГ**, НМГ (B01AB: Группа гепарина), фондапаринукса натрия, ПОАК (B01A: Антитромботические средства) и АВК, при отсутствии противопоказаний [84, 85, 122, 126, 279, 342, 687, 688].
УДД 5 УУР С
- Лечение травматологических больных с ТГВ, которым предполагается хирургическое вмешательство на ОДА, а также которые находятся на ИВЛ (искусственная вентиляция легких (A16.09.011)), рекомендуется начинать с парентерального введения антикоагулянтов (B01A: Антитромботические средства) (НФГ**, НМГ (B01AB: Группа гепарина)) [84, 85, 126, 688].
УДД 5 УУР С
- Пациентам травматологического профиля с ТГВ находящихся в стабильном состоянии, и которым не планируют выполнение оперативного вмешательства на ОДА, препаратами выбора рекомендуется считать ПОАК (B01A: Антитромботические средства) [84, 85, 122, 126, 279, 342, 687, 688].
УДД 5 УУР С
- При выявлении в стационаре ТГВ у больного с повреждениями или заболеваниями ОДА и не нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, рекомендуется проведение АКТ парентеральными препаратами (лечебные дозы НМГ (B01AB: Группа гепарина) предпочтительны) и динамический ультразвуковой контроль ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)) за состоянием тромба и венозного русла. После стабилизации тромботического процесса, подтверждённого данными УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)), и стихания острых клинических проявлений тромбоза (через 3-5 суток) возможно выполнение оперативного вмешательства на ОДА [689–691].
УДД 4 УУР C
- При выявлении в стационаре тромбоза илиокавального сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве любой формы, из-за высокой вероятности прогрессирования тромботического процесса рекомендуется имплантация кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) с последующим выполнением предполагаемого оперативного вмешательства на ОДА [692, 693].
УДД 4 УУР С
- При выявлении в стационаре тромба бедренно-подколенного сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, при невозможности имплантации кава-фильтра, временного/постоянного*** (установка венозного фильтра (A16.12.027)) рекомендуется рассмотреть возможность перевязки ((перевязка сосуда (A16.12.014)) (или пликация) поверхностной бедренной вены рассасывающейся лигатурой, с последующим выполнением предполагаемого оперативного вмешательства на ОДА и назначением лечебных доз антикоагулянтов (B01A: Антитромботические средства) [692–696].
УДД 4 УУР C
- При выявлении в стационаре изолированного ТГВ голени у пациента, нуждающегося в выполнении экстренного или срочного оперативного вмешательства на ОДА, рекомендуется проведение необходимого вмешательства и назначение АКТ в послеоперационном периоде на фоне динамического ультразвукового контроля состояния тромба и венозного русла [692, 693].
УДД 4 УУР C
3.8.5.2. Тактика лечения ТГВ у пациентов неврологического профиля
Венозный тромбоз у пациентов неврологического профиля, как правило формируется в глубоких венах голени в ранние сроки основного заболевания и практически во всех случаях не сопровождается типичными клиническими проявлениями, а выявляется только при проведении УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)). Преимущественно ТГВ возникает на стороне двигательных нарушений, локализуясь, наиболее часто, в камбаловидных венах. Иногда первым признаком ТГВ является ТЭЛА. АКТ увеличивает риск геморрагической трансформации у пациентов с ишемическим поражением и увеличивает объем интракраниальной гематомы. Поэтому назначение терапевтических доз антикоагулянтов (B01A: Антитромботические средства) следует отложить на 10-14 дней. В начальном периоде следует использовать профилактические дозы.
- С целью выявления бессимптомного ТГВ у пациентов неврологического профиля рекомендуется определения концентрации Д-димера в крови (A09.05.051.001) на 4 сутки госпитализации и при выявлении его повышенных значений, рекомендуется выполнение триплексного сканирования нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [697].
УДД 4 УУР C
- Пациентам с ОНМК по ишемическому типу лечение ТГВ рекомендуется начинать с профилактических доз антикоагулянтов (B01A: Антитромботические средства) [698].
УДД 3 УУР В
- Пациентам с внутримозговой гематомой лечение ТГВ рекомендуется начинать с профилактических доз НФГ (гепарин натрия**). АКТ рекомендуется начинать со второго дня госпитализации при условии стабильного состояния пациента. На 10-14 день возможно рассмотреть вопрос о переводе пациента на прием ПОАК (B01A: Антитромботические средства) [698].
УДД 3 УУР В
- Пациентам с субарахноидальным кровоизлиянием лечение ТГВ рекомендуется начинать с профилактических доз НФГ (гепарин натрия**). АКТ рекомендуется начинать со второго дня госпитализации при условии стабильного состояния пациента [698].
УДД 3 УУР В
3.8.5.3. Тактика лечения ТГВ у пациентов с почечной недостаточностью
- Пациентам с 1-3 стадией ХБП при лечении ТГВ рекомендуется отдавать предпочтение ПОАК (B01A: Антитромботические средства) [342, 343, 381].
УДД 2 УУР А
Комментарий: результаты современных исследований, продемонстрировали схожую эффективность и безопасность использования ПОАК (B01A: Антитромботические средства) у пациентов с начальными стадиями ХБП. Следует избегать назначения дабигатрана этексилата** при клиренсе креатинина менее 30 мл/мин, апиксабана** и ривароксабана** – менее 15 мл/мин.
- Пациентам с 4-5 стадией ХБП при лечении ТГВ рекомендуется отдавать предпочтение НФГ (гепарин натрия**) с последующим назначением АВК [699].
УДД 5 УУР C
Комментарий: НФГ (гепарин натрия**) обладает коротким периодом полувыведения, терапию им легко контролировать c помощью АЧТВ, а АВК возможно использовать у пациентов с любой степенью тяжести ХБП
- При назначении НМГ (B01AB: Группа гепарина) или фондапаринукса натрия у пациентов с 3-4 стадией ХБП рекомендуется следовать инструкции к применению препаратов (таблица 24) [363, 700, 701].
УДД 2 УУР С
Таблица 24. Дозировка парентеральных антикоагулянтов (B01A: Антитромботические средства) в зависимости от степени нарушения почечной функции
| Профилактическая доза | Лечебная доза |
|---|
НФГ (гепарин натрия**) | КлКР <15 мл/мин – 5000 ЕД 2 раза в сутки | коррекция дозы не предусмотрена, индивидуальная доза под контролем АЧТВ |
Эноксапарин натрия** (АТХ: Группа гепарина, B01AB05) | КлКР <30 мл/мин – уменьшить до 20 мг х 1 р/сут. | КлКР <30 мл/мин – уменьшить до 1 мг/кг х 1 р/сут. |
Надропарин Кальция (АТХ: группа гепарина, B01AB06) | КлКР <50 мл/мин – уменьшить дозу на 25-33% | КлКР от 30 до 50 мл/мин – уменьшить дозу на 25-33% КлКР <30 мл/мин – противопоказан |
Далтепарин натрия (АТХ: Группа гепарина, B01AB04) | КлКР <30 мл/мин – стандартные дозы до 10 сут. | КлКР <30 мл/мин – индивидуальные дозы под контролем анти-Ха-активности (A09.05.052 Исследование уровня гепарина в крови) |
Парнапарин натрия** (АТХ: группа гепарина, B01AB07) | КлКР <30 мл/мин – подбор дозы под контролем анти-Ха-активности (A09.05.052 Исследование уровня гепарина в крови) | КлКР <30 мл/мин – подбор дозы под контролем анти-Ха-активности (A09.05.052 Исследование уровня гепарина в крови) |
Фондапаринукс Натрия (АТХ группа: другие антитромботические средства, B01AX) | СКФ от 20 до 30 мл/мин – 1,5 мг х 1 р/сут или 2,5 мг через день СКФ <20 мл/мин – противопоказан | СКФ <30 мл/мин – противопоказан |
3.8.5.4. Тактика лечения ТГВ у пациентов с ожирением
Лечение ТГВ у пациентов с избыточной массой тела представляет собой непростую задачу. В первую очередь это связано с тем, что парентеральные антитромботические средства подбирают по массе тела и у них есть максимально допустимая суточная доза. В настоящее время проведено несколько РКИ, которые продемонстрировали эффективность и безопасность ПОАК (B01A: Антитромботические средства) у пациентов с ожирением.
- У пациентов с ожирением рекомендуется использовать ПОАК (B01A: Антитромботические средства) в стандартных дозировках [702, 703].
УДД 2 УУР В
Комментарий: по данным мета-анализа, объединяющего результаты 5 исследований, эффективность и безопасность применения ПОАК (B01A: Антитромботические средства) не отличалась от таковой при использовании НМГ (B01AB: Группа гепарина) и АВК у пациентов с ИМТ ≥40 кг/м или массой тела ≥10 кг [703].
- У пациентов с ожирением дозу НМГ (B01AB: Группа гепарина) рекомендуются подбирать по актуальной массе тела в соответствии с инструкцией к препарату [122, 132].
УДД 5 УУР C
Комментарий: подбор дозы НМГ (B01AB: Группа гепарина) по актуальной массе тела может требовать однократного назначения необычно большого количества препарата, что может противоречить инструкции: для далтепарина натрия максимальная разовая дневная доза при однократном введении не должна превышать 18000 МЕ, для других НМГ особые указания отсутствуют. Фармакодинамические особенности препаратов порождают опасения при введении больших доз в отношении риска развития кровотечений у пациентов с ожирением [704]. НМГ (B01AB: Группа гепарина) преимущественно распределяются в плазме крови и высоко васкуляризованных тканях, относительное количество которых уменьшено у лиц с ожирением, что чревато передозировкой. Исследования с оценкой антикоагулянтного ответа по уровню анти-Ха активности не показали различий между пациентами с ожирением и нормальной массой тела для дозы эноксапарина натрия** (максимальный вес 144 кг) и далтепарина натрия (максимальный вес 190 кг), подобранной по актуальной массе тела [705, 706]. Исследования с изучением клинических исходов при использовании эноксапарина натрия** и далтепарина натрия в дозах, подобранных на основании актуальной массы тела у пациентов с ожирением, также не обнаружили значительного увеличения риска геморрагических осложнений [707, 708]. В рамках подготовки клинических рекомендаций Американского общества гематологов авторы провели систематический обзор и обнаружили 5 исследований, среди которых ни одно напрямую не сравнивало использование доз НМГ (B01AB: Группа гепарина), подобранных по актуальной массе тела (без максимальной суточной дозы) и ограниченных верхним пределом (с наличием максимальной суточной дозы). По результатам мета-анализа была выявлена тенденция в пользу доз, подобранных по актуальной массе тела, в виде снижения риска рецидива ВТЭО (ОР, 0,76; 95% ДИ, 0,11-5,45) без влияния на риск кровотечения и общую смертность [132]. Парнапарин натрия** у пациентов с ожирением может использоваться в дозе 0,4 мл (4250 анти -Ха МЕ) 1 раз в сутки в соответствии с пунктом инструкции к препарату, определяющему режим назначения для пациентов с повышенным риском ТГВ. Этот режим в отношении пациентов с ожирением изучен в исследовании BAFLUX [709]. Было продемонстрировано, что даже при наличии выраженного ожирения (индекс массы тела >45 кг/м2) применение профилактической дозы препарата (4250 МЕ подкожно 1 раз в сутки) не менее эффективно, чем использование более высокой дозировки.
- У пациентов с ожирением и высоким риском рецидива ВТЭО или кровотечения рекомендуется рассмотреть подбор дозы НМГ (B01AB: Группа гепарина) под контролем анти-Ха активности (A09.05.052 Исследование уровня гепарина в крови) [122, 132].
УДД 5 УУР С
Комментарий: мета-анализ 7 исследований, выполненный рамках разработки клинических рекомендаций Американского общества гематологов не выявил преимуществ от подбора дозы НМГ (B01AB: Группа гепарина) под контролем анти-Ха активности (A09.05.052 Исследование уровня гепарина в крови) [132]. При использовании подобранных по актуальной массе тела доз эноксапарина натрия** частота обнаружения показателя в целевом диапазоне достигала 45%, а при использовании далтепарина натрия – 71%, что не коррелировало с риском развития осложнений. При использовании лабораторного контроля отмечена недостоверная тенденция к увеличению риска рецидива ВТЭО и кровотечения. На основании полученных данных авторы сделали вывод об отсутствии пользы от подбора дозы НМГ (B01AB: Группа гепарина) под контролем анти-Ха активности у пациентов с ожирением. Ранее опубликованных рекомендации АССР предполагали возможность индивидуального подбора дозы НМГ (B01AB: Группа гепарина) у отдельных пациентов с ожирением. При этом целевой диапазон показателя зависит от кратности введения препарата и составляет 0,6-1,0 МЕ/мл через 4 часа после инъекции [122]. Уровень доказательств всеми авторами расценен, как очень низкий. В отсутствие достоверных сведений возможно предположить, что отдельные пациенты с ожирением могут иметь преимущество от контроля анти-Ха активности (A09.05.052 Исследование уровня гепарина в крови) на фоне применения подобранных по актуальной массе тела доз НМГ (B01AB: Группа гепарина).
- При использовании фондапаринукса натрия (АТХ группа: другие антитромботические средства, B01AX) рекомендуется применять дозу 10 мг один раз в день [702, 710].
УДД 4 УУР А
Комментарий: субанализ исследования Matisse, включившего 4418 пациентов, из которых 11% имели массу тела более 100 кг и 28% имели ИМТ ≥30 кг/м2, изучавшего эффективность и безопасность применения фондапаринукса натрия в сравнении с внутривенной инфузией НФГ (гепарин натрия**) (внутривенное введение лекарственных препаратов (A11.12.003) при ТЭЛА или подкожным введением НМГ (B01AB: Группа гепарина) (подкожное введение лекарственных препаратов (A11.01.002)) при ТГВ не выявил достоверных различий по эффективности и безопасности применения всех препаратов у пациентов с ожирением и без. Максимальный вес пациента в анализе эффективности составил 166 кг, в анализе безопасности – 120 кг [710].
3.8.5.5. Тактика лечения ТГВ у пациентов с тромбофилиями
- У пациентов с наследственной тромбофилией рекомендуется использовать те же подходы к антикоагулянтной терапии, как у пациентов без наследственной тромбофилии [294, 711–713].
УДД 1 УУР А
Комментарий: данная рекомендации касается выбора вида, дозы, режима введения и длительности использования антикоагулянтов (B01A: Антитромботические средства). Целесообразность тестирования на тромбофилию и длительность терапии антикоагулянтами (B01A: Антитромботические средства) обсуждаются в соответствующих разделах.
- У пациентов с подтвержденным тройно-позитивным АФС или АФС с наличием тромбозов в артериальном или микроциркуляторном русле не рекомендуется использование ПОАК (B01A: Антитромботические средства) [336, 714,715].
УДД 1 УУР А
Комментарий: по данным мета-анализа 4 РКИ с участием 576 пациентов применение ПОАК (B01A: Антитромботические средства) в сравнении с АВК у пациентов с АФС, включая тройно-позитивные случаи, ассоциируется с увеличением риска артериальных тромбозов в 5 раз [336].
- У пациентов с подтвержденным АФС рекомендуется длительная АКТ [337, 716].
УДД 2 УУР В
- У пациентов с АФС и ТГВ рекомендуется применение НФГ (гепарин натрия**) с последующим переводом на АВК [717, 718]
УДД 5 УУР С
- У пациентов с выявленным АФС и рецидивирующим течением ВТЭО на фоне АКТ варфарином** при показателях МНО 2-3 рекомендуется увеличение дозы препарата до целевого интервала МНО до 3,0-4,0 или переход на НМГ (B01AB: Группа гепарина) [201].
УДД 5 УУР С
3.9. Тромбоз глубоких вен верхних конечностей
3.9.1. Эпидемиология
Тромбозы глубоких вен верхних конечностей (ТГВ ВК) составляют 10-11% от всех острых венозных тромбозов, и встречаются с частотой 4-10 случаев на 100000 населения [719, 720].
ТГВ ВК осложняются ТЭЛА в 6-15% случаев, и ассоциируются с развитием посттромботической болезни верхних конечностей у 25-77% пациентов [390, 721, 722].
Следует различать первичные и вторичные ТГВ ВК. На долю первичных приходится 33% всех ТГВ ВК, к ним относят идиопатические тромбозы, когда провоцирующий фактор выявить не удается и синдром Педжета-Шреттера. Впервые эпоним – синдром Педжета-Шреттера был предложен в 1948 году Hughes E.S., который опубликовал обзор 320 случаев ТГВ ВК [723]. Синдром Педжета-Шреттера или тромбоз усилия развивается в следствии интенсивной физической нагрузки мускулатуры верхнего плечевого пояса у пациентов с наличием синдрома верхней апертуры грудной клетки (СВАГК). Другое название СВАГК – синдром выхода из грудной клетки.
СВАГК – группа клинических синдромов, вызванная врожденной или приобретенной компрессией плечевого сплетения или подключичных сосудов, вследствие их прохождения через верхнюю апертуру грудной клетки. Частота новых случаев СВАГК варьируется от 3 до 80 на 1000 новых случав в год, заболевание встречается чаще у взрослых пациентов в возрасте от 25 до 50 лет, женщины болеют в 3 раза чаще, чем мужчины [724, 725]. На долю венозной формы СВАГК приходится только 4%. Чаще, в 95% развивается нейрогенная форма СВАГК, реже в 1% – артериальный СВАГК. Наличие СВАГК опасно не только развитием синдрома Педжета-Шреттера, но и лежит в основе развития синдрома МакКлири (McCleery).
Синдром МакКлири (McCleery) – перемежающаяся обструкция подключичной вены при отсутствии венозного тромбоза клинически проявляется периодически возникающим отеком и нарушением окраски кожного покрова верхней конечности. Именно McCleery R.S. в 1951 г. детально описал синдром и предположил, что его основой является компрессия подключичной вены подключичной связкой и передней лестничной мышцей [726].
Различают следующие причины компрессии подключичной вены: сочленение ключицы и первого ребра, добавочное шейное ребро, гипертрофированная передняя лестничная мышца, удлиненный поперечный отросток 7 шейного позвонка, гипертрофированная подключичная мышца.
На долю вторичных ТГВ ВК приходится 67% всех ТГВ ВК. Вторичный ТГВ ВК чаще связан с наличием внутривенного катетера, но выделяют и другие его причины: наличие искусственного водителя ритма, онкология, иммобилизация, операции на верхних конечностях.
Согласно мета-анализу, опубликованному в 2019 г., частота развития ПТБ была выше у пациентов с неспровоцированным ТГВ ВК, чем у вторичных, тогда как рецидивы отмечали чаще у пациентов с вторичным ТГВ ВК [727].
3.9.2. Критерии диагноза
Наиболее частыми признаками ТГВ ВК служат набухание подкожных вен (усиленный венозный рисунок) как на верхней конечности, так и на передней поверхности грудной клетки (100%), отек верхней конечности (93%), цианоз (77%), боль, усиливающаяся при физической нагрузке (66%). Иногда симптоматическая ТЭЛА может быть первым признаком ТГВ ВК. Клиническая оценка имеет низкую специфичность (30-64%), и диагноз должен быть подтвержден дополнительным диагностическим исследованием [227].
3.9.2.1. Лабораторная диагностика
- Определение концентрации Д-димера в крови (A09.05.051.001) рекомендуется только для исключения тромбоза у амбулаторных пациентов при подозрении на ТГВ ВК [728, 729].
УДД 2 УУР В
Комментарий: Определение концентрации Д-димера в крови (A09.05.051.001) в алгоритме диагностики ТГВ ВК имеет ряд существенных ограничений. Во-первых, до настоящего времени место Д-димера в диагностике ТГВ ВК достаточно не изучено. Во-вторых, наличие у пациентов с ТГВ ВК сопутствующих заболеваний, связанных с повышением уровня Д-димера, затрудняет трактовку полученного результата [728]. В исследование Sartori M. вошло 239 пациентов, у которых врачами первичного звена был заподозрен ТГВ ВК. Всем пациентам выполнили определение уровня Д-димера (пороговое значение: ≤500 нг/мл) и УЗАС. При первичном УЗАС ТГВ ВК был обнаружен у 24 (10%) пациентов. Чувствительность и специфичность Д-димера для ТГВ составили 92% (95% ДИ: 73-99%) и 60% (95% ДИ: 52-67%) соответственно, с отрицательной прогностической ценностью 98% (95% ДИ: 93-100%) [729]. Таким образом, при ТГВ ВК определение концентрации Д-димера в крови (A09.05.051.001) представляет интерес только для исключения тромбоза у амбулаторных пациентов при подозрении на ТГВ ВК.
3.9.2.2. Инструментальная диагностика
- Пациентам с подозрением на ТГВ ВК в качестве первичной инструментальной диагностики рекомендуется дуплексное сканирование вен верхних конечностей (A04.12.005.004) [730–732].
УДД 1 УУР A
- При недостаточной информативности УЗАС ((A04.12.006.002 Дуплексное сканирование вен нижних конечностей или A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)), а также для выявления и уточнения источника компрессии вены, пациенту рекомендуется выполнение флебографии (флебография верхней конечности прямая (A06.12.036) или компьютерной томографии (компьютерно-томографическая ангиография сосудов верхних конечностей (A06.12.054)) [733].
УДД 5 УУР С
- Для выявления экстравазального сдавления, как причины тромбоза, рекомендуется использование при ультразвуковом исследовании функциональных проб в виде провокационных маневров с максимальным отведением и ротацией руки кнаружи [734].
УДД 5 УУР С
3.9.3. Тактика лечения
Задачи лечения ТГВ ВК: предотвращение прогрессирования тромбоза и легочной эмболии, развития посттромботической болезни, профилактика рецидива тромбоза. В настоящее время подходы к лечению ТГВ ВК неоднозначны, одни рекомендации настаивают на терапии антикоагулянтами (B01A: Антитромботические средства) [279], другие предлагают активную хирургическую тактику с обязательным назначением после операции АКТ. Так, согласно рекомендациям Американского Венозного Форума 2017 г., первым этапом в лечении подмышечно-подключичного венозного тромбоза у пациентов с синдромом верхней грудной апертуры должен быть тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) с последующим декомпрессионным хирургическим вмешательством [390].
3.9.3.1. Антикоагулянтная терапия
- Пациентам с первичным тромбозом глубоких вен верхних конечностей рекомендуется антикоагулянтная терапия в течение трех месяцев [735–738].
УДД 4 УУР С
Комментарий: все пациенты с ТГВ ВК должны получать АКТ. Схемы применения, дозировки лекарственных препаратов аналогичны таковым при ТГВ в системе НПВ.
- У пациентов с ТГВ ВК, которым выполняется тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011), рекомендуется такая же интенсивность и длительность АКТ, что и пациентам с ТГВ ВК, которым тромболизис (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) не проводился [390].
УДД 5 УУР С
3.9.3.2. Ранняя дезобструкция (удаление тромбов)
- Для лечения первичного подмышечно-подключичного венозного тромбоза у пациентов с синдромом верхней грудной апертуры рекомендуется рассмотреть возможность выполнения тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) с последующей декомпрессией верхней грудной апертуры [390, 731, 739–742].
УДД 2 УУР В
Комментарий: выполнение тромболизиса в острой фазе ТГВ ВК эффективно для удаления тромба и ведет к быстрому купированию симптомов. Проведение системного тромболизиса не показано. Оптимальной стратегией удаления тромба является выполнение КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011).
- Рекомендуется выполнять КТЛ (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) в первые 14 дней после развития ТГВ ВК. Организованный тромб старше двух недель менее подвержен тромболизису [227, 390, 739].
УДД 3 УУР С
3.9.3.3. Хирургическая коррекция синдрома грудного выхода
Активная тактика с выполнением резекции первого ребра после успешного тромболизиса (локальный эндоваскулярный трансвенозный тромболизис (A16.23.034.011) значительно улучшает исходы: полное разрешение симптомов наблюдают в 95%, восстановление проходимости вены при УЗАС в 94% случаев [739].
- Пациентам с ТГВ ВК, перенесших раннюю дезобструкцию, рекомендуется рассмотреть возможность выполнения резекции первого ребра, если есть доказательства синдрома венозного выхода из грудной клетки [390, 739].
УДД 3 УУР С
Комментарий: существует несколько хирургических доступов для резекции первого ребра: подмышечный, подключичный и надключичный. Подмышечный доступ обеспечивает хорошую визуализацию реберно-ключичного пространства в месте компрессии и обеспечивает хороший косметический результат. Однако, показания к данному доступу могут быть ограничены необходимостью обширного объема венозной реконструкции и риском повреждения длинного грудного нерва. Применение подключичного доступа обеспечивает превосходную визуализацию первого ребра и вены для выполнения реконструкции [743]. Его дополнительные преимущества – минимальное воздействие на плечевое сплетение, диафрагмальный нерв и подключичную артерию, которые не вовлекаются в синдром верхней грудной апертуры, и возможность придания пациенту положения лежа на спине для выполнения флебографии.
- Стентирование подключичной вены (установка стента в сосуд (A16.12.028)) после хирургической декомпрессии при синдроме верхней грудной апертуры рекомендуется при значительных рефрактерных поражениях, но доказательств относительно долгосрочной безопасности этой методики недостаточно [390].
УДД 5 УУР С
- Не рекомендуется рассматривать стентирование (установка стента в сосуд (A16.12.028)) подключичной вены при синдроме верхней грудной апертуры в качестве альтернативы открытой декомпрессии [390].
УДД 5 УУР C
Комментарий: в настоящее время нет единого мнения о необходимости эндоваскулярного вмешательства (баллонная ангиопластика подключичной вены и стентирование (установка стента в сосуд (A16.12.028)) после выполнения костной декомпрессии. При принятии решения целесообразно ориентироваться на сохранение симптомов обструкции вен после декомпрессии.
3.10. Катетер-ассоциированный тромбоз глубоких вен
Повреждение сосудистой стенки во время введения катетера, гиперкоагуляция в ответ на повреждение стенки вены, замедление тока крови, наличие катетера в вене могут привести к катетер-ассоциированному тромбозу. Частота симптоматических форм катетер-ассоциированного тромбоза крайне мала и составляет 1-5%.
Факторами риска являются: место пункции и установки центрального венозного катетера (катетеризация подключичной и других центральных вен A11.12.001), его тип, ВТЭО в анамнезе. Наиболее частой локализацией катетер-ассоциированного тромбоза является бедренная вена [744].
- Пациентам с катетер-ассоциированным тромбозом рекомендуется терапия лечебными дозами антикоагулянтов (B01A: Антитромботические средства) в течение как минимум трех месяцев [279, 745, 746].
УДД 3 УУР В
- При ТГВ ВК, связанном с ЦВК, не рекомендуется удалять катетер если в нем есть необходимость, при условии, что он функционирует. АКТ продолжают до удаления ЦВК [747].
УДД 4 УУР С
- У пациентов с тромбозом, связанным с катетером, рекомендуется рассмотреть его удаление (удаление центрального венозного катетера (A11.12.015)) в следующих ситуациях: когда в нем нет необходимости; он не работает; антикоагулянты противопоказаны; симптомы не исчезают при назначении АКТ; тромбоз опасен для конечностей или жизни [748].
УДД 5 УУР С
- АКТ рекомендовано проводить минимум 3 месяца после удаления устройства центрального венозного доступа (удаление центрального венозного катетера (A11.12.015)) [226, 279, 747].
УДД 4 УУР С
3.11. Эластичная компрессия
- При ТГВ рекомендуется начать использовать компрессионную терапию с давлением 30-40 мм рт. ст. в первые 24 часа от момента заболевания для уменьшения боли и отека, ускорения реканализации вен (эластическая компрессия нижних конечностей (A15.12.002)) [749–753].
УДД 2 УУР В
Комментарий: применение компрессионного трикотажа в первые сутки после развития ТГВ позволяет уменьшить болевые ощущения и отечность (эластическая компрессия нижних конечностей (A15.12.002)) [751].
- При ТГВ рекомендуется раннее назначение компрессионного трикотажа, что в совокупности с АКТ позволяет уменьшить риск прогрессирования тромбоза (эластическая компрессия нижних конечностей (A15.12.002)) [751, 754].
УДД 2 УУР В
- Рекомендуется применение эластичной компрессии как можно раньше после подтверждения диагноза ТГВ с целью профилактики ПТБ (эластическая компрессия нижних конечностей (A15.12.002)) [610, 755–758].
УДД 1 УУР А
Комментарий: компрессионная терапия может значительно снизить частоту ПТБ легкой и средней степени тяжести (эластическая компрессия нижних конечностей (A15.12.002)).
- При проксимальном ТГВ использование компрессионного трикотажа ниже колена рекомендуется с целью снижения риска развития ПТБ (эластическая компрессия нижних конечностей (A15.12.002)) [752, 755, 756, 759, 760].
УДД 2 УУР А
Комментарий: имеющиеся литературные данные поддерживают компрессионную терапию (эластическая компрессия нижних конечностей (A15.12.002)) для профилактики ПТБ в клинической практике, по крайней мере, у пациентов с симптомами [610].
- При ТГВ рекомендуется постоянное использование компрессионного трикотажа (эластическая компрессия нижних конечностей (A15.12.002)) от 6 до 12 месяцев с последующей оценкой наличия ПТБ и продолжением лечения при сохранении симптомов [610, 760–762].
УДД 2 УУР А
- Не рекомендуется использовать компрессионную терапию как единственную меру профилактики рецидива венозного тромбоза (эластическая компрессия нижних конечностей (A15.12.002)) [610, 760,761].
УДД 2 УУР А
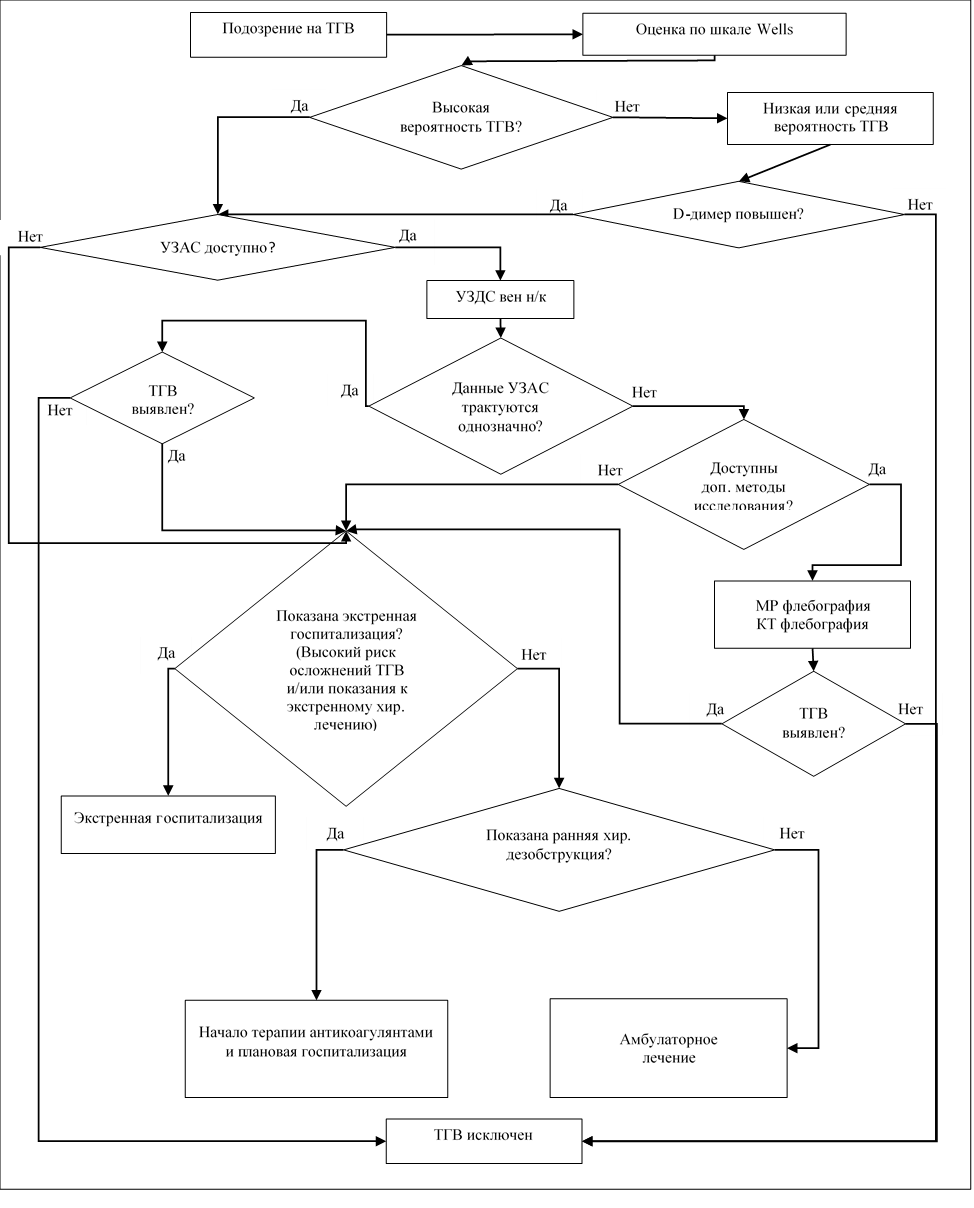
Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint