Эффективность генной терапии тяжелого комбинированного иммунодефицита
Тяжелый комбинированный иммунодефицит (ТКИД) характеризуется недостатком Т-лимфоцитов при недостатке или дисфункции В-лимфоцитах. Это генетически гетерогенная болезнь: она может быть вызвана дефектом в любом из ~20 генов. Популяционный скрининг новорожденных установил, что ТКИД встречается примерно у 1 из 65 000 новорожденных. Фермент репарации ДНК Artemis необходим для перестройки рецепторов Т- и В-клеток. Мутации в DCLRE1C, кодирующем Artemis, вызывают ТКИД с дефицитом Artemis (ART-ТКИД), который плохо реагирует на аллогенную трансплантацию гемопоэтических клеток, поэтому исследователи ищут новые методы лечения[1].
Группа ученых из США представила результаты переливания аутологичных клеток CD34+, трансфицированных лентивирусным вектором, содержащим DCLRE1C, у 10 младенцев с впервые диагностированным ART-ТКИД.
Материалы и методы
В исследование включили 10 младенцев с недавно диагностированным ART-ТКИД, у которых не было HLA-совместимого родственного донора. После изготовления, криоконсервации и проверки качества аутологичных клеток CD34+, трансдуцированных генами, пациенты получали бусульфан внутривенно в течение 2 дней.
Первую дозу рассчитывали по фармакокинетической модели с учетом возраста и массы тела. Фармакокинетические данные первой дозы были использованы для корректировки второй дозы. Фармакокинетические образцы после второй дозы позволили рассчитать кумулятивную площадь крови под кривой AUC каждого пациента. Через день клетки с генокоррекцией размораживали и вводили.
Измерения восстановления иммунитета и маркировки генов начинались через 4 недели после инфузии, а разнообразие Т-клеточных рецепторов (TCR) и анализ места вставки вектора начинали через 12 недель после инфузии. Последующие оценки проводили ежемесячно до 6-го месяца, каждые 3 месяца до 24-го месяца.
Первым показателем успеха лечения было безопасное введение бусульфана и трансдуцированных клеток, определяемое через 42 дня после инфузии. Ученые оценили осуществимость, безопасность, восстановление после кондиционирования и доказательства раннего приживления трансдуцированных клеток без нежелательных явлений степени 3 или выше. Вторым показателем успеха лечения было функциональное восстановление Т-клеток через 12 месяцев. ДНК из клеток, выделенных по линии, анализировали с помощью анализа капельной цифровой полимеразной цепной реакции (ПЦР) с праймерами, специфичными для вектора AProArt, и области гена альбумина для получения среднего числа копий вектора (VCN) на клетку.
Результаты
Медиана наблюдения за 10 пациентами составила 31,2 месяца (диапазон от 10,0 до 48,9). Смертельных случаев не было. Генно-маркированные (VCN, ≥0,01) CD3+ Т-клетки были обнаружены в среднем через 12 недель (диапазон от 6 до 16) у всех 10 пациентов, а у 5 из 6 пациентов, наблюдаемых в течение не менее 24 месяцев, восстановление клеточного иммунитета происходило в среднем 12 месяцев (диапазон от 6 до 24). Уровни CD3+, CD4+ и CD8+ Т-клеток, наивных CD4+ Т-клеток и регуляторных Т-клеток (Treg) увеличивались в течение 9 месяцев после инфузии (рисунок 1).
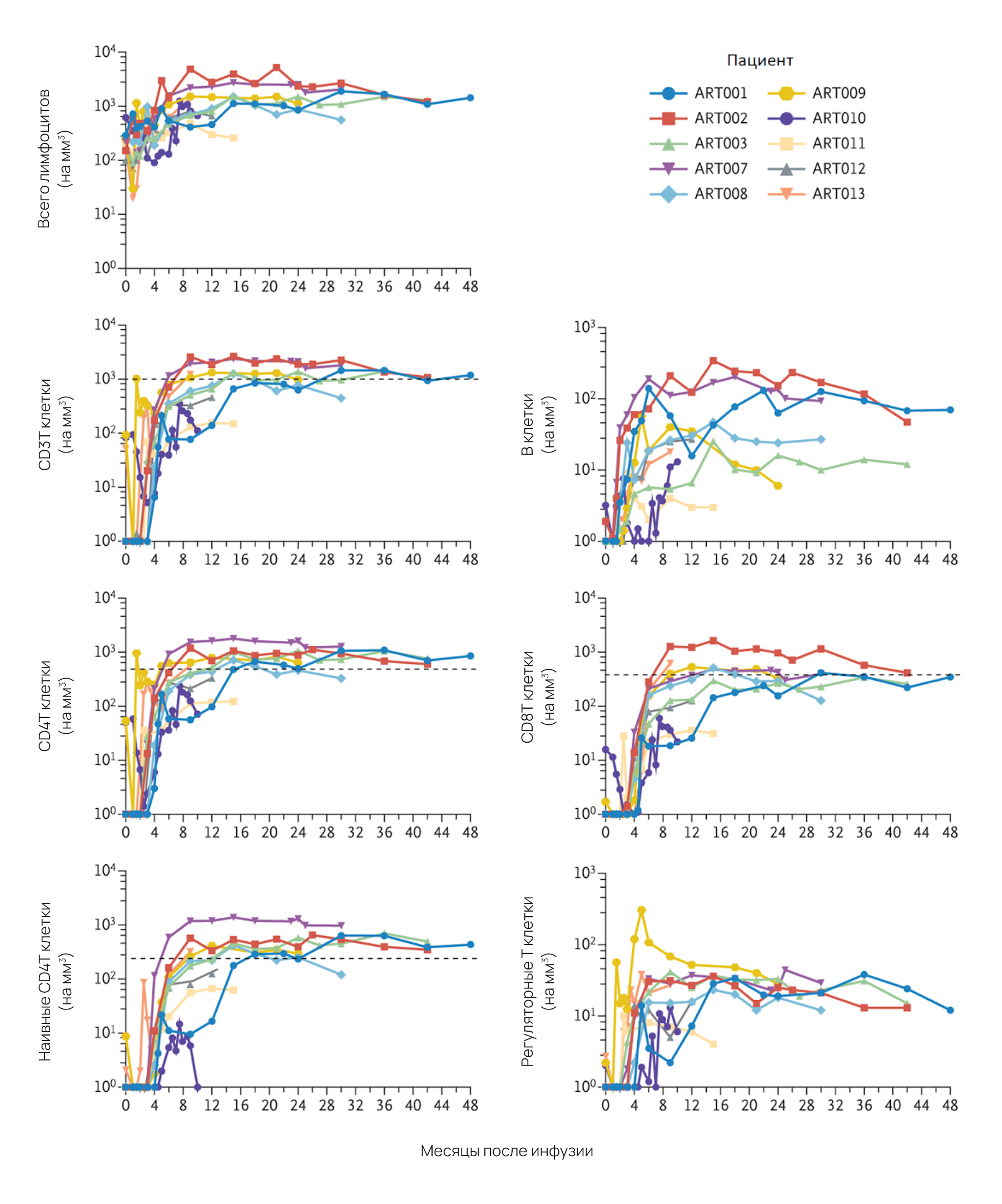
В-клетки были обнаружены с помощью проточной цитометрии и генной маркировки (VCN, ≥0,01) у всех 10 пациентов в среднем через 6 недель (диапазон от 4 до 10). Три пациента (ART001, ART002 и ART007) имели нормальные концентрации IgM и ответы на иммунизацию через 24 месяца после инфузии. На момент написания этого отчета четвертый пациент (ART008) имел нормальные титры IgM и изогемагглютинина, больше не получал инфузии IgG и начал иммунизацию.
При последнем обследовании у 9 пациентов было от 34 до 77% CD3+/CD4+/CD45RA+/CCR7+ наивных Т-клеток и нормальный пролиферативный ответ лимфоцитов. У всех 10 пациентов в крови были обнаружены IgM; 4 имели нормальный уровень для своего возраста.
Исследователи сочли, что в общей сложности 40 несерьезных нежелательных явлений возможно, вероятно или определенно связаны с исследуемым препаратом, 23 из них были степени 1 или 2. Из 17 нежелательных явлений степени 3-4 было 16 цитопений, и у 1 пациента развилась аутоиммунная гемолитическая анемия.
Выводы
- Инфузия лентивирусных аутологичных клеток CD34+ с скорректированными генами, которой предшествовала трапия бусульфаном с низкой экспозицией, привела к появлению генетически скорректированных и функциональных Т- и В-лимфоцитов у младенцев с недавно диагностированным ART-ТКИД.
- Из неблагоприятных явлений чаще всего встречалась цитопения.
- Ученые заключили, что этот подход восстанавливал иммунитет и был безопасным (в контексте заболевания и альтернативных подходов), и пришли к выводу, что необходимы дальнейшие исследования.
Cowan MJ, Yu J, Facchino J, Fraser-Browne C, Sanford U, Kawahara M, Dara J, Long-Boyle J, Oh J, Chan W, Chag S, Broderick L, Chellapandian D, Decaluwe H, Golski C, Hu D, Kuo CY, Miller HK, Petrovic A, Currier R, Hilton JF, Punwani D, Dvorak CC, Malech HL, McIvor RS, Puck JM. Lentiviral Gene Therapy for Artemis-Deficient SCID. N Engl J Med. 2022 Dec 22;387(25):2344-2355. doi: 10.1056/NEJMoa2206575. PMID: 36546626; PMCID: PMC9884487.

Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint