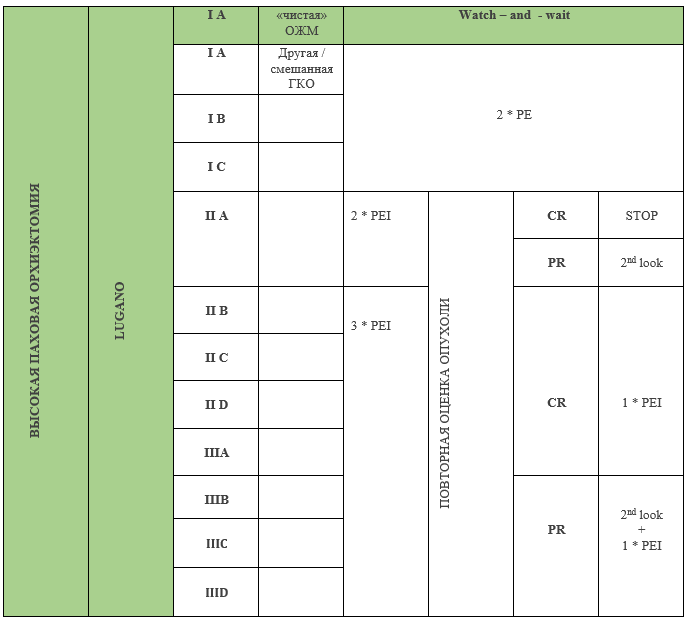
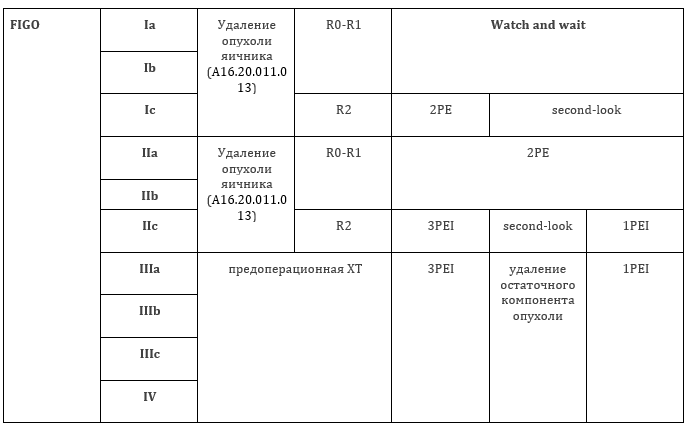
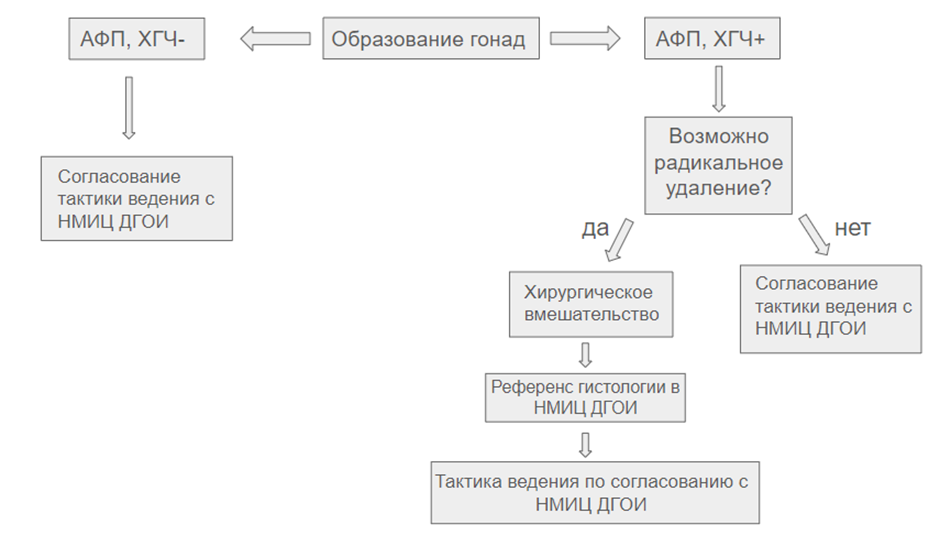
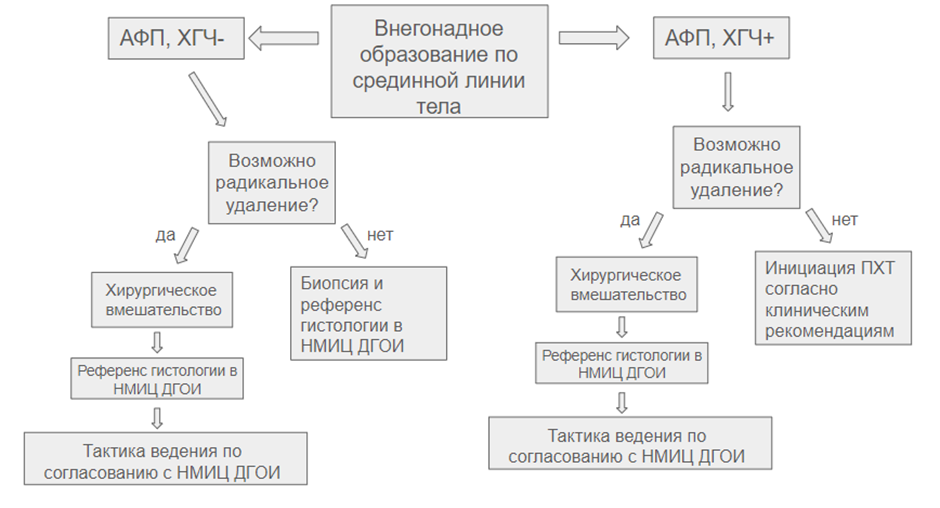
Приложение А3.1. Схемы химиотерапии с сопроводительной терапией
Таблица 9. Схема терапии Цисплатин**/этопозид** (PE) [13]
Препарат | Доза, сут | Продолжительность инфузии | Дни курса | Кумулятивная Доза за курс |
|---|
Цисплатин** (Р) | 20 мг/м2 | 1 ч | 1,2,3,4,5 | 100 мг/м2 |
#Этопозид** (Е) | 100 мг/м2 | 1 ч (до цисплатина**) | 1,2,3 | 300 мг/м2 |
Таблица 10. Схема терапии Цисплатин**/этопозид**/#ифосфамид** (PEI) [13]
Препарат | Доза, сут | Продолжительность инфузии | Дни курса | Кумулятивная Доза за курс |
|---|
Цисплатин** (Р) | 20 мг/м2 | 1 ч | 1, 2, 3, 4, 5 | 100 мг/м2 |
#Этопозид** (Е) | 100 мг/м2 | 1 ч (до цисплатина**) | 1, 2, 3 | 300 мг/м2 |
#Ифосфамид** (I) на фоне инфузионной терапии месной** | 1500 мг/м2 | 22 ч | 1, 2, 3, 4, 5 | 7 500 мг/м2 |
Рекомендации по проведению химиотерапии
- интервал между курсами ХТ – 21 день;
- детям младше 2 лет, либо меньше 10 кг доза должна быть рассчитана на кг (30 кг = 1 м2);
- при индексе Карновского менее 50 – доза #ифосфамида** 1000 мг/м2/день, дни 1-5;
- в возрасте менее 4 месяцев #ифосфамид** исключается из схемы лечения;
- условия для продолжения ХТ:
- количество лейкоцитов более 1,5×109/л o количество тромбоцитов более 50×109/л;
Режимы терапии второй линии
Режим терапии CarboPET [13]
Таблица 11. 1 курс – #Карбоплатин**+Этопозид**
Препарат | Доза | Путь введения | Дни введения |
|---|
#Карбоплатин** | 400 мг/м2 | внутривенно за 3 часа | -5-4-3 |
#Этопозид** | 500 мг/м2 | внутривенно за 3 часа | -5-4-3 |
ПСКК | 2-4х106 CD34/кг | внутривенно за 1 час | 0 |
Таблица 12. 2 курс – Тиотепа+Этопозид на 28-е сутки от начала 1-го курса
Препарат | Доза | Путь введения | Дни введения |
|---|
#Тиотепа | 300 мг/м2 | внутривенно за 3 часа | -5-4-3 |
#Этопозид** | 500 мг/м2 | внутривенно за 3 часа | -5-4-3 |
ПСКК | 2-4х106 CD34/кг | внутривенно за 1 час | 0 |
Режим терапии TI-CE [14] [86]
Табоица 13. 1 этап – 2 цикла индукционной химиотерапии с аферезом ПСКК
Препарат | Доза | Путь введения | Дни введения |
|---|
#Паклитаксел** | 200 мг/м2 | внутривенно за 24 часа | 1 |
#Ифосфамид** на фоне профилактики Уромитексаном | 2000 мг/м2 | внутривенно за 3 часа | 2-4 |
Тайминг между курсами 14 дней
Количество целевых клеток для каждой реинфузии составляло не менее 2×10 клеток CD34/кг массы тела.
Таблица 14. 2 этап – 3 цикла высокодозной химиотерапии с поддержкой аутологичных ПСКК
Препарат | Доза | Путь введения | Дни введения |
|---|
#Этопозид** | 400 мг/м2 | внутривенно за 1 час | -4-2 |
#Карбоплатин** | AUC=8 | внутривенно за 1 час | -4-2 |
Тайминг между курсами 21-28 дней
Режим терапии TIP [14] [31]
Таблица 15. Схема терапии TIP
Препарат | Доза | Путь введения | Дни введения |
|---|
#Паклитаксел** | 175 мг/м2 | внутривенно за 3 часа | 1 |
Ифосфамид** на фоне профилактики месной** 500 мг/м2** | 1000 мг/м2 | внутривенно за 1 час | 1-5 |
Цисплатин** | 20 мг/м2 | внутривенно за 1 час | 1-5 |
Тайминг между курсами 21 день
Режим терапии #Гемцитабин**+#Паклитаксел** [15]
Таблица 16. Схема терапии #Гемцитабин**+#Паклитаксел**
Препарат | Доза | Путь введения | Дни введения |
|---|
#Гемцитабин** | 1000 мг/м2 | внутривенно за 30 минут | 1,8,15 |
#Паклитаксел** | 100 мг/м2 | внутривенно за 1 час | 1,8,15 |
Тайминг между курсами 28 день
Режим терапии #Гемцитабин**+#Паклитаксел**+Оксалиплатин** [32]
Таблица 17. Схема терапии #Гемцитабин**+ #Паклитаксел**+Оксалиплатин**
Препарат | Доза | Путь введения | Дни введения |
|---|
#Гемцитабин** | 800 мг/м2 | внутривенно за 30 минут | 1,8 |
#Паклитаксел** | 80 мг/м2 | внутривенно за 1 час | 1,8 |
#Оксалиплатин** | 130 мг/м2 | внутривенно за 2 часа | 1 |
Тайминг между курсами 21 день
Для детей младшего возраста (до 10 лет) с рефрактерными формами или рецидивами ГКО возможно применение следующих режимов химиотерапии: режим JEB, высокодозный режим CarboPET [13]. Решение о выборе оптимального режима второй линии терапии принимается индивидуально для каждого пациента после обсуждения клинической ситуации с Федеральным центром!
Режим терапии JEB
Таблица 19. Схема терапии JEB (#Карбоплатин**+Этопозид**+Блеомицин**) [36]
Препарат | Доза | Путь введения | Дни введения |
|---|
#Карбоплатин** | 600 мг/м2 | внутривенно за 3 часа | 2 |
#Этопозид** | 120 мг/м2 | внутривенно за 3 часа | 1-3 |
Блеомицин** | 15 мг/м2 | внутривенно за 1 час | 3 |
Тайминг между курсами – 21 день
Приложение А3.2. Профилактика и лечение тошноты и рвоты, обусловленных проведением противоопухолевой терапии
A3.2.1. Определение уровня эметогенности и варианта профилактики ТИР
Для выбора адекватного режима профилактики ТИР на первом этапе необходимо определение уровня эметогенности (риска развития ТИР) режима противоопухолевой терапии, который планируется использовать у пациента. Уровень эметогенности влияет на выбор препаратов для профилактики ТИР, их дозы и длительность применения [18].
В Приложении А3.2.6. (Таблица 20) представлена общая классификация эметогенности препаратов химиотерапии согласно рекомендациям ASCO (American Society of Clinical Oncology) [18] [37].
А3.2.2. Профилактика тошноты и рвоты на фоне высокоэметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, для детей в возрасте от 5 лет и/или массой 15 кг и более подходит использование четырехкомпонентной схемы, включающей блокаторы серотониновых 5HT3-рецепторов, антагониста NK1-рецепторов (другие противорвотные препараты), #дексаметазон**, и #оланзапин** [18] [38] [39] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется. Использование #оланзапина** у детей в возрасте менее 5 лет и/или массой тела менее 15 кг не исследовалось и не может быть рекомендовано.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 3-х дней после завершения введения препаратов химиотерапии, подходит использование комбинации #дексаметазона** и #оланзапина** [39] [41] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения антагониста NK1-рецепторов (другие противорвотные препараты) использование комбинации, состоящей из любого блокаторы серотониновых 5HT3-рецепторов, #дексаметазона** и #оланзапина** [41] [42] [40]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения #дексаметазона** в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов используется палоносетрон в комбинации с антагонистом NK1-рецепторов (другие противорвотные препараты, при возможности назначения) и #оланзапином** [43] [44]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.3. Профилактика тошноты и рвоты на фоне умеренно эметогенной химиотерапии
Для оптимальной профилактики острой ТИР, возникающих в день/дни введения препаратов химиотерапии, использование двухкомпонентной схемы, включающей блокатор серотониновых 5HT3-рецепторов и #дексаметазон** [18]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
Если в режим противоопухолевой терапии входит глюкокортикоид в дозе равной или превышающей дозу, показанную к использованию с противорвотной целью, дополнительного (к режиму противоопухолевой терапии) введения глюкокортикоида для профилактики ТИР в этот день не требуется.
Для оптимальной профилактики отсроченной ТИР, проводимой в течение 1 дня после завершения введения противоопухолевых препаратов, использование #дексаметазона** [18]. Режимы и дозы представлены в Приложении А3.2.6 (Таблица 1).
В случае отсутствия возможности назначения #дексаметазона** использование комбинации, состоящей из любого блокатора серотониновых 5HT3-рецепторов и антагониста NK1-рецептора (другие противорвотные препараты). Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
В случае отсутствия возможности назначения и #дексаметазона**, и антагониста NK1-рецепторов (другие противорвотные препараты), в качестве предпочтительного блокатора серотониновых 5HT3-рецепторов использование палоносетрона [18] [45]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.4. Профилактика тошноты и рвоты на фоне низко- и минимально эметогенной химиотерапии
Профилактика ТИР на фоне низко- и минимально эметогенной химиотерапии включает в себя однокомпонентную профилактику, включающей блокаторы серотониновых 5HT3-рецепторов, при низкоэметогенной терапии или же вовсе отсутствие ее в случае химиотерапии с минимальной эметогенной активностью [18]. Режимы и дозы представлены в Приложении А3.2.7 (Таблица 21).
А3.2.5. Лечение прорывной и рефрактерной рвоты
Пациентам с прорывной и рефрактерной рвотой на фоне цитостатической терапии показано:
Если прорывная ТИР возникла на фоне цитостатической терапии (и соответственно профилактики), относящейся к минимально, низко- или среднеэметогенному уровню, то необходимо использовать препараты, предусмотренные следующим, более высоким уровнем профилактики.
Если пациент и так получает профилактику, предусмотренную для высокоэметогенной терапии, то при возникновении прорывной ТИР необходимо рассмотреть вопрос о добавлении #оланзапина** (если он не применялся ранее в связи с неподходящим возрастом или массой тела). При невозможности использовать #оланзапин** в качестве альтернативы может быть применен метоклопрамид**.
В случае, если у пациента наблюдается рефрактерная ТИР и он еще не получает максимальный уровень профилактики, то необходимо провести эскалацию противорвотной терапии. Если рефрактерная ТИР наблюдается на фоне максимального уровня профилактики, возможна замена использующегося блокатора серотониновых 5HT3-рецепторовна палоносетрон, введение дополнительных доз блокаторов серотониновых 5HT3-рецепторов. При неудаче этих подходов к профилактике показано на постоянной основе добавить #оланзапин**, метоклопрамид** или другие препараты, показавшие у пациента эффективность при лечении прорывной рвоты [46].
A3.2.6 Таблица 20 – Уровень эметогенности противоопухолевых препаратов
Степень эметогенности (риск развития рвоты) | Рекомендации COG 2022 (педиатрические) + Рекомендации ASCO 2020 (общие для взрослых и детей) |
|---|
Высокая (>90%) | Монотерапия |
Аспарагиназа** (в/в) ≥20 000 МЕ/м2 Бусульфан (в/в) ≥0,8 мг/кг Бусульфан** (р.о.) ≥1 мг/кг Дакарбазин** (в/в) Дактиномицин (в/в) ≥1,35 мг/м2 Доксорубицин** (в/в) ≥30 мг/м2 Идарубицин (р.о.) ≥30 мг/м2 | Карбоплатин** (в/в) ≥175 мг/м2 Кармустин** (в/в) Мелфалан** (в/в) Метотрексат** (в/в) ≥12 г/м2 Цисплатин** (в/в) ≥12 мг/м2 Циклофосфамид** (в/в) ≥1200 мг/м2 Цитарабин** (в/в) ≥3 г/м2/сутки |
Комбинированные режимы |
Дакарбазин** ≥250 мг/м2 (в/в) + доксорубицин** (в/в) ≥60 мг/м2 Дактиномицин 900 мкг/м2(в/в) + ифосфамид** 3 г/м2 Циклофосфамид** >600 мг/м2 + дактиномицин ≥1 мг/м2 Циклофосфамид** ≥400 мг/м2 + доксорубицин** ≥40 мг/м2 | Цитарабин** ≥90 мг/м2 (в/в) + метотрексат** (в/в) ≥150 мг/м2 Этопозид** (в/в) ≥60 мг/м2 + ифосфамид** (в/в) ≥1,2 г/м2 Этопозид** (в/в) ≥250 мг/м2 + тиотепа (в/в) ≥300 мг/м2 |
Умеренная (31-90%) | Монотерапия |
Алемтузумаб** (в/в) Бендамустин** (в/в) Дактиномицин (в/в) 10 мг/кг Даунорубицин** (в/в) Доксорубицин** (в/в) 25 мг/м2 Идарубицин** (в/в) Иксабепилон** (в/в) 3-10 мг/м2 Иматиниб** (р.о.) >260 мг/м2/сутки Интерферон альфа** (в/в) 15-30 млнМЕ/м2/сутки Иринотекан** (в/в) | Ифосфамид** (в/в) Карбоплатин** (в/в) Клофарабин (в/в) Метотрексат** (в/в) 5 г/м2 Метотрексат** (и/т) Оксалиплатин** (в/в) Темозоломид** (в/в) Тиотепа (в/в) Циклофосфамид** (в/в) 1000 мг/м2 Цитарабин** (в/в) 75 мг/м2 Эпирубицин** (в/в) |
Комбинированные режимы |
Цитарабин** (в/в) 100 мг/м2 + Даунорубицин** (в/в) 45 мг/м2 + Этопозид** (в/в) 100 мг/м2 + Преднизолон** (р.о.) | Цитарабин** 60 или 90 мг/м2 + Метотрексат** 120 мг/м2 |
Низкая (10-30%) | Монотерапия |
Афлиберцепт** (в/в) Блинатумомаб** (в/в) Бортезомиб** (в/в) Децитабин (в/в) Доцетаксел** (в/в) Гемцитабин** (в/в) Гефитиниб** (р.о.) 150-500 мг/м2/сутки Иматиниб** (р.о.) 260 мг/м2/сутки Инотузумаб озогамицин (в/в) Кабазитаксел** (в/в) Карфилзомиб** (в/в) Мелфалан** (р.о.) 0,2 мг/г Меркаптопурин** (р.о.) ≤4,2 мг/кг Метотрексат** (в/в) 38-83 мг/м2 Митоксантрон** (в/в) ≤33 мг/м2 Митомицин** (в/в) Неларабин** (в/в) Паклитаксел** (в/в) Панитумумаб** (в/в) Пегилированный липосомальный доксорубицин** (в/в) | Пеметрексед** (в/в) Пертузумаб** (в/в) Прокарбазин (р.о.) 50-100 мг/м2/сутки Руксолитиниб** (р.о.) 15-21 мг/м2 Селуметиниб (р.о.) 20-30 мг/м2 Сорафениб** (р.о.) 150-325 мг/м2 Темозоломид** (р.о.) 200 мг/м2 Темсиролимус (в/в) Топотекан (в/в) Фторурацил** (в/в) Цетуксимаб** (в/в) Циклофосфамид** (в/в) 500 мг/м2 Циклофосфамид** (р.о.) 2-3 мг/кг Эверолимус** (р.о.) 0,8-9 мг/м2/сутки Элотузумаб** (в/в) Энфортумаб ведотин (в/в) Эрлотиниб** (р.о.) 35-150 мг/м2/сутки Эрибулин** (в/в) Этопозид** (в/в) |
Комбинированная терапия |
Цитарабин** (в/в) 60 мг/м2 + метотрексат** (в/в) 90 мг/м2 |
Минимальная (<10%) | Монотерапия |
Авелумаб** (в/в) Атезолизумаб** (в/в) Бевацизумаб** (в/в) Блеомицин** (в/в) Бусульфан** (в/в) Винбластин** (в/в) Винкристин** (в/в) ≤1,5 мг/м2 Винорелбин** (в/в) Даратумумаб (в/в) Доксорубицин** (в/в) 10 мг/м2 Дурвалумаб**(в/в) Ипилимумаб** (в/в) Кладрибин (в/в) | Меркаптопурин** (р.о.) ≤4.2 мг/кг Метотрексат** (р.о.) ≤10 мг/м2 Ниволумаб** (в/в) Обинутузумаб** (в/в) Офатумумаб (в/в) Пембролизумаб** (в/в) Полатузумаб ведотин (в/в) Рамуцирумаб** (в/в) Ритуксимаб** (в/в) Трастузумаб (в/в) Хлорамбуцил** (р.о.) ≤0.2 мг/кг/сутки Флударабин** (в/в) |
Комбинированные режимы |
Меркаптопурин** (р.о.) ≤ 2.5 мг/кг +метотрексат** (р.о.) ≤0.1 мг/кг/сутки | Цисплатин** ≤60 мг/м2 (в/а) + доксорубицин** ≤30 мг/м2 (в/а) |
A3.2.7 Таблица 21 – Дозы и режимы противорвотных препаратов
Степень эметогенности | Режимы | Дозы |
|---|
Высокая | Блокаторы серотониновых 5HT3-рецепторов + #Дексаметазон** + NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты) + #Оланзапин** | I. #Дексаметазон** 1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 внутривенно/перорально все дни химиотерапии и три дня после ее заверешения; 2. Дети, получающие химиотерапию с умеренной эметогенной активностью: ≤0,6 м2: 2 мг внутривенно/перорально каждые 12 часов; >0,6 м2: 4 мг внутривенно/перорально каждые 12 часов. При одновременном применении с #апрепитантом необходимо уменьшение дозы дексаметазона на 50%. II. Блокаторы серотониновых 5HT3-рецепторов #Гранисетрон 1. Дети, получающие высокоэметогенную химиотерапию: 40 мкг/кг внутривенно однократно. 2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 40 мкг/кг внутривенно однократно. 3. Дети, получающие химиотерапию с низкой эметогенной активностью: 40 мкг/кг внутривенно однократно. #Ондансетрон** 1. Дети, получающие высокоэметогенную химиотерапию: 5 мг/м2 (0,15 мг/кг) внутривенно/перорально перед терапией однократно, а затем каждые 8 часов. 2. Дети, получающие химиотерапию с умеренной эметогенной активностью: 5 мг/м2 (0,15 мг/кг; максимум 8 мг) внутривенно/ перорально перед терапией однократно, а затем каждые 12 часов. 3. Дети, получающие химиотерапию с низкой эметогенной активностью: 10 мг/м2 (0,3 мг/кг; максимум 16 мг внутривенно или 24 мг перорально) до начала терапии однократно. Палоносетрон 1. Дети от 1 месяца до 17 лет: 0,02 мг/кг (максимум 1,5 мг) внутривенно один раз перед терапией. 2. Дети 17 лет и старше: 0,5 мг внутривенно однократно перед терапией. III. Антагонисты NK-1 рецепторов (по АТХ классификации A04AD: Другие противорвотные препараты) #Апрепитант Дети старше 6 месяцев: - 1-й день: 3 мг/кг (максимум 125 мг) перорально 1 раз в сутки за 1 час до химиотерапии - 2-й и 3-й дни: 2 мг/кг (максимум 80 мг) перорально один раз в сутки. #Фосапрепитант 1. Дети от 6 месяцев до 2-х лет: 5 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день; 2. Дети от 2-х до 12 лет: 4 мг/кг (максимальная доза 150 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день; 3. Дети от 12 до 17 лет: 150 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день Комбинация #апрепитант + #фосапрепитант 1. Дети от 6 месяцев до 12 лет: - 3 мг/кг (максимальная доза 115 мг) внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день; - 2 мг/кг (максимальная доза 80 мг) перорально, дни 2,3; 2. Дети от 12 до 17 лет: - 115 мг внутривенно в течение 30 минут за 60 минут до начала химиотерапии в первый день - 80 мг перорально, дни 2,3. IV. #Оланзапин** 1. Дети весом от 30 кг – 0,07 мг/кг (от 30 до 55 кг – 2,5 мг/сут, свыше 55 кг – 5 мг/сут) перорально за 1 час до введения противоопухолевых препаратов, все дни химиотерапии и три дня после ее завершения; 2. Дети весом >15 и <30 кг – 2,5 мг/сут перорально за 1 час до введения противоопухолевых препаратов , все дни химиотерапии и три дня после ее завершения; Для детей весом менее 15 кг и/или возрастом менее 5 лет – неприменимо в силу отсутствия данных исследований об эффективности и безопасности #оланзапина**. |
Блокаторы серотониновых 5HT3-рецепторов+ #Дексаметазон** + NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты) |
Блокаторы серотониновых 5HT3-рецепторов+ #Дексаметазон** + #Оланзапин** |
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон) + #Оланзапин** +/- NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты) |
Умеренная | Блокаторы серотониновых 5HT3-рецепторов+ #Дексаметазон** |
Блокаторы серотониновых 5HT3-рецепторов+ NK1-антагонисты (по АТХ классификации A04AD: Другие противорвотные препараты) |
Блокаторы серотониновых 5HT3-рецепторов (палоносетрон) |
|
Низкая | Блокаторы серотониновых 5HT3-рецепторов |
Минимальная | Блокаторы серотониновых 5HT3-рецепторов или отсутствие профилактики |
Приложение А3.3. Рекомендации по оценке нутритивного статуса и его коррекции
А3.3.1. Нутритивный скрининг и мониторинг
Всем пациентам при поступлении в стационар и далее от 1 до 4 раз в месяц показано проводить нутритивный скрининг (скрининговую оценку нутритивного статуса) с целью выявления белково-энергетической недостаточности либо риска ее развития [47] [28] [48]
Выявление нутритивных нарушений на ранних этапах их развития, особенно до начала противоопухолевой терапии позволяет своевременно начать нутритивную коррекцию. Критерии белково-энергетической недостаточности, ожирения и факторы нутритивного риска – см. приложение А3.3.2. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/инструментов для проведения нутритивного скрининга [49].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [29].
Для проведения нутритивного скрининга необходимо использовать специальные валидированные опросники/ инструменты, особенно актуальным их использование является на этапе первичного поступления в стационар и/или на (очередном) этапе поступления в клиническое отделение [29] [50].
В своем большинстве скрининговые инструменты ориентированы на объединение данных об основном диагнозе, клиническом статусе, антропометрических показателях, динамике массы тела, состоянии питания и интеграции этих данных в общий балл с последующим разделением пациентов на 2 или 3 когорты: не нуждаются в нутритивной коррекции (поддержке); требуют повторного скрининга в динамике («тревожная» группа); нуждаются в нутритивной коррекции (поддержке). Клиническое подразделение (или учреждение) вправе использовать тот инструмент, или комбинацию инструментов, которую посчитает наиболее приемлемой для проведения нутритивного скрининга среди своих пациентов. Необходимо помнить, что существующие скрининговые инструменты не предназначены для ответа на вопрос об объеме и способе необходимой нутритивной поддержки, не несут в себе прогностической информации для конкретного пациента, поскольку их применение нацелено исключительно на медицинскую сортировку. К тому же, универсального инструмента для скрининга в педиатрии не существует
Для первичной (общей) оценки нутритивного статуса и выявления нутритивного риска необходимо учитывать антропометрические показатели, изменение массы тела за определенный период (3, 6 или 12 месяцев), данные о питании (режим, привычный состав питания, особенности приема пищи, возможные нарушения приема пищи, наличие непереносимости/аллергии на компоненты пищи), об эндокринном статусе (данные о выявленных эндокринных нарушениях у ребенка), данные о выявленных гастроинтестинальных нарушениях [29] [50].
В качестве обязательного минимума основных антропометрических параметров для первичной и регулярной оценки нутритивного статуса необходимо использовать следующие: масса тела, рост (длина тела), индекс массы тела [29] [47].
В качестве дополнительных антропометрических параметров в случае потребности в детальном антропометрическом исследовании для первичной и регулярной оценки нутритивного статуса используются следующие: измерение окружностей, длин, толщины складок, кистевая динамометрия [28] [47].
Для соотнесения полученных данных антропометрии (рост, масса тела, индекс массы тела, окружность плеча) с нормативными значениями по педиатрической популяции используются референсные значения (шкалы), либо локальных (отечественных) референсов, либо мировых общеиспользуемых номограмм: центильные значения/перцентили, либо величина отклонения полученного значения от среднего по популяции (SDS или z-score) [47] [50].
Часто используемыми «по умолчанию» в РФ являются референсы ВОЗ (WHO growth charts), для удобства работы с которыми существуют свободно доступные программы (WHO anthro и WHO anthro plus), которые быстро позволяют высчитать ключевые антропометрические параметры в соотнесении их с референсными данными ВОЗ. Однако возможно использование и других референтных данных для соотнесения данных пациента с нормативами – в таком случае необходимо указывать, какие конкретно референсы применялись.
Пациентам с выявленными нутритивными нарушениями при первичном скрининге рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр и опрос на предмет выявления нутритивно-метаболических нарушений и их предикторов [29].
Ввиду высокой распространенности в детской популяции с онкологическими заболеваниями нарушений состава тела, тканевого дисбаланса в виде скрытой белково-энергетической недостаточности (саркопении), скрытого ожирения (накопления жировой массы), в виду распространенности отеков (в том числе и скрытых), а также нарушений распределения компартментов жидкости показана оценка состава тела различными имеющимися методами: биоимпедансный анализ, двухэнергетическая рентгеновская абсорбциометрия, МРТ, КТ и др. – для уточняющей и углубленной оценки состава тела в группах риска. Эти группы следующие: хроническая белково-энергетическая недостаточность, длительная, более 2 месяцев, необходимость в парентеральном питании, включение в терапию гормональных препаратов, опухоли ЦНС, хронические расстройства приема пищи (пищевого поведения), реципиенты ГСК при выявленных антропометрически нутритивных нарушениях [29] [50].
Всем пациентам, получающим нутритивную поддержку, показано проводить нутритивный мониторинг, в который включается опрос, антропометрию, анализ тканевого состава тела, лабораторные показатели (анализ крови биохимический общетерапевтический, копрологическое исследование) [29] [51]
А3.3.2. Нутритивная поддержка
Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) показано проведение нутритивной поддержки (НП) [29].
Наличие белково-энергетической недостаточности или высокого риска ее развития у детей с ЗНО в процессе противоопухолевого лечения обуславливает связанные с этим риски увеличения инвалидизации, увеличения длительности и объема основного и сопроводительного лечения, низкой успешности проводимого лечения, увеличения смертности и общих финансовых затрат на лечебно-реабилитационные мероприятия – в процессе активного противоопухолевого лечения и после его окончания. Скрытая БЭН (например, избытком жировой массы на фоне длительного приема глюкокортикоидов) сопровождается такими же рисками. Поэтому, учитывая высокую вероятность усугубления нутритивных проблем на фоне лечения, пациентам целесообразно назначать нутритивную поддержку в дополнение к существующему рациону или заменяя его.
У пациентов с ожирением (избытком жировой массы) возможно развитие скрытой белково-энергетической недостаточности, определяемой дефицитом безжировой массы тела и критическим уменьшением ее скелетно-мышечного компартмента, в связи с чем показано проведение коррекции данного вида дефицита, наличие ожирения само по себе не является противопоказанием для проведения нутритивной поддержки энтеральным или парентеральным путем [50] [52] [53].
При выборе формы, метода, вида и объема нутритивной поддержки необходимо руководствоваться, в первую очередь, принципом индивидуального пациент-ориентированного подхода – сообразно клинической ситуации и логике [29].
В случае, если пациент не может/не хочет/не готов принимать назначенный объем смеси в необходимом режиме самостоятельно показана установка назогастрального или назоинтестинального зонда или гастростомия [29] [54].
Отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии – показания для проведения ЭП через зонд питательный назогастральный. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) – в этих случаях показана реализация ЭП через зонд назоеюнальный стерильный однократного применения.
При текущей или потенциальной необходимости проведения зондового питания продолжительностью более 6 недель, показана гастростомия [29].
В случае, когда выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), возможно превентивная гастростомия, минуя этап зондового питания.
Ключевым показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность (как минимум, на уровне энергопотребности основного обмена) пациента энтеральным путем – текущая или потенциально возможная в краткосрочной перспективе.
Начало парентерального питания необходимо производить постепенно, ступенчато увеличивая объем (и скорость) суточной инфузии, начиная от трети/ половины расчетного целевого объема и, под мониторингом показателей анализа крови биохимического общетерапевтического (прежде всего, глюкоза, прямой билирубин, мочевина), исследование кислотно-основного состояния и газов крови, за несколько суток (скорость достижения целевого объема определяется индивидуально по клинической ситуации) довести объем до целевого. Отмену парентерального питания необходимо производить также постепенно, ступенчато, в обратном порядке.
Крайне нежелательно назначение парентерального питания сразу в полном объеме, равно как разовая («со следующих суток») отмена полного парентерального питания. Особенно опасным является назначение полного парентерального питания больным с длительным отсутствием алиментации – ввиду возможного развития рефидинг-синдрома. Объем ПП должно постепенно (ступенчато) увеличивать под параллельным контролем КЩС (исследование кислотно-основного состояния и газов крови), электролитов, глюкозы, мочевины, прямого билирубина в крови. При необходимости, объем и состав ПП должны корректироваться.
А3.3.3. Справочно-информационные таблицы по оценке нутритивного статуса и его коррекции.
Таблица 22. Интерпретация нутритивного статуса на основании Z-score согласно референсным данным ВОЗ [48].
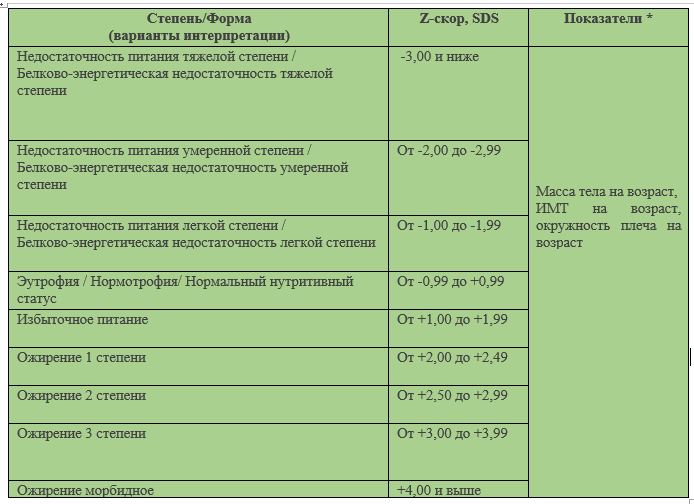
Примечания: нутритивный статус в онкопедиатрии оценивается по совокупным данным (клинические, лабораторные, инструментальные), с учетом нутритивного риска, антропометрические показатели позволяют критериально ориентироваться в определении нутритивного статуса и не могут быть единственно определяющими [50].
* – в определении нутритивного статуса используется показатель с минимальным SDS; SDS – standard deviation score (величина стандартного отклонения), ожирение – простое; гипоталамическое; при нейроэндокринных заболеваниях; ятрогенное; моногенное; синдромальное
Таблица 23. Факторы высокого риска развития нарушений нутритивного статуса [50]
Критерии |
|---|
1. Нарушения аппетита в течение ближайшей недели или особенности аппетита (избирательность, привередливость в питании, нестабильный и непостоянный аппетит и др.), выявленные анамнестически, свойственные данному ребенку с раннего возраста 2. Снижение объема потребления пищи на 1/3-1/2 и более от рекомендуемых возрастных норм (или снижение частоты/ объема питания в динамике за неделю по данным опроса или данным пищевого дневника) 3. Потеря более 2% массы тела за неделю или более 5% за месяц 4. Исходная гастроинтестинальная дисфункция (хронические заболевания ЖКТ, непереносимость компонентов пищи и пищевая аллергия) или сформировавшаяся на фоне противоопухолевого лечения 5. Заболевания обмена веществ и/или эндокринные заболевания 6. Опухоли брюшной полости, малого таза, локализованные забрюшинно, опухоли головы и шеи 7. Предстоящая ТГСК и ранний – до 3-х месяцев – посттрансплантационный период 8. Возраст менее 3 лет |
Примечание: При наличии минимум двух вышеперечисленных критериев пациент относится к группе высокого нутритивного риска – вне зависимости от текущего нутритивного статуса, его текущего питания и клинической ситуации |
Таблица 24. Основные скрининговые инструменты для выявления риска нутритивных нарушений в педиатрии [51] [50]
Скрининговый инструмент | Данные, необходимые для оценки риска |
|---|
Определение степени острой и хронической БЭН | Антропометрические данные |
Простая педиатрическая шкала для выявления детей с риском недоедания (PNRS) | Антропометрические данные Прием пищи Желудочно-кишечная дисфункция Симптомы, которые могут нарушать аппетит (боль, одышка, депрессия) Тяжесть основного заболевания |
Инструмент скрининга для оценки недоедания в педиатрии (STAMP) | Антропометрические данные Прием пищи Тяжесть основного заболевания |
Инструмент скрининга нутритивного риска у детей в стационаре (STRONGkids) | Прием пищи Субъективная клиническая оценка Тяжесть основного заболевания Потеря веса |
Детская шкала недоедания по Йоркиллу (PYMS) | Индекс массы тела Потеря веса Изменения в приеме пищи |
Инструмент нутритивного скрининга для детской онкологии (SCAN) | Тип онкологического заболевания Интенсивность лечения (химиотерапия, лучевая терапия, ТГСК) Желудочно-кишечная дисфункция Прием пищи Потеря веса Субъективная клиническая оценка |
Субъективная глобальная оценка питания (SGNA) | Антропометрические данные Потеря веса Желудочно-кишечная дисфункция Клинический статус Прием пищи |
Таблица 25. Рекомендуемые потребности детей в основных нутриентах и энергии (на кг массы тела в сутки) при расчете диетотерапии и энтерального питания [55].
Возраст | Белки, г/кг в сутки | Жиры, г/кг в сутки | Углеводы, г/кг в сутки | Энергия, ккал/кг в сутки |
|---|
Новорожденные | 1,5-4 | 3-4 | 18 | 110-120 |
до 1 года | 1-2,5 | 3-4 | 16-18 | 90-100 |
1-2 года | 1-2 | 2-3 | 12-14 | 75-90 |
3-6 лет | 10-12 | 75-90 |
7-12 лет | до 12 | 60-75 |
13-18 лет | до 10 | 30-60 |
Примечания: Потребности приведены для ориентировки расчета и назначения энтерального питания; они не отменяют и не заменяют пациент-ориентированный подход в назначении нутритивной поддержки: в каждом конкретном случае следует учитывать клиническую картину, возможные метаболические и органные дисфункции и корректировать поступление нутриентов с учетом возможности и переносимости ребенком
Приложение А3.4. Гемотрансфузионная поддержка
Приказ Министерства здравоохранения РФ от 28 октября 2020 г. №1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", зарег. в Минюсте РФ 27.11.2020 №61123 регламентирует порядок гемотрансфузионной поддержки пациентов, нуждающихся в оказании такого рода медицинской помощи.
Детям со злокачественными новообразованиями, получающими химио- и/или лучевую терапию, при тяжелой анемии (Нв ˂70 г/л, Ht ˂25%) с проявлениями симптомов и признаков анемической гипоксии и без кровотечений рекомендуются трансфузии эритроцитсодержащих компонентов донорской крови [56].
Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после индуцированной аплазии. Однако, в случае предстоящей интенсивной химиотерапии в отсутствии клинических проявлений анемического синдрома трансфузии эритроцитсодержащих компонентов донорской крови могут быть оправданы. Решение о применении трансфузий должно обосновываться, прежде всего, клиническими, а не лабораторными данными [57] [58].
Стабильным пациентам детского возраста со злокачественными новообразованиями в отсутствие кровотечений показано проводить трансфузии эритроцитсодержащих компонентов донорской крови в дозе 10-15 мл на кг массы тела [57] [58] .
Пациентам детского возраста с онкологическими заболеваниями проводят трансфузии лейкоредуцированных компонентов донорской крови [59].
Было показано, что применение лейкоредуцированных компонентов донорской крови позволяет снизить частоту фебрильных негемолитических трансфузионных реакций, а также существенно снижает вероятность HLA-аллоиммунизации пациента и передачу некоторых гемотрансмиссивных инфекций (цитомегаловирус, вирус Эпштейна-Барр).
С целью предотвращения посттрансфузионной реакции трансплантат против хозяина, пациентам со злокачественными заболеваниями, получающими химио- и/или лучевую терапию и находящимися в иммуносупрессии, рекомендуется проводить трансфузии клеточных компонентов крови, облученных ионизирующим излучением в дозе 25 Гр [59].
У детей со злокачественными новообразованиями и гипопролиферативной тромбоцитопенией, вызванной основным заболеванием и/или его лечением, показаны профилактические трансфузии концентрата тромбоцитов при следующих условиях [60]:
- стабильным новорожденным при снижении количества тромбоцитов ≤25×109/л;
- стабильным пациентам при снижении количества тромбоцитов ≤10×109/л;
- пациентам с лихорадкой при снижении количества тромбоцитов ≤15×109/л;
- у пациентов с повышенным риском кровотечений при снижении количества тромбоцитов ≤20×109/л;
- перед выполнением малой хирургической манипуляции в некритических локусах при снижении количества тромбоцитов ≤20×109/л;
- перед выполнением люмбальной пункции, при снижении количества тромбоцитов ≤40×109/л;
- перед выполнением чрескожной биопсии печени, если количество тромбоцитов ≤50× 109/л;
- при хирургических вмешательства в критических локализациях (например, центральная нервная система), если количество тромбоцитов ≤75-100×109/л;
- перед иными оперативными вмешательствами при количестве тромбоцитов ≤50×109/л
Повышенный риск кровотечений имеют пациенты получающие антитромботические средства, пациенты с ДВС, сепсисом и др.
Трансфузии концентрата тромбоцитов у детей с гипопролиферативной тромбоцитопенией и геморрагическим синдромом используются при [60]:
- малом геморрагическом синдроме и снижении количества тромбоцитов ≤10×109/л;
- умеренном геморрагическом синдроме и снижении количестве тромбоцитов ≤20×109/л;
- тяжелом геморрагическом синдроме и снижении количестве тромбоцитов ≤30×109/л;
- при кровотечении в критически важной локализации (например, ЦНС) синдроме и снижении количестве тромбоцитов ≤100×109/л
Трансфузии тромбоцитов у детей со злокачественными новообразованиями показаны в следующей дозе [60]:
- новорожденные 10-15мл/кг
- дети с массой тела более 10кг: 10мл/кг
Трансфузии гранулоцитного концентрата показаны детям с онкологическими заболеваниями и тяжелой, затяжной нейтропенией (количество нейтрофилов менее 200/мкл) при наличии тяжелой бактериальной или грибковой инфекции, не поддающейся лечению адекватной противомикробной терапией [59].
Трансфузии донорской свежезамороженной плазмы крови показаны детям с онкологическими заболеваниями при наличии клинически-значимого кровотечения в сочетании с повышением активированного частичного тромбопластинового времени (АЧТВ) и/или международного нормализованного отношения (МНО) более чем в 1,5 раза от верхней границы нормы [59].
Трансфузии донорской свежезамороженной плазмы детям со злокачественными новообразованиями показаны в дозе 15 мл/кг массы тела [59].
Трансфузии криопреципитата у детей с онкологическими заболеваниями показаны при снижении концентрации фибриногена менее 1-1.5г/л [61].
Трансфузии криопреципитата при приобретённом дефиците фибриногена, вызванном различными причинами, показаны при снижении его концентрации в сыворотке менее 1 г/л. Трансфузии криопреципитата при снижении его концентрации в крови ниже 1,5 г/л показан для пациентов с острым промиелоцитарным лейкозом, при тяжелом интраоперационном кровотечении и у пациентов с сепсисом при развитии геморрагического синдрома.
Приложение А3.5. Особенности венозного доступа в обеспечении успешных диагностических и лечебных мероприятий у детей с онкологическими и гематологическими заболеваниями.
3.5.1 Общие особенности венозного доступа.
Прилагаемая производителем инструкция и документация к устройству венозного доступа позволяет предоставить ключевую информацию об устройстве, возможных скоростях и ограничении давления при введении, объеме заполнения устройства всему персоналу занимающемуся ежедневным уходом за пациентом или проводящим диагностические процедуры [62]. Данная документация должна быть быстро и постоянно доступна персоналу, работающему с пациентом.
3.5.2 Рекомендации по выбору устройства
Выбор устройства венозного доступа должен основываться на потребностях пациента и учитывать:
- Диагноз, план ведения и ожидаемую продолжительность внутривенного лечения;
- Возраст пациента;
- Возможные предпочтения пациента в отношении типа или расположения устройства;
- Состояние вен пациента;
- Доступные ресурсы для установки и поддержания работоспособности устройства.
Не существует достаточных доказательств для однозначного преимущества одного устройства перед другим для каждой категории пациентов. Желательно использовать центральный венозный катетер с наименьшим числом просветов [63].
При наличии противопоказаний к введению центрального венозного катетера через вены бассейна верхней полой вены используются центральные венозные катетеры, вводимые через бедренную вену.
Для постоянного использования (ежедневно или хотя бы один раз в неделю) показано применять внешние катетеры такие как PICC, CICC, для периодического использования (реже одного раза в неделю) – полностью имплантированные системы (порт) (порт/катетер инфузионный/инъекционный, имплантируемый***) [62].
3.5.3 Рекомендации по установке устройства
Устройство центрального венозного доступа вводится по срочным и плановым показаниям в условиях асептического операционного зала. Подробное описание имеется в клинических рекомендациях ФАР.
Выбор вены зависит от состояния венозной системы пациента. Предпочтительнее использовать устройства, позволяющие вводить высокие потоки и контрастное средство [64] [65]. Следует стремиться чтобы соотношение диаметра центрального венозного катетера к диаметру вены не превышало 1/3.
Использование многопросветных центральных венозных катетеров, хоть и показано некоторым специфическим категориям пациентов, но при этом связано с повышенным риском инфицирования [66] [67].
Выбирать материал центрального венозного катетера необходимо, основываясь на высоких характеристиках потока и сопротивления давлению, а также долговечности устройств.
3.5.4. Уход за венозным доступом и его удаление.
Уход за венозным доступом осуществляется с соблюдением правил асептики и антисептики, показана периодическая смена повязки, промывание венозного доступа, его «закрытие» в случае прерывистого характера лечения, удаление в соответствие с показаниями [68].
Приложение А3.6. Профилактика и лечение инфекций
3.6.1 Используемые стандартные определения
Нейтропения определяется количеством гранулоцитов менее 0,5х109/л, либо менее 1,0х109/л с ожидаемым снижением в течение нескольких последующих дней.
Фебрилитет – однократный подъем температуры тела ≥38,3°С или температура тела ≥37,8°C, сохраняющаяся в течение одного и более часа.
Гипотермия – снижение температуры тела менее 36°С. Данный показатель является важным признаком инфекционного процесса, особенно у детей младшего возраста и у пациентов, получающих глюкокортикоиды.
Лихорадка неясной этиологии – состояние, характеризующееся фебрилитетом при отсутствии клинико-рентгенологических проявлений инфекции и микробиологических данных.
Бактериемия – идентификация микроорганизма из гемокультуры, взятой во время фебрильного эпизода, не являющегося присевным. К ложной бактериемии относится идентификация так называемых присевных микроорганизмов – комменсалов кожи рук: коагулазонегативных стафилококков, Propionibacterium spp., Micrococcus spp., и др. – в случае их однократной идентификации.
Доказанной является инфекция, при которой имеется идентификация микроорганизма из стерильных субстратов организма (кровь, ликвор, моча, биопсийный материал) при наличии симптомов воспалительной реакции, либо изоляция патогена из нестерильных субстратов (кожа, слизистые, желудочно-кишечный тракт) при соответствующей локальной клинической картине инфекции.
Вероятной является инфекция, при которой нет идентификации микроорганизма из исследуемых сред, а имеются клинические и/или радиологические признаки инфекции с быстрым ответом на противоинфекционную терапию.
Фебрильная нейтропения – симптомокомплекс, сочетающий развитие фебрилитета или гипотермии у пациента с критериями нейтропении. Является наиболее ожидаемым инфекционным осложнением и развивается у подавляющего большинства пациентов группы высокого риска, реже – у пациентов стандартного риска.
Пациенты с ГКО относятся к стандартной группе риска. В данной группе ожидаемая продолжительность нейтропении менее 7 дней.
3.6.2 Антибиотикотерапия
При развитии фебрильной нейтропении после забора крови для микробиологического исследования крови на стерильность показано незамедлительное внутривенное назначение антибиотиков широкого спектра действия (антибактериальные препараты системного действия) – при стабильном состоянии пациентов максимально допустимый интервал не должен превышать 60 минут, а в случае нестабильной гемодинамики 30 минут [24] [69] [70]. Все остальное обследование в необходимом объеме должно быть проведено после назначения стартовой терапии.
При развитии ФН необходимо инициировать эмпирическую антибиотикотерапию широкого спектра с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. Выбор стартовой терапии зависит от группы риска, соматического состояния пациента, локальных эпидемиологических данных и рекомендаций, а также результатов скрининга и предшествующего инфекционного анамнеза пациента [70] [21]. Для пациентов стандартной группы риска показано назначение цефалоспоринов (ЦФ) третьего поколения [21].
Целесообразные варианты эмпирической антибиотикотерапии:
- #Пиперациллин+[Тазобактам] 300 (400) мг/кг/сут за 3-4 введения или непрерывной инфузией (максимальная суточная доза 16 г) +/- #амикацин** 15-22,5 мг/кг/сут за одно введение) [71]
- #Цефепим** (150 мг/кг/сут за 3 введения (максимальная суточная доза 6 г) +/- #амикацин** 15–22,5 мг/кг/сут за одно введение) [71].
- #Цефоперазон+[Сульбактам]** 40-80 мг/кг/сутки (4 г х 2 раза либо 160 мг/кг/сут по цефоперазону за 3 введения +/- #амикацин** 15-22,5 мг/кг/сут за одно введение) [71].
- Цефтазидим** (по 2 г х 3 раза либо 100-150 мг/кг/сут за 3 введения) [71].
1. В клиниках с низкой частотой детекции энтеробактерий с продукцией БЛРС допустимо назначение:
- #Цефепим** (по 2 г х 3 раза либо 100-150 мг/кг/сут за 3 введения) [71].
- Цефтазидим** (2 г х 3 раза, внутривенно либо 100-150 мг/кг/сут за 3 введения) [71].
Назначение ванкомицина** внутривенно в дополнение к базовому препарату в первой линии терапии показано при развитии язвенно-некротического стоматита, поражении мягких тканей, подозрении на катетерную инфекцию (до получения микробиологического подтверждения), у пациентов после проведения ХТ с применением высоких доз цитарабина**, а также в случае предшествующей колонизации пациента метициллин-резистентным золотистым стафилококком (МРЗС);
2. При тяжелой инфекции в 1-й линии терапии могут быть назначены карбапенемы (интраабдоминальная инфекция, поражение мягких тканей параректальной области и др.):
- #Имипенем+[Циластатин]** 60-100 мг/кг/сут за 3-4 введения + #амикацин** 15-20 мг/кг/сут за одно введение) [71].
- #Меропенем** 60 мг/кг/сутки каждые 8 часов, при тяжелой инфекции 120 мг/кг/сутки каждые 8 часов (максимальная суточная доза 6 г) + #амикацин** 15-20 мг/кг/сут за одно введение) [71].
3. При подозрении на развитие анаэробной инфекции (гингивит, целлюлит периоральной области, интраабдоминальная или параректальная инфекция) необходимо назначение антибиотиков, обладающих антианаэробной активностью (#Пиперациллин+[Тазобактам], #Имипенем+[Циластатин]**, #метронидазол*) [71, 72].
4. При развитии клостридиальной инфекции или диареи при невозможности определения токсина C. difficile в кале – #метронидазол** (0,5 г каждые 8 часов, внутривенно или 10 мг/кг каждые 8 часов. При тяжелом течении энтероколита возможно пероральное назначение ванкомицина** в суточной дозе 500 мг х 4 раза в сутки [72].
5. При аллергии на бета-лактамные антибактериальные препараты, пенициллины в качестве альтернативной схемы могут быть назначены фторхинолоны:
- #Левофлоксацин** (10 мг/кг х 2 р/сут в/в – детям до 5 лет, 10 мг/кг в/в за одно введение (максимум 750 мг/сут ) – детям старше 5 лет [73].
Модификация противомикробной терапии проводится на основании клинических симптомов, инструментальных и микробиологических исследований. При сохранении фебрилитета и стабильном клиническом состоянии пациентов, допустимо ожидать клинического ответа на стартовую антибактериальную терапию в течение 48-72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса. У больных с персистирующей фебрильной нейтропенией и отрицательной гемокультурой при модификации учитывают чувствительность грамотрицательных бактерий, колонизирующих слизистую оболочку кишечника. Препаратами резервной группы являются #колистиметат натрия, полимиксин В**, #тигециклин**, #Цефтолозан+[Тазобактам]**, Цефтазидим+[Авибактам]** (в некоторых ситуациях в комбинации с азтреонамом).
Рекомендованные дозы:
- #Колистиметат натрия – нагрузочная доза 118 000 ЕД/кг, далее по 74 000 ЕД/кг каждые 12 часов (максимально 320 мг х 2 р/сут) [74]
- Полимиксин В** 2,5 мг/кг/сут за 2 введения; у детей до 1 года 4 мг/кг/сут за 2 введения
- #Тигециклин**
#Тигециклин** (дети от 2,5 до 8 лет): нагрузочная доза 2 мг/кг (100 мг), далее по 1,2 мг/кг (50 мг) каждые 12 часов [75].
#Тигециклин** (дети от 8 д о 11 лет и от 12 до 17 лет): 1,2 мг/кг каждые 12 часов (максимальная доза 50 мг), далее каждые 12 часов 50 мг [75].
- #Цефтазидим+[Авибактам]** 120 мг/кг/сутки в/в по сутки по цефтазидиму каждые 8 часов для детей старше для детей 3-5 месяцев, 150 мг/кг/сутки в/в каждые 8 часов для детей старше 6 месяцев (максимальная суточная доза 6 г) [76].
- При необходимости назначения #Цефтазидим+[Авибактам]** в комбинации с азтреонамом** препараты должны вводиться одновременно параллельными инфузиями.
При развитии признаков сепсиса и септического шока следует назначить антибактериальные препараты системного действия наиболее широкого спектра действия: карбапенемы в сочетании с аминогликозидами и ванкомицином**, а пациентам с известной колонизацией – препараты группы резерва. При развитии тяжелых инфекционных осложнений и/или сепсиса антибактериальные препараты системного действия назначаются в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме [77] [78] [79].
При развитии инфекций, ассоциированных с грамположительной флорой, выбор антибактериальных препаратов системного действия должен проходить с учетом данных чувствительности и наибольшей эффективности в контексте конкретной клинической ситуации:
3.6.4 Эмпирическое назначение противогрибковых препаратов системного действия
При сохранении фебрилитета в течение 96-120 часов, несмотря на проводимую эмпирическую антибактериальную терапию первой и второй линий, и отсутствие очагов инфекции начало эмпирической противогрибковой терапии [80] [81] [82]:
- Каспофунгин** (дети старше 3 мес) 70 мг/м2 в первые сутки (не более 70 мг в сутки), далее по 50 мг/м2 (не более 70 мг в сутки) внутривенно 1 раз в сутки
- Амфотерицина В [липосомальный] (дети старше 1 мес) (3 мг/кг/сут за 1 введение)
- Альтернативными препаратами являются другие эхинокандины (другие противогрибковые препараты системного действия) – микафунгин** [81]:
- Микафунгин** (дети старше 16 лет): масса тела >40 кг – 100 мг/сутки, масса тела <40 кг: 2 мг/кг/сутки;
- Микафунгин** (дети старше 4 месяцев и младше 16 лет): масса тела >40 кг – 100 мг/сутки, масса тела <40 кг: 2 мг/кг/сутки;
- Микафунгин** (дети <4 месяцев): 4-10 мг/кг сутки.
Приложение А3.7. Уровень альфа-фетопротеина у здоровых новорожденных
Таблица 26. Уровень альфа-фетопротеина у здоровых новорожденных
Возраст, дни | Медиана АФП, ng/ml | АФП 95 % интервал, ng/ml | Период полураспада в днях |
|---|
0 | 158 125 | 31 261-799 834 | 6 |
1 | 140 605 | 27 797-711 214 |
2 | 125 026 | 24 717-732 412 |
3 | 111 173 | 21 979-562 341 |
4 | 98 855 | 19 543-500 035 |
5 | 87 902 | 17 371-444 631 |
6 | 77 625 | 15 346-392 645 |
7 | 69 183 | 12 589-349 945 |
8-14 | 43 401 | 6 039-311 889 |
15-21 | 19 230 | 2 667-151 356 | 14 |
22-28 | 12 246 | 1 164-118 850 |
29-45 | 5 129 | 389-79 433 |
46-60 | 2 443 | 91-39 084 |
61-90 | 1 047 | 19-21 878 | 28 |
91-120 | 398 | 9-18 620 |
121-150 | 193 | 4-8 318 |
151-180 | 108 | 3-4 365 |
181-270 | 47 | 0,8-2 630 | 100 |
271-360 | 18 | 0,4-832 |
361-720 | 4 | 0-372 |