Окончательное решение по варианту лечения должен принимать врач –травматолог–ортопед, в сложных случаях совместно с другими специалистами (например, врачом – пластическим хирургом, врачом – клиническим фармакологом, врачом – инфекционистом). Успешное лечение ИАИ включает комбинацию адекватной хирургической тактики и антимикробной терапии, активной в отношении возбудителей данного инфекционного процесса. Выбор неверной хирургической тактики и/или нерациональное применение антибиотиков являются наиболее частыми причинами персистирующего и рецидивирующего характера течения инфекционного процесса. Во многом выбор тактики лечения определятся патогенезом ИАИ, а именно стадией зрелости микробной биопленки, о чем говорилось ранее. Необходимо отметить, что между ППИ и ПАИ существует целый ряд принципиальных отличий, оказывающих влияние на тактику лечения. В настоящее время отсутствуют общепринятые критерии и стандартные подходы для лечения ПАИ. При этом в сравнении с ППИ перелом-ассоциированная инфекция, как правило, характеризуется:
- худшим состоянием перифокальных тканей, что определяется характером и тяжестью травмы,
- необходимостью повторных операций для коррекции фиксации, закрытия мягкотканых дефектов и т.д.,
- необходимостью обеспечения биомеханической стабильности поврежденного сегмента конечности,
- более частым назначением стартовой эмпирической антибактериальной терапии, в связи с выделением возбудителя в большинстве случаев только из интраоперационно забранных образцов.
Существенным преимуществом в сравнении с ППИ является то, что внутренние и фиксирующие устройства при ПАИ могут быть удалены по достижении сращения перелома.
3.1 Консервативное лечение
Консервативное лечение на дооперационном этапе должно быть направлено на купирование болевого синдрома с применением в зависимости от его выраженности – НПВП и/или парацетамола**, при их неэффективности – опиоидные анальгетики, а также на подготовку пациента к большому оперативному вмешательству, что подразумевает компенсацию сопутствующей патологии [49, 54]. После ревизионных операций по поводу ИАИ на костях и суставах нижних конечностей и позвоночнике, как и после любых больших ортопедических операциях на опорно-двигательном аппарате пациенту необходимо проводить фармакологическую профилактику венозных тромбоэмболических осложнений с применением антитромботических препаратов (АТХВ01А) [111], а также симптоматическую терапию, включающую адекватное обезболивание, нутриционную поддержку, препараты железа и системную антибактериальную терапию [203], инфузионная терапия для коррекции ОЦК и электролитных нарушений; а также при необходимости препараты для терапии сопутствующей патологии.
- Пациентам, с гипопротеинемией и/или снижением нутриционного статуса, рекомендуется коррекция этих нарушений для снижения риска неблагоприятного исхода лечения [143, 144].
УДД 5 УУР C
Комментарии. В настоящее время неопровержимым является факт, что снижение нутриционного статуса, в том числе гипоальбуминемия, являются неблагоприятным прогностическими признаками для исхода ревизионных операций [143, 144], что является основанием для назначения таким пациентам нутритивной поддержки (АТХ B05BA01 Аминокислоты**, АТХ B05AA01 Альбумин**) и препаратов железа для парентерального применения (АТХ B03AC).
- Всем пациентам с умеренным или выраженном болевом синдроме после ревизионных операций на опорно-двигательном аппарате рекомендуется назначение обезболивающих: НПВП, парацетамола**, опиоидных анальгетиков [145];
УДД 2 УУР А
Комментарии. Мультимодальная анальгезия, определяемая как использование различных анальгетических препаратов и методов, нацеленных на различные механизмы действия в периферической и / или центральной нервной системе, может иметь аддитивные или синергические эффекты и более эффективное облегчение боли по сравнению с одномодальными методами. Для каждой конкретной ситуации возможны различные мультимодальные комбинации и режимы в зависимости от объема конкретной операции и индивидуальных особенностей пациента. Системная терапия может сочетаться с локальным введением местных анестетиков, а также выполнением регионарной или нейроаксиальной анестезии, особенно для предупреждения интенсивных болей в раннем послеоперационном периоде. Системные опиоиды требуются не всем пациентам [145].
- Пациентам с ИАИ в большинстве случаев при отсутствии противопоказаний рекомендуется назначение комбинированной длительной (не менее 6 недель) большедозной антибактериальной терапии для усиления антимикробного эффекта, активности в отношении микробных биопленок и внутриклеточно расположенных возбудителей [146–155].
УДД 2 УУР А
- Пациентов с ИАИ в послеоперационном периоде при положительной клинико-лабораторной динамике на фоне курса парентеральной антибактериальной терапии рекомендуется переводить на пероральный прием антибактериальных препаратов системного действия c высокой биодоступностью [156].
УДД 2 УУР В
- Пациентам, у которых ИАИ вызвана полирезистентными штаммами возбудителей, при рецидивирующем течении инфекции, а также при наличии противопоказаний или развитии нежелательных явлений при приеме антибактериальных препаратов рекомендовано выполнить консультацию специалиста по антимикробной химиотерапии (клинического фармаколога или инфекциониста) [157].
УДД 5 УУР C
Комментарии. Основой антибактериальной терапии ИАИ является стационарное внутривенное введение (продолжительностью 7-14 дней) препаратов с последующим переходом на пероральный приём преимущественно бактерицидных антибиотиков с хорошей биодоступностью [158]. Для пациентов с ППИ, которым выполнена санирующая операция с сохранением имплантата или его одноэтапной заменой рекомендуется продленный до 3-месяцев курс лечения [155,319]. Данная продолжительность комбинированной терапии показала сходную эффективность в сравнении с 6 месячным курсом терапии у пациентов с сохранением эндопротеза коленного или тазобедренного сустава в нескольких клинических исследованиях, включая рандомизированные [147,148,151]. В случае двухэтапного лечения ППИ общепринятой является продолжительность курса АБТ до 6-8 недель после каждого этапа в зависимости от характера инфекционного процесса [21,54,159]. На основе собственных разработок [4,21,54] и рекомендаций европейских коллег [159] сформированы перечни препаратов для этиотропной антибактериальной терапии (Приложение А3.1), которые составлены с учетом накопленных к настоящему времени знаний о патогенезе ППИ, результатах мониторинга чувствительности возбудителей АИА к антибиотикам и известных способах воздействия на микробные биопленки.
В отношении ПАИ не существует сравнительных исследований, определяющих продолжительность антибактериального лечения. Согласительные рекомендации экспертов предлагаю назначать АБТ при удалении имплантата и лечении остеомиелита в течение 6 недель, при одно- или двухэтапной замене имплантата – 12 недель [158,159]. У пациентов с отсроченной инфекцией продолжительность курса антибиотиков индивидуальна и может продолжаться в течение всего периода сращения перелома и 1-2 недели после удаления фиксирующей системы ортопедической [158]. Необходимо регулярно оценивать консолидацию кости и удалить имплантат после сращения перелома, что может существенно сократить курс АБТ. Помимо активности антибактериального препарата в отношении установленного возбудителя инфекции, необходимо учесть со стороны пациента: лекарственную непереносимость в анамнезе, функцию почек и печени, возможность принимать препарат внутрь. Для профилактики антибиотико-ассоциированного колита целесообразно рассмотреть назначение препаратов из группы противодиарейных микроорганизмов.
На фоне длительных курсов антибактериальной терапии показан периодический мониторинг их эффективности (исследование СОЭ в крови, уровня СРБ в сыворотке крови) и безопасности (выполнение в зависимости от выбранных препаратов исследования уровня креатинина в сыворотке крови и/или определение активности АЛТ, а также выполнение общего (клинического) анализа крови), для своевременного выявления нежелательных реакций со стороны почек, печени или костного мозга [32,54].
- Пациентам с ИАИ рекомендуется назначение стартовой эмпирической антибактериальной терапии широкого спектра, включающего метициллин-резистентные стафилококки и с учетом результатов дооперационного микробиологического (культурального) исследования синовиальной жидкости и/или раневого (гнойного) отделяемого, и последующей коррекцией после получения результатов микробиологического (культурального) исследования костной ткани на аэробные и факультативно-анаэробные микроорганизмы и, если применимо, удаленного имплантата [160].
УДД 4 УУР C
Комментарии: Антибактериальная терапия может быть: эмпирической и этиотропной. Эмпирическую АБТ проводят активными в отношении ведущих грамположительных и грамотрицательных возбудителей ИАИ препаратами, перечень которых определяется на основе локального микробиологического мониторинга в МО. Однако с учетом ведущей роли стафилококков в этиологии ортопедической инфекции и распространенности метициллинорезистентных штаммов, целесообразно включать в состав эмпирической терапии препараты активные в отношении данных возбудителей. В настоящее время отмечают снижение клинической эффективности ванкомицина**, в связи с чем необходимо рассмотреть возможность назначения альтернативных препаратов с анти-MRS -активностью, к примеру, #даптомицина** (в дозе 8-10 мг/кг/сут внутривенно [150,151] или #линезолида** (в дозе 600 мг 2 раза в сутки внутривенно) [161,162]. Несмотря на то, что ни один из них не имеет зарегистрированного показания при лечении инфекции костей и суставов, уже накоплен практический опыт их применения при лечении профильных больных. Данные препараты демонстрируют хорошее проникновение в костную ткань и эффективность при назначении в составе комбинированной терапии, к примеру, с рифампицином** [149–152]. Однако инфекции костей и суставов обычно требуют длительного лечения, в связи с чем применение #линезолида** более 4 недель остается спорным, т.к. необходимо учитывать серьезные побочные эффекты при его длительном приеме: периферическую невропатию, неврит зрительного нерва и угнетение костного мозга. Что касается #даптомицина** (в дозе 8-10 мг/кг/сут внутривенно [150,151], то в настоящий момент недостаточно клинических данных, чтобы окончательно оценить его роль в лечении ИАИ. Так имеющиеся данные указывают на схемы лечения с дозами от 8 мг/кг до 10 мг/кг один раз в день и комбинацией с рифампицином** [12], но при этом требуется мониторинг его серьезных нежелательных эффектов.
В отношении грамотрицательных возбудителей ИАИ наибольшую активность проявляют цефоперазон + [сульбактам]** и препараты группы карбапенемов [5,7,48]. После получения результатов культурального исследования тканевых биоптатов и удаленных конструкций проводят коррекцию АБТ с переходом с эмпирической на этиотропную. В связи с частым выделением микробных ассоциаций именно из тканевых биоптатов, только после получения результатов их интраоперационных посевов целесообразно считать этиологию инфекции окончательно установленной.
Пероральным АБП, высокоактивным в отношении стафилококковых биопленок, является рифампицин**, который в связи с быстрым развитием к нему резистентности необходимо (согласно инструкции к применению) назначать только в составе комбинированной терапии. Наиболее активной комбинацией пероральных препаратов при стафилококковой ИАИ является комбинация рифампицина** с фторхинолонами [163]: #левофлоксацином** (в дозе 0,5 г 2 раза в сутки или 0,75 г 1 раз в сутки внутрь [21, 146, 283]) или #моксифлоксацином** (в дозе 400 мг 1 раз в сутки внутрь [164]). Бактериостатических АБП, таких как клиндамицин** при ППИ следует избегать, если есть возможность назначения препаратов с бактерицидным действием.
Применение высоких доз АБП является еще одной особенностью антибактериальной терапии ИАИ, что связано с необходимостью создания в очаге инфекции концентраций препаратов, активных не только в отношении планктонных, но и сессильных форм бактерий в составе биопленок. На фоне длительной высокодозной антибактериальной терапии рекомендован контроль функции печени и/или почек для своевременного выявления нежелательных эффектов не только на стационарном, но и амбулаторном этапе.
Из-за образования микробной биоплёнки и перехода бактерий в сессильную фазу с пониженным метаболизмом в терапии ИАИ эффективным в отношении них может быть только ограниченный перечень АБП, обладающих антибиоптеночной активностью. В настоящее время в него включены: активный в отношении стафилококков рифампицин**, в отношении грамотрицательных бактерий – фторхинолоны и проявляющий высокую эффективность при энтерококковых инфекциях #фосфомицин**. Устойчивые к указанным препаратам штаммы в настоящее время классифицируют как трудные для эрадикации возбудители (ТЭВ-возбудители). Лекарственных средств, высоко активных в отношении биопленок, сформированных указанными патогенами, на современном этапе развития медицины не существует [21,159]. Наибольшую проблему представляет выбор препаратов для антибаткриальной терапии ИАИ, обусловленной фторхинолон-резистентными штаммами грамотрицательных возбудителей (представители сем. Enrerobacteriaceae, P.aeruginosa, Acinetobacter spp. и др.) или микробными ассоциациями с их участием. Причиной этого является невозможность назначения этиотропной пероральной пролонгированной антибактериальной терапии на амбулаторном этапе [5]. Этим обусловлена более низкая эффективность лечения инфекции, вызванной данными возбудителями [5,48,165–167]. У пациентов с рецидивирующей ИАИ, обусловленной полирезистентными, включая карбапенем-устойчивые, и панрезистентными штаммами целесообразно рассмотреть включение в состав терапии альтернативные антибактериальные препараты, обладающие активностью в отношении выделенных возбудителей, или комбинацию 2-3 препаратов в максимально возможных дозах, в спектр активности которых входят выделенные патогены, для преодоления механизмов их резистентности (Приложение А3.1) [5,168]
- При ревизии и санации гнойного очага пациенту с ИАИ рекомендуется начинать антибактериальную терапию интраоперационно после взятия образцов на микробиологическое (культуральное) исследование клинического материала и удаленных конструкций, если состояние больного не требует немедленного начала терапии [7,48,54].
УДД 5 УУР C
- Пациенту с ИАИ при отсутствии тяжелого течения инфекции с риском генерализации процесса и развитием системной воспалительной реакции, сепсиса, не рекомендуется назначение антибактериальной терапии до санирующей операции и взятия образцов биоматериала и удаленных имплантатов для микробиологического (культурального) исследования [7,48,54].
УДД 5 УУР C
Комментарии. Консервативное лечение ИАИ при отсутствии адекватной санации очага инфекции не позволяет купировать инфекционный процесс. Без удаления инфицированного имплантата антибактериальную терапию следует назначать только тем пациентам с хронической ППИ и ПАИ, у которых высокий риск генерализации процесса, или, которые могут не перенести оперативное вмешательство (септическое состояние и/или выраженная сопутствующая патология и т.д.) до стабилизации состояния или длительно, иногда пожизненно. Также назначение АБТ возможно в случае ПАИ, когда имплантат обеспечивает стабильную фиксацию перелома и сращение кости возможно на фоне инфекционного процесса, контролируемого АБТ [159]. На этапе реимплантации эндопротеза при двухэтапном лечении ППИ введение антибиотиков целесообразно начинать за 30-40 мин. до разреза, согласно принципам профилактики хирургических инфекций. При этом выбор препаратов необходимо основывать на выделенном ранее возбудителе [32,53,154].
- Пациентам с тяжелым течением сопутствующих заболеваний, которые могут не перенести оперативное вмешательство рекомендуется назначение супрессивной пероральной антибактериальной терапии постоянно (от нескольких месяцев до пожизненной) АБТ без выполнения радикального хирургического вмешательства по решению мультидисциплинарной группы специалистов [170–172].
УДД 4 УУР C
Комментарии: Решение о выборе данного метода лечения целесообразно принимать мультидисциплинарной группой врачей, когда у пациента с тяжёлыми сопутствующими заболеваниями в стадии декомпенсации невозможно выполнение радикального хирургического вмешательства [36,173]. Основными задачами такого подхода является снижение симптомов острого инфекционного процесса, предотвращение генерализации инфекции и поддержка функционирования сустава. Эффективность супрессивной антибактериальной терапии без хирургической санации гнойного очага не выше 25%. В случаях, когда была выполнена хирургическая обработка очага ППИ с сохранением эндопротеза, последующим длительным (в течение нескольких недель) курсом парентеральной АБТ с переходом на пероральную комбинированную терапию с рифампицином**, и только после этого назначением хроническую супрессивную терапию, результаты лечения были более обнадеживающими [174]. Еще одним подходом может быть формирование постоянного свищевого хода с постоянным назначением низких доз АБП, при этом надо понимать, что в 80% после отмены антибиотика наблюдается рецидив инфекции [173]. Более подробно эта методика описана в разделе 3.2.1. Хирургическое лечение ППИ.
Данный подход можно рекомендовать только при наличии следующих условий:
- у пациента нет признаков системной инфекции;
- выполнение полноценной санации гнойного очага с удалением инфицированного эндопротеза невозможно из-за ослабленного состояния пациента;
- протез стабилен;
- этиология инфекции обусловлена низковирулентным возбудителем с хорошей чувствительностью к пероральным АБП;
- достигнута договоренность врача и пациента, который готов принимать рекомендованные препараты в течение длительного времени.
Применение супрессивной терапии у больных молодого возраста является спорным, и показания для лечения должны быть определены индивидуально в каждом конкретном случае. При назначении постоянной антибактериальной терапии врач должен учитывать возможную токсичность препаратов при длительном применении и риск селекции устойчивых микроорганизмов в случае развития рецидива.
Препаратами выбора для данной стратегии являются бета-лактамные АБП, препараты их групп фторхинолонов, тетрациклинов или ко-тримоксазол**, клиндамицин**, в зависимости от чувствительности возбудителя и переносимости препарата пациентов [170–172]. Не рекомендовано использовать для супрессивной антибактериальной монотерапии #линезолид**, рифампицин** и фузидовую кислоту. Это обусловлено, с одной стороны, высоким риском развития нежелательных реакций (более чем 4-недельная длительность применения #линезолида** существенно усиливает риск развития обратимой миелосупрессии в 40% случаев) и необратимой периферической невропатии (в 5% случаях). С другой стороны, при монотерапии рифампицином** или фузидовой кислотой у возбудителей быстро развивается резистентность к данным препаратам.
- Пациентам с ИАИ в составе комплексного лечения ИАИ рекомендуется применение локальной антимикробной терапии с целью создания эффективных концентраций антибактериальных препаратов в области гнойного очага в костной ткани [175, 178].
УДД 3 УУР C
- При импрегнации костного цемента предназначенного для фиксации компонентов постоянного эндопротеза не рекомендуется применять более 5 мас% антимикробного препарата для системного действия [48,54,176].
УДД 5 УУР C
Комментарии. Известно, что минимальные концентрации антибиотиков для эрадикации биопленок превышают минимальные подавляющие концентрации (МПК) для планктонных форм бактерий в тысячи раз [177], в связи с чем эрадикацию патогено в очаге остеомиелита пожно получить только комбинацией системной и местной антибактериальной терапии. Считается, что антибиотик, высвобождающийся непосредственно в очаге инфекции в концентрации, превышающей МПК для конкретного микроорганизма, напрямую уничтожает планктонные формы бактерий и дополнительно повреждает микробные биопленки, повышая эффективность антибактериальной терапии в целом. Высокая локальная концентрация позволяет препаратам проникать в некротизированные ткани и участки с плохим кровоснабжением путем диффузии. При ИАИ общепринятой методикой является импрегнация АМП костного цемента для установки антимикробного спейсера, при остеомиелите, в том числе после ПАИ в ряде случаев используют биокерамику на основе сульфатов или фосфатов кальция, гидроксиапатита. При выборе АМП для применения в составе костного цемента необходимо учитывать результаты дооперационного микробиологического исследования синовиальной жидкости (аспирата) или предполагаемый характер возбудителя (Приложение А3.3). К примеру, в случае ИАИ, вызванной MSSA для смешивания с костным цементом можно применять #цефуроксим**, а случае MRSA – #ванкомицин**. В настоящее время выделяют несколько групп остеозамещающих материалов, которые могут применяться в очаге ИАИ: нерассасывающиеся (цементы на основе полиметилметакрилата) и биодеградируемые материалы (костные трансплантаты, деминерализованный костный матрикс, материалы на основе биокерамики, природные и синтетические полимеры, комбинированные транспортные системы для антимикробных средств) [48,176,178].
3.2 Хирургическое лечение
- При сохранении стойкого раневого отделяемого в течение 72 часов у пациента после операции с установкой ортопедического имплантата рекомендуется последовательное проведение консервативного и при необходимости оперативного лечения [144, 179, 202].
УДД 4 УУР С
Комментарии. До настоящего времени нет валидированного определения «стойкого раневого отделяемого». При отсутствии таких данных, консенсус международных экспертов по лечению ППИ определяет постоянное отделяемое как любое продолжающееся выделение жидкости из области хирургического вмешательства более 72 часов после операции [48]. Лечение ран со стойким отделяемым после установки ортопедического имплантата состоит из двух основных этапов: неоперативного и оперативного. Неоперативные меры включают: модификацию профилактики венозных тромбоэмболий (ВТЭ), локальные мероприятия (такие как терапия раны отрицательным давлением) и ограничение подвижности. Если отделяемое продолжается более 3-7 дней после начала неоперативных мероприятий, необходимо рассмотреть возможность оперативного вмешательства. В зависимости от клинической ситуации это может включать в себя промывание и санацию, иссечение суставной сумки (синовэктомию), замену мобильных компонентов эндопротеза или, если требуется, одноэтапную замену эндопротеза. В некоторых ситуациях может быть показано только поверхностное промывание раны. В большинстве случаев своевременно выполненная ревизия области хирургического вмешательства в раннем послеоперационном периоде позволяет сохранить имплантат и предупредить хронизацию инфекционного процесса [179, 202].
- Пациентам с выраженными острыми симптомами инфекционно-воспалительного процесса на фоне ИАИ при отсутствии возможности выполнить радикальное хирургическое вмешательство в полном объеме, для снижения риска генерализации инфекции рекомендуется выполнить вскрытие и дренирование синовиальной сумки/флегмоны (абсцесса) в условиях любого отделения хирургического профиля, назначить антибактериальную терапию с последующим направлением в профильный травматолого-ортопедический стационар [180].
УДД 5 УУР C
- Пациентам с ИАИ, нуждающимся в оказания неотложной медицинской помощи в связи с риском генерализации инфекции, при отсутствии возможности выполнить радикальное хирургическое вмешательство в полном объеме не рекомендуется проведение только консервативного лечения [181].
Комментарии. В настоящее время отсутствуют публикации об оказании помощи пациентам с ИАИ в непрофильных отделениях. Однако участие микробных биопленок в патогенезе ИАИ однозначно определяет невозможность купирования инфекционного процесса назначением антибактериальной терапией при отсутствии хирургической санации гнойного очага у пациента и имплантатом [7,48,54]. Невозможность выполнения радикального хирургического вмешательства пациенту с ИАИ может быть обусловлена отсутствием технической возможности (отсутствие материально-технического оснащения и/или квалифицированного медицинского персонала в МО по месту жительства пациента), а также состоянием пациента, который может не перенести обширное хирургическое вмешательство (септическое состояние и/или выраженная декомпенсация сопутствующей патологии и т.д.). Наиболее рациональной тактикой в таких случаях является вскрытие и дренирование гнойного очага для снижения микробной нагрузки на организм, с коротким курсом антибактериальной терапии до снятия остроты процесса, и последующим направлением пациента в профильный стационар.
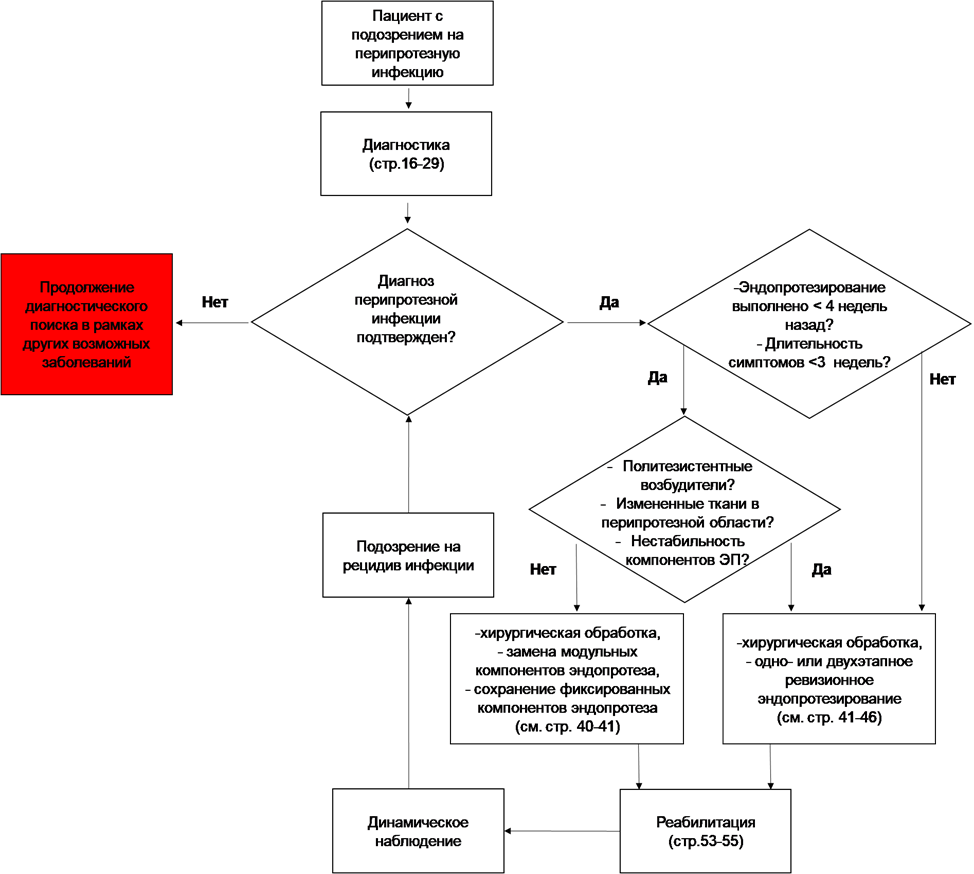
- Пациентам с острой послеоперационной (<4 недель после операции) или острой гематогенной (<3 недель c момента манифестации) ППИ рекомендуется выполнение радикальной хирургической обработки с промыванием раны, сохранением хорошо фиксированных компонентов эндопротеза (РСЭП) и длительной антибактериальной терапией при соответствии следующим критериям [182–184]:
- компоненты эндопротеза стабильны;
- отсутствует неотграниченное инфекционное воспаление мягких тканей (целлюлит, фасциит и пр.);
- отсутствует возбудитель, устойчивый к пероральным АМП;
- возможен длительный (до 3 мес.) курс антибактериальной терапии.
УДД 2 УУР A
- Пациентам с ППИ, не отвечающим указанным выше критериям, но для которых другая хирургическая тактика неприемлема или несет высокий риск для жизни может быть также рекомендована хирургическая санация с сохранением эндопротеза, но рецидив более вероятен [185–187].
УДД 2 УУР B
Комментарии. Недавнее исследование показало сходную эффективность РСЭП при лечении ранней послеоперационной инфекцией (85%) и острой гематогенной инфекцией (79%) [185]. Строгое соблюдение рекомендованных критериев крайне важно для эффективности РСЭП. До настоящего времени четко не установлен срок созревания микробной пленки в организме человека и период 3-4 недели с момента операции или манифестации определен, как наиболее оптимальный, в большинстве профильных публикаций и рекомендаций. Однако некоторые исследователи считают, что РСЭП можно рассматривать как операцию выбора только у пациентов с симптомами инфекции, которые длятся менее 5-и дней [186]. В целом ряде систематических обзоров доказано, что выполнение РСЭП при острых послеоперационных и гематогенных инфекциях должно быть своевременным и агрессивным (с заменой модульных частей), т. к. каждый дополнительный день ожидания снижает шансы на успешный результат [187–190]. К наиболее значимым факторам успешного исхода после проведения РСЭП относят период времени от появления симптомов до ревизионного эндопротезирования до 7 дней, замену модульных компонентов эндопротеза (141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 241970 Вкладыш для эндопротеза коленного сустава одномыщелковый***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***)[48,187], а также отсутствие у пациента тяжелой сопутствующей патологии [185] и дооперационной анемии [191]. Существенное влияние также оказывает и характер возбудителя, в связи с чем, выполнение РСЭП пациентам с ИАИ, обусловленной полирезистентными штаммами патогенов (MRSA и MRSE, особенно резистентные в рифампицину**, грамотрицательные палочки, устойчивые к фторхинолонам, ванкомицин-резистентный энтерококк (VRE) и др.), характеризуется крайне низкой эффективностью [189,192–194] .
Необходимо учитывать, что острая гематогенная инфекция может быть проявлением общего плохого состояния здоровья пациента, т. к. почти половина из них страдает тяжелой сопутствующей патологией, которая может не только предрасполагать к развитию инфекции, но и приводить к высокому риску развития сепсиса и смертности около 20% в течение 2 лет от операции [195,196].
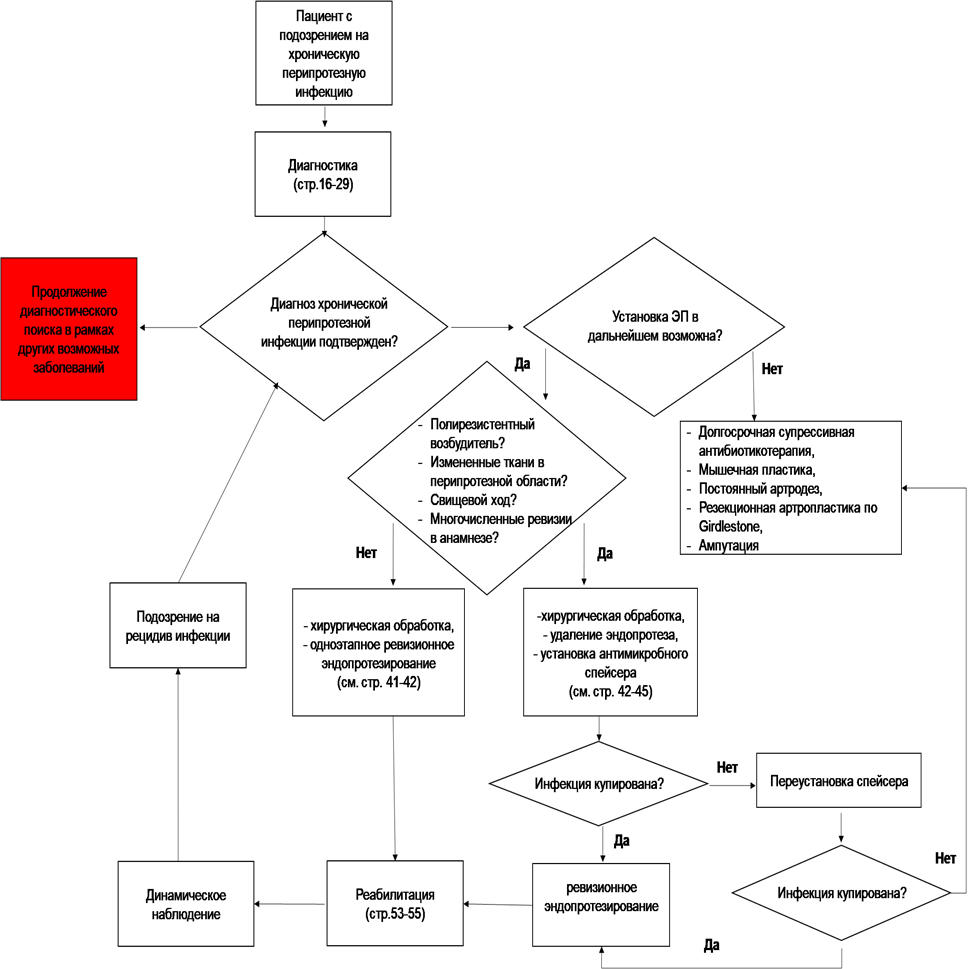
- Для пациентов с хронической ППИ при наличии хорошего состояния мягких тканей в области инфекции, идентифицированным до операции возбудителем, чувствительным к пероральным АБП с высокой биодоступностью, рекомендуется одноэтапное ревизионное эндопротезирование в случае, если позволяет материально-техническое оснащение стационара и уровень квалификации медперсонала [197,198].
УДД 2 УУР A
- Для пациентов с культуронегативной хронической ППИ при наличии хорошего состояния мягких тканей в области инфекции, рекомендуется одноэтапное ревизионное эндопротезирование в случае, если позволяет материально-техническое оснащение стационара и уровень квалификации медперсонала [262]
УДД 2 УУР В
Комментарии: Одноэтапная замена эндопротеза (107830 Ножка удлиняющая для эндопротеза коленного сустава***, 109390 Клин для эндопротеза коленного сустава***, 114100 Заглушка для ацетабулярного компонента эндопротеза тазобедренного сустава***, 114130 Оболочка ацетабулярного компонента эндопротеза тазобедренного сустава***, 128870 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128880 Компонент эндопротеза коленного сустава тибиальный непокрытый, полиэтиленовый***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 129080 Компонент эндопротеза коленного сустава тибиальный непокрытый с вкладышем***, 129120 Компонент эндопротеза коленного сустава тибиальный одномыщелковый непокрытый, металлический***, 141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 151960 Компонент эндопротеза коленного сустава феморальный трабекулярный***, 151980 Компонент эндопротеза коленного сустава тибиальный трабекулярный с вкладышем***, 152030 Эндопротез плечевого компонента локтевого сустава покрытый***, 152060 Компонент эндопротеза тазобедренного сустава феморальный, покрытый, модульный***, 152110 Компонент эндопротеза коленного сустава феморальный, покрытый***, 152120 Компонент эндопротеза коленного сустава тибиальный покрытый***, 152130 Компонент эндопротеза коленного сустава тибиальный покрытый с вкладышем***, 152350 Эндопротез локтевого сустава тотальный шарнирный***, 152390 Компонент эндопротеза коленного сустава феморальный одномыщелковый покрытый***, 161180 Эндопротез коленного сустава тотальный с задней стабилизацией***, 165410 Компонент эндопротеза тазобедренного сустава ацетабулярный полиэтиленовый***, 165420 Компонент эндопротеза локтевого сустава локтевой полиэтиленовый***, 178660 Компонент эндопротеза коленного сустава феморальный поверхностный частичный***, 178800 Эндопротез коленного сустава тотальный с сохранением крестообразной связки***, 206730 Эндопротез плечевого сустава тотальный***, 207700 Компонент эндопротеза локтевого сустава локтевой с металлическим покрытием***, 208890 Компонент эндопротеза плечевого сустава гленоидный***, 210090 Эндопротез коленного сустава тотальный с мобильной платформой***, 214680 Эндопротез тазобедренного сустава тотальный с парой трения металл-полиэтилен***, 214690 Эндопротез тазобедренного сустава тотальный с парой трения металл-металл***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 218500 Эндопротез тазобедренного сустава тотальный с парой трения керамика-керамика***, 218510 Эндопротез тазобедренного сустава тотальный с парой трения керамика-полиэтилен***, 218520 Эндопротез тазобедренного сустава тотальный с парой трения керамика-металл***, 221510 Эндопротез коленного сустава двухкомпонентный***, 54990 Головка эндопротеза плечевого сустава с анкерным типом крепления***, 269390 Эндопротез плечевого сустава тотальный реверсивный***, 269420 Чашка реверсивного эндопротеза плечевого сустава полиэтиленовая***, 269440 Головка реверсивного эндопротеза плечевого сустава***, 272800 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, модульный***, 272810 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, однокомпонентный***, 273600 Компонент эндопротеза тазобедренного сустава феморальный ревизионный покрытый***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***, 284590 Эндопротез коленного сустава тотальный шарнирный***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***, 320760 Тело реверсивного эндопротеза плечевого сустава***, 321740 Компонент эндопротеза тазобедренного сустава ацетабулярный из комбинированного материала***, 321750 Компонент эндопротеза тазобедренного сустава ацетабулярный металлический***, 321760 Эндопротез ацетабулярного компонента тазобедренного сустава керамический***, 322360 Чашка реверсивного эндопротеза плечевого сустава металлическая***) включает радикальную хирургическую обработку мягких тканей, тщательное удаление костного цемента и всех других инородных тел, создание локального депо АБП, имплантацию нового эндопротеза, а также длительную послеоперационную АБТ (до 3 мес.) [32,48,54]. Как правило, одноэтапное реЭП выполняют с цементной фиксацией компонентов и с применением цемента костного, содержащего лекарственные средства***. Возможно также применение импрегнированного антибиотиком костного матрикса (имплантата костного матрикса, композитного***, синтетического антибактериального***, животного*** или человеческого происхождения***,) или внутрисуставных катетеров для местной АБТ, которые обеспечивают успешные результаты одноэтапного реЭП до 92% [200,201].
Противопоказаниями к одноэтапному реЭП являются: неограниченное инфекционное воспаление мягких тканей (целлюлит, фасциит, затеки в мягкие ткани, в полость малого таза и область сосудисто-нервных пучков); синдром системной воспалительной реакции (ССВР); недостаточный объем мягких тканей для закрытия операционной раны; дефекты и плохое качество кости (склероз / остеопороз), не позволяющие имплантировать стандартные конструкции эндопротезов; наличие других, не санированных очагов инфекции (трофические язвы, мочеполовая инфекция, инфекция полости рта и др.); наличие в анамнезе больного ревизионных операций, в том числе по поводу ППИ, и (или) курсов АБТ по поводу ППИ; невозможность проведения длительной (до 3 мес.) пероральной АТБ [202–208]. Кроме того, больные с рецидивом ППИ после одноэтапного реЭП, не могут быть кандидатами для повторного одноэтапного реЭП [209]. Как показывают два мета-анализа, одноэтапное реЭП позволяет достичь статистически сопоставимого с двухэтапным вмешательством риска рецидива инфекции вне зависимости от локализации инфекции в тазобедренном или коленном суставах [197,198]. В случае же тщательного отбора пациентов для операции показатель успешных исходов одноэтапного реЭП достигал 100% [210]. Недавний мета-анализ не показал существенных различий в эффективности лечения при сравнении 1- и 2-этапной методик у пациентов с культуронегативной ППИ [199, 262].
- Пациентам с хронической, в том числе рецидивирующей ППИ, вызванной резистентными патогенами, а также с острой ППИ при наличии противопоказаний к выполнению других типов оперативного вмешательства, рекомендуется двухэтапное ревизионное ЭП, при условии, что общее состояние пациента позволяет перенести несколько хирургических вмешательств с прогнозируемым удовлетворительным функциональным результатом лечения [211–213].
УДД 2 УУР A
Комментарии. Двухэтапное лечение остаётся наиболее распространенным методом хирургического лечения хронической ППИ [159,203,211]. Основными показаниями к двухэтапному реЭП являются: хроническая послеоперационная (продолжительность симптомов более 4-х недель) или гематогенная (продолжительность симптомов более 3-х недель), в том числе рецидивирующая ППИ; острое воспаление перипротезных мягких тканей; наличие других не санированных очагов инфекции; высокий уровень резистентности возбудителей к АБ, а также невозможность выполнения операций другого типа при острой ППИ [32,54]. Противопоказаниями к двухэтапному реЭП являются: декомпенсация сопутствующих заболеваний; неограниченное естественными барьерами инфекционное воспаление мягких тканей (острый некротический фасциит, гнойные затеки в межфасциальные пространства, к сосудисто-нервным пучкам и др.); дефицит мягких тканей, которых недостаточно для укрытия послеоперационной раны; обширные дефекты кости, не позволяющие в дальнейшем имплантировать постоянный эндопротез; многократные (более 3-х) рецидивы ППИ после реЭП по поводу инфекционных осложнений; панрезистентные возбудители; отказ больного от этапных операций [32,54].
Цель первого этапа - купирование инфекции, а при наличии условий сохранение (восстановление) функции нижней конечности. Единого стандарта выполнения санирующего этапа двухэтапного ревизионного эндопротезирования не существует, так как ход операции во многом зависит от области распространенности инфекционного процесса, общего состояния пациента, состояния окружающих эндопротез мягких тканей и т.д. [48,203]. Обязательным требованиями первого этапа являются: тотальное иссечение пораженной кости, некрэктомия; направление на микробиологическое (культуральное) исследование костной ткани на аэробные и факультативно-анаэробные микроорганизмы (3-5 образцов) и патолого-анатомическое исследование операционного материала, а также отправка для микробиологического (культурального) исследования удаленных компонентов эндопротеза; промывание операционной раны значительным количеством антисептиков (до 10-12 л) с помощью специальных технических средств для хирургической обработки раневой поверхности; заполнение дефектов тканей временными конструкциями (спейсерами), сформированными из цемента костного, содержащего лекарственные средства***, последующее послойное ушивание тканей, профилактика послеоперационных гематом [31].
В зависимости от восстановления биомеханической цепи нижней конечности имеется два варианта спейсеров из костного цемента: с наличием (артикулирующие) и без (блоковидные) артикулирующих поверхностей. Выбор типа спейсера, с учётом имеющихся достоинств и недостатков для каждого конкретного случая, осуществляет оперирующий врач – травматолог-ортопед [214–220]. При изготовлении спейсеров целесообразно добавлять в цемент костный, содержащий лекарственные средства *** дополнительный АБ на основании предоперационной антибиотикограммы, к примеру, цефуроксим** при инфекции, вызванной MSSA. Перечень антибактериальных препаратов и их дозы, которые могут быть добавлены в костный цемент представлен в Приложении А3.3. Возможно в качестве спейсеров использовать протезы тазобедренного сустава временные***, а также компоненты эндопротеза пораженного сустава с цементной фиксацией (107830 Ножка удлиняющая для эндопротеза коленного сустава***, Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***). Основные принципы локальной антибактериальной терапии описаны в разделе 3.1 Консервативное лечение и приложении А3.3. Полностью цементный антимикробный спейсер активен в течение ограниченного периода времени и должен быть удален [203,221–223].
В исключительных случаях при удалении в ходе санирующей операции хорошо фиксированных компонентов эндопротеза, особенно индивидуальных конструкций, онкологических протезов, выполнение остеотомии может привести к формированию массивных дефектов кости, что в дальнейшем вызывает технические сложности со стабильной фиксацией компонентов ЭП на этапе реимплантации и в конечном итоге может привести к стойкому нарушению функции конечности [224–226]. При лечении данной категории пациентов в специализированных центрах, имеющих в своем составе мультидисциплинарную группу врачей, занимающихся лечением ППИ, возможно рассмотреть вариант выполнения таким пациентам неполного (субтотального) удаления ЭП [224,225,227–229]. В случае выявления каким-либо способом (рентгенологически, по данным КТ, визуально интраоперационно) нестабильности компонентов ЭП, при наличии свища, заболеваний, приводящих к иммуносупрессии (сахарный диабет, ревматоидный артрит и др.), а также при неустановленном до операции возбудителем инфекции или при его резистентности к антибиотикам с антибиопленочной активностью [224] выполнение неполного удаления ЭП строго противопоказано. Жесткое соблюдение критериев отбора приводит к крайне редкому применению данной методики, однако, позволяет достичь купирования инфекции в подавляющем большинстве случаев: в сериях из 18, 15 и 5 наблюдений соответственно в 84% [224], 93,3% [229] и 100% случаев [225].
Сегодня не существует однозначных рекомендаций по выбору оптимального интервала времени межу этапами реЭП [48,203]. В тоже время, в течение десятилетий ортопедическим сообществом накоплен успешный опыт реимплантации эндопротеза(107830 Ножка удлиняющая для эндопротеза коленного сустава***, 109390 Клин для эндопротеза коленного сустава***, 114100 Заглушка для ацетабулярного компонента эндопротеза тазобедренного сустава***, 114130 Оболочка ацетабулярного компонента эндопротеза тазобедренного сустава***, 128870 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, модульный***, 128880 Компонент эндопротеза коленного сустава тибиальный непокрытый, полиэтиленовый***, 128910 Компонент эндопротеза коленного сустава феморальный непокрытый***, 128940 Компонент эндопротеза голеностопного сустава тибиальный непокрытый***, 128950 Компонент эндопротеза локтевого сустава плечевой непокрытый***, 128960 Компонент эндопротеза коленного сустава тибиальный непокрытый, металлический***, 128990 Компонент эндопротеза голеностопного сустава таранный непокрытый***, 129010 Компонент эндопротеза тазобедренного сустава феморальный непокрытый, однокомпонентный***, 129080 Компонент эндопротеза коленного сустава тибиальный непокрытый с вкладышем***, 129120 Компонент эндопротеза коленного сустава тибиальный одномыщелковый непокрытый, металлический***, 141740 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава, не ограничивающий движения, полиэтиленовый***, 151960 Компонент эндопротеза коленного сустава феморальный трабекулярный***, 151980 Компонент эндопротеза коленного сустава тибиальный трабекулярный с вкладышем***, 152030 Эндопротез плечевого компонента локтевого сустава покрытый***, 152060 Компонент эндопротеза тазобедренного сустава феморальный, покрытый, модульный***, 152110 Компонент эндопротеза коленного сустава феморальный, покрытый***, 152120 Компонент эндопротеза коленного сустава тибиальный покрытый***, 152130 Компонент эндопротеза коленного сустава тибиальный покрытый с вкладышем***, 152350 Эндопротез локтевого сустава тотальный шарнирный***, 152390 Компонент эндопротеза коленного сустава феморальный одномыщелковый покрытый***, 161180 Эндопротез коленного сустава тотальный с задней стабилизацией***, 165410 Компонент эндопротеза тазобедренного сустава ацетабулярный полиэтиленовый***, 165420 Компонент эндопротеза локтевого сустава локтевой полиэтиленовый***, 178660 Компонент эндопротеза коленного сустава феморальный поверхностный частичный***, 178800 Эндопротез коленного сустава тотальный с сохранением крестообразной связки***, 206730 Эндопротез плечевого сустава тотальный***, 207700 Компонент эндопротеза локтевого сустава локтевой с металлическим покрытием***, 208890 Компонент эндопротеза плечевого сустава гленоидный***, 210090 Эндопротез коленного сустава тотальный с мобильной платформой***, 214680 Эндопротез тазобедренного сустава тотальный с парой трения металл-полиэтилен***, 214690 Эндопротез тазобедренного сустава тотальный с парой трения металл-металл***, 218470 Вкладыш для ацетабулярного компонента эндопротеза тазобедренного сустава керамический***, 218500 Эндопротез тазобедренного сустава тотальный с парой трения керамика-керамика***, 218510 Эндопротез тазобедренного сустава тотальный с парой трения керамика-полиэтилен***, 218520 Эндопротез тазобедренного сустава тотальный с парой трения керамика-металл***, 221510 Эндопротез коленного сустава двухкомпонентный***, 54990 Головка эндопротеза плечевого сустава с анкерным типом крепления***, 269390 Эндопротез плечевого сустава тотальный реверсивный***, 269420 Чашка реверсивного эндопротеза плечевого сустава полиэтиленовая***, 269440 Головка реверсивного эндопротеза плечевого сустава***, 272800 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, модульный***, 272810 Компонент эндопротеза тазобедренного сустава феморальный с "пресс-фит" фиксацией, однокомпонентный***, 273600 Компонент эндопротеза тазобедренного сустава феморальный ревизионный покрытый***, 273730 Компонент эндопротеза тазобедренного сустава феморальный ревизионный непокрытый***, 284590 Эндопротез коленного сустава тотальный шарнирный***, 290010 Вкладыш для эндопротеза ацетабулярного компонента тазобедренного сустава ограничивающий полиэтиленовый***, 320760 Тело реверсивного эндопротеза плечевого сустава***, 321740 Компонент эндопротеза тазобедренного сустава ацетабулярный из комбинированного материала***, 321750 Компонент эндопротеза тазобедренного сустава ацетабулярный металлический***, 321760 Эндопротез ацетабулярного компонента тазобедренного сустава керамический***, 322360 Чашка реверсивного эндопротеза плечевого сустава металлическая***) пораженного сустава через 2-12 месяцев после удаления имплантатов [203,230–232]. Однако длительное ожидание второго этапа увеличивает период нетрудоспособности больных, функциональной несостоятельности и стоимости лечения. Помимо механических осложнений при несвоевременной замене временной конструкции на постоянный протез сустава, в научной литературе описаны единичные случаи развития нарушений функции почек после установки спейсеров, импрегнированных большими дозами нефротоксичных АБП, в частности ванкомицина** [233–235]. В настоящее время случае отсутствия дефектов параартикулярных тканей и чувствительности выявленного возбудителя к АБ для перорального приема считают возможным сокращение интервала между этапами лечения до 2-3 недель за счет эффективного применения этиотропной АБТ [236–238].
Во время второго этапа ревизионного эндопротезирования возможно применение конструкций цементной или бесцементной фиксации [54,203,239,240]. В ходе операции выполняют повторную хирургическую обработку, забирают 3-5 образов на микробиологическое (культуральное) исследование костной ткани на аэробные и факультативно-анаэробные микроорганизмы, а также образцы для патолого-анатомического исследования операционного материала. Удаленный спейсер так же направляют на микробиологическое исследование [32,54]. В среднем применение данной методики позволяет достичь контроля инфекции в 75-80% случаев [241,242], однако, может снижаться до 30-50% у пациентов с выраженной сопутствующей патологией, а также при инфекции, вызванной резистентными возбудителями [167,243,244].
- Пациентам с хронической рецидивирующей ППИ области тазобедренного сустава при неэффективности других методов лечения, в особенности в случае инфекции, обусловленной трудными для эрадикации возбудителями, рекомендуется выполнение резекционной артропластики, в том числе с мышечной пластикой несвободным мышечным лоскутом, которую в случае сохранения анатомических возможностей следует рассматривать как санирующий этап для возможной после достижения стойкой ремиссии инфекционного процесса имплантации ЭП [22,245].
УДД 3 УУР С
Комментарии.: до настоящего времени единые взгляды на тактику ведения пациентов с многократно рецидивирующей ППИ, в том числе обусловленной сложными возбудителями отсутствуют, в таких случаях врачи - хирурги отказываются на время или навсегда от выполнения реЭП. Методом выбора для лечения данной категории пациентов следует считать резекционную артропластику. Показаниями для резекционной артропластики являются: дефицит мягких тканей, не позволяющий закрыть операционную рану после реЭП (более 100 см2); неоднократные (≥ 3) рецидивы ППИ; хронический вторичный остеомиелит костей, образующих сустав; противопоказания к АБТ (полиорганная недостаточность, поливалентная аллергия, др.); этиология ППИ, включающая ТЭВ [32,54]. К группе ТЭВ в настоящее время относят рифампицин-устойчивые стафилококки и/или ампициллин-резистентные энтерококки и/или ципрофлоксацин-устойчивые грамотрицательные бактерии и/или грибы рода Candida, устойчивые к флуконазолу** [21].
Целью резекционной артропластики служит восполнение дефекта мягких тканей в области сустава, компенсация тяжёлых сопутствующих заболеваний, лечение хронического остеомиелита, эрадикация патогенной микрофлоры. Суть оперативного вмешательства заключается в пластике несвободным мышечным лоскутом дефекта кости, мягких тканей или укрытии местными тканями и дренировании послеоперационной раны (к примеру, операция Girdlestone). При этом спейсеры не используют. Применение резекционной артропластики ТБС в сочетании с несвободной мышечной пластикой (Патент RU 2735651 C1) позволяет достичь стойкой ремиссии ППИ более чем в 90% наблюдений, несмотря на длительное и тяжёлое течение инфекции, обусловленной ТЭВ [22,245]. Во многом это обусловлено тем, что при несвободной пересадке островкового мышечного лоскута гарантировано высокое кровоснабжение перемещенного фрагмента мышечной ткани, способствующего хорошей доставке лейкоцитов, кислорода и антибиотиков в инфекционный очаг [246]. Все это позволяет рассматривать данный тип хирургического вмешательства как операцию выбора при развитии рецидива трудноизлечимой ППИ с возможным выполнением реЭП на фоне стойкой ремиссии инфекционного воспаления. Однако следует учитывать возможные и достаточно частые осложнения, развивающиеся в раннем послеоперационном периоде: формирование культуронегативных гематом, рецидив инфекции, частичный или полный некроз мышечного лоскута [22]. Кроме того, в случае выполнения резекционной артропластики как окончательного этапа лечения, большинство пациентов в отдалённом предъявляют жалобы на боль в области сустава при движении, его нестабильность, необходимость использовать постоянно внешние фиксаторы и дополнительную опору при ходьбе [247].
- Пациентам с хронической многократно рецидивирующей ППИ коленного сустава рекомендуется выполнение артродеза коленного сустава при отсутствии показаний для дальнейшей этапной имплантации ЭП и имеющейся возможности сохранить часть функций конечности путем обездвиживания сустава в функционально удобном положении [248–250].
УДД 1 УУР А
Комментарии. Среди больных, перенесших одно и двухэтапное реЭП коленного сустава, 22,7-39,7% пациентов нуждаются в повторных ревизионных хирургических вмешательствах по поводу рецидива ППИ [242,251]. У иммунокомпрометированных пациентов или при инфекции, вызванной полирезистентными возбудителями, данный показатель достигает 50-75% [243,244]. В этих обстоятельствах выполнение артродеза КС позволяет сформировать безболезненную опорную конечность у большинства пациентов [247, 249], обеспечивает контроль инфекции у 78-89% пациентов [241,252,253], лучший уровень социальной адаптации и снижение летальности в сравнении с исходами ампутации и протезирования конечности [254–256]. Показаниями к артродезу являются: дефект капсулы, связок, разгибательного аппарата сустава; дефицит окружающих сустав мягких тканей, не позволяющий закрыть операционную рану после реЭП; тяжёлые сопутствующие заболевания, иммуносупрессия, исключающие дальнейшее оперативное лечение; хронический вторичный остеомиелит костей, образующих сустав;трудные для эрадикации возбудители; категорический отказ больного от эндопротезирования в дальнейшем. Противопоказаниями к артродезу являются тяжёлая патология смежных суставов и значительные дефекты суставных концов сочленяющихся кости. Необходимо помнить, что даже после хорошей консолидации фрагментов кости, функциональном положении конечности, у ряда пациентов сохраняется неудовлетворенность отсутствием движений в суставе [257].
- Пациентам с жизнеугрожающим течением хронической рецидивирующей ППИ при исчерпании возможностей всех других методов лечения рекомендуется выполнить ампутацию/экзартикуляцию конечности, направленную на спасение жизни больного или обеспечение ухода за ним [258, 259].
УДД 4 УУР С
Комментарии. После многократных безуспешных ревизионных операциях при тяжёлом течении инфекционного воспаления, развитии ССВР (сепсиса) операцию выполняют по жизненным показаниям [247,259]. В других случаях показаниями к ампутации (экзартикуляции) являются: рецидивирующее течение хронической ППИ, которое привело к полной утрате функции конечности, инвалидизации больного; некротический фасциит, резистентный к расширенной хирургической обработке (РХО); нарастающая полиорганная недостаточность, как результат обострения хронической рецидивирующей ППИ; осложнения заболеваний сосудов, угрожающие жизни больного; дефект мягких тканей и/или кости, не подлежащие ортопедической коррекции и восстановлению функции конечности; выраженный некупируемый, болевой синдром, причиняющий непереносимые страдания больному; настойчивые требования больного прекратить дальнейшие попытки хирургического лечения.
Уровень ампутации (экзартикуляции) определяют необходимостью резекции области инфекционного воспаления и обеспечения последующего протезирования [247], что имеет существенное значение для дальнейшего восстановления функции конечности [256]. В настоящее время в ряде случаев ампутация при ППИ коленного сустава с последующим протезированием современными высокотехнологичными протезами может превосходить артродезирование в плане восстановления функции конечности и качества жизни пациента [253]. За исключением экстренных случаев выполнять ампутации рекомендуется в многопрофильных хирургических стационарах по месту жительства больного, после заключения о необходимости данной операции междисциплинарной группой врачей специализированного центра, обладающего опытом лечения ППИ.
- Пациентам с развитием ССВР или сепсиса на фоне ППИ рекомендуется назначение парентеральной антибактериальной терапии и выполнение хирургического вмешательства, направленного на снижение микробной нагрузки, исходя из состояния больного, его локального статуса и возможности последующего этапного лечения [48].
УДД 4 УУР С
Комментарии. Развитие ССВР иили сепсиса на фоне ППИ существенно ухудшает прогноз лечения и увеличивает риск летальности [260–263] С учетом необходимости снижения микробной нагрузки, оценки возможности пациента перенести определенный объем оперативного вмешательства, а также перспектив дальнейшей имплантации ЭП возможно выполнение вскрытия и дренирования или вторичной хирургической обработки гнойного очага с сохранением имплантатов или с удалением его компонентов (если это показано и безопасно для больного), или выполнение ампутации (экзартикуляции) по жизненным показаниям [48]. Обязательным компонентом должна быть эмпирическая или этиотропная АБТ, которую начинают сразу, после выявления ССВР или сепсиса [264].
- Пациентам с хронической рецидивирующей ППИ в случаях, когда другие хирургические методы лечения по заключению междисциплинарной группы врачей противопоказаны, рекомендуется формирование постоянной фистулы (ПФ) и назначение в дальнейшем длительной или пожизненной супрессивной пероральной АБТ (см. раздел 3.1) [173,265,266].
УДД 3 УУР С
Коментарии. Основные показания к назначению супрессивной пероральной АБТ и ее особенности описаны в п. 3.1 Консервативное лечение. Для формирования постоянного свищевого хода проводят короткий разрез по старому послеоперационному рубцу для доступа к полости сустава и ЭП; вводят в полость сустава дренажную трубку (дренаж по Редону, или полутрубка диаметром 10 мм, или др.); выводят дренажную трубку из полости сустава дистальнее нижнего угла раны и подшивают её к коже нерассасывающейся хирургической нитью [173]. Дренажную трубку предпочтительнее сохранять в ране пожизненно или возможно ее удаление не менее чем через 6 недель после эпителизации стенок свищевого хода, нов среднем после формирования постоянного свищевого хода, выполняют до 3-х ревизионных операций для восстановления его функции [173].
- Пациентам с хронической ППИ рекомендуется проводить хирургическое лечение, требующее удаления или замены компонентов эндопротеза в условиях стационаров и отделений, кадровое и материально-техническое обеспечение, которых позволяет выполнение ревизионного эндопротезирования, а также которые укомплектованны мультидисциплинарной командой специалистов [48,157,267,268].
УДД 4 УУР С
Комментарии. Несмотря на отсутствие научных публикаций об оказании помощи пациентам с ИАИ в непрофильных отделениях, очевидно, что удаление хорошо фиксированных компонентов эндопротеза и цементной мантии требует наличия специализированных инструментов, которые отсутствуют в стационарах и отделениях общехирургического профиля, и наличия специалиста – врача-травматолога-ортопеда, владеющего техникой ревизионного эндопротезирования. Как указано выше в отделениях общехирургического профиля возможно выполнение вскрытия и дренирования гнойного очага при развитии острого состояния с коротким курсом антибактериальной терапии до снятия остроты процесса и последующим направлением пациента с ППИ в специализированное учреждение, а также выполнение ампутации или экзартикуляции по жизненным или плановым показаниям. Наличие команды врачей различных специальностей помимо врачей-травматологов-ортопедов, специализирующихся на лечении ИАИ (врачей – реаниматологов, врачей – медицинских микробиологов, врачей – клинических фармакологов, врачей – пластических хирургов, врачей – врачей клинической-лабораторной диагностики и пр.), существенно улучшает результаты лечения профильных пациентов [156,157,267,268].
Выбор типа оперативного вмешательства при ПАИ зависит от нескольких факторов: типа инфекции (острая или хроническая), консолидации перелома, качества репозиции отломков, стабильности имплантата, состояния мягких тканей, характера возбудителя и способности пациента перенести операцию [274]. На сегодняшний день представляется учитывать при выборе метода лечения ПАИ тип остеомиелита на момент выполнения вмешательства с применением классификации Cierny и Mader (1984). Данная классификационная система предполагает выбор стратегии лечения остеомиелита в зависимости от типа поражения костей, характера распространения гнойного процесса (медуллярный, поверхностный, локализованный или диффузный), а также соматического статуса больного и состояния его иммунной системы [44,286].
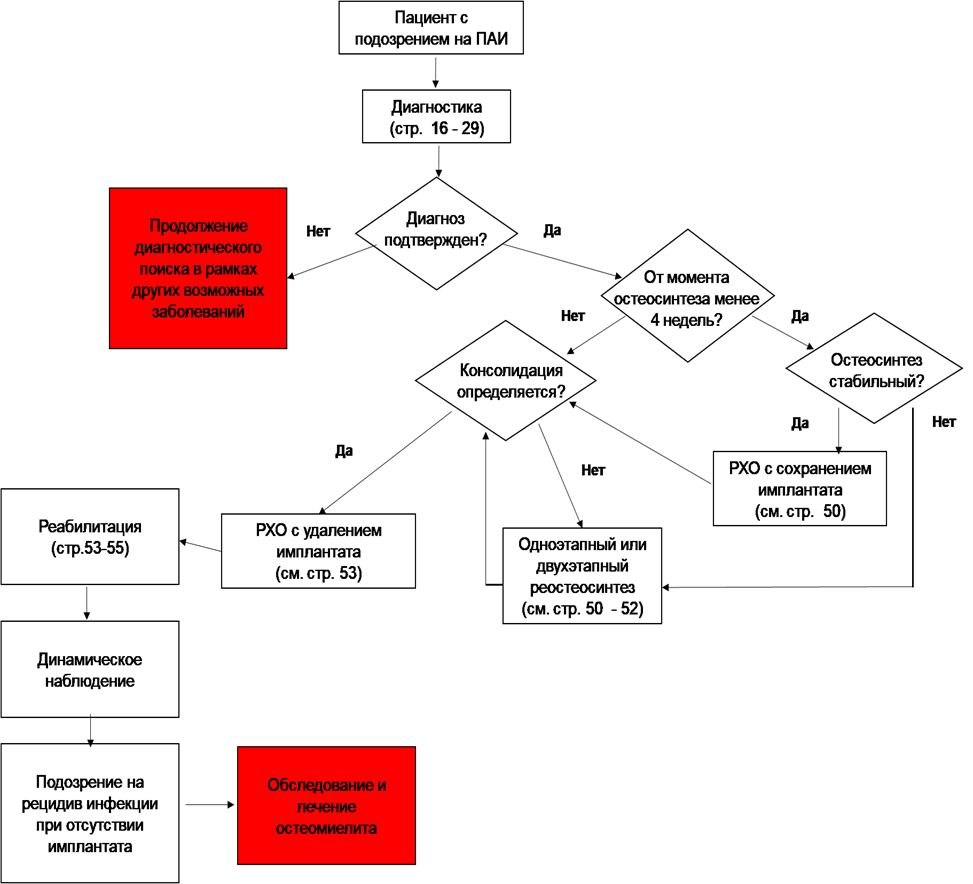
- Пациентам с острой ПАИ (срок манифестации менее 2 недель) при отсутствии консолидации перелома, удовлетворительной репозиции отломков при условии стабильности имплантата, удовлетворительного состояния мягких тканей и идентифицированного возбудителя, чувствительного к пероральным препаратам для пролонгированной АБТ, рекомендуется радикальная хирургическая обработка раны или инфицированной ткани (дебридмент) с сохранением имплантата, замещением сформированных костных дефектов антимикробным спейсером и пролонгированная АБТ [269–271].
УДД 5 УУР C
Комментарии. Крайне важным при выполнении ревизии с сохранением имплантата является тщательное удаление некротизированных тканей и некровоснабжаемых фрагментов кости; с применением системы обработки раны пульсирующей струей (объем жидкости не менее 6-9 литров) [28,270].
- Пациентам с острой или хронической ПАИ при отсутствии консолидации перелома и клинико-рентгенологических признаков нестабильности остеосинтеза, при условии достаточного для ушивания послеоперационной раны объема мягких тканей и идентифицированного возбудителя, чувствительного к пероральным препаратам для пролонгированной АБТ, рекомендуется одноэтапный ревизионный остеосинтез (реОС) с реконструкцией дефектов костей и мягких тканей, при необходимости с удалением внутреннего фиксирующего устройства и установкой наружного фиксирующего устройства (конверсия фиксации), а также пролонгированная АБТ [269,271–273].
УДД 3 УУР C
Комментарии. В данной клинической ситуации выполняют одномоментную (частичную в случаях аппаратов внешней фиксации) замену спиц и стержней в наружном фиксирующем устройстве, радикальную хирургическую обработку раны или инфицированной ткани, некрэктомию и обильное промывание раны растворами антисептиков (объем жидкости не менее 6-9 литров) [270]. Для реостеосинтеза нередко используют стержень костный ортопедический, нерассасывающийся***, который устанавливают интрамедуллярно предварительно покрывая костным цементом, содержащим лекарственные средства*** (антибактериальные препараты), или накладывают аппарат внешней фиксации [16,272,273]. Интрамедулярный стержень с цементной мантией оказывает местный санирующий эффект, а также стабилизирует зону перелома. Такой тип фиксации может быть окончательным до полной консолидации отломков. Необходимо помнить, что существенным недостатком погружных видов остеосинтеза (стержней, пластин) при лечении ПАИ является то, что они остаются в зоне санированного инфекционного очага. Радикальная хирургическая обработка раны или инфицированной ткани не обеспечивает полную стерильность оперированных тканей. Небольшие колонии бактерий могут повторно контаминировать поверхность импланта с последующим формированием биопленки.
Альтерантивным вариантом цементному стержню являются аппараты внешней фиксации (монолатеральные и циркулярные). Их основное преимущество заключается во внешней (вне зоны воспаления) фиксации отломков костей; возможности ранней полной нагрузки на оперированную конечность; коррекции оси конечности в послеоперационном периоде. Однако длительное ношение аппарата внешней фиксации может осложниться воспалением мягких тканей спиц и/или стержней, а также контрактурой смежных суставов [273].
Рассмотрев показания и особенности выполнения одноэтапной ревизии, стоит отметить, что врачи – травматологи-ортопеды нередко вынуждены прибегать к значительным резекциям нежизнеспособных фрагментов костей для достижения полноценной санации [276]. Такие сложные клинические ситуации практически невозможно разрешить без укорочения конечности, используя методику одноэтапного лечения.
- Пациентам с острой или хронической ПАИ с распространенным очагом патологического процесса, неконсолидированным переломом с неудовлетворительным стоянием отломков, значительным поражением костной ткани, требующим резекции и замещения пострезекционного дефекта, объемом мягких тканей, недостаточным для укрытия послеоперационной раны, а также полирезистентным штаммом возбудителя рекомендуется выполнение двухэтапного реОС с реконструкцией дефектов кости и мягких тканей при необходимости с конверсией метода фиксации и АБТ [16,45,271,274,277,278].
УДД 2 УУР В
Комментарии. Двухэтапный реОС является наиболее широко распространенной методикой лечения ПАИ. Основной задачей первого этапа является купирование инфекционного процесса посредством удаления инфицированного имплантата, резекции нежизнеспособных фрагментов костной ткани, ирригацию тканей растворами антисептиков и стабилизацию оперированного сегмента конечности (цементным спейсером с антибактериальными препаратами и/или аппаратом внешней фиксации), а также пластическое замещение мягкотканых дефектов при их наличии. Второй этап хирургического лечения выполняют отсрочено, через 2-10 недель. Его задачей является восполнение пострезекционного дефекта кости ауто –, аллокостью (технология Маскуле и ее модификации) или другими имплантатами костного матрикса (композитного***, синтетического антибактериального***, животного*** или человеческого происхождения***), или остеотомированного фрагмента кости по технологии Илизарова [16,45,271,274,277–280].
Существуют также гибридные варианты остеосинтеза, когда на период дистракции остеотомированного фрагмента используют компоненты систем внешней ортопедический фиксации, после чего осуществляют замену внешней фиксации на внутреннюю – установку стержня интрамедуллярного (111890 Стержень большеберцовый интрамедуллярный, нестерильный***, 111880 Стержень большеберцовый интрамедуллярный, стерильный*** , 328090 Стержень для удлинения эндопротеза бедренной/большеберцовой кости, непокрытый*** , 258660 Стержень интрамедуллярный бедренный, нестерильный***, 258670 Стержень интрамедуллярный бедренный, стерильный***, 318410 Стержень интрамедуллярный для артродеза, нестерильный***, 267030 Стержень интрамедуллярный для артродеза, стерильный***, 270050 Стержень интрамедуллярный плечевой, нестерильный***, 270030 Стержень интрамедуллярный плечевой, стерильный***, 245700 Стержень костный ортопедический, нерассасывающийся***) [281,282] .
- Пациентам с ПАИ, неконсолидированным переломом и противопоказаниями к ревизионному остеосинтезу при идентифицированном возбудителе, чувствительном к пероральным препаратам, рекомендовано выполнение РХО гнойного очага с последующим формированием постоянной фистулы и назначение супрессивной АБТ [271,275].
УДД 3 УУР С
Комментарии. При наличии противопоказаний к реОС, целесообразно проведение радикальной (по возможности) хирургической обработки очага инфекции с сохранением стабильного имплантата; ирригации тканей с помощью УЗ кавитации и пульсирующей струей с общим объемом жидкости не менее 9 литров; этиотропная пероральная АБТ на весь период до появления клинико-рентгенологических признаков консолидации отломков костей. Данный вариант лечения не предусматривает использование дополнительных имплантатов (ПММК, костных трансплантатов и остеозамещающих материалов) и, по сути, направлен на предупреждение (или профилактику) септического состояния больного и снижение бактериальной контаминации зоны перелома до момента консолидации поврежденной кости. После компенсации сопутствующих заболеваний и достижения консолидации возможно удаление внутреннего фиксирующего устройства [26,28,45,284,285].
- Пациентам с ПАИ и консолидированным переломом рекомендуется удаление внутреннего фиксирующего устройства и при необходимости лечение остеомиелита, хирургическое вмешательство, объем которого зависит от конкретной клинической ситуации, в комплексе с этиотропной антибактериальной терапией [283].
УДД 5 УУР С