Основной целью медицинской помощи больным с ОКН опухолевой этиологии является ликвидация кишечной непроходимости, которая позволяет создать благоприятные условия для скорейшего начала онкологически обоснованного лечения.
Операция является основным методом лечения опухолевой кишечной непроходимости. Объем, срочность и этапность оперативного лечения зависят от технического обеспечения лечебного учреждения, подготовки хирургической, анестезиологической и реанимационной бригад, функционального статуса и степени операционно-анестезиологического риска пациента, распространенности и наличия осложнений онкологического заболевания, в том числе перфорации с формированием перитонита, абсцесса, сепсиса и септического шока.
3.1 Консервативная терапия
Неоперативное лечение является этапом подготовки к операции и, в отличие от тонкокишечной непроходимости, не рассматривается как самостоятельный окончательный метод лечения опухолевой кишечной непроходимости.
- Пациентам с ОКН без признаков кишечной перфорации может быть рекомендовано начальное неоперативное лечение, целью которого является подготовка к операции в наиболее благоприятных условиях [20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
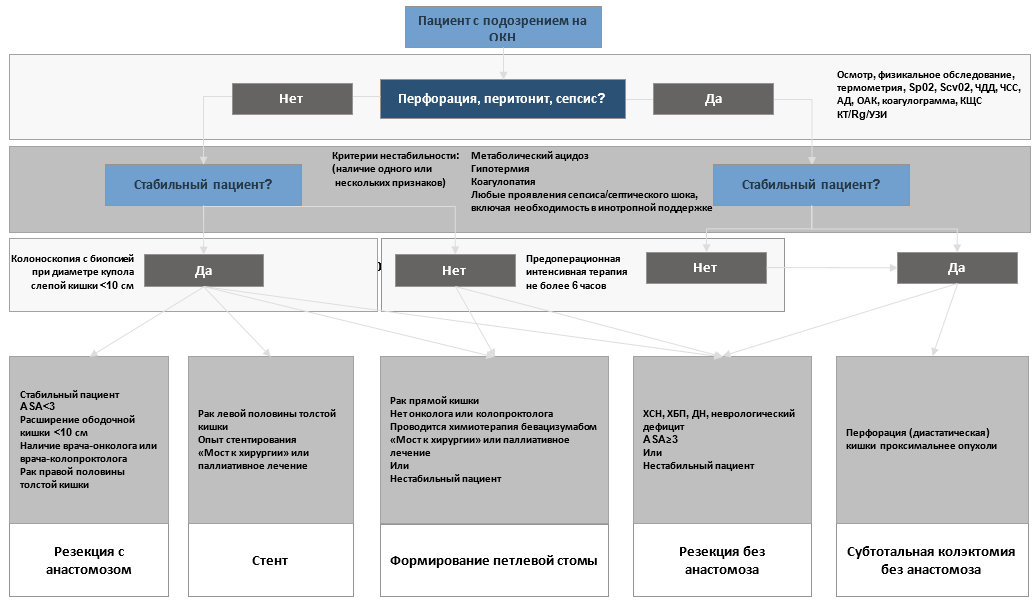
Комментарий: для достижения наилучших условий необходима коррекции водно-электролитных нарушений, анемии, нутритивного статуса, обеспечения квалифицированной анестезиологической и хирургической бригады. В качестве показания к немедленному оперативному лечению указывается стойкий ацидоз и дилятация купола слепой кишки больше 10 см, что указывает на угрозу перфорации. При отсутствии признаков компрометации кишечной стенки лечение может быть продолжено до оптимальных условий с контролем лабораторных и инструментальных показателей каждые 6-12 часов [20].
- Всем пациентам с ОКН следует проводить коррекцию гиповолемии и водно-электролитных нарушений [22,23].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств - 2)
Комментарий: гиповолемия может иметь катастрофические последствия для хирургических пациентов и является основным фактором предотвратимой летальности. Гиповолемия у пациентов перед операцией должна быть устранена всегда, когда это возможно. На начальном этапе коррекции гиповолемии следует отдавать предпочтение сбалансированным кристаллоидным растворам (растворы, влияющие на водно-электролитный баланс, АТХ B05BB) [22].
- Больным с ОКН, демонстрирущим симптомы гастростаза рекомендуется обеспечивать декомпрессию проксимальных отделов ЖКТ путём аспирации содержимого через назогастральный или назоинтестинальный зонд [20;24].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств - 5)
Комментарий: хотя в международных рекомендациях [7] при ОКН, в отличии от тонкокишечной непроходимости, процедура декомпрессии ЖКТ на предоперационном этапе не описана, ее применении при тонко-толстокишечной непроходимости позволяет рассчитывать на снижение внутрибрюшного давления, концентрации микробной флоры, токсического действия застойного содержимого желудка и тонкой кишки. Рекомендация по декомпрессии ЖКТ на дооперационном этапе могут быть актуальны, в первую очередь, при опухолях правых отделов ободочной кишки, проявляющихся тонкокишечной непроходимостью с дилятацией проксимальных отделов ЖКТ. При левосторонней ОКН дилятация проксимальной части тонкой кишки и желудка встречается реже, в связи с чем, при отсутствии застойного содержимого в желудке нет необходимости в установке зонда для декомпрессии верхних отделов ЖКТ. В отечественном исследовании влияния декомпрессии желудка на выживаемость пациентов с тонкокишечной непроходимостью не установлено [25]. Однако, предварительная декомпрессия ЖКТ позволяет облегчить манипуляции в брюшной полости. В связи с этим, декомпрессия ЖКТ с помощью назо-гастрального (интестинального) зонда может быть рекомендована.
- Всем пациентам с ОКН рекомендовано прекращение энтерального питания [26].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств - 5)
Комментарий: энтеральное питание оказывает трофическое действие на кишечный эпителий, предотвращает атрофию слизистой, препятствует бактериальной транслокации. Однако, энтерльное питание невозможно в случае обструкции желудочно-кишечного тракта, перфорации или ишемии кишечной стенки [26].
- Всем больным с ОКН рекомендуется проводить оценку эффективности проводимого лечения, клиническую – каждые 6 часов, инструментальную (обзорная рентгенография органов брюшной полости или УЗИ) – каждые 12 часов [6;19;20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: к наиболее важным клиническим признакам улучшения – консеравтивного разрешеия ОКН следует отнести восстановление отхождения газов и естественного опорожнения кишечника. В качестве критериев прекращения неоперативного лечения следует принимать клинико-рентгенологические данные, указывающие на интраоабдоминальные осложнения (перфорация), высокий уровень лактата (сывороточный лактат выше 2 ммоль/л) и лейкоцитоза (более 18х109), температура более 38,5°С, нарастание креатинина (более чем в 2 раза по сравнению с поступлением) [20]. Кроме того, расширение купола слепой кишки более 10 см, неподдающийся коррекции ацидоз следует рассматривать как показания к выполнению срочного оперативного вмешательства [20]. Решение о возможности дальнейшего проведения консервативной терапии должно приниматься каждые 6 часов. Показано, что отсрочка в начале оперативного вмешательства более чем на 6 часов при перфорации кишки и септическом шоке сопряжена со 100% 60-дневной летальностью [6].
- Нестабильным пациентам с ОКН, перитонитом и септическим шоком оперативное вмешательство рекомендуется после интенсивной терапии и стабилизации состояния [27].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3)
Комментарий: больные с ОКН, перитонитом и септическим шоком нуждаются в интенсивной предоперационной терапии. К факторам риска летального исхода относятся гипотермия (менее 35°С), метаболический ацидоз, наличие клинических или лабораторных признаков коагулопатии [27]. Кроме того, в интенсивной терапии нуждаются коморбидные больные и лица старше 70 лет [28]. Целевыми показателями стабилизации состояния являются восстановление центрального венозного давления до 8-12 мм рт. ст., среднего артериального давления >65 мм. рт. ст., центральной венозной сатурации до (ScvO2)>70% [29;30]. Лечение нестабильных пациентов с ОКН целесообразно проводить в условиях отделения реанимации.
- Пациентам с установленной кишечной перфорацией и перитонитом, рано, как только возможно, должна быть рекомендована антибактериальная терапия [31–33].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
Комментарии: интраабдоминальные инфекции, обусловленные перфорацией толстой кишки часто вызываются смесью аэробных и анаэробных бактерий. Антимикробная терапия, рекомендуемая при интраабдоминальных инфекциях [31], включает монотерапию препаратом из группы карбапенемов и комбинированную терапию метронидазолом** с цефалоспоринами третьего поколения или фторхинолонами. Хотя метронидазол** используется в качестве стандартной терапии трихомониаза, анаэробных и амебных инфекций во всем мире с 1970-х годов, резистентность к метронидазолу** остается низкой [33]. Показано, что комбинированная терапия метронидазолом** может быть эффективным и безопасным вариантом лечения интраабдоминальных инфекций, подобно монотерапии карбапенемами [32].
- С целью профилактики тромбоэмболических осложнений у пациентов с ОТНК рекомендовано назначение препаратов группы гепарина, использование компрессионного трикотажа [34].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1)
Комментарий: пациенты, которым выполняется оперативное вмешательство по поводу колоректального рака, относятся к группе высокого риска возникновения тромбоэмболических осложнений. При наличии кишечной непроходимости риск подобных осложнений расценивается как крайне высокий. Применение низкомолекулярных гепаринов (АТХ – группа гепарина) может существенно снизить вероятность возникновения тромбоза глубоких вен нижних конечностей и тромбоэмболию легочной артерии. Использование других препаратов группы гепаринов не отличается по эффективности, однако сопряжено с большим числом геморрагических осложнений и развитием гепарин-индуцированной тромбоцитопении. Дополнительно используются компрессионные чулки, а также терапевтическая система пневматической компрессии. В то же время раннее прекращение постельного режима является одним из условий успешной профилактики венозного тромбоза и практикуется во всех случаях, когда это возможно. У больных, перенесших обширные оперативные вмешательства по поводу онкологических операций, целесообразно проводить профилактические мероприятия, сочетающиеся с введением низкомолекулярных гепаринов как минимум в течение 4 недель [35;36].
3.2 Неинвазивные методы лечения
Нет.
3.3 Хирургическое лечение
Основной задачей хирургического лечения ОКН является спасение жизни больного от развившегося осложнения рака толстой кишки, а также создание благоприятных условий для скорейшего начала онкологически обоснованного лечения. К операции по удалению опухоли ободочной кишки при ОКН следует прибегать только в тех случаях, когда это необходимо для спасения жизни больного, а также в ситуациях, когда потенциальный риск неблагоприятного исхода этапного лечения превышает выгоду одноэтапного подхода.
Существует два варианта хирургического лечения ОКН, а именно: 1) начальная декомпрессия толстой кишки с последующей плановой резекцией ободочной кишки; 2) первичная резекция ободочной кишки. С целью декомпрессии толстой кишки может быть сформирована проксимальная кишечная стома, установлен стент или декомпрессионный колоноскопический катетер (колоректальный зонд, в англоязычной литературе «Dennis Colorectal Tube»). К первично резекционным вмешательствам относят обструктивную сегментарную резекцию ободочной кишки без формирования анастомоза (операция по типу Гармана, правосторонняя гемиколэкотмия с формированием концевой илеостомы/илеоасцендостомы), субтотальную резекцию ободочной кишки и сегментарную резекцию ободочной кишки с первичным анастомозом. Проблему выбора оптимального хирургического подхода нельзя считать решенной, поиск оптимальных лечебных подходов продолжается.
3.3.1 Эндоскопические декомпрессионные малоинвазивные вмешательства
К малоинвазивным методам хирургического лечения больных с ОКН опухолевой этиологии относят установку саморасширяющегося стента, а также проведение колоноскопического декомпрессионного катетера проксимальнее опухоли толстой кишки. Разрешение кишечной непроходимости позволяет избежать выполнения экстренного или срочного оперативного вмешательства, что дает возможность использовать дополнительные лечебные и диагностические мероприятия для подготовки больного к плановому оперативному лечению, в том числе, лапароскопическим доступом. Ликвидация острой кишечной непроходимости на первом этапе лечения осложнённого рака толстой кишки позволяет снизить вероятность возникновения тяжелых осложнений и летального исхода, создаёт условия для выполнения операции с формированием первичного анастомоза, а в некоторых случаях без наложения превентивной кишечной стомы [37].
3.3.1.1 Эндоскопическое стентирование при опухолевом стенозе
Наиболее распространённым неинвазивным методом лечения, позволяющим купировать ОКН является стентирование кишки саморасширяющейся сетчатой системой (стент для толстой кишки металлический непокрытый), вводимой в просвет кишки на уровень опухоли с помощью эндоскопа.
- При отсутствии признаков перфорации, перитонита, кровотечения, полной окклюзии просвета кишки опухолью левых отделов ободочной кишки рекомендована установка саморасширяющегося металлического стента (стент для толстой кишки металлический непокрытый) [38].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
Комментарий: техническая эффективность метода составляет 80-100%, в то время как клиническое улучшение наблюдается у 73-89% больных. Наиболее опасным осложнением стентирования является перфорация, которая наблюдается в 12,8% случаев, при этом, «скрытая» перфорация, обнаруживаемая только при инструментальном исследовании, возникает в 26,7% случаев [39]. Перфорация опухоли во время стентирования является фактором неблагоприятного прогноза [40], после стентирования чаще обнаруживается поражение лимфатических узлов и периневральная опухолевая инвазия [41]. Вместе с тем, при наличии достаточного опыта стентирования (не менее 40 процедур) и выполнении радикальной операции по удалению опухоли ободочной кишки в течение 14 дней, общая и безрецидивная выживаемость в группе стентирования и первичной резекции не отличается [38;42], частота несостоятельности анастомоза и формирования стомы при стентировании ниже [43]. Более ранние рекомендации не допускали рутинное применение этого метода лечения из-за опасений в ухудшении отдалённых результатов лечения [44].
- Во избежание рецидива непроходимости радикальное оперативное вмешательство рекомендовано выполнять в течение 14-30 суток c момента ликвидации ОКН у пациентов, не требующих дополнительного лечения, в том числе, неоадьювантной лекарственной и/или лучевой теарпии [45].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
Комментарий: после стентирования значимых различий в пострезекционных осложнениях, продолжительности пребывания в стационаре или лапароскопических резекциях при выполнении операции через 11–17 дней по сравнению с 5–10 днями не наблюдалось. Из осложнений, связанных со стентом, 48% возникли у пациентов, прооперированных в сроки более 17 дней после декомпрессии. По сравнению с вмешательствами, выполненными в течение 14 дней после формирования стомы, операции, осуществлённые в период 14-28 дней после декомпрессии сопровождались значительно большим количеством лапароскопических резекций, большим числом первичных анастомозов и меньшим койко-днём. Не было продемонстрировано влияния сроков радикального оперативного вмешательства на летальность, безрецидивную или общую выживаемость [45].
- Стентирование опухоли при ОКН на фоне проводимой противоопухолевой терапии препаратами на основе моноклональных антител ингибирующих биологическую активность фактора роста эндотелия сосудов (бевацизумаб**) не рекомендовано [46].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
Комментарий: наличие стента в опухолевом канале у больных, длительно получающих бевацизумаб**, связано с высоким риском перфорации опухоли [46].
- У пациентов с ОКН, обусловленной опухолью нижне-ампулярного и средне-ампулярного отделов прямой кишки стентирование не рекомендовано [47].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: при низкой локализации рака в прямой кишке в зону стентирования может попасть зубчатая линия, что служит причиной появления выраженного болевого синдрома, кровотечения, тенезмов и недержания кишечного содержимого [47].
3.3.1.2 Ретроградное проведение декомпрессионного колоноскопического катетера
Метод заключается в трансанальном проведении декомпрессионного колоноскопического катетера через опухолевый канал с последующим промыванием проксимальных отделов ободочной кишки. Осуществляется во время колоноскопии под контролем рентгеноскопии.
- При отсутствии признаков перфорации, перитонита, кровотечения и полной окклюзии просвета кишки опухолью левых отделов ободочной кишки, в качестве альтернативы стентированию, рекомендована установка декомпрессионного колоноскопического катетера [48].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: проведение рентгеноконтрастной трубки возможно при диаметре опухолевого канала не менее 3 мм. Техническая эффективность метода составляет 80%, клиническая - 72,5%; частота перфорации кишки может достигать 10%.
Потенциальным преимуществом метода является возможность осуществить лаваж проксимальных отделов толстой кишки, и, предположительно, меньшая травматизация кишки в зоне опухоли из-за отсутствия растяжения опухолевого канала, имеющего место при стентировании. Существенным ограничением метода к использованию является отсутствие данных о его онкологической безопасности [43].
3.3.2 Оперативное лечение
Первоочередной задачей хирургического лечения при ОКН является ликвидация кишечной непроходимости и сохранение жизни пациенту. При наличии в лечебном учреждении колоректального хирурга – онколога или колопроктолога решение об объеме оперативного лечения принимается, исходя из индивидуальных особенностей пациента – при отсутствии перитонита допустимо выполнение как резекционных, так и декомпрессивных вмешательств (кишечная стома). Рациональным методом хирургического лечения при ОКН в неспециализированных стационарах является формирование проксимальной стомы с последующим радикальным оперативным вмешательством по удалению опухоли толстой кишки, которое предпочтительно выполнять в специализированных медицинских учреждениях онкоколопроктологического профиля.
- Показанием к прекращению дальнейшей терапии и выполнению срочного оперативного вмешательства следует считать наличие стойкого ацидоза и/или расширение купола слепой кишки более 10 см [20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: показанием к срочному оперативному лечению является дилятация купола слепой кишки больше 10 см из-за угрозы перфорации, а также неподдающийся коррекции ацидоз [20].
- Всем больным, которым планируется формирование кишечной стомы, перед операцией рекомендована маркировка области предполагаемой стомы [49].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: если пациенту предполагается формирование стомы, то ход самой процедуры и ее последствия должны быть тщательно ему разъяснены. Необходимо выполнить маркировку области, где предполагается сформировать стому. Наиболее оптимальным перед выполнением операции является консультация специалиста по реабилитации стомированных больных. В экстренных ситуациях не всегда возможно соблюдение указанных выше рекомендаций, в таких случаях разметка области предполагаемого выведения стомы должна проводиться оперирующим врачом-хирургом. Разметка производится в положении больного стоя, лежа и сидя, с учетом его индивидуальных и конституциональных особенностей, в соответствии с клиническими рекомендациями по лечению больных с кишечной стомой [50].
- Пациентам, без признаков перфорации кишки, перитонита, абсцедирования, оперируемым по поводу ОКН опухолевой этиологии, рекомендовано проведение антибиотикопрофилактики антибактериальными препаратами системного действия (АТХ J01) [51].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
Комментарий: эффективным считается однократное введение антибактериального препарата широкого спектра действия (АТХ: J01CA Пенициллины широкого спектра действия, J01DC Цефалоспорины второго поколения, J01DD Цефалоспорины третьего поколения, J01DE Цефалоспорины четвертого поколения, J01DH Карбапенемы, J01M Антибактериальные препараты производные хинолона) непосредственно перед операцией, а при длительности хирургического вмешательства более 3 ч — его повторное введение. Назначение антибактериальных препаратов системного действия может уменьшать частоту развития инфекционных осложнений, укорачивать сроки пребывания больного в стационаре, снижать затраты на лечение осложнений после хирургических операций [51].
- Всем больным с ОКН рекомендовано осуществление интраоперационной декомпрессии тонкой кишки [49].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: декомпрессия тонкой кишки необходима для устранения абдоминального компартмент синдрома, обеспечения условий для ушивания раны брюшной стенки без натяжения, снижения концентрации микробной флоры, устранения токсического действия застойного содержимого желудка и тонкой кишки, нормализации дыхательной функции, снижения риска аспирационной пневмонии, улучшения перфузии кишечной стенки, восстановления моторной и всасывательной функций кишечника.
По данным систематического обзора, нет статистически значимых различий в результатах лечения больных с ОКН при применении назогастрального зонда с мануальной декомпрессией тонкой кишки или «открытой» декомпрессией кишки [52]. При лечении тонкокишеной непроходимости, по результатам проведённого метаанализа, использование назоинтестинального зонда не имеет преимуществ перед назогастральным [53].
Выбор способа декомпрессии пищеварительного тракта должен решаться индивидуально для каждого больного, основываться на особенностях его заболевания, опыте лечебного учреждения и оперирующего хирурга.
3.3.2.1 Формирование петлевой стомы.
Формирование петлевой илеостомы/колостомы является альтернативой стентированию в стратегии «мост к хирургии», когда лечение направлено только на ликвидацию острой кишечной непроходимости с целью создания оптимальных условий для выполнения основного этапа хирургического вмешательства - удаления опухоли толстой кишки [37;54].
- При неэффективности проводимого лечения, отсутствии признаков перитонита, а также в качестве альтернативы стентированию рекомендовано выполнение оперативного вмешательства в объёме формирования проксимальной петлевой кишечной стомы [55–57] .
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: преимуществом петлевой стомы является относительная простота операции, надёжная декомпрессия толстой кишки, возможность выполнения тотальной колоноскопии (при формировании двуствольной колостомы), позволяющей в 2,3-12,4% случаев обнаружить синхронное новообразование [55]. Вопрос о выборе илео- или колостомы решается индивидуально, в зависимости от конкретной клинической ситуации. Частота осложнений при обоих вариантах операции сопоставима, однако, у больных с илеостомой выше риск развития дегидратации [56]. Было показано, что больные, которые первым этапом подвергались формированию петлевой стомы статистически значимо реже имели кишечную стому после операции по удалению опухоли толстой кишки - 29% против 67% в группе стентирования (р<0,001) [57]. При этом, следует указать на более высокую частоту тяжелых осложнений у стомированных больных - 15,3% против 5,8% в группе стентирования, однако, это не оказывало влияния на общую и безрецидивную выживаемость, которая была сопоставима в группах [57]. В сравнении с первичной резекцией толстой кишки частота кумулятивной летальности и осложнений сопоставимы, однако, в группе больных со стомой чаще удаётся сформировать межкишечный анастомоз - в 89,3% в отличие от 49,2% при удалении опухоли толстой кишки на первом этапе лечения. В 9,4% случаев больные остаются с постоянной стомой, в то время как в группе первичных резекций этот показатель равен 21,6% [54]. В случае кишечной непроходимости, обусловленной опухолью прямой кишки, от выполнения первичной резекции прямой кишки по Гартману целесообразно отказаться, так как это существенно затрудняет последующую реабилитацию больного. Помимо этого, при локализации опухоли в средне- или нижнеампулярном отделе прямой кишки, особенно в случае местно-распространенных опухолей, выполнение резекционного вмешательства лишает больного возможности проведения неоадъювантной химиолучевой терапии, тем самым дискредитирует принципы онкологического радикализма [58;59].
- У нестабильных пациентов с опухолевой обтурационной ОКН или при технических трудностях выведения петлевой колостомы в качестве декомпрессионной операции может быть использована пристеночная колостома [60].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: пациентам с опухолевой обтурационной ОКН не рекомендуется формирование пристеночной колостомы, в том числе цекостомы, поскольку она не обеспечивает полного отключения пассажа кишечного содержимого и полноценного купирования осложнений опухолевого процесса. Данная операция может быть оправдана только у ограниченного количества пациентов в критическом состоянии, когда стентирование или формирование петлевой кишечной стомы не могут быть выполнены [60].
3.3.2.2 Резекция толстой кишки
Наиболее часто выполняемое радикальное оперативное вмешательство при раке левой половины ободочной кишки, осложненном ОКН – резекция ободочной кишки с формированием концевой колостомы (операция по типу Гартмана) [12]. При расположении новообразований в правых отделах ободочной кишки выполняются операции с формированием анастомоза, а при необходимости выполнения резекции ободочной кишки без создания анастомоза формируется одноствольная илеостома.
Преимуществом такого рода операций является исключение вероятности развития несостоятельности межкишечного анастомоза, у также, удаление опухоли на начальном этапе лечения. Однако, следует отметить, что резекционные вмешательства сопряжены с высоким уровнем послеоперационной летальности - 9% и послеоперационных осложнений, в том числе, связанных с кишечной стомой. Факторами риска летального исходя являются пожилой возраст больных – старше 70 лет, высокий анестезиологический риск – ASA 3, сердечно-сосудистая недостаточность и неврологические нарушения. Немаловажным является низкая частота выполнения реконструктивно-восстановительных вмешательств - только 35% больным в последующем удаётся восстановить естественную дефекацию [12]. Было показано, что среднее число лимфатических узлов в удаленном препарате после экстренных вмешательств ниже, чем в плановой хирургии (8,7 против 21) [61].
Следует отметить, что по проблеме выбора оптимальной стратегии хирургического лечения больных с ОКН проведены десятки рандомизированных исследований и метаанализов. При анализе Pubmed за последние 5 лет по запросу “large bowel obstruction” обнаружено 10 метаанализов, посвященных выбору оптимальной первичной операции: стома, стент, резекция. Из них единственное исследование показало, что первичная декомпрессионная операция, в частности стент, имела преимущества перед первичной резекцией по госпитальной – 90-дневной летальности: 6.5% против 8,1% (ОР 0,65, P = 0,01) [62]. Одинаковые результаты общей 3-х и 5-летней выживаемости получены при сравнении стомы и стента с первичной резекцией, за исключением единственного метаанализа, где стома и стент имели преимущества. В этом же исследовании установлена более высокая 5-летняя безрецидивная выживаемость при использовании стомы и стента. По 3-х летней безрецидивной выживаемости в двух метаанализах установлены преимущества первичной резекции [63;64]. Явные преимущества имели группы стомы и стента по частоте осложнений и формированию первичного анастомоза, при некотором преимуществе первичной резекции по совокупной длительности стационарного лечения. Количество удаленных лимфоузлов было или равным [63], или имела преимущество группа стома и стент [65].
В целом, по сравнению с экстренной хирургией саморасширяющиеся металлические стенты и стома улучшают краткосрочные результаты хирургического лечения при сопоставимой общей и безрецидивной выживаемости. При этом стабильные пациенты могут получить преимущества от экстренного резекционного вмешательства, в т.ч. с первичным анастомозом, нестабильные – от декомпрессии стомой, стентом или колоректальным зондом [66]. Анализ результатов оперативного лечения ОКН, по данным проспективного национального регистра Нидерландов, показал летальность после экстренной резекции от 2,9% у пациентов <70 лет до 32,2% у пожилых пациентов с высоким риском. Для немощных пожилых пациентов послеоперационная летальность свыше 30% требует поиска альтернативных стратегий лечения [67].
- У стабильных пациентов с ОКН без перфорации и перитонита, обусловленной опухолью ободочной кишки, при наличии квалифицированной бригады хирургов онкологов или колопроктологов, после дообследования в соответствии с клиническими рекомендациями по лечению рака ободочной кишки и ректосигмоидного отдела возможно выполнение операции по удалению опухоли ободочной кишки [63;64].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 1)
Комментарий: учитывая имеющиеся на сегодняшний день данные, к резекционным вмешательствам следует прибегать лишь в тех случаях, когда они выполняются квалифицированной бригадой хирургов, онкологов или колопроктологов, имеются условия для проведения качественного морфологического исследования удалённой опухоли, а также, когда другие варианты лечения не могут быть применены. Обеспечение квалифицированной врачебной бригадой имеет особое значение в случае резекционных вмешательств, которые требуют соблюдения онкологических принципов хирургии. Объем операции при экстренной резекции в условиях отсутствия перфорации и перитонита не должен отличаться от планового вмешательства, за исключением вопроса формирования межкишечного анастомоза. При невозможности операции по установленным приницпам лечения рака ободочной кишки у пациентов без перфорации резекционные вмешательства выполняться не должны. Объем операции необходимо ограничить декомпресионной стомой.
- При обнаружении перфорации, перитонита, абсцедирования, диастатических разрывов и ишемических изменений ободочной кишки рекомендовано выполнение резекции толстой кишки без формирования анастомоза [12;27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: существует два основных механизма, приводящих к перфорации кишки и перитониту на фоне ОКН опухолевой этиологии. Во-первых, это образование дефекта стенки кишки на уровне опухоли за счёт некроза и распада опухолевой ткани; во-вторых, диастатический разрыв стенки растянутой кишки, расположенной проксимальнее места обструкции. Второй вариант зачастую является более тяжелым и ассоциирован с высокой летальностью за счёт диффузной контаминации брюшной полости и быстрого развития тяжелого септического шока [68]. В целом, в этой ситуации необходимо приложить все усилия для резекции пораженного участка кишки вместе с опухолью, однако тактика лечения должна быть сбалансирована и учитывать тяжесть состояния пациента - нестабильные больные могут подвергаться только тем процедурам, которые они могут переносить, и обычно это соответствует технически простым и быстро выполняемым вмешательствам, таким как операция по типу Гартмана или правосторонняя гемиколэктомия без анастомоза, с формированием одноствольной илеостомы, при диастатической перфорации правых отделов ободочной кишки у больных раком левой половины ободочной кишки выполняется субтотальная резекция ободочной кишки без анастомоза [12;27].
- Операции по удалению злокачественной опухоли толстой кишки с формированием межкишечного анастомоза при ОКН рекомендовано выполнять только после разрешения симптомов ОКН у стабильных пациентов без выраженных сопутствующих заболеваний, при наличии квалифицированной бригады хирургов врачей-онкологов или врачей-колопроктологов, в соответствии с клиническими рекомендациями по лечению больных раком ободочной и прямой кишки [7;89;90].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: при ОКН выше риск развития потенциально фатального осложнения - несостоятельности межкишечного анастомоза. Частота несостоятельности анастомоза при ОКН составляет 11,2% - 14,3%, летальность при этом достигает 17,1% [69;70]. Наиболее часто несостоятельность анастомоза возникает после субтотальной колэктомии - 14%, левосторонней гемиколэктомии - 13%, резекции поперечной ободочной кишки - 10,3% [12]. К факторам риска неблагоприятного прогноза при операции с формированием анастомоза относят возраст больного старше 70 лет, высокий анестезиологический риск (ASA > 3), анемию (Hb < 75 г/л), хроническую болезнь почек (скорость клубочковой фильтрации (СКФ) < 45 мл/мин/1.73 m2), хроническую сердечную недостаточность, дыхательную недостаточность, неврологический дефицит. При наличии любого из перечисленных факторов риска от формирования анастомоза следует отказаться в пользу резекционного вмешательства без наложения межкишечного соустья [12;71]. Осложнённое течение послеоперационного периода может быть причиной позднего начала химиотерапии, или вовсе отказа от её проведения.
3.4 Паллиативное лечение больных с острой обтурационной кишечной непроходимостью
Основной целью лечения больных с раком толстой кишки IV стадии и острой кишечной непроходимостью является увеличение продолжительности жизни пациента и улучшение её качества. Доступные варианты лечения включают использование кортикостероидов системного действия и стимуляторов моторики желудочно-кишечного тракта, симптоматическое лечение – назогастральную интубацию и парентеральное питание, стентирование кишки и хирургические вмешательства - формирование проксимальной стомы и резекция кишки. Вместе с тем, общая выживаемость низкая, независимо от типа лечения. Повсеместно плохие исходы предполагают, что острую кишечную непроходимость на фоне инкурабельного рака толстой кишки следует рассматривать как предтерминальное событие [72]. В таких ситуациях предпочтителен индивидуализированный мультидисциплинарный подход с расширением участия пациента в выборе объёма лечения [73]. При выявлении признаков перфорации, странгуляции и перитонита у больных с IV стадией рака толстой кишки необходимо экстренное оперативное лечение. Следует стремиться к осуществлению минимально возможного объёма вмешательства, отдавая предпочтение формированию проксимальной стомы. При выявлении перфорации кишки, ишемии и абсцедирования - выполнять её резекцию.
У пациентов с диссеминированной формой рака толстой кишки, осложненного компенсированной кишечной непроходимостью возможно выполнение оперативного вмешательства в объёме паллиативной резекции толстой кишки. Основанием для выполнения такой операции служит решение мультидисплинарного онкологического консилиума. В настоящий момент нет убедительных данных о пользе или недостатке выполнения паллиативной резекции кишки у больных с диссеминированной формой рака. Результаты существующих исследований противоречат друг другу, большинство работ имеют ретроспективный характер, из-за чего многие значимые переменные, такие как число метастазов, их размеры, характеристика органов-мишеней могут быть не учтены, что не позволяет применять точные методы статистической обработки информации [74]. Обоснованиями выполнения паллиативной резекции служат ожидаемое улучшение качества жизни больного и обеспечение оптимальных условий для проведения химиотерапии.
Вопросы контроля болевого синдрома и поддержки нутритивного статуса у паллиативных больных в данных рекомендациях не рассматриваются.
- При опухолевой обтурационной кишечной непроходимости у больных раком толстой кишки IV стадии, короткой ожидаемой продолжительностью жизни рекомендовано применение метода стентирования кишки [75].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
Комментарий: стентирование кишки в рамках паллиативного лечения больных с обтурационной ОКН может избавить от необходимости формирования кишечной стомы, что, потенциально, позволяет обеспечить приемлемое качество жизни пациентам [53]. Однако, несмотря на высокую частоту технически успешного стентирования (при наличии только одного опухолевого препятствия) – от 90 до 100% случаев, более короткую продолжительность госпитализации по сравнению с формированием стомы [76], при стентировании чаще наблюдаются ранние послеоперационные осложнения [44]. Частота повторного возникновения острой кишечной непроходимости выше в группе пациентов, подвергшихся стентированию - 20,7% против 9% в группе хирургического лечения [75].
- У пациентов с IV стадией рака при невозможности стентирования кишки, наличии нескольких участков обструкции кишки, а также, в случае, если проводится лекарственное противоопухолевое лечение рекомендовано хирургическое вмешательство в объёме формирования проксимальной колостомы/илеостомы [77].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: основой лечения больных с диссеминированной формой рака толстой кишки является химиотерапия. В связи с тем, что наличие стента в опухолевом канале у больных, длительно получающих бевацизумаб** связано с высоким риском перфорации опухоли, следует использовать другие методы декомпрессии толстой кишки [46]. Формирование стомы является относительно простой и доступной процедурой, позволяющей обеспечить быструю и надёжную декомпрессию толстой кишки [77].

Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint