Мокрышева, Н., et al., Анализ основных эпидемиологических характеристик первичного гиперпаратиреоза в России (по данным регистра). Проблемы эндокринологии, 2012. 58(5).
Bilezikian, J.P., et al., Primary hyperparathyroidism. Nature reviews Disease primers, 2016. 2: p. 16033.
Walker, M.D. and J.P. Bilezikian, Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. 2017, Springer.
Cromer, M.K., et al., Identification of somatic mutations in parathyroid tumors using whole-exome sequencing. The Journal of Clinical Endocrinology & Metabolism, 2012. 97(9): p. E1774-E1781.
Thakker, R., Genetics of parathyroid tumours. Journal of internal medicine, 2016. 280(6): p. 574-583.
Bricaire, L., et al., Frequent large germline HRPT2 deletions in a French National cohort of patients with primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2013. 98(2): p. E403-E408.
Warner, J., et al., Genetic testing in familial isolated hyperparathyroidism: unexpected results and their implications. Journal of Medical Genetics, 2004. 41(3): p. 155-160.
Yu, W., et al., Whole-exome sequencing studies of parathyroid carcinomas reveal novel PRUNE2 mutations, distinctive mutational spectra related to APOBEC-catalyzed DNA mutagenesis and mutational enrichment in kinases associated with cell migration and invasion. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(2): p. E360-E364.
Wermers, R.A., et al., The rise and fall of primary hyperparathyroidism: a population-based study in Rochester, Minnesota, 1965-1992. Annals of Internal Medicine, 1997. 126(6): p. 433-440.
Khan, A.A., et al., Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int, 2017. 28(1): p. 1-19.
Clarke, B.L., Asymptomatic Primary Hyperparathyroidism, in Parathyroid Disorders. 2019, Karger Publishers. p. 13-22.
Christensson, T., et al., Prevalence of hypercalcaemia in a health screening in Stockholm. Acta Medica Scandinavica, 1976. 200(1‐6): p. 131-137.
Palmer, M., et al., Prevalence of hypercalcaemia in a health survey: a 14‐year follow‐up study of serum calcium values. European journal of clinical investigation, 1988. 18(1): p. 39-46.
Yu, N., et al., Epidemiology of primary hyperparathyroidism in Tayside, Scotland, UK. Clinical endocrinology, 2009. 71(4): p. 485-493.
Siilin, H., et al., Prevalence of primary hyperparathyroidism and impact on bone mineral density in elderly men: MrOs Sweden. World journal of surgery, 2011. 35(6): p. 1266-1272.
Yeh, M.W., et al., Incidence and prevalence of primary hyperparathyroidism in a racially mixed population. The Journal of Clinical Endocrinology & Metabolism, 2013. 98(3): p. 1122-1129.
Cusano, N.E., et al., Normocalcemic hyperparathyroidism and hypoparathyroidism in two community-based nonreferral populations. The Journal of Clinical Endocrinology & Metabolism, 2013. 98(7): p. 2734-2741.
Rubin, M.R., et al., The natural history of primary hyperparathyroidism with or without parathyroid surgery after 15 years. The Journal of Clinical Endocrinology & Metabolism, 2008. 93(9): p. 3462-3470.
Silverberg, S.J., et al., A 10-year prospective study of primary hyperparathyroidism with or without parathyroid surgery. New England Journal of Medicine, 1999. 341(17): p. 1249-1255.
Vestergaard, P., et al., Cardiovascular events before and after surgery for primary hyperparathyroidism. World J Surg, 2003. 27(2): p. 216-22.
Вороненко, И., et al., Состояние сердечно-сосудистой системы при клинически выраженном и малосимптомном первичном гиперпаратиреозе. Проблемы эндокринологии, 2009. 3: p. 17-22.
Vestergaard, P. and L. Mosekilde, Cohort study on effects of parathyroid surgery on multiple outcomes in primary hyperparathyroidism. BMJ, 2003. 327(7414): p. 530-4.
Thomas, A. and A. Kautzky-Willer, Diabetes in hyperparathyroidism, in Diabetes Secondary to Endocrine and Pancreatic Disorders. 2014, Karger Publishers. p. 92-100.
Procopio, M., et al., Cardiovascular risk and metabolic syndrome in primary hyperparathyroidism and their correlation to different clinical forms. Endocrine, 2014. 47(2): p. 581-9.
Mendoza-Zubieta, V., et al., High prevalence of metabolic syndrome in a mestizo group of adult patients with primary hyperparathyroidism (PHPT). BMC endocrine disorders, 2015. 15(1): p. 16.
Christensen, S.E., et al., Discriminative power of three indices of renal calcium excretion for the distinction between familial hypocalciuric hypercalcaemia and primary hyperparathyroidism: a follow‐up study on methods. Clinical endocrinology, 2008. 69(5): p. 713-720.
Nordenström, E., P. Katzman, and A. Bergenfelz, Biochemical diagnosis of primary hyperparathyroidism: analysis of the sensitivity of total and ionized calcium in combination with PTH. Clinical biochemistry, 2011. 44(10-11): p. 849-852.
Amin, A.L., et al., Normal PTH levels in primary hyperparathyroidism: still the same disease? Annals of surgical oncology, 2011. 18(12): p. 3437-3442.
Monchik, J.M. and E. Gorgun, Normocalcemic hyperparathyroidism in patients with osteoporosis. Surgery, 2004. 136(6): p. 1242-1246.
Lowe, H., et al., Normocalcemic primary hyperparathyroidism: further characterization of a new clinical phenotype. The Journal of Clinical Endocrinology & Metabolism, 2007. 92(8): p. 3001-3005.
Silverberg, S.J. and J.P. Bilezikian, “Incipient” primary hyperparathyroidism: a “forme fruste” of an old disease. The Journal of Clinical Endocrinology & Metabolism, 2003. 88(11): p. 5348-5352.
Maeda, S.S., et al., Factors affecting vitamin D status in different populations in the city of São Paulo, Brazil: the São PAulo vitamin D Evaluation Study (SPADES). BMC endocrine disorders, 2013. 13(1): p. 14.
Ross, A.C., et al., The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. The Journal of Clinical Endocrinology & Metabolism, 2011. 96(1): p. 53-58.
Martinez, I., et al., The importance of dietary calcium and phosphorous in the secondary hyperparathyroidism of patients with early renal failure. American journal of kidney diseases, 1997. 29(4): p. 496-502.
Walker, M.D., et al., Effect of renal function on skeletal health in primary hyperparathyroidism. J Clin Endocrinol Metab, 2012. 97(5): p. 1501-7.
Coe, F.L., et al., Evidence for secondary hyperparathyroidism in idiopathic hypercalciuria. The Journal of clinical investigation, 1973. 52(1): p. 134-142.
Balsa, J., et al., Role of calcium malabsorption in the development of secondary hyperparathyroidism after biliopancreatic diversion. Journal of endocrinological investigation, 2008. 31(10): p. 845-850.
Selby, P.L., et al., Bone loss in celiac disease is related to secondary hyperparathyroidism. Journal of Bone and Mineral Research, 1999. 14(4): p. 652-657.
Rejnmark, L., et al., Effects of thiazide‐and loop‐diuretics, alone or in combination, on calcitropic hormones and biochemical bone markers: a randomized controlled study. Journal of internal medicine, 2001. 250(2): p. 144-153.
MALLETTE, L.E., et al., Lithium treatment increases intact and midregion parathyroid hormone and parathyroid volume. The Journal of Clinical Endocrinology & Metabolism, 1989. 68(3): p. 654-660.
Makras, P., et al., Parathyroid hormone changes following denosumab treatment in postmenopausal osteoporosis. Clinical endocrinology, 2013. 79(4): p. 499-503.
Fraser, W.D., et al., Direct and indirect assessment of the parathyroid hormone response to pamidronate therapy in Paget's disease of bone and hypercalcaemia of malignancy. Bone and mineral, 1991. 12(2): p. 113-121.
Udén, P., et al., Primary hyperparathyroidism in younger and older patients: symptoms and outcome of surgery. World journal of surgery, 1992. 16(4): p. 791-797.
Reid, L., et al., Presentation, diagnostic assessment and surgical outcomes in primary hyperparathyroidism: a single centre’s experience. Endocrine connections, 2018. 1(aop).
Di Monaco, M., et al., Primary hyperparathyroidism in elderly patients with hip fracture. Journal of bone and mineral metabolism, 2004. 22(5): p. 491-495.
Bergström, I., B.-M. Landgren, and B. Freyschuss, Primary hyperparathyroidism is common in postmenopausal women with forearm fracture and low bone mineral density. Acta obstetricia et gynecologica Scandinavica, 2007. 86(1): p. 61-64.
Bandeira, F., et al., From mild to severe primary hyperparathyroidism: the Brazilian experience. Arquivos Brasileiros de Endocrinologia & Metabologia, 2006. 50(4): p. 657-663.
Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of Bone and Mineral Research, 1999. 14(10): p. 1700-1707.
Yadav, S.K., et al., Primary hyperparathyroidism in developing world: a systematic review on the changing clinical profile of the disease. Archives of Endocrinology and Metabolism, 2020. 64(2): p. 105-110.
Wikström, B., et al., Ambulatory diagnostic evaluation of 389 recurrent renal stone formers. Klinische Wochenschrift, 1983. 61(2): p. 85-90.
Fuss, M., et al., Infrequency of primary hyperparathyroidism in renal stone formers. British journal of urology, 1988. 62(1): p. 4-6.
Walker, V., E.M. Stansbridge, and D.G. Griffin, Demography and biochemistry of 2800 patients from a renal stones clinic. Annals of clinical biochemistry, 2013. 50(2): p. 127-139.
Sharma, S., et al., PREVALENCE AND PREDICTORS OF PRIMARY HYPERPARATHYROIDISM AMONG PATIENTS WITH UROLITHIASIS. Endocrine Practice, 2017. 23(11): p. 1311-1315.
Kim, J.-k., et al., The prevalence of primary hyperparathyroidism in Korea: a population-based analysis from patient medical records. Annals of surgical treatment and research, 2018. 94(5): p. 235-239.
Sorensen, M.D., et al., Urinary parameters as predictors of primary hyperparathyroidism in patients with nephrolithiasis. The Journal of urology, 2012. 187(2): p. 516-521.
Ebert, E.C., The parathyroids and the gut. Journal of clinical gastroenterology, 2010. 44(7): p. 479-482.
Gasparoni, P., et al., Primary hyperparathyroidism and peptic ulcer. Minerva medica, 1989. 80(12): p. 1327-1330.
Jacob, J.J., et al., Does hyperparathyroidism cause pancreatitis? A South Indian experience and a review of published work. ANZ journal of surgery, 2006. 76(8): p. 740-744.
Inzucchi, S.E., Understanding hypercalcemia: its metabolic basis, signs, and symptoms. Postgraduate medicine, 2004. 115(4): p. 69-76.
Walsh, J., N. Gittoes, and P. Selby, SOCIETY FOR ENDOCRINOLOGY ENDOCRINE EMERGENCY GUIDANCE: Emergency management of acute hypercalcaemia in adult patients. Endocrine connections, 2016. 5(5): p. G9-G11.
Suh, J.M., J.J. Cronan, and J.M. Monchik, Primary hyperparathyroidism: is there an increased prevalence of renal stone disease? American Journal of Roentgenology, 2008. 191(3): p. 908-911.
Cipriani, C., et al., Prevalence of kidney stones and vertebral fractures in primary hyperparathyroidism using imaging technology. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(4): p. 1309-1315.
Miller, P.D. and J.P. Bilezikian, Bone densitometry in asymptomatic primary hyperparathyroidism. Journal of bone and mineral research: the official journal of the American Society for Bone and Mineral Research, 2002. 17: p. N98.
Abboud, B., R. Daher, and J. Boujaoude, Digestive manifestations of parathyroid disorders. World Journal of Gastroenterology: WJG, 2011. 17(36): p. 4063.
FRAME, B. and W.S. HAUBRICH, Peptic ulcer and hyperparathyroidism: a survey of 300 ulcer patients. AMA Archives of Internal Medicine, 1960. 105(4): p. 536-541.
Corleto, V., et al., Prevalence and causes of hypergastrinemia in primary hyperparathyroidism: a prospective study. The Journal of Clinical Endocrinology & Metabolism, 1999. 84(12): p. 4554-4558.
Norton, J.A., et al., Prospective study of surgery for primary Hyperparathyroidism (HPT) in multiple endocrine neoplasia-type 1 (MEN1), and Zollinger-Ellison syndrome (ZES): long-term outcome of a more virulent form of HPT. Annals of surgery, 2008. 247(3): p. 501.
Turken, S.A., et al., Neuromuscular involvement in mild, asymptomatic primary hyperparathyroidism. The American journal of medicine, 1989. 87(5): p. 553-557.
Coker, L.H., et al., Primary hyperparathyroidism, cognition, and health-related quality of life. Annals of surgery, 2005. 242(5): p. 642.
Morris, G.S., et al., Parathyroidectomy improves functional capacity in “asymptomatic” older patients with primary hyperparathyroidism: a randomized control trial. Annals of surgery, 2010. 251(5): p. 832-837.
Walker, M.D., et al., Neuropsychological features in primary hyperparathyroidism: a prospective study. J Clin Endocrinol Metab, 2009. 94(6): p. 1951-8.
Murray, S.E., et al., Improvement of sleep disturbance and insomnia following parathyroidectomy for primary hyperparathyroidism. World journal of surgery, 2014. 38(3): p. 542-548.
Blanchard, C., et al., Surgery for ‘asymptomatic’mild primary hyperparathyroidism improves some clinical symptoms postoperatively. European Journal of Endocrinology, 2013. 169(5): p. 665-672.
Bilezikian, J.P., et al., Guidelines for the management of asymptomatic primary hyperparathyroidism: summary statement from the Fourth International Workshop, in J Clin Endocrinol Metab. 2014. p. 3561-9.
Ong, G.S., et al., The importance of measuring ionized calcium in characterizing calcium status and diagnosing primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2012. 97(9): p. 3138-3145.
Thode, J., et al., Comparison of serum total calcium, albumin-corrected total calcium, and ionized calcium in 1213 patients with suspected calcium disorders. Scandinavian journal of clinical and laboratory investigation, 1989. 49(3): p. 217-223.
Gao, P. and P. D'Amour, Evolution of the parathyroid hormone (PTH) assay--importance of circulating PTH immunoheterogeneity and of its regulation. Clinical laboratory, 2005. 51(1-2): p. 21-29.
Boudou, P., et al., Third-or second-generation parathyroid hormone assays: a remaining debate in the diagnosis of primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2005. 90(12): p. 6370-6372.
Hedbäck, G. and A. Oden, Cardiovascular disease, hypertension and renal function in primary hyperparathyroidism. Journal of internal medicine, 2002. 251(6): p. 476-483.
Benson, L., et al., Optimal discrimination of mild hyperparathyroidism with total serum calcium, ionized calcium and parathyroid hormone measurements. Upsala Journal of Medical Sciences, 1987. 92(2): p. 147-176.
Forster, J., J. Monchik, and H.F. Martin, A comparative study of serum ultrafiltrable, ionized, and total calcium in the diagnosis of primary hyperparathyroidism in patients with intermittent or no elevation in total calcium. Surgery, 1988. 104(6): p. 1137-1142.
Rubin, M.R., et al., An N-terminal molecular form of parathyroid hormone (PTH) distinct from hPTH (1–84) is overproduced in parathyroid carcinoma. Clinical chemistry, 2007. 53(8): p. 1470-1476.
Yamashita, H., et al., Influence of renal function on clinico-pathological features of primary hyperparathyroidism. European journal of endocrinology, 2003. 148(6): p. 597-602.
Wang, W.-H., et al., Association between parathyroid hormone, 25 (OH) vitamin D, and chronic kidney disease: a population-based study. BioMed Research International, 2017. 2017.
Tassone, F., et al., Glomerular filtration rate and parathyroid hormone secretion in primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2009. 94(11): p. 4458-4461.
Muthukrishnan, J., et al., Distal renal tubular acidosis due to primary hyperparathyroidism. Endocrine Practice, 2008. 14(9): p. 1133-1136.
Bilezikian, J.P., et al., Primary hyperparathyroidism in women: a tale of two cities--New York and Beijing. International journal of fertility and women's medicine, 2000. 45(2): p. 158-165.
Bandeira, F., et al., Relationship between serum vitamin D status and clinical manifestations of primary hyperparathyroidism. Endocrine Practice, 2002. 8(4): p. 266-270.
Moosgaard, B., et al., Vitamin D status, seasonal variations, parathyroid adenoma weight and bone mineral density in primary hyperparathyroidism. Clinical endocrinology, 2005. 63(5): p. 506-513.
Bilezikian, J.P. and S.J. Silverberg, Normocalcemic primary hyperparathyroidism. Arquivos Brasileiros de Endocrinologia & Metabologia, 2010. 54(2): p. 106-109.
Hannan, F.M., et al., Identification of 70 calcium-sensing receptor mutations in hyper- and hypo-calcaemic patients: evidence for clustering of extracellular domain mutations at calcium-binding sites. Human Molecular Genetics, 2012. 21(12): p. 2768-2778.
Dershem, R., et al., Familial Hypocalciuric Hypercalcemia Type 1 and Autosomal-Dominant Hypocalcemia Type 1: Prevalence in a Large Healthcare Population. The American Journal of Human Genetics, 2020. 106(6): p. 734-747.
Eisner, B.H., J. Ahn, and M.L. Stoller, Differentiating primary from secondary hyperparathyroidism in stone patients: the “thiazide challenge”. Journal of endourology, 2009. 23(2): p. 191-192.
Пампутис, С. and Е. Лопатникова, ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА НОРМОКАЛЬЦИЕМИЧЕСКОГО ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА С ИСПОЛЬЗОВАНИЕМ ДИАГНОСТИЧЕСКОГО ТЕСТА" ПРОБА С АЛЬФАКАЛЬЦИДОЛОМ". Таврический медико-биологический вестник, 2017. 20(3-2).
Valcour, A., et al., Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. The Journal of Clinical Endocrinology & Metabolism, 2012. 97(11): p. 3989-3995.
Björkman, M., A. Sorva, and R. Tilvis, Responses of parathyroid hormone to vitamin D supplementation: a systematic review of clinical trials. Archives of gerontology and geriatrics, 2009. 48(2): p. 160-166.
Володичева В.Л., Милютина А.П., Еремкина А.К., Бибик Е.Е., Чечельницкая С.М., Гаврилова Е.Ф., Мокрышева Н.Г. Влияние занятий лечебной физкультурой в послеоперационном периоде на состояние костно-мышечной системы у пациентов с ремиссией первичного гиперпаратиреоза. В книге: Акцент на пациента: путь от теории к практике. Сборник тезисов. IX Конгресс, посвященный 100-летию зацепина сергея тимофеевича проблема остеопороза в травматологии и ортопедии. Воронеж, 2024. С. 31-32.
Saliba, W., et al., The relationship between serum 25 (OH) D and parathyroid hormone levels. The American journal of medicine, 2011. 124(12): p. 1165-1170.
Holick, M.F., Vitamin D deficiency. New England Journal of Medicine, 2007. 357(3): p. 266-281.
Parfitt, A., The interactions of thiazide diuretics with parathyroid hormone and vitamin D: Studies in patients with hypoparathyroidism. The Journal of clinical investigation, 1972. 51(7): p. 1879-1888.
Holick, M.F., et al., Evaluation, Treatment, and Prevention of Vitamin D Deficiency: an Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism, 2011. 96(7): p. 1911-1930 %@ 0021-972X.
Levin, A., et al., Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: Results of the study to evaluate early kidney disease. Kidney International, 2007. 71(1): p. 31-38.
Пигарова, Е.А., et al., Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии, 2016. 62(4).
Дедов, И.И., et al., Первичный гиперпаратиреоз: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы эндокринологии, 2016. 62(6).
Карасева, Е.В., et al., Возможности применения короткой функциональной пробы с активными метаболитами витамина D в дифференциальной диагностике первичного и вторичного гиперпаратиреоза в условиях стационара. Профилактическая медицина, 2022. 25(6): p. 68‑74.
Еремкина, А.К., et al., Возможности применения короткой функциональной пробы с гидрохлоротиазидом в дифференциальной диагностике первичного и вторичного гиперпаратиреоза в условиях стационара. Проблемы эндокринологии, 2022. 4(68).
Cheung, K., et al., A meta-analysis of preoperative localization techniques for patients with primary hyperparathyroidism. Annals of surgical oncology, 2012. 19(2): p. 577-583.
Moghadam, R.N., et al., Comparative diagnostic performance of ultrasonography and 99mTc-sestamibi scintigraphy for parathyroid adenoma in primary hyperparathyroidism; systematic review and meta-analysis. Asian Pacific journal of cancer prevention: APJCP, 2017. 18(12): p. 3195.
Ruda, J.M., C.S. Hollenbeak, and B.C. Stack Jr, A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003. Otolaryngology—Head and Neck Surgery, 2005. 132(3): p. 359-372.
Артемова, А., Сравнительная оценка методов топической диагностики при первичном гиперпаратиреозе. Тезисы докладов Международного научного форума «Патология паращитовидных желез: современные подходы к диагностике и лечению».—Санкт-Петербург, 2010: p. 29-30.
Untch, B.R., et al., Surgeon-performed ultrasound is superior to 99Tc-sestamibi scanning to localize parathyroid adenomas in patients with primary hyperparathyroidism: results in 516 patients over 10 years. Journal of the American College of Surgeons, 2011. 212(4): p. 522-529.
Carlier, T., et al., 99m Tc-MIBI pinhole SPECT in primary hyperparathyroidism: comparison with conventional SPECT, planar scintigraphy and ultrasonography. European journal of nuclear medicine and molecular imaging, 2008. 35(3): p. 637-643.
Witteveen, J., et al., Therapy of endocrine disease: hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. European Journal of Endocrinology, 2013. 168(3): p. R45-R53.
Nam, M., H.-S. Jeong, and J.H. Shin, Differentiation of parathyroid carcinoma and adenoma by preoperative ultrasonography. Acta Radiologica, 2017. 58(6): p. 670-675.
Agha, A., et al., The role of contrast-enhancend ultrasonography (CEUS) in comparison with 99mTechnetium-sestamibi scintigraphy for localization diagnostic of primary hyperparathyroidism. Clinical hemorheology and microcirculation, 2014. 58(4): p. 515-520.
Kluijfhout, W.P., et al., Use of PET tracers for parathyroid localization: a systematic review and meta-analysis. Langenbecks Arch Surg, 2016. 401(7): p. 925-935.
Leslie, W.D., et al., Parathyroid 99m Tc-sestamibi scintigraphy: dual-tracer subtraction is superior to double-phase washout. European journal of nuclear medicine and molecular imaging, 2002. 29(12): p. 1566-1570.
Kluijfhout, W.P., et al., Diagnostic performance of computed tomography for parathyroid adenoma localization; a systematic review and meta-analysis. European journal of radiology, 2017. 88: p. 117-128.
Паша, С.П., Клиническая значимость радионуклидных методов визуализации паращитовидных желез при гиперпаратиреозе. Russian Electronic Journal Of Radiology, 2015. 5: p. 11-21.
Hindié, E., et al., 2009 EANM parathyroid guidelines. Eur J Nucl Med Mol Imaging, 2009. 36(7): p. 1201-16.
Maccora, D., et al., Parathyroid scintigraphy in primary hyperparathyroidism: comparison between double-phase and subtraction techniques and possible affecting factors. J Endocrinol Invest, 2019. 42(8): p. 889-895.
Taieb, D., et al., Parathyroid scintigraphy: when, how, and why? A concise systematic review. Clin Nucl Med, 2012. 37(6): p. 568-74.
Neumann, D.R., N.A. Obuchowski, and F.P. Difilippo, Preoperative 123I/99mTc-sestamibi subtraction SPECT and SPECT/CT in primary hyperparathyroidism. J Nucl Med, 2008. 49(12): p. 2012-7.
Wong, K.K., et al., Parathyroid adenoma localization with 99mTc-sestamibi SPECT/CT: a meta-analysis. Nucl Med Commun, 2015. 36(4): p. 363-75.
Singer, M.C., et al., Improved localization of sestamibi imaging at high-volume centers. Laryngoscope, 2013. 123(1): p. 298-301.
Ciappuccini, R., et al., Dual-phase 99mTc sestamibi scintigraphy with neck and thorax SPECT/CT in primary hyperparathyroidism: a single-institution experience. Clin Nucl Med, 2012. 37(3): p. 223-8.
Zhou, J., et al., Diagnosis performance of (99m)Tc-MIBI and multimodality imaging for hyperparathyroidism. J Huazhong Univ Sci Technolog Med Sci, 2017. 37(4): p. 582-586.
Слащук, К.Ю., et al., Предоперационная визуализация и интраоперационная навигация новообразований околощитовидных желез при первичном гиперпаратиреозе. Опухоли головы и шеи, 2021. 11(4): p. 10-21.
Okudan, B., et al., Comparison between single-photon emission computed tomography/computed tomography and ultrasound in preoperative detection of parathyroid adenoma: retrospective review of an institutional experience. Nuclear medicine communications, 2019. 40(12): p. 1211-1215.
Casara, D., et al., 99m Tc-MIBI radio-guided minimally invasive parathyroid surgery planned on the basis of a preoperative combined 99m Tc-pertechnetate/99m Tc-MIBI and ultrasound imaging protocol. European journal of nuclear medicine, 2000. 27(9): p. 1300-1304.
Wakamatsu, H., et al., Parathyroid scintigraphy with 99mTc-MIBI and 123I subtraction: a comparison with magnetic resonance imaging and ultrasonography. Nuclear medicine communications, 2003. 24(7): p. 755-762.
Kluijfhout, W.P., et al., Use of PET tracers for parathyroid localization: a systematic review and meta-analysis. Langenbeck's archives of surgery, 2016. 401(7): p. 925-935.
Ruf, J., et al., Preoperative localization of parathyroid glands. Nuklearmedizin, 2004. 43(03): p. 85-90.
Hunter, G.J., et al., Accuracy of four-dimensional CT for the localization of abnormal parathyroid glands in patients with primary hyperparathyroidism. (1527-1315 (Electronic)).
Lubitz, C.C., et al., Accuracy of 4-dimensional computed tomography in poorly localized patients with primary hyperparathyroidism. Surgery, 2010. 148(6): p. 1129-37; discussion 1137-8.
Starker, L.F., et al., 4D parathyroid CT as the initial localization study for patients with de novo primary hyperparathyroidism. Ann Surg Oncol, 2011. 18(6): p. 1723-8.
Harari, A., et al., Computed tomography can guide focused exploration in select patients with primary hyperparathyroidism and negative sestamibi scanning. Surgery, 2008. 144(6): p. 970-6; discussion 976-9.
Beggs, A.D. and S.F. Hain, Localization of parathyroid adenomas using 11C-methionine positron emission tomography. Nucl Med Commun, 2005. 26(2): p. 133-6.
Treglia, G., et al., Diagnostic performance of choline PET for detection of hyperfunctioning parathyroid glands in hyperparathyroidism: a systematic review and meta-analysis. Eur J Nucl Med Mol Imaging, 2019. 46(3): p. 751-765.
Erbil, Y., et al., Value of parathyroid hormone assay for preoperative sonographically guided parathyroid aspirates for minimally invasive parathyroidectomy. Journal of Clinical Ultrasound, 2006. 34(9): p. 425-429.
Barczynski, M., et al., Technetium‐99m‐sestamibi subtraction scintigraphy vs. ultrasonography combined with a rapid parathyroid hormone assay in parathyroid aspirates in preoperative localization of parathyroid adenomas and in directing surgical approach. Clinical endocrinology, 2006. 65(1): p. 106-113.
Giusti, M., et al., Institutional experience of PTH evaluation on fine-needle washing after aspiration biopsy to locate hyperfunctioning parathyroid tissue. Journal of Zhejiang University SCIENCE B, 2009. 10(5): p. 323-330.
Abdelghani R, Noureldine S, Abbas A, Moroz K, Kandil E. The diagnostic value of parathyroid hormone washout after fine-needle aspiration of suspicious cervical lesions in patients with hyperparathyroidism. Laryngoscope. 2013 May;123(5):1310-3. doi: 10.1002/lary.23863. Epub 2013 Apr 2.
Marshall, D., O. Johnell, and H. Wedel, Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Bmj, 1996. 312(7041): p. 1254-1259.
Marcocci, C., L. Cianferotti, and F. Cetani, Bone disease in primary hyperparathyrodism. Therapeutic advances in musculoskeletal disease, 2012. 4(5): p. 357-368.
Wood, K., et al., What is the utility of distal forearm DXA in primary hyperparathyroidism? The oncologist, 2012. 17(3): p. 322.
Bandeira, F., et al., Bone disease in primary hyperparathyroidism. Arquivos Brasileiros de Endocrinologia & Metabologia, 2014. 58(5): p. 553-561.
Briot, K., et al., Accuracy of patient-reported height loss and risk factors for height loss among postmenopausal women. Cmaj, 2010. 182(6): p. 558-562.
Abdelhadi, M. and J.r. Nordenström, Bone mineral recovery after parathyroidectomy in patients with primary and renal hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 1998. 83(11): p. 3845-3851.
PARISIEN, M., et al., The histomorphometry of bone in primary hyperparathyroidism: preservation of cancellous bone structure. The Journal of Clinical Endocrinology & Metabolism, 1990. 70(4): p. 930-938.
Hansen, S., et al., Effects on bone geometry, density, and microarchitecture in the distal radius but not the tibia in women with primary hyperparathyroidism: A case‐control study using HR‐pQCT. Journal of Bone and Mineral Research, 2010. 25(9): p. 1941-1947.
Stein, E.M., et al., Primary hyperparathyroidism is associated with abnormal cortical and trabecular microstructure and reduced bone stiffness in postmenopausal women. Journal of Bone and Mineral Research, 2013. 28(5): p. 1029-1040.
Romagnoli, E., et al., “Trabecular Bone Score”(TBS): an indirect measure of bone micro-architecture in postmenopausal patients with primary hyperparathyroidism. Bone, 2013. 53(1): p. 154-159.
Silva, B.C., et al., Trabecular bone score (TBS)—a novel method to evaluate bone microarchitectural texture in patients with primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2013. 98(5): p. 1963-1970.
Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of Bone and Mineral Research, 1999. 14(10): p. 1700-1707.
Vignali, E., et al., Morphometric vertebral fractures in postmenopausal women with primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2009. 94(7): p. 2306-2312.
Kulak, C.A.M., et al., Marked improvement in bone mass after parathyroidectomy in osteitis fibrosa cystica. The Journal of Clinical Endocrinology & Metabolism, 1998. 83(3): p. 732-735.
Hansen, S., et al., Parathyroidectomy improves bone geometry and microarchitecture in female patients with primary hyperparathyroidism: A one‐year prospective controlled study using high‐resolution peripheral quantitative computed tomography. Journal of Bone and Mineral Research, 2012. 27(5): p. 1150-1158.
Eller-Vainicher, C., et al., Bone quality, as measured by trabecular bone score, in patients with primary hyperparathyroidism. European journal of endocrinology, 2013. 169(2): p. 155-162.
Starup-Linde, J., et al., Renal stones and calcifications in patients with primary hyperparathyroidism: associations with biochemical variables. European Journal of Endocrinology, 2012. 166(6): p. 1093-1100.
Odvina, C.V., et al., Biochemical characterization of primary hyperparathyroidism with and without kidney stones. Urological research, 2007. 35(3): p. 123-128.
Corbetta, S., et al., Risk factors associated to kidney stones in primary hyperparathyroidism. Journal of endocrinological investigation, 2005. 28(4): p. 122-128.
Rejnmark, L., P. Vestergaard, and L. Mosekilde, Nephrolithiasis and renal calcifications in primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2011. 96(8): p. 2377-2385.
Bouzidi, H., D. de Brauwere, and M. Daudon, Does urinary stone composition and morphology help for prediction of primary hyperparathyroidism? Nephrology Dialysis Transplantation, 2010. 26(2): p. 565-572.
Mallette, L., et al., Primary hyperparathyroidism: clinical and biochemical features. Medicine, 1974. 53(2): p. 127-146.
Bai, H.X., et al., The association of primary hyperparathyroidism with pancreatitis. Journal of clinical gastroenterology, 2012. 46(8): p. 656.
Procopio, M., et al., Cardiovascular risk and metabolic syndrome in primary hyperparathyroidism and their correlation to different clinical forms. Endocrine, 2014. 47(2): p. 581-589.
Горбачева, А.М., et al., Структура метаболических нарушений и сердечно-сосудистых заболеваний у пациентов с первичным гиперпаратиреозом: одноцентровое ретроспективное обсервационное исследование. Профилактическая медицина, 2022. 25(8): p. 54‑66.
Бибик, Е.Е., et al., Изменения метаболических параметров у пациентов с первичным гиперпаратиреозом различных возрастных групп. Ожирение и метаболизм, 2022. 19(3).
Добрева, Е.А., et al., Кардиоваскулярные нарушения у пациентов с первичным гиперпаратиреозом по данным регистра. Профилактическая медицина, 2020. 23: p. 13-22.
Tassone, F., et al., Prevalence and characteristics of metabolic syndrome in primary hyperparathyroidism. J Endocrinol Invest, 2012. 35(9): p. 841-6.
Han, D., S. Trooskin, and X. Wang, Prevalence of cardiovascular risk factors in male and female patients with primary hyperparathyroidism. J Endocrinol Invest, 2012. 35(6): p. 548-52.
Yavari, M., et al., The influence of parathyroidectomy on cardiometabolic risk factors in patients with primary hyperparathyroidism: a systematic review and meta-analysis. Endocrine, 2021. 72(1): p. 72-85.
Walker, M.D. and S.J. Silverberg, Cardiovascular aspects of primary hyperparathyroidism. Journal of Endocrinological Investigation, 2008. 31(10): p. 925-931.
Vestergaard, P., et al., Cardiovascular Events before and after Surgery for Primary Hyperparathyroidism. World Journal of Surgery, 2003. 27(2): p. 216-222.
Clifton-Bligh, P.B., et al., Mortality associated with primary hyperparathyroidism. Bone, 2015. 74: p. 121-124.
Bolland, M.J., et al., Association between Primary Hyperparathyroidism and Increased Body Weight: A Meta-Analysis. The Journal of Clinical Endocrinology & Metabolism, 2005. 90(3): p. 1525-1530.
Frey, S., et al., Impact of parathyroidectomy on cardiovascular risk in primary hyperparathyroidism: A narrative review. Nutr Metab Cardiovasc Dis, 2021. 31(4): p. 981-996.
Kouvaraki, M.A., et al., Indications for operative intervention in patients with asymptomatic primary hyperparathyroidism: practice patterns of endocrine surgery. Surgery, 2006. 139(4): p. 527-534.
Vestergaard, P. and L. Mosekilde, Fractures in patients with primary hyperparathyroidism: nationwide follow-up study of 1201 patients. World J Surg, 2003. 27(3): p. 343-9.
Tassone, F., et al., Parathyroidectomy halts the deterioration of renal function in primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(8): p. 3069-3073.
Rose, D.M., et al., Long-term management and outcome of parathyroidectomy for sporadic primary multiple-gland disease. Archives of Surgery, 2001. 136(6): p. 621-626.
Sivula, A. and R. Pelkonen, Long-term health risk of primary hyperparathyroidism: the effect of surgery. Annals of medicine, 1996. 28(2): p. 95-100.
Norenstedt, S., et al., Primary hyperparathyroidism and metabolic risk factors; impact of parathyroidectomy and vitamin D supplementation; results of a randomized double-blind study. European journal of endocrinology, 2013: p. EJE-13-0547.
Shah, V., et al., Influence of age and gender on presentation of symptomatic primary hyperparathyroidism. Journal of postgraduate medicine, 2012. 58(2): p. 107.
Silverberg, S.J., I. Brown, and J.P. Bilezikian, Age as a criterion for surgery in primary hyperparathyroidism. The American journal of medicine, 2002. 113(8): p. 681-681.
VanderWalde, L.H., I.-L.A. Liu, and P.I. Haigh, Effect of bone mineral density and parathyroidectomy on fracture risk in primary hyperparathyroidism. World journal of surgery, 2009. 33(3): p. 406-411.
Fang, W.L., et al., The management of high‐risk patients with primary hyperparathyroidism–minimally invasive parathyroidectomy vs. medical treatment. Clinical endocrinology, 2008. 68(4): p. 520-528.
Rao, D.S., et al., Randomized controlled clinical trial of surgery versus no surgery in patients with mild asymptomatic primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2004. 89(11): p. 5415-5422.
Vestergaard, P., et al., Cohort study of risk of fracture before and after surgery for primary hyperparathyroidism. Bmj, 2000. 321(7261): p. 598-602.
Bollerslev, J., et al., Medical observation, compared with parathyroidectomy, for asymptomatic primary hyperparathyroidism: a prospective, randomized trial. The Journal of Clinical Endocrinology & Metabolism, 2007. 92(5): p. 1687-1692.
Roschger, P., et al., New observations on bone quality in mild primary hyperparathyroidism as determined by quantitative backscattered electron imaging. Journal of Bone and Mineral Research, 2007. 22(5): p. 717-723.
Ambrogini, E., et al., Surgery or surveillance for mild asymptomatic primary hyperparathyroidism: a prospective, randomized clinical trial. The Journal of Clinical Endocrinology & Metabolism, 2007. 92(8): p. 3114-3121.
Lundstam, K., et al., Effect of Surgery Versus Observation: Skeletal 5‐Year Outcomes in a Randomized Trial of Patients With Primary HPT (the SIPH Study). Journal of Bone and Mineral Research, 2017. 32(9): p. 1907-1914.
Vestergaard, P. and L. Mosekilde, Parathyroid surgery is associated with a decreased risk of hip and upper arm fractures in primary hyperparathyroidism: a controlled cohort study. Journal of internal medicine, 2004. 255(1): p. 108-114.
Peacock, M., Primary hyperparathyroidism and the kidney: biochemical and clinical spectrum. Journal of bone and mineral research: the official journal of the American Society for Bone and Mineral Research, 2002. 17: p. N87-94.
Salahudeen, A., et al., Hypertension and renal dysfunction in primary hyperparathyroidism: effect of parathyroidectomy. Clinical Science, 1989. 76(3): p. 289-296.
Mollerup, C.L., et al., Risk of renal stone events in primary hyperparathyroidism before and after parathyroid surgery: controlled retrospective follow up study. Bmj, 2002. 325(7368): p. 807.
Deaconson, T.F., S.D. Wilson, and L. Jacob, The effect of parathyroidectomy on the recurrence of nephrolithiasis. Surgery, 1987. 102(6): p. 910-913.
Hedbäck, G., K. Abrahamsson, and A. Oden, The improvement of renal concentration capacity after surgery for primary hyperparathyroidism. European journal of clinical investigation, 2001. 31(12): p. 1048-1053.
Sejean, K., et al., Surgery versus medical follow-up in patients with asymptomatic primary hyperparathyroidism: a decision analysis. European journal of endocrinology, 2005. 153(6): p. 915-927.
Zanocco, K., P. Angelos, and C. Sturgeon, Cost-effectiveness analysis of parathyroidectomy for asymptomatic primary hyperparathyroidism. Surgery, 2006. 140(6): p. 874-882.
Zanocco, K. and C. Sturgeon, How should age at diagnosis impact treatment strategy in asymptomatic primary hyperparathyroidism? A cost-effectiveness analysis. Surgery, 2008. 144(2): p. 290-298.
Wilhelm, S.M., et al., The American Association of Endocrine Surgeons guidelines for definitive management of primary hyperparathyroidism. JAMA surgery, 2016. 151(10): p. 959-968.
Udelsman, R., et al., The surgical management of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. The Journal of Clinical Endocrinology & Metabolism, 2014. 99(10): p. 3595-3606.
Mittendorf, E., et al., Improvement of sleep disturbance and neurocognitive function after parathyroidectomy in patients with primary hyperparathyroidism. Endocrine Practice, 2007. 13(4): p. 338-344.
Pashtan, I., et al., Primary hyperparathyroidism in adolescents: the same but different. Pediatric surgery international, 2013. 29(3): p. 275-279.
Paunovic, I., et al., Primary Hyperparathyroidism in Children and Young Adults:-A Single Institution Experience. Acta chirurgica Belgica, 2013. 113(1): p. 35-39.
Mack, L.A. and J.L. Pasieka, Asymptomatic primary hyperparathyroidism: a surgical perspective. The Surgical clinics of North America, 2004. 84(3): p. 803-816.
Almqvist, E.G., et al., Early parathyroidectomy increases bone mineral density in patients with mild primary hyperparathyroidism: a prospective and randomized study. Surgery, 2004. 136(6): p. 1281-1288.
Schillaci, G., et al., Large-artery stiffness: a reversible marker of cardiovascular risk in primary hyperparathyroidism. Atherosclerosis, 2011. 218(1): p. 96-101.
Silverberg, S.J., et al., Current Issues in the Presentation of Asymptomatic Primary Hyperparathyroidism: Proceedings of the Fourth International Workshop. The Journal of Clinical Endocrinology & Metabolism, 2014. 99(10): p. 3580-3594.
Stewart, Z.A., et al., 25-hydroxyvitamin D deficiency is a risk factor for symptoms of postoperative hypocalcemia and secondary hyperparathyroidism after minimally invasive parathyroidectomy. Surgery, 2005. 138(6): p. 1018-1026.
Udelsman, R., Z. Lin, and P. Donovan, The superiority of minimally invasive parathyroidectomy based on 1650 consecutive patients with primary hyperparathyroidism. Annals of surgery, 2011. 253(3): p. 585-591.
Venkat, R., et al., Long-term outcome in patients with primary hyperparathyroidism who underwent minimally invasive parathyroidectomy. World journal of surgery, 2012. 36(1): p. 55-60.
Suliburk, J.W., et al., 1000 minimally invasive parathyroidectomies without intra‐operative parathyroid hormone measurement: lessons learned. ANZ journal of surgery, 2011. 81(5): p. 362-365.
Aspinall, S.R., S. Boase, and P. Malycha, Long-term symptom relief from primary hyperparathyroidism following minimally invasive parathyroidectomy. World journal of surgery, 2010. 34(9): p. 2223-2227.
Lombardi, C.P., et al., Video-assisted minimally invasive parathyroidectomy: benefits and long-term results. World journal of surgery, 2009. 33(11): p. 2266.
Wilhelm, S.M., et al., The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperparathyroidism. JAMA Surgery, 2016. 151(10): p. 959-968.
McCoy, K.L., et al., The Small Abnormal Parathyroid Gland is Increasingly Common and Heralds Operative Complexity. World Journal of Surgery, 2014. 38(6): p. 1274-1281.
Miccoli, P., et al., Minimally invasive, video-assisted parathyroid surgery for primary hyperparathyroidism. Journal of endocrinological investigation, 1997. 20(7): p. 429-430.
Garimella, V., et al., Minimally invasive video-assisted parathyroidectomy is a safe procedure to treat primary hyperparathyroidism. the surgeon, 2012. 10(4): p. 202-205.
Allendorf, J., et al., 1112 consecutive bilateral neck explorations for primary hyperparathyroidism. World journal of surgery, 2007. 31(11): p. 2075-2080.
Abdulla, A.G., et al., Trends in the frequency and quality of parathyroid surgery: analysis of 17,082 cases over 10 years. Annals of surgery, 2015. 261(4): p. 746-750.
Lumachi, F., et al., Advantages of combined technetium-99m-sestamibi scintigraphy and high-resolution ultrasonography in parathyroid localization: comparative study in 91 patients with primary hyperparathyroidism. European journal of endocrinology, 2000. 143(6): p. 755-760.
Purcell, G.P., et al., Parathyroid localization with high-resolution ultrasound and technetium Tc 99m sestamibi. Archives of Surgery, 1999. 134(8): p. 824-830.
Casara, D., et al., 99mTc-MIBI radio-guided minimally invasive parathyroidectomy: experience with patients with normal thyroids and nodular goiters. Thyroid, 2002. 12(1): p. 53-61.
Irvin, G.L., V.D. Dembrow, and D.L. Prudhomme, Operative monitoring of parathyroid gland hyperfunction. The American journal of surgery, 1991. 162(4): p. 299-302.
Irvin III, G.L., D.M. Carneiro, and C.C. Solorzano, Progress in the operative management of sporadic primary hyperparathyroidism over 34 years. Annals of surgery, 2004. 239(5): p. 704.
Woodrum, D.T., et al., The influence of sample site on intraoperative PTH monitoring during parathyroidectomy. Surgery, 2004. 136(6): p. 1169-1175.
Кузнецов, Н., И. Ким, and С. Кузнецов, Интраоперационное определение паратгормона в стратегии хирургического лечения первичного гиперпаратиреоза. Эндокринная хирургия, 2011(2).
Barczynski, M., et al., Evaluation of Halle, Miami, Rome, and Vienna intraoperative iPTH assay criteria in guiding minimally invasive parathyroidectomy. Langenbeck's archives of surgery, 2009. 394(5): p. 843-849.
Alesina, P.F., et al., Feasibility of video-assisted bilateral neck exploration for patients with primary hyperparathyroidism and failed or discordant localization studies. Langenbeck's archives of surgery, 2013. 398(1): p. 107-111.
McGill, J., et al., How does the operative strategy for primary hyperparathyroidism impact the findings and cure rate? A comparison of 800 parathyroidectomies. Journal of the American College of Surgeons, 2008. 207(2): p. 246-249.
Järhult, J., et al., Long‐term results of surgery for lithium‐associated hyperparathyroidism. British Journal of Surgery, 2010. 97(11): p. 1680-1685.
Marti, J.L., et al., Surgical approach and outcomes in patients with lithium-associated hyperparathyroidism. Annals of surgical oncology, 2012. 19(11): p. 3465-3471.
Thakker, R.V., et al., Clinical Practice Guidelines for Multiple Endocrine Neoplasia Type 1 (MEN1). The Journal of Clinical Endocrinology & Metabolism, 2012. 97(9): p. 2990-3011.
Sandelin, K., et al., Prognostic factors in parathyroid cancer: a review of 95 cases. World journal of surgery, 1992. 16(4): p. 724-731.
Schulte, K.-M. and N. Talat, Diagnosis and management of parathyroid cancer. Nature Reviews Endocrinology, 2012. 8(10): p. 612.
Hundahl, S.A., et al., Two hundred eighty‐six cases of parathyroid carcinoma treated in the US between 1985–1995: a National Cancer Data Base Report. Cancer, 1999. 86(3): p. 538-544.
Miura, D., et al., Does intraoperative quick parathyroid hormone assay improve the results of parathyroidectomy? World journal of surgery, 2002. 26(8): p. 926-930.
Libutti, S.K., et al., Kinetic analysis of the rapid intraoperative parathyroid hormone assay in patients during operation for hyperparathyroidism. Surgery, 1999. 126(6): p. 1145-1151.
Richards, M.L., et al., An optimal algorithm for intraoperative parathyroid hormone monitoring. Archives of Surgery, 2011. 146(3): p. 280-285.
Gawande, A.A., et al., Reassessment of parathyroid hormone monitoring during parathyroidectomy for primary hyperparathyroidism after 2 preoperative localization studies. Archives of Surgery, 2006. 141(4): p. 381-384.
Kald, B., et al., Risk assessment for severe postoperative hypocalcaemia after neck exploration for primary hyperparathyroidism. Scandinavian journal of surgery, 2005. 94(3): p. 216-220.
Mittendorf, E.A., J.I. Merlino, and C.R. McHenry, Post-Parathyroidectomy Hypocalcemia: Incidence, Risk Factors, and Management/DISCUSSION. The American surgeon, 2004. 70(2): p. 114.
Strickland, P.L. and J. Recabaren, Are preoperative serum calcium, parathyroid hormone, and adenoma weight predictive of postoperative hypocalcemia? The American surgeon, 2002. 68(12): p. 1080.
Bergenfelz, A., et al., Unilateral versus bilateral neck exploration for primary hyperparathyroidism: a prospective randomized controlled trial. Annals of surgery, 2002. 236(5): p. 543.
Roman, S.A., et al., The effects of serum calcium and parathyroid hormone changes on psychological and cognitive function in patients undergoing parathyroidectomy for primary hyperparathyroidism. Annals of surgery, 2011. 253(1): p. 131-137.
Sperlongano, P., et al., Postoperative hypocalcemia: assessment timing. International Journal of Surgery, 2014. 12: p. S95-S97.
Sinha, S. and D.K. Baskota, Comparison of corrected serum calcium changes following thyroid and non thyroid neck surgeries. Nepalese Journal of ENT Head and Neck Surgery, 2015. 6(1): p. 1-4.
Bergenfelz, A., et al., Conventional bilateral cervical exploration versus open minimally invasive parathyroidectomy under local anaesthesia for primary hyperparathyroidism. British Journal of Surgery: Incorporating European Journal of Surgery and Swiss Surgery, 2005. 92(2): p. 190-197.
Witteveen, J.E., et al., Hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. Eur J Endocrinol, 2013. 168(3): p. R45-53.
Mitchell, D.M., et al., Long-term follow-up of patients with hypoparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2012. 97(12): p. 4507-4514.
Puzziello, A., et al., Hypocalcemia following thyroid surgery: incidence and risk factors. A longitudinal multicenter study comprising 2,631 patients. Endocrine, 2014. 47(2): p. 537-542.
Khan, M., S. Waguespack, and M. Hu, Medical management of postsurgical hypoparathyroidism. Endocrine Practice, 2010. 17(Supplement 1): p. 18-25.
Yu, N., et al., The natural history of treated and untreated primary hyperparathyroidism: the parathyroid epidemiology and audit research study. QJM: An International Journal of Medicine, 2011. 104(6): p. 513-521.
Cassibba, S., et al., Silent renal stones in primary hyperparathyroidism: prevalence and clinical features. Endocrine Practice, 2014. 20(11): p. 1137-1142.
Majid, H., et al., IDENTIFYING PARATHYROID HORMONE DISORDERS AND THEIR PHENOTYPES THROUGH A BONE HEALTH SCREENING PANEL: IT'S NOT SIMPLE VITAMIN D DEFICIENCY! Endocrine Practice, 2016. 22(7): p. 814-821.
Ross, A.C., The 2011 report on dietary reference intakes for calcium and vitamin D. Public health nutrition, 2011. 14(5): p. 938-939.
Locker, F.G., S.J. Silverberg, and J.P. Bilezikian, Optimal dietary calcium intake in primary hyperparathyroidism. The American journal of medicine, 1997. 102(6): p. 543-550.
Jorde, R., et al., The effects of calcium supplementation to patients with primary hyperparathyroidism and a low calcium intake. European journal of nutrition, 2002. 41(6): p. 258-263.
Riss, P., et al., The influence of thiazide intake on calcium and parathyroid hormone levels in patients with primary hyperparathyroidism. Clinical endocrinology, 2016. 85(2): p. 196-201.
Tsvetov, G., et al., Thiazide treatment in primary hyperparathyroidism—a new indication for an old medication? The Journal of Clinical Endocrinology & Metabolism, 2016. 102(4): p. 1270-1276.
Nawrot, I., et al., Reoperations for persistent or recurrent primary hyperparathyroidism: results of a retrospective cohort study at a tertiary referral center. Medical science monitor: international medical journal of experimental and clinical research, 2014. 20: p. 1604.
Udelsman, R., Approach to the patient with persistent or recurrent primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2011. 96(10): p. 2950-2958.
Akerstrom, G., Current controversy in parathyroid operation and reoperation. Parathyroid pathology, 1994: p. 23-41.
McDow, A.D. and R.S. Sippel, Should Symptoms Be Considered an Indication for Parathyroidectomy in Primary Hyperparathyroidism? Clinical Medicine Insights: Endocrinology and Diabetes, 2018. 11: p. 1179551418785135.
Marcocci, C., et al., Medical management of primary hyperparathyroidism: proceedings of the fourth International Workshop on the Management of Asymptomatic Primary Hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2014. 99(10): p. 3607-3618.
Sankaran, S., et al., Skeletal effects of interventions in mild primary hyperparathyroidism: a meta-analysis. The Journal of Clinical Endocrinology & Metabolism, 2010. 95(4): p. 1653-1662.
Khan, A., et al., Cinacalcet normalizes serum calcium in a double-blind randomized, placebo-controlled study in patients with primary hyperparathyroidism with contraindications to surgery. Eur J Endocrinol, 2015. 172(5): p. 527-35.
Leere, J.S., et al., Denosumab and cinacalcet for primary hyperparathyroidism (DENOCINA): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Diabetes & Endocrinology, 2020. 8(5): p. 407-417.
Palermo, A., R. Cesareo, E. Di Stasio, F. Vescini, G. Campagna, R. Cianni, V. Pasqualini, F. Romitelli, F. Grimaldi, S. Manfrini &. Osteoporos Int, 2015. 26: p. 1295-1302.
Drake, M.T., B.L. Clarke, and S. Khosla. Bisphosphonates: mechanism of action and role in clinical practice. in Mayo Clinic Proceedings. 2008. Elsevier.
Segula, D., et al., Long term outcome of bisphosphonate therapy in patients with primary hyperparathyroidism. International Journal of Clinical Medicine, 2014. 5(14): p. 829.
Yeh, M.W., et al., The relationship of parathyroidectomy and bisphosphonates with fracture risk in primary hyperparathyroidism: an observational study. Annals of internal medicine, 2016. 164(11): p. 715-723.
Vera, L., et al., Five-year longitudinal evaluation of mild primary hyperparathyroidism—medical treatment versus clinical observation. Endokrynologia Polska, 2014. 65(6): p. 456-463.
Rossini, M., et al., Effects of oral alendronate in elderly patients with osteoporosis and mild primary hyperparathyroidism. Journal of Bone and Mineral Research, 2001. 16(1): p. 113-119.
Parker, C., et al., Alendronate in the treatment of primary hyperparathyroid-related osteoporosis: a 2-year study. The Journal of Clinical Endocrinology & Metabolism, 2002. 87(10): p. 4482-4489.
Chow, C., et al., Oral alendronate increases bone mineral density in postmenopausal women with primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2003. 88(2): p. 581-587.
Khan, A.A., et al., Alendronate in primary hyperparathyroidism: a double-blind, randomized, placebo-controlled trial. The Journal of Clinical Endocrinology & Metabolism, 2004. 89(7): p. 3319-3325.
Khan, A., et al., Alendronate therapy in men with primary hyperparathyroidism. Endocrine Practice, 2009. 15(7): p. 705-713.
Grigorie, D. and A. Sucaliuc, A SINGLE-DOSE, OPEN-LABEL, PROSPECTIVE CLINICAL STUDY OF DENOSUMAB IN PATIENTS WITH PRIMARY HYPERPARATHYROIDISM. Acta Endocrinologica (1841-0987), 2014. 10(3).
Eller‐Vainicher, C., et al., Protective Effect of Denosumab on Bone in Older Women with Primary Hyperparathyroidism. Journal of the American Geriatrics Society, 2018. 66(3): p. 518-524.
Shalaby, T., et al., The Use of Denosumab in a Nonagenarian with Primary Hyperparathyroidism. European endocrinology, 2014. 10(2): p. 151.
Rozhinskaya, L.Y., et al., Denosumab treatment in patients with different courses of osteoporosis. Osteoporosis and Bone Diseases, 2017. 20(2): p. 58-62.
Tong, C., et al., Use of denosumab in parathyroid carcinoma with refractory hypercalcemia. QJM, 2015. 108(1): p. 49-50.
Fountas, A., et al., The emerging role of denosumab in the long-term management of parathyroid carcinoma-related refractory hypercalcemia. Endocrine Practice, 2015. 21(5): p. 468-473.
Mandema, J.W., et al., Time Course of Bone Mineral Density Changes With Denosumab Compared With Other Drugs in Postmenopausal Osteoporosis: A Dose-Response–Based Meta-Analysis. The Journal of Clinical Endocrinology & Metabolism, 2014. 99(10): p. 3746-3755.
Peacock, M., et al., Cinacalcet treatment of primary hyperparathyroidism: biochemical and bone densitometric outcomes in a five-year study. The Journal of Clinical Endocrinology & Metabolism, 2009. 94(12): p. 4860-4867.
Faggiano, A., et al., Cinacalcet hydrochloride in combination with alendronate normalizes hypercalcemia and improves bone mineral density in patients with primary hyperparathyroidism. Endocrine, 2011. 39(3): p. 283-287.
Sajid-Crockett, S., F.R. Singer, and J.M. Hershman, Cinacalcet for the treatment of primary hyperparathyroidism. Metabolism, 2008. 57(4): p. 517-521.
Iglesias, P., et al., Acute and one-year effects of cinacalcet in patients with persistent primary hyperparathyroidism after unsuccessful parathyroidectomy. The American journal of the medical sciences, 2008. 335(2): p. 111-114.
Martín, A.A., et al., Low-dose cinacalcet reduces serum calcium in patients with primary hyperparathyroidism not eligible for surgery. Endocrinología y Nutrición (English Edition), 2011. 58(1): p. 24-31.
Cetani, F., et al., Cinacalcet efficacy in patients with moderately severe primary hyperparathyroidism according to the European Medicine Agency prescription labeling. Journal of endocrinological investigation, 2012. 35(7): p. 655-660.
Filopanti, M., et al., MEN1-related hyperparathyroidism: response to cinacalcet and its relationship with the calcium-sensing receptor gene variant Arg990Gly. European journal of endocrinology, 2012. 167(2): p. 157-164.
Luque-Fernández, I., A. García-Martín, and A. Luque-Pazos, Experience with cinacalcet in primary hyperparathyroidism: results after 1 year of treatment. Therapeutic advances in endocrinology and metabolism, 2013. 4(3): p. 77-81.
Saponaro, F., et al., Cinacalcet in the management of primary hyperparathyroidism: post marketing experience of an Italian multicentre group. Clinical endocrinology, 2013. 79(1): p. 20-26.
Shah, V.N., et al., Effect of 25 (OH) D replacements in patients with primary hyperparathyroidism (PHPT) and coexistent vitamin D deficiency on serum 25 (OH) D, calcium and PTH levels: a meta‐analysis and review of literature. Clinical endocrinology, 2014. 80(6): p. 797-803.
Norenstedt, S., et al., Vitamin D Supplementation After Parathyroidectomy: Effect on Bone Mineral Density—A Randomized Double‐Blind Study. Journal of Bone and Mineral Research, 2014. 29(4): p. 960-967.
Stein, E.M., et al., Vitamin D deficiency influences histomorphometric features of bone in primary hyperparathyroidism. Bone, 2011. 48(3): p. 557-561.
Holick, M.F., Resurrection of vitamin D deficiency and rickets. The Journal of clinical investigation, 2006. 116(8): p. 2062-2072.
Bischoff-Ferrari, H.A., et al., Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes–. The American journal of clinical nutrition, 2006. 84(1): p. 18-28.
Rolighed, L., et al., Vitamin D treatment in primary hyperparathyroidism: a randomized placebo controlled trial. J Clin Endocrinol Metab, 2014. 99(3): p. 1072-1080.
Westerdahl, J., et al., Risk factors for postoperative hypocalcemia after surgery for primary hyperparathyroidism. Archives of Surgery, 2000. 135(2): p. 142-147.
Carty, S.E., et al., Elevated serum parathormone level after “concise parathyroidectomy” for primary sporadic hyperparathyroidism. Surgery, 2002. 132(6): p. 1086-1093.
Carneiro, D.M. and G.L. Irvin III, Late parathyroid function after successful parathyroidectomy guided by intraoperative hormone assay (QPTH) compared with the standard bilateral neck exploration. Surgery, 2000. 128(6): p. 925-929.
Beyer, T.D., et al., Oral vitamin D supplementation reduces the incidence of eucalcemic PTH elevation after surgery for primary hyperparathyroidism. Surgery, 2007. 141(6): p. 777-783.
Kantorovich, V., et al., Bone mineral density increases with vitamin D repletion in patients with coexistent vitamin D insufficiency and primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2000. 85(10): p. 3541-3543.
Ahmad, S., G. Kuraganti, and D. Steenkamp, Hypercalcemic crisis: a clinical review. The American journal of medicine, 2015. 128(3): p. 239-245.
Schweitzer, V.G., et al., Management of severe hypercalcemia caused by primary hyperparathyroidism. Archives of surgery (Chicago, Ill.: 1960), 1978. 113(4): p. 373-381.
Cannon, J., J.I. Lew, and C.C. Solórzano, Parathyroidectomy for hypercalcemic crisis: 40 years' experience and long-term outcomes. Surgery, 2010. 148(4): p. 807-813.
Phitayakorn, R. and C.R. McHenry, Hyperparathyroid crisis: use of bisphosphonates as a bridge to parathyroidectomy. Journal of the American College of Surgeons, 2008. 206(6): p. 1106-1115.
Starker, L.F., et al., Clinical and histopathological characteristics of hyperparathyroidism-induced hypercalcemic crisis. World journal of surgery, 2011. 35(2): p. 331-335.
Beck, W., J.I. Lew, and C.C. Solórzano, Hypercalcemic crisis in the era of targeted parathyroidectomy. Journal of Surgical Research, 2011. 171(2): p. 404-408.
Bilezikian, J.P., Management of acute hypercalcemia. New England Journal of Medicine, 1992. 326(18): p. 1196-1203.
Gurrado, A., et al., Hypercalcaemic crisis due to primary hyperparathyroidism—a systematic literature review and case report. Endokrynologia Polska, 2012. 63(6): p. 494-502.
NAKAOKA, D., et al., Evaluation of changes in bone density and biochemical parameters after parathyroidectomy in primary hyperparathyroidism. Endocrine journal, 2000. 47(3): p. 231-237.
Nordenström, E., J. Westerdahl, and A. Bergenfelz, Recovery of bone mineral density in 126 patients after surgery for primary hyperparathyroidism. World journal of surgery, 2004. 28(5): p. 502-507.
Brandi, M.L., et al., Consensus: guidelines for diagnosis and therapy of MEN type 1 and type 2. The Journal of Clinical Endocrinology & Metabolism, 2001. 86(12): p. 5658-5671.
Lassen, T., et al., Primary hyperparathyroidism in young people. When should we perform genetic testing for multiple endocrine neoplasia 1 (MEN-1)? The Journal of Clinical Endocrinology & Metabolism, 2014. 99(11): p. 3983-3987.
Giusti, F., et al., Multiple endocrine neoplasia syndrome type 1: institution, management, and data analysis of a nationwide multicenter patient database. Endocrine, 2017. 58(2): p. 349-359.
Sakurai, A., et al., Multiple endocrine neoplasia type 1 in Japan: establishment and analysis of a multicentre database. Clinical endocrinology, 2012. 76(4): p. 533-539.
Manoharan, J., et al., Is routine screening of young asymptomatic MEN1 patients necessary? World journal of surgery, 2017. 41(8): p. 2026-2032.
Goudet, P., et al., Risk factors and causes of death in MEN1 disease. A GTE (Groupe d’Etude des Tumeurs Endocrines) cohort study among 758 patients. World journal of surgery, 2010. 34(2): p. 249-255.
Trouillas, J., et al., Pituitary tumors and hyperplasia in multiple endocrine neoplasia type 1 syndrome (MEN1): a case-control study in a series of 77 patients versus 2509 non-MEN1 patients. The American journal of surgical pathology, 2008. 32(4): p. 534-543.
Gibril, F., et al., Prospective study of the natural history of gastrinoma in patients with MEN1: definition of an aggressive and a nonaggressive form. The Journal of Clinical Endocrinology & Metabolism, 2001. 86(11): p. 5282-5293.
Ito, T., et al., Causes of death and prognostic factors in multiple endocrine neoplasia type 1: a prospective study: comparison of 106 MEN1/Zollinger-Ellison syndrome patients with 1613 literature MEN1 patients with or without pancreatic endocrine tumors. Medicine, 2013. 92(3): p. 135.
Eller‐Vainicher, C., et al., Sporadic and MEN1‐related primary hyperparathyroidism: differences in clinical expression and severity. Journal of Bone and Mineral Research, 2009. 24(8): p. 1404-1410.
Hosking, S.W., et al., Surgery for parathyroid adenoma and hyperplasia: relationship of histology to outcome. Head & neck, 1993. 15(1): p. 24-28.
Machens, A., et al., Age‐related penetrance of endocrine tumours in multiple endocrine neoplasia type 1 (MEN1): a multicentre study of 258 gene carriers. Clinical endocrinology, 2007. 67(4): p. 613-622.
Schaaf, L., et al., Developing effective screening strategies in multiple endocrine neoplasia type 1 (MEN 1) on the basis of clinical and sequencing data of German patients with MEN 1. Experimental and clinical endocrinology & diabetes, 2007. 115(08): p. 509-517.
Carling, T. and R. Udelsman, Parathyroid surgery in familial hyperparathyroid disorders. Journal of internal medicine, 2005. 257(1): p. 27-37.
Ростомян, Л.Г., Синдром множественных эндокринных неоплазий 1 типа: распространенность среди пациентов с первичным гиперпаратиреозом, клинические и молекулярно-генетические характеристики. Дис.... кандидат медицинских наук. М, 2011.
Goudet, P., et al., MEN1 disease occurring before 21 years old: a 160-patient cohort study from the Groupe d'étude des Tumeurs Endocrines. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(4): p. 1568-1577.
Triponez, F., et al., Long-term follow-up of MEN1 patients who do not have initial surgery for small≤ 2 cm nonfunctioning pancreatic neuroendocrine tumors, an AFCE and GTE Study: Association Francophone de Chirurgie Endocrinienne & Groupe d’Etude des Tumeurs Endocrines. Annals of surgery, 2018. 268(1): p. 158.
de Laat, J.M., et al., Low accuracy of tumor markers for diagnosing pancreatic neuroendocrine tumors in multiple endocrine neoplasia type 1 patients. The Journal of Clinical Endocrinology & Metabolism, 2013. 98(10): p. 4143-4151.
Conemans, E.B., et al., Prognostic factors for survival of MEN1 patients with duodenopancreatic tumors metastatic to the liver: results from the DMSG. Endocrine Practice, 2017. 23(6): p. 641-648.
Tomassetti, P., et al., Endocrine pancreatic tumors: factors correlated with survival. Annals of Oncology, 2005. 16(11): p. 1806-1810.
Skandarajah, A., et al., Should routine analysis of the MEN1 gene be performed in all patients with primary hyperparathyroidism under 40 years of age? World journal of surgery, 2010. 34(6): p. 1294-1298.
Starker, L.F., et al., Frequent germ-line mutations of the MEN1, CASR, and HRPT2/CDC73 genes in young patients with clinically non-familial primary hyperparathyroidism. Hormones and Cancer, 2012. 3(1-2): p. 44-51.
Wit, D., V. Der Luijt, and P. van Amstel, Criteria for mutation analysis in MEN 1‐suspected patients: MEN 1 case‐finding. European journal of clinical investigation, 2000. 30(6): p. 487-492.
Cardinal, J., et al., A report of a national mutation testing service for the MEN1 gene: clinical presentations and implications for mutation testing. Journal of medical genetics, 2005. 42(1): p. 69-74.
Langer, P., et al., Prevalence of multiple endocrine neoplasia type 1 in young patients with apparently sporadic primary hyperparathyroidism or pancreaticoduodenal endocrine tumours. British journal of surgery, 2003. 90(12): p. 1599-1603.
Мамедова, Е.О., et al., Молекулярно-генетические особенности первичного гиперпаратиреоза у пациентов молодого возраста. Проблемы эндокринологии, 2016. 62(2).
Elaraj, D.M., et al., Results of initial operation for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2003. 134(6): p. 858-864.
Lairmore, T.C., et al., A randomized, prospective trial of operative treatments for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2014. 156(6): p. 1326-1335.
Pieterman, C.R., et al., Primary hyperparathyroidism in MEN1 patients: a cohort study with longterm follow-up on preferred surgical procedure and the relation with genotype. Annals of surgery, 2012. 255(6): p. 1171-1178.
Lambert, L.A., et al., Surgical treatment of hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Archives of Surgery, 2005. 140(4): p. 374-382.
Salmeron, M.D.B., et al., Causes and treatment of recurrent hyperparathyroidism after subtotal parathyroidectomy in the presence of multiple endocrine neoplasia 1. World journal of surgery, 2010. 34(6): p. 1325-1331.
Lairmore, T.C., et al., Clinical genetic testing and early surgical intervention in patients with multiple endocrine neoplasia type 1 (MEN 1). Annals of surgery, 2004. 239(5): p. 637.
Giusti, F., F. Tonelli, and M.L. Brandi, Primary hyperparathyroidism in multiple endocrine neoplasia type 1: when to perform surgery? Clinics, 2012. 67: p. 141-144.
Powell, A.C., et al., The utility of routine transcervical thymectomy for multiple endocrine neoplasia 1-related hyperparathyroidism. Surgery, 2008. 144(6): p. 878-884.
Ferolla, P., et al., Thymic neuroendocrine carcinoma (carcinoid) in multiple endocrine neoplasia type 1 syndrome: the Italian series. The Journal of Clinical Endocrinology & Metabolism, 2005. 90(5): p. 2603-2609.
Burgess, J.R., N. Giles, and J.J. Shepherd, Malignant thymic carcinoid is not prevented by transcervical thymectomy in multiple endocrine neoplasia type 1. Clinical endocrinology, 2001. 55(5): p. 689-693.
Gatta-Cherifi, B., et al., Adrenal involvement in MEN1. Analysis of 715 cases from the Groupe d'etude des Tumeurs Endocrines database. European journal of endocrinology, 2012. 166(2): p. 269-279.
Yip, L., et al., Multiple endocrine neoplasia type 2: evaluation of the genotype-phenotype relationship. Archives of Surgery, 2003. 138(4): p. 409-416.
Voss, R.K., et al., Medullary thyroid carcinoma in MEN2A: ATA moderate-or high-risk RET mutations do not predict disease aggressiveness. The Journal of Clinical Endocrinology & Metabolism, 2017. 102(8): p. 2807-2813.
Lairmore, T.C., et al., Management of pheochromocytomas in patients with multiple endocrine neoplasia type 2 syndromes. Annals of surgery, 1993. 217(6): p. 595.
Raue, F., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type 2A. Journal of internal medicine, 1995. 238(4): p. 369-373.
Scholten, A., et al., Evolution of surgical treatment of primary hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Endocrine practice, 2010. 17(1): p. 7-15.
Magalhães, P.K.R., et al., Primary hyperparathyroidism as the first clinical manifestation of multiple endocrine neoplasia type 2A in a 5-year-old child. Thyroid, 2011. 21(5): p. 547-550.
Keiser, H.R., et al., Sipple's syndrome: medullary thyroid carcinoma, pheochromocytoma, and parathyroid disease: studies in a large family. Annals of internal medicine, 1973. 78(4): p. 561-579.
Kraimps, J.L., et al., Hyperparathyroidism in multiple endocrine neoplasia syndrome. Surgery, 1992. 112(6): p. 1080-1088.
Herfarth, K.K.-F., et al., Surgical management of hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Surgery, 1996. 120(6): p. 966-974.
Kraimps, J.-L., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type IIa: retrospective French multicentric study. World journal of surgery, 1996. 20(7): p. 808-813.
Iacobone, M., et al., Hereditary hyperparathyroidism—a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbeck's archives of surgery, 2015. 400(8): p. 867-886.
Iacobone, M., et al., Hyperparathyroidism–jaw tumor syndrome: a report of three large kindred. Langenbeck's archives of surgery, 2009. 394(5): p. 817-825.
Jackson, C.E., et al., Hereditary hyperparathyroidism and multiple ossifying jaw fibromas: a clinically and genetically distinct syndrome. Surgery, 1990. 108(6): p. 1006-12; discussion 1012-3.
van der Tuin, K., et al., CDC73-related disorders: clinical manifestations and case detection in primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2017. 102(12): p. 4534-4540.
Pichardo-Lowden, A., et al., Familial hyperparathyroidism due to a germline mutation of the CDC73 gene: implications for management and age-appropriate testing of relatives at risk. Endocrine Practice, 2011. 17(4): p. 602-609.
Harman, C.R., et al., Sporadic primary hyperparathyroidism in young patients: a separate disease entity? Archives of surgery, 1999. 134(6): p. 651-656.
Lee, M. and N.S. Pellegata, Multiple endocrine neoplasia type 4, in Endocrine Tumor Syndromes and Their Genetics. 2013, Karger Publishers. p. 63-78.
Giusti, F., et al., Hereditary hyperparathyroidism syndromes. Journal of Clinical Densitometry, 2013. 16(1): p. 69-74.
Simonds, W.F., et al., Familial isolated hyperparathyroidism: clinical and genetic characteristics of 36 kindreds. Medicine, 2002. 81(1): p. 1-26.
Lee, P.K., et al., Trends in the incidence and treatment of parathyroid cancer in the United States. Cancer, 2007. 109(9): p. 1736-1741.
Cetani, F., E. Pardi, and C. Marcocci, Parathyroid carcinoma: a clinical and genetic perspective. Minerva endocrinologica, 2018. 43(2): p. 144-155.
Ryhänen, E.M., et al., A nationwide study on parathyroid carcinoma. Acta Oncologica, 2017. 56(7): p. 991-1003.
Мокрышева, Н.Г., Ю.А. Крупинова, and С.С. Мирная, Клинические и лабораторно-инструментальные возможности предоперационной диагностики рака околощитовидных желез. Эндокринная хирургия, 2017. 11(3).
Talat, N. and K.-M. Schulte, Clinical presentation, staging and long-term evolution of parathyroid cancer. Annals of surgical oncology, 2010. 17(8): p. 2156-2174.
Erovic, B.M., et al., Parathyroid cancer: outcome analysis of 16 patients treated at the Princess Margaret Hospital. Head & neck, 2013. 35(1): p. 35-39.
Shane, E., Parathyroid carcinoma. The Journal of Clinical Endocrinology & Metabolism, 2001. 86(2): p. 485-493.
Busaidy, N.L., et al., Parathyroid carcinoma: a 22‐year experience. Head & Neck: Journal for the Sciences and Specialties of the Head and Neck, 2004. 26(8): p. 716-726.
Wang, L., et al., Non-functional parathyroid carcinoma: a case report and review of the literature. Cancer biology & therapy, 2015. 16(11): p. 1569-1576.
Montenegro, F.L.d.M., et al., Clinical suspicion and parathyroid carcinoma management. Sao Paulo Medical Journal, 2006. 124(1): p. 42-44.
Villar-del-Moral, J., et al., Prognostic factors and staging systems in parathyroid cancer: a multicenter cohort study. Surgery, 2014. 156(5): p. 1132-1144.
Schulte, K.-M., et al., Oncologic resection achieving r0 margins improves disease-free survival in parathyroid cancer. Annals of surgical oncology, 2014. 21(6): p. 1891-1897.
Hsu, K.-T., et al., Is central lymph node dissection necessary for parathyroid carcinoma? Surgery, 2014. 156(6): p. 1336-1341.
Erickson, L.A., et al., Overview of the 2022 WHO Classification of Parathyroid Tumors. Endocrine Pathology, 2022. 33(1): p. 64-89.
DeLellis, R.A., Pathology and genetics of tumours of endocrine organs. Vol. 8. 2004: IARC.
Lloyd, R., OR, Klöppel G, Rosai J. WHO Classification of Tumours of Endocrine Organs. 4th edition. WHO, Geneva, 2017.
Landry, C., et al., Parathyroid. AJCC Cancer Staging Manual, 2017: p. 903-910.
Мамедова, Е., et al., Мутации в гене CDC73 у молодых пациенток с первичным гиперпаратиреозом (описание двух клинических случаев). Терапевтический архив (архив до 2018 г.), 2016. 88(10): p. 57-62.
Newey, P.J., et al., Cell division cycle protein 73 homolog (CDC73) mutations in the hyperparathyroidism‐jaw tumor syndrome (HPT‐JT) and parathyroid tumors. Human mutation, 2010. 31(3): p. 295-307.
Pandya, C., et al., Genomic profiling reveals mutational landscape in parathyroid carcinomas. JCI insight, 2017. 2(6).
Shattuck, T.M., et al., Somatic and germ-line mutations of the HRPT2 gene in sporadic parathyroid carcinoma. New England Journal of Medicine, 2003. 349(18): p. 1722-1729.
Carpten, J., et al., HRPT2, encoding parafibromin, is mutated in hyperparathyroidism–jaw tumor syndrome. Nature genetics, 2002. 32(4): p. 676.
Demir, H., et al., FDG PET/CT findings in primary hyperparathyroidism mimicking multiple bone metastases. European Journal of Nuclear Medicine and Molecular Imaging, 2008. 35(3): p. 686-686.
Мокрышева, Н., et al., Позитронная эмиссионная томография совмещенная с компьютерной томографией с 18 F-фторхолином в топической диагностике опухолей околощитовидных желез и вторичных изменений костной ткани при гиперпаратиреоидной остеодистрофии: два клинических наблюдения. Problemy Endokrinologii, 2018. 64(5).
Penhoat, M.G., et al., Contribution of 18-FDG PET/CT to brown tumor detection in a patient with primary hyperparathyroidism. Joint Bone Spine, 2017. 84(2): p. 209-212.
Calandra, D., et al., Parathyroid carcinoma: biochemical and pathologic response to DTIC. Surgery, 1984. 96(6): p. 1132.
Bukowski, R.M., et al., Successful combination chemotherapy for metastatic parathyroid carcinoma. Archives of Internal Medicine, 1984. 144(2): p. 399-400.
Munson, N.D., et al., Parathyroid carcinoma: is there a role for adjuvant radiation therapy? Cancer, 2003. 98(11): p. 2378-2384.
Wynne, A.G., et al., Parathyroid carcinoma: clinical and pathologic features in 43 patients. Medicine, 1992. 71(4): p. 197-205.
Sanden, A.K. and P. Vestergaard, Kontrol af serumcalcium med cinacalcet ved parathyroideacancer. Ugeskrift for Laeger, 2009. 171(41): p. 3004-6.
Çalapkulu, M., et al., Control of Refractory Hypercalcemia with Denosumab in a Case of Metastatic Parathyroid Carcinoma. Journal of the College of Physicians and Surgeons--Pakistan: JCPSP, 2020. 30(7): p. 757-759.
Fountas, A., S. Tigas, and A. Tsatsoulis, Denosumab is a long-term option for the management of parathyroid carcinoma-related refractory hypercalcemia. QJM: An International Journal of Medicine, 2017. 110(1): p. 53-54.
Takeuchi, Y., et al., Cinacalcet hydrochloride relieves hypercalcemia in Japanese patients with parathyroid cancer and intractable primary hyperparathyroidism. Journal of bone and mineral metabolism, 2017. 35(6): p. 616-622.
Silverberg, S.J., et al., Cinacalcet hydrochloride reduces the serum calcium concentration in inoperable parathyroid carcinoma. The Journal of Clinical Endocrinology & Metabolism, 2007. 92(10): p. 3803-3808.
Pramanik, S., et al., Parathyroid carcinoma and persistent hypercalcemia: A case report and review of therapeutic options. Saudi journal of medicine & medical sciences, 2018. 6(2): p. 115.
Thosani, S. and M.I. Hu, Denosumab: a new agent in the management of hypercalcemia of malignancy. Future Oncology, 2015. 11(21): p. 2865-2871.
Sun, L. and S. Yu, Efficacy and safety of denosumab versus zoledronic acid in patients with bone metastases: a systematic review and meta-analysis. American journal of clinical oncology, 2013. 36(4): p. 399-403.
Chen, F. and F. Pu, Safety of Denosumab Versus Zoledronic Acid in Patients with Bone Metastases: A Meta-Analysis of Randomized Controlled Trials. Oncol Res Treat, 2016. 39(7-8): p. 453-9.
Rozhinskaya, L., et al., Diagnosis and treatment challenges of parathyroid carcinoma in a 27-year-old woman with multiple lung metastases. Endocrinol Diabetes Metab Case Rep, 2017. 2017.
Alharbi, N., et al., Intrathyroidal Parathyroid Carcinoma: An Atypical Thyroid Lesion. Front Endocrinol (Lausanne), 2018. 9: p. 641.
Mokrysheva, N., A. Lipatenkova, and N. Taller, Primary hyperparathyroidism and pregnancy.
Norman, J., D. Politz, and L. Politz, Hyperparathyroidism during pregnancy and the effect of rising calcium on pregnancy loss: a call for earlier intervention. Clinical endocrinology, 2009. 71(1): p. 104-109.
Schnatz, P.F. and S.L. Curry, Primary hyperparathyroidism in pregnancy: evidence-based management. Obstetrical & gynecological survey, 2002. 57(6): p. 365-376.
Hirsch, D., et al., Pregnancy outcomes in women with primary hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(5): p. 2115-2122.
Cassir, G., C. Sermer, and A.K. Malinowski, Impact of Perinatal Primary Hyperparathyroidism on Maternal and Fetal and Neonatal Outcomes: Retrospective Case Series. Journal of Obstetrics and Gynaecology Canada, 2020.
McMullen, T.P., et al., Hyperparathyroidism in pregnancy: options for localization and surgical therapy. World journal of surgery, 2010. 34(8): p. 1811-1816.
Vitetta, G.M., et al., Role of ultrasonography in the management of patients with primary hyperparathyroidism: retrospective comparison with technetium-99m sestamibi scintigraphy. Journal of ultrasound, 2014. 17(1): p. 1-12.
Shaw, P., et al., Radiation exposure and pregnancy. 2011, Elsevier.
Diaz-Soto, G., et al., Primary hyperparathyroidism in pregnancy. Endocrine, 2013. 44(3): p. 591-597.
Malekar-Raikar, S. and B. Sinnott, Primary hyperparathyroidism in pregnancy—a rare cause of life-threatening hypercalcemia: case report and literature review. Case reports in endocrinology, 2011. 2011.
Ip, P., Neonatal convulsion revealing maternal hyperparathyroidism: an unusual case of late neonatal hypoparathyroidism. Archives of gynecology and obstetrics, 2003. 268(3): p. 227-229.
SHANGOLD, M.M., et al., Hyperparathyroidism and pregnancy: a review. Obstetrical & gynecological survey, 1982. 37(4): p. 217-228.
Kelly, T.R., Primary hyperparathyroidism during pregnancy. Surgery, 1991. 110(6): p. 1028-1034.
Kristoffersson, A., et al., Primary hyperparathyroidism in pregnancy. Surgery, 1985. 97(3): p. 326-330.
Walker, A., J.J. Fraile, and J.G. Hubbard, “Parathyroidectomy in pregnancy”—a single centre experience with review of evidence and proposal for treatment algorithim. Gland surgery, 2014. 3(3): p. 158.
Hu, Y., et al., Clinical presentation, management, and outcomes of primary hyperparathyroidism during pregnancy. International journal of endocrinology, 2017. 2017.
McCarthy, A., et al., Management of primary hyperparathyroidism in pregnancy: a case series. Endocrinology, diabetes & metabolism case reports, 2019. 2019(1).
Schnatz, P.F. and S. Thaxton, Parathyroidectomy in the third trimester of pregnancy. Obstetrical & gynecological survey, 2005. 60(10): p. 672-682.
Trebb, C., et al., Concurrent parathyroidectomy and caesarean section in the third trimester. Journal of Obstetrics and Gynaecology Canada, 2014. 36(6): p. 502-505.
Krysiak, R., M. Wilk, and B. Okopien, Recurrent pancreatitis induced by hyperparathyroidism in pregnancy. Archives of gynecology and obstetrics, 2011. 284(3): p. 531-534.
Levy, S., et al., Pregnancy outcome following in utero exposure to bisphosphonates. Bone, 2009. 44(3): p. 428-430.
Vera, L., et al., Primary hyperparathyroidism in pregnancy treated with cinacalcet: a case report and review of the literature. Journal of medical case reports, 2016. 10(1): p. 361.
Horjus, C., et al., Cinacalcet for hyperparathyroidism in pregnancy and puerperium. Journal of Pediatric Endocrinology and Metabolism, 2009. 22(8): p. 741-750.
Nadarasa, K., et al., The use of cinacalcet in pregnancy to treat a complex case of parathyroid carcinoma. Endocrinology, diabetes & metabolism case reports, 2014. 2014(1).
Carroll, R. and G. Matfin, Endocrine and metabolic emergencies: hypercalcaemia. Therapeutic advances in endocrinology and metabolism, 2010. 1(5): p. 225-234.
Eremkina, A., et al., Denosumab for management of severe hypercalcemia in primary hyperparathyroidism. Endocrine Connections, 2020. 9(10): p. 1019-1027.
Pekkolay, Z., et al., Preoperative Parenteral Ibandronate for Treating Severe Hypercalcemia Associated with Primary Hyperparathyroidism: An Effective and Cheap Drug. Turkish Journal of Endocrinology and Metabolism, 2018. 22(2): p. 39.
Oueslati, I., et al., Management of severe hypercalcemia secondary to primary hyperparathyroidism: The efficacy of saline hydration, furosemide, and zoledronic acid. Endocrinology, diabetes & metabolism case reports, 2022.
Alhefdhi, A., H. Mazeh, and H. Chen, Role of postoperative vitamin D and/or calcium routine supplementation in preventing hypocalcemia after thyroidectomy: a systematic review and meta-analysis. The Oncologist, 2013. 18(5): p. 533.
Armstrong, A.J., et al. Effect of Prophylactic Calcitriol Administration on Serum Ionized Calcium Concentrations after Parathyroidectomy: 78 Cases (2005–2015). J Vet Intern Med, 2018. 32: 99-106.
Pecori Giraldi F, et al. Specificity of first-line tests for the diagnosis of Cushing's syndrome: assessment in a large series. J Clin Endocrinol Metab. 2007;92(11):4123-9.
Petranović Ovčariček P, et al. An essential practice summary of the new EANM guidelines for parathyroid imaging. Q J Nucl Med Mol Imaging. 2022 Jun;66(2):93-103.
Мокрышева Н.Г., et al. Первичный гиперпаратиреоз в России по данным регистра. Проблемы эндокринологии, 2019. 65(5):300-310.
Verly E., et al. Evaluation of the Thiazide Challenge Test to Differentiate Primary From Hypercalciuria-Related Hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism, 2024. dgae239
Turner J., et al. SOCIETY FOR ENDOCRINOLOGY EMERGENCY ENDOCRINE GUIDANCE: Emergency management of acute hypocalcaemia in adult patients. Endocr Connect. 2019 Jun 1;8(6):X1
Ким Е.И., Лавренюк А.А., Урусова Л.С., Еремкина А.К., Елфимова А.Р., Мокрышева Н.Г. Роль иммуногистохимического анализа в дифференциальной диагностике атипических опухолей и карцином околощитовидных желез. Архив патологии. 2024;86(4):5–12.
Елфимова А.Р., Еремкина А.К., Реброва О.Ю., Ковалева Е.В., Мокрышева Н.Г. Ассоциация предоперационной терапии колекальциферолом и гипокальциемии после паратиреоидэктомии у больных с первичным гиперпаратиреозом // Проблемы эндокринологии. — 2024. — Т. 70. — №1. — С. 38-45. doi: https://doi.org/10.14341/probl13324
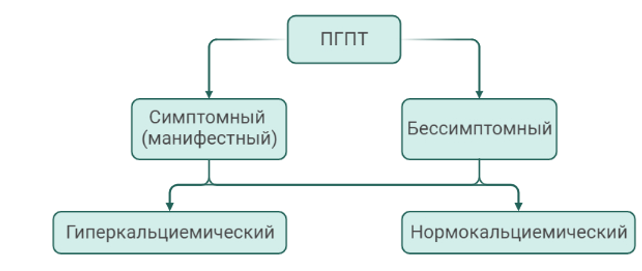
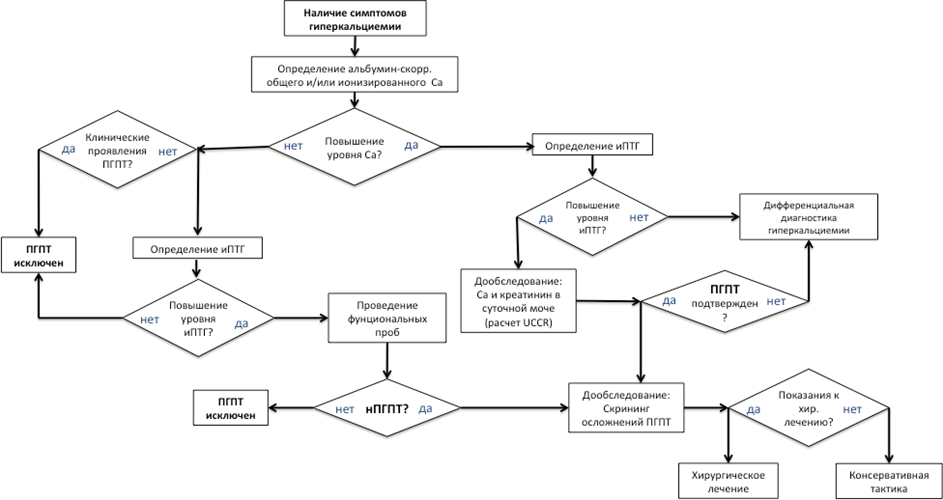
Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint