Вакцинация лиц пожилого и старческого возраста
Профессиональные ассоциации:
Рабочая группа по подготовке текста: О.Н. Ткачева, Ю.В. Котовская, М.П. Костинов, Н.В. Шарашкина, А.А. Дубов
Комитет экспертов: О.Н. Ткачева, Ю.В. Котовская, Э.К. Вергазова, И.Б. Куликова, В.П. Чуланов, Л.С. Намазова-Баранова, Н.И. Брико, М.П. Костинов, Н.Н. Авдеев, Р.С. Козлов, О.М. Драпкина, Л.Ю. Дроздова, А.С. Белевский, А.А. Мельникова, Н.К. Рунихина, Е.В. Фролова, Н.В. Шарашкина, Г.Л. Игнатова, И.В. Демко, Т.А. Черкашенко, О.В. Кириллов, К.М. Алиева, Х.М. Мустафин, Т.М. Василенко, Л.В. Канунникова, О.В. Татаринова
Разработчики:
Российская ассоциация геронтологов и гериатров
Список сокращений
АДС-М – вакцина адсорбированная дифтерийно-столбнячная в малых дозах
АС – столбнячный анатоксин
БА – Бронхиальная астма
ВВЗ – вирус варицелла-зостер
ВГА – вирусный гепатит А
ВГВ – вирусный гепатит В
ВОЗ – Всемирная организация здравоохранения
ВП – внебольничная пневмония
ВГВ – гепатит В
ГКС – глюкокортикостероиды
ГСК - гематопоэтические стволовые клетки
ИПИ – инвазивная пневмококковая инфекция
ИФА – иммуноферментный анализ
МИ – менингококковая инфекция
МО – Медицинская организация
ОИМ – Острый инфаркт миокарда
ОРВИ – острая респираторная вирусная инфекция
ОРИ – острая респираторная инфекция
ПВО – поствакцинальные осложнения
ПКВ 13 – 13 - валентная пневмококковая конъюгированная вакцина
ППВ 23 – 23 – валентная полисахаридная вакцина
ПСС – противостолбнячная сыворотка
ПСЧИ – противостолбнячный человеческий иммуноглобулин
ПЦР – полимеразная цепная реакция
ССЗ – сердечно-сосудистые заболевания
ТИА – транзиторная ишемическая атака
ХОБЛ – хроническая обструктивная болезнь легких
СDC - Центр по контролю за заболеваемостью и профилактике
1. Актуальность проблемы вакцинации у лиц пожилого и старческого возраста
Вакцинология и практика вакцинации являются неотъемлемой частью профилактического направления медицины. Профилактика острых инфекционных и многих хронических неинфекционных заболеваний, их неблагоприятного инвалидизирующего течения, осложнений и летальных исходов; увеличение продолжительности и повышение качества жизни невозможны сегодня без вакцинации против многочисленных острых и персистирующих инфекций. Ни одной медицинской науке мир не обязан предотвращением стольких смертей, как вакцинологии. Опыт мировой медицины свидетельствует, что наиболее эффективным и экономически доступным средством достижения «здоровья для всех» является вакцинопрофилактика, снижающая смертность детей и взрослых от массовых инфекций, увеличивающая ожидаемую продолжительность жизни и обеспечивающая активное долголетие во всех социальных группах [1].
Во всем мире население стареет из-за увеличения продолжительности жизни и снижения рождаемости. По оценкам ООН к 2025 году 15% населения мира будет старше 60 лет, и к 2050 году эта доля возрастет до 20% [80]. Эти демографические тенденции уже создают значительную экономическую нагрузку, особенно в странах с государственными пенсиями и системами здравоохранения, и можно ожидать, что последствия только возрастут [81, 82]. С ростом численности людей старших возрастных групп, имеющих хронические заболеваниям, растут и расходы на здравоохранение, поскольку индивидуальная потребность в медицинских услугах заметно возрастает с возрастом. Стратегическими мерами в таких условиях становятся меры, направленные на то, чтобы пожилые люди были экономически и социально активными дольше, чем это было в предыдущих поколениях (концепция «прибавления жизни к годам»), и на то, чтобы максимально отсрочить неизбежный рост использования услуг здравоохранения, связанный с возрастом – концепция «здорового старения» [83]. Всемирная организация здравоохранения недавно определила концепцию здорового старения как «процесс развития и поддержания функциональных способностей, обеспечивающих благополучие в пожилом возрасте». Здоровое старение само по себе является похвальной целью улучшения благосостояния и качества жизни, но оно также определенно признано необходимым для противодействия ожидаемому росту расходов на здравоохранение вследствие происходящих демографических изменений. Традиционные стереотипы более не применимы к нынешней популяции пожилых людей, которые зачастую более здоровы и активны, чем предыдущие поколения, и в настоящее время основное внимание уделяется не хронологическому возрасту, а функциональным возможностям и независимости от помощи окружающих (автономности) [84].
Иммунизация взрослых, в том числе и лиц пожилого и старческого возраста, - одна из ключевых мер, способных обеспечить здоровое старение. Среди пожилых людей вакцинация снижает возникновение тяжелых заболеваний и осложнений на 60%, а смертность - на 80% [2].
В 2019 году Всемирной организацией здравоохранения (ВОЗ) опубликован список десяти проблем здравоохранения, куда вошли и проблемы вакцинации. Консультативная группа ВОЗ по вакцинам называет основными факторами, препятствующими вакцинации, недоверие к вакцинам и отсутствие удобного доступа к услугам по вакцинации [3].
В Российской Федерации создана уникальная система организации вакцинопрофилактики, признанная ВОЗ одной из самых эффективных, так как она предусматривает ведение государственного учёта и отчётности о проводимых прививках и случаях поствакцинальных осложнений, функционирование специализированных прививочных кабинетов, а также контроль коллективного иммунитета.
Однако реализация программы всеобщей вакцинопрофилактики сдерживается не столько отсутствием средств и недостаточной изученностью вопроса об эффективности и безопасности вакцинации лиц пожилого и старческого возраста, страдающих хроническими, иногда очень тяжёлыми заболеваниями, сколько недостаточной информированностью врачей в этих вопросах. Несмотря на огромную работу по совершенствованию вакцинных препаратов, эффективность и безопасность которых год от года возрастает, сохраняется насторожённость и предубеждение врачей не только против дополнительной вакцинации по календарю профилактических прививок, проводимых по эпидемиологическим показаниям, но и против прививок Национального календаря у пациентов, страдающих теми или иными заболеваниями. Хронические заболевания, особенно неврологические и серьёзные соматические, часто рассматриваются врачами в качестве прямого и безусловного противопоказания к проведению профилактической вакцинации любыми вакцинными препаратами, в то время как эти хронические заболевания во всём мире и в России, напротив, признаны основанием для отнесения пациентов в группу повышенного риска, то есть подлежащую вакцинации в первую очередь. Значительная часть врачей произвольно расширяет противопоказания к вакцинации в рамках Национального календаря профилактических прививок и не рекомендует проведение иммунизации вакцинами, не включенными в Национальный календарь, несмотря на то, что они массово применяются в других странах, разрешены к применению и могут быть использованы в России за счёт средств реципиента [1].
Одной из важных проблем также является отсутствие скоординированной инфраструктуры общественного здравоохранения для поддержки программы иммунизации взрослых [4]. Отсутствие координации было отмечено в качестве барьера для эффективной доставки вакцины против гриппа H1N1 во время программы вакцинации против гриппа H1N1 2009-2010 [5] и остается барьером для других обычных прививок у взрослых [6].
К общим барьерам для иммунизации лиц пожилого и старческого возраста относятся:
- Недооценка важности иммунизации взрослых в целом и лиц пожилого и старческого возраста в частности
- Недостаток знаний медицинских работников об иммунизации взрослых, включая лиц пожилого и старческого возраста, и рекомендуемых вакцинах
- Недостаток рекомендаций по вакцинации со стороны медицинских работников
- Недостаток понимания безопасности и эффективности вакцинации у лиц пожилого и старческого возраста
- Преувеличение рисков вакцинации у лиц пожилого и старческого возраста
- Недостаточная координация программ иммунизации для лиц пожилого и старческого возраста, включая проведение вакцинации в стационарных учреждения социальной защиты.
- Низкая информированность населения о важности иммунизации лиц пожилого и старческого возраста
- Боязнь инъекций со стороны лиц старших возрастных групп
- Отсутствие систем ведения медицинской документации, обеспечивающей преемственность и доступность информации о вакцинации
Вакцинация лиц пожилого и старческого возраста требует улучшения для того, чтобы уменьшить последствия для здоровья от болезней, предупреждаемых с помощью вакцин [8,9,10].
На сегодняшний день доказано, что вакцинация может защитить не только от инфекционных заболеваний, но и от их системных последствий в отношении повышения сердечно-сосудистых рисков, тяжести течения хронических неинфекционных заболеваний. Вакцинация снижает риск госпитализации в связи с болезнями сердечно-сосудистой системы и дыхательной системы, снижает общую смертность, и эти эффекты максимально выражены у лиц старших возрастных групп. Инфекционные заболевания сопровождаются выраженной системной воспалительной реакцией, которая может провоцировать развитие кардиоваскулярных катастроф, и этот риск может быть снижен при проведении специфической профилактики. Все пациенты с сердечно-сосудистыми заболеваниями должны при отсутствии противопоказаний ежегодно вакцинироваться против гриппа согласно Национальному календарю прививок. Международный опыт показывается, что вакцинация против гриппа в течение эпидемического сезона снижает риск инсульта на 33% причем наиболее значимое снижение риска было отмечено в подгруппе вакцинированных перед началом подъема заболеваемости. Наиболее яркие результаты были получены в группе лиц старше 65 лет, а именно проведение двойной вакцинации против гриппа и пневмококковой инфекции позволяет снизить риск развития инфаркта миокарда на 48%, риск инсульта на 33%, и общей смертности на 35% у пожилых пациентов.
Программы по улучшению ситуации с вакцинацией пожилых людей должны сочетать информационно-просветительские меры и пропаганду вакцинации, обеспечение доступности служб вакцинации, использование методов, которые доказали свою эффективность для улучшения охвата вакцинацией, в том числе, систем напоминания, мер по устранению административных и финансовых барьеров для вакцинации, разработку постояннодействующих программ для вакцинации, систематическую оценку уровня вакцинации [11].
2. Старение иммунной системы
Более низкий иммунный ответ у пожилых людей коррелирует с более высокой восприимчивостью к инфекционным заболеваниям и более высоким риском госпитализации или серьезных исходов, чем у более молодого человека. Ситуация усугубляется более высокой распространенностью сопутствующих заболеваний, характерных для пожилых людей [85].
Начиная с шестого десятилетия жизни, иммунная система человека претерпевает драматические изменения, связанные со старением, которые непрерывно прогрессируют до состояния иммуносенесценции.
Иммуносенесценция - совокупное влияние старения на иммунную функцию, на все типы клеток и молекулярные пути на всех уровнях иммунного ответа. Результирующий общий фенотип - низкоуровневое воспаление на исходном уровне, но с нарушением врожденных и адаптивных иммунных реакций на острый стимул.
Изменения в иммунной системе затрагивают практически все клеточные линии, и приводят к изменениям в разнообразных врожденных иммунных реакциях, опосредующих самые ранние взаимодействие иммунной системы с патогенами или вакцинами, а также более медленное начало иммунных ответов в В-клетках и Т-клетках. Действительно, эти изменения распространяются на гемопоэтические стволовые клетки в костном мозге, которые дают начало всем клеточным линиям иммунной системы. Возрастные иммунологические изменения проявляются изменениями в клеточной сигнальной трансдукции или функции, которые могут возникнуть в результате внутренних механизмов с генетическим компонентом, но также отражают сложные взаимодействия старения иммунной системы с такими факторами, как хроническая или повторяющаяся инфекция (например, при реактивации семейства герпесвирусов или ВИЧ), гормональные изменения и эндогенное повреждение клеток как потенциальный результат хронических заболеваний.
Иммунное старение имеет глубокие клинические последствия у пожилых людей, которые подвергаются повышенному риску заболеваемости и смертности от инфекционных заболеваний. Например, у людей пожилого и старческого возраста чаще развивается реактивация туберкулеза и вируса ветряной оспы (ВВЗ), чем у молодых людей. Возраст является также независимым фактором риска смерти при сепсисе. Старение иммунной система также способствует ослаблению реакции иммунитета на вакцины против гриппа и других патогенных микроорганизмов [45]. Стареющая иммунная система теряет способность защищать организм от инфекций и рака и не поддерживает надлежащее заживление ран.
Воспалительные реакции, опосредованные врожденной иммунной системой, увеличиваются по интенсивности и продолжительности, что делает пожилых людей восприимчивыми к повреждающему ткани иммунитету и воспалительным заболеваниям. Старение связано с увеличением частоты воспалительных заболеваний, особенно сердечно-сосудистых заболеваний [13]. Многие дегенеративные заболевания пожилых людей, такие как болезнь Альцгеймера, болезнь Паркинсона и остеоартрит, имеют значительный воспалительный компонент. Выработка аутоантител гораздо чаще встречается у пожилых людей [14]. В сущности, иммунное старение связано со снижением защитного иммунитета в сочетании с увеличением частоты воспалительных заболеваний. [12]
Таблица 1. Основные признаки старения иммунной системы [12].

Старение иммунной системы связано с резкими изменениями в распределении и компетентности иммунных клеток [15]. Гематопоэтические стволовые клетки (ГСК) костном мозге вызывают все линии крови и в результате должны сохранять способность дифференцироваться и самообновляться, чтобы кроветворение продолжалось в течение всей жизни. Эффекты старения на ГСК сложны; например, число ГСК, увеличиваются с возрастом, а не уменьшаются, что можно было бы ожидать. Старение связано с нарушением дифференцировки и репопуляции клеток крови. Примечательно, что существует значительный сдвиг в пользу развития стволовых клеток-предшественников для миелоидного ростка (отвечает за образование гранулоцитов, моноцитов, макрофагов, эритроцитов и тромбоцитов) и уменьшается количество лимфоидных предшественников, ответственных за развитие B- и T-лимфоцитов. Это, вероятно, способствует нарушению в развитии B- и T-клеток у пожилых людей, и можно предположить, что увеличение миелоидных предшественников может способствовать возникновению возрастных миелопролиферативных нарушений [45].
Из-за потери адаптивного иммунитета и усиления неспецифического врожденного иммунитета пожилые люди восприимчивы к инфекции и раку и не защищены от хронического воспаления тканей. Механизмы, способствующие воспалительным заболеваниям в пожилом возрасте, включают потерю иммуноингибирующей способности, в частности, ухудшение регуляторной функции Т-клеток (Treg) [16,17.18]. Иммунное старение является фактором риска и усиливает многие патологии, связанные с процессом старения. Терапевтические вмешательства, поддерживающие или устраняющие иммунное старение, открывают возможности для улучшения лечения заболеваний, связанных со старением, и оказывают значительное влияние на состояние здоровья [19].
3. Вакцинация лиц пожилого и старческого возраста
3.1. Вакцинация против пневмококковой инфекции
Определение. Пневмококковая инфекция – группа повсеместно распространенных антропонозных болезней, обусловленных наличием передаваемых воздушно-капельным путем бактерий S. pneumoniae, способных проникать в обычно стерильные среды организма человека, вызывая серьезную патологию с высокой летальностью.
Характеристика возбудителя. Streptococcus pneumoniae – неподвижный грамположительный, каталазо- и оксидазоотрицательный ланцетовидный диплококк. Основой клеточной стенки пневмококка является пептидогликан со встроенными углеводами, тейхоевыми кислотами, липопротеинами и поверхностными белками. Полисахаридная капсула пневмококка - главный фактор патогенности и вирулентности возбудителя, способна ограничивать аутолиз и снижать активность антибиотиков. В то же время, выработка протективных специфических антител в ходе развития инфекционного процесса, а также в результате вакцинации, происходит именно в отношении антигенов полисахаридной оболочки пневмококка.
На основании разнообразия состава полисахаридной капсулы в настоящее время выделено 96 серотипов S. pneumoniae. Серотип определяет степень вирулентности пневмококка, уровень устойчивости к антибиотикам, форму и тяжесть заболевания. Распространение серотипов варьирует в зависимости от возраста, практики применения антибактериальной терапии, клинических проявлений, географического местоположения и сезона.
S.pneumoniae является представителем условно-патогенной флоры человека. Единственно эпидемически значимым резервуаром возбудителя является человек, больной той или иной формой пневмококковой инфекции или бактерионоситель [20].
Эпидемиология. Пневмококковая инфекция (ПИ) признана ВОЗ самой опасной из всех предупреждаемых вакцинопрофилактикой болезней и до внедрения универсальной вакцинации ежегодно приводила к смерти 1,6 млн человек. Значительную роль в развитии эпидемического процесса играют социальные факторы. Показатель летальности при ПИ может быть высоким, колеблясь от 20% при септицемии до 50% при менингите в развивающихся странах. Показатели смертности наиболее высоки среди детей раннего возраста и лиц старше 65 лет.
Ведущим направлением предупреждения инфекций, вызываемых устойчивыми к антибиотикам пневмококками, признана вакцинация. Рациональная антибиотикотерапия в комбинации с универсальной вакцинацией препятствуют распространению устойчивых к антибиотикам штаммов пневмококка и, соответственно, наиболее тяжелых клинических форм инфекции.
Клинические данные. Эффективность ПКВ13 у взрослых в возрасте 65 лет и старше доказана в крупномасштабном рандомизированном двойным-слепым, плацебо-контролируемым исследовании CAPITA (84 496 пациентов ≥ 65 лет). В данном исследовании ПКВ13 продемонстрировала 45,6%эффективность в профилактике первого эпизода внебольничной пневмонии, вызванной вакцинными серотипами, включая инвазивные и неинвазивные случаи. Эффективность в отношении первого эпизода вызванной вакцинными серотипами неинвазивной внебольничной пневмонии составила 45% (ДИ 14.2%–65.3%), эффективность относительно первого эпизода инвазивной пневмококковой инфекции, вызванной вакцинными серотипами, составила 75% (ДИ 41.4%–90.8%) [21] .
В исследовании в регионе Лигурия (Италия) взрослым старше 70 лет вводили ПКВ13. Анализ результатов в период с 2010 по 2014 год с последующим наблюдением показал снижение заболеваемости инфекциями нижних дыхательных путей на 24,5% (95% ДИ 11,3-47,8%) [86].
В исследовании эпиднадзора в Луисвилле (США) у взрослых в возрасте ≥65 лет, отмечалось снижение риска госпитализаций по поводу ВП среди привитых ПКВ13 на 73% по сравнению с не привитыми. примерно [87].
Вакцинация ППВ23 продемонстрировала 65–84% эффективность против инвазивных инфекций, вызванных серотипами, входящими в состав вакцины у пациентов особых групп (с диабетом, ИБС, ХСН, ХОБЛ и анатомической аспленией) [106].
Фармакоэкономический анализ показал, что вакцинация ПКВ13 в РФ когорты 65-летних граждан и старше групп высокого и умеренного риска может позволить вернуть в бюджет 60,9% от вложенных средств за счет предотвращенных случаев заболеваний в 5-летнем горизонте (при условии вакцинации в ходе планового визита к врачу (без дополнительного визита) и может рассматриваться в качестве экономически высоко эффективного вмешательства, обеспечивающего существенное снижение заболеваемости пневмококковыми инфекциями (пневмония, бактериемия, менингит) и обусловленной ею летальности [107].
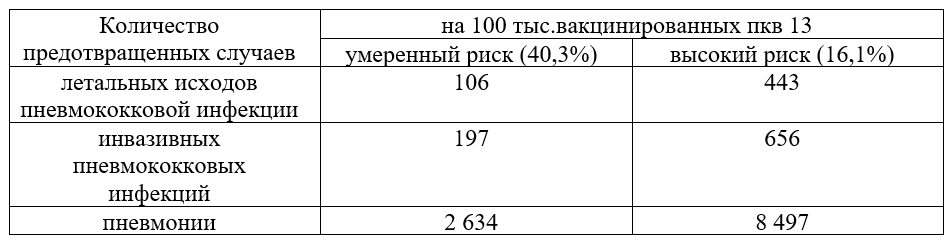
Таблица 2. Пневмококковые вакцины, разрешенные к применению у взрослых, включая пациентов пожилого и старческого возраста

В основе действия конъюгированных вакцин (ПКВ) лежит Т-зависимый иммунный ответ: в результате конъюгации полисахаридов с белком-носителем формируется качественно другой по сравнению с ППВ иммунный ответ. Антигенпрезентирующая клетка распознает полисахаридный антиген, захватывая белок-носитель, одновременно обрабатывая и презентуя его Т-клеткам в составе с молекулами комплекса гистосовместимости. Т-клетки, в свою очередь, обеспечивают необходимые процессы для переключения классов антител преимущественно с IgM-и IgG2- на IgG1-типы, связанные с более высоким уровнем бактерицидной активности сыворотки крови, а также для родственного созревания и выработки В-клеток памяти. Кроме того, происходит прайминг для последующей ревакцинации, что выражается в очень быстром нарастании титра антител с высокой опсонфагоцитарной активностью при последующей вакцинации ППВ.
Greenberg RN at all. в 2014 году провели рандомизированное, модифицированное двойное слепое исследование с участием 720 взрослых в возрасте 60-64 лет, не получавших пневмококковую вакцину ранее. Исследование показало, что последующее введение ПКВ23 для многих серотипов усиливало первоначальный иммунный ответ на введение ПКВ 13. Наоборот, при начальном введении ПКВ 23 приводил к снижению ответа на ПКВ 13 для всех серотипов [88], что продемонстрировало иммунологические особенности выработки иммунного ответа на конъюгированные и полисахаридные вакцины.
Рекомендации по вакцинации против пневмококковой инфекции пациентов пожилого и старческого возраста

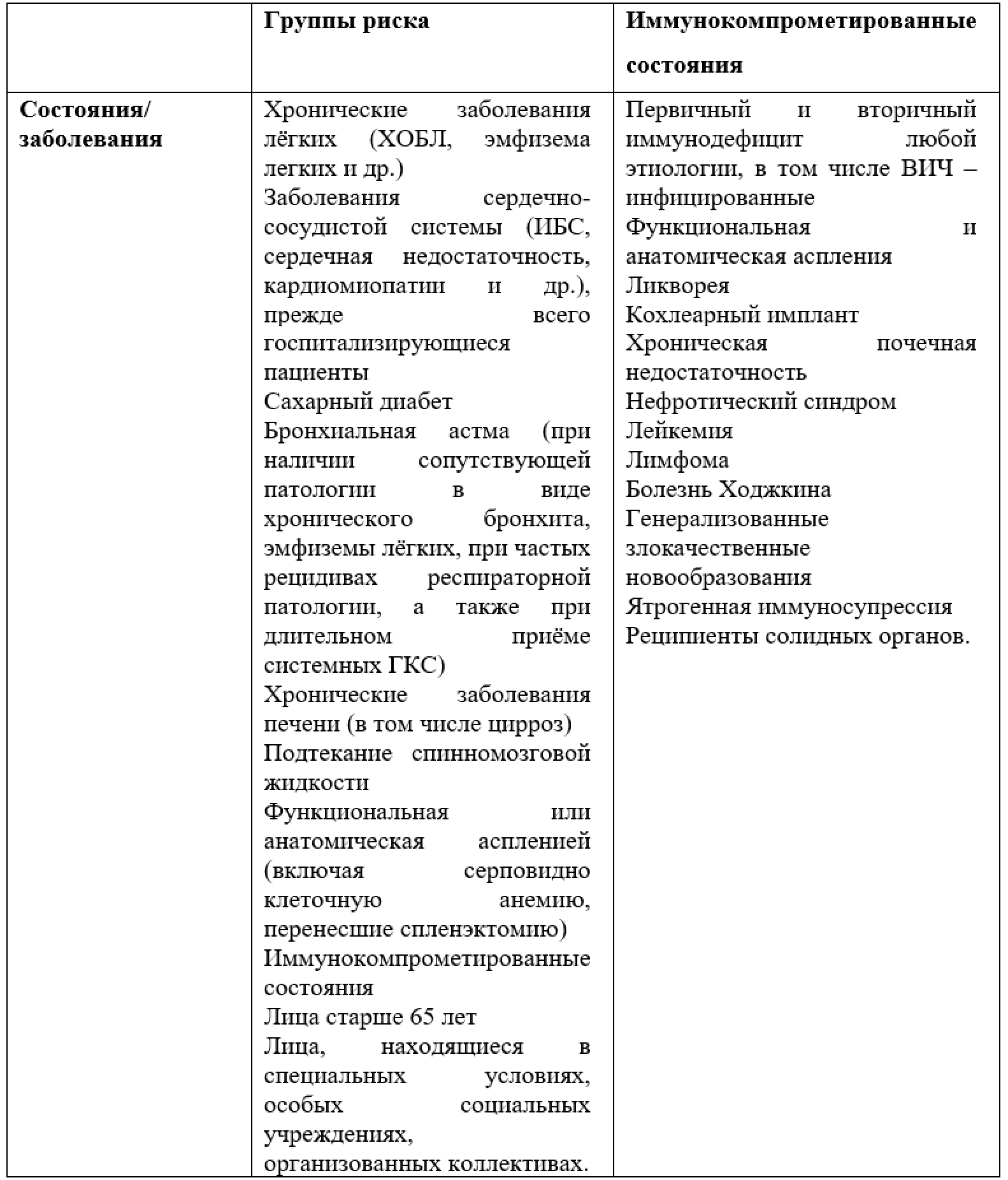
Таблица 3. Группы риска пневмококковой инфекции и иммунокомпрометированные состояния [20].
Противопоказания к вакцинации
Постоянные противопоказания: гиперчувствительность к любому компоненту вакцины, выраженная реакция на предыдущее введение вакцины, сильная реакция или поствакцинальное осложнение.
Временные противопоказания: острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний. Вакцинация осуществляется на фоне противорецидивной (базисной) терапии, при согласовании со специалистом. Прививки проводят через 2–4 недели после стабилизации процесса или начала ремиссии.
3.2. Вакцинация против гриппа
Определение. Грипп (франц. grippe, инфлуэнца) - острая чрезвычайно контагиозная респираторная вирусная инфекция с воздушно-капельным механизмом передачи, вызываемая вирусами гриппа типа А, В и С. Несмотря на почти 100-летнюю историю изучения вируса гриппа, несомненные успехи инфектологии, вирусологии, эпидемиологии, вакцинопрофилактики, грипп до сих пор остается непредсказуемой и трудно управляемой инфекцией.
Эпидемиология. Грипп занимает особое место среди всех других инфекционных болезней человека, что обусловлено его повсеместным распространением, высокой заболеваемостью населения независимо от экономического состояния стран, ежегодно возникающими вспышками, эпидемиями, негативными социально-экономическими последствиями, неблагоприятным влиянием на конкретного человека и общество в целом, способностью к пандемическому распространению. Считается, точ в среднем ежегодно гриппом заболевает каждый десятый взрослый и каждый третий ребенок. При этом наряду с легкой и среднетяжелой формами, заканчивающимися выздоровлением, у части больных возникают осложнения, приводящие к летальному исходу. По данным ВОЗ, каждый год во время вспышек гриппа в мире заболевает до 15% населения, 250-500 тыс из них умирают. У пациентов с сопутствующими сердечно-сосудистыми заболеваниями, патологией органов дыхания в период эпидемии гриппа смертность в 50-100 раз выше, чем среди здоровых людей. Осложнения после гриппа возникают не только у лиц, входящих в группы риска, но и у молодых, до того здоровых людей. Каждая вспышка гриппа наносит существенный ущерб здоровью населения и экономике соответствующего региона и страны. [27]
Экономические затраты, связанные с заболеванием гриппом, составляют 1 391 023,1 тыс руб (в 2016 г – 12 место среди всех заболеваний) [28].
Вакцинация является наиболее эффективным средством профилактики гриппозной инфекции. Во многих странах внедрены ежегодные программы вакцинации против гриппа. Растет понимание потенциальных социальных и медицинских преимуществ вакцинации беременных, детей в возрасте от 6 месяцев до 5 лет, людей пожилого и старческого возраста и лиц с хроническими заболеваниями, которые делают их уязвимыми для серьезных осложнений гриппа. [26]
Клинические данные. В исследование «случай-контроль» по Общей базе данных исследований общей практики в Англии и Уэльсе было включено 78706 пациентов, среди которых было зарегистрировано 16012 случаев острого инфаркта миокарда. Вакцинация от гриппа была ассоциирована со снижением частоты острого инфаркта миокарда на 19% (0,81, 95% ДИ 0,77–0,85). Ранняя сезонная вакцинация против гриппа была связана с более низкой частотой острого инфаркта миокарда (0,79, 95% ДИ 0,75–0,83), чем вакцинация после середины ноября (0,88, 95% ДИ 0,79–0,97). Для пневмококковой вакцинации не было установлено достоверной ассоциации со снижением частоты острого инфаркта миокарда (0,96, 95% ДИ 0,91–1,02) [22].
В исследовании по базе данных исследований общей практики Великобритании с включением 26 784 случаев инсульта и 20 227 случаев ТИА с равным количеством соответствующих контрольных лиц было установлено, что вакцинация против гриппа в течение сезона была связана со снижением риска возникновения инсульта на 24% (0,76, 95% ДИ 0,72-0,80), но без снижения риска возникновения ТИА (1,03, 95% ДИ 0,98-1,09). Пневмококковая вакцинация не была ассоциирована со снижением риска инсульта (0,98, 95% ДИ 0,94-1,00) или ТИА (1,15, 95% ДИ 1,08-1,23) [23].
Корейское многоцентровое ретроспективное исследование «случай-контроль», в котором оценивалась эффективность противогриппозной вакцины в профилактике госпитализации в связи с обострением сердечно-легочной недостаточности, показало общую эффективность вакцинации в плане снижения госпитализации по поводу обострения сердечно-лёгочных заболеваний на 33,7% (95% ДИ 14,0–49,0%; P = 0,002). Логистический регрессионный анализ показал, что вакцинация против гриппа значительно снижала риск госпитализации, особенно в связи с обострением ИБС и ХСН, у пациентов в возрасте 65 лет и старше. Снижение риска у этих пациентов составило 56,0% (95% ДИ 32,1–71,4%, P = 0,002) [24].
Рекомендации по вакцинации против гриппа у пациентов пожилого и старческого возраста

Иммунизацию против гриппа инактивированными вакцинами можно проводить одновременно с вакцинацией против других заболеваний, включая иммунизацию от пневмококковых инфекций [31] .
Минимально допустимый интервал между двумя прививками против гриппа составляет 1 месяц, если предыдущая прививка сделана в конце сезона и появилась вакцина нового сезона [30].
Консультативный комитет США по практике иммунизации рекомендует, чтобы плановая ежегодная вакцинация против гриппа рекомендовалась всем лицам в возрасте ≥ 6 месяцев при отсутствии противопоказаний. Лица высокого риска, такие как пожилые люди в возрасте ≥65 лет, пациенты с хроническими заболеваниями, их близкие контакты, работники здравоохранения должны оставаться высокоприоритетными группами населения в кампаниях вакцинации [25].
3.3. Вакцинация против столбняка
Определение. Столбняк - тяжелое заболевание, вызываемое токсином (тетаноспазмином) столбнячной бактерии (Clostridium tetani).
Характеристика возбудителя. Возбудителем болезни является спорообразующая, строго анаэробная бактерия Clostridium tetani. Споры имеют распространение в окружающей среде, особенно в почве теплых и влажных регионов, а также могут обитать в кишечнике человека и животных. При попадании в некротические раны споры могут прорасти в бактерии, производящие столбнячный экзотоксин. Входные ворота C. tetani в некоторых случаях неизвестны или невидимы на момент проявления симптомов.
Тетаноспазмин является сильнейшим токсином, вырабатываемым C. tetani. Этот токсин блокирует ингибирующие нейротрансмитеры центральной нервной системы и вызывает мышечное напряжение и судороги, характерные для генерализованного столбняка.
Инкубационный период при столбняке обычно составляет от 3 до 21 дня (в среднем, 7 дней в диапазоне от 0 до более 60 дней). Более чем в 80% случаев столбняк представляет собой генерализованную спастическую болезнь. Характерными признаками столбняка являются ранние судороги лицевых мышц (тризм, или "зажатая челюсть" и "сардоническая улыбка"), после чего развиваются спазмы спинной мускулатуры (опистоноз) и внезапные генерализованные тонические судороги (тетаноспазмы). Спазм голосовой щели может вызвать внезапную смерть. Заболевание может поразить любую возрастную группу и даже при наличии современных блоков интенсивной терапии в больницах уровень летальности очень высок. При отсутствии медицинского вмешательства летальность приближается к 100%. Болеют главным образом люди старшего и пожилого возраста, ранее не привитые против столбняка. [33]
Эпидемиология. В последние годы в России регистрируется в среднем 30-35 случае столбняка в год, из них 12-14 заканчиваются смертью больного, остальные выздоровлением. Вероятность летального исхода, таким образом, составляет 39% [34].
Общий уровень частоты смертельных случаев в результате столбняка варьируется между 10% и 70%, в зависимости от лечения, возраста и общего состояния здоровья пациента. Без госпитализации и интенсивного лечения смертность составляет почти 100% среди пациентов самого пожилого и самого юного возраста. При проведении наиболее оптимального лечения смертность может быть снижена до 10%-20% [33].
Клинические данные. По данным Центра контроля заболеваний США за период 2001-2008 год риск заболевания столбняком и смертности был выше среди людей в возрасте ≥65 лет, чем среди людей в возрасте <65 лет. К 70 годам только 45% мужчин и 21% женщин имели защитный уровень антител к столбняку [89]. Иммунитет к столбнячному токсину редко, если вообще приобретается естественным путем, но столбняк можно предотвратить с помощью высокоэффективных вакцин, содержащих столбнячный токсин [90]. Для пациентов пожилого и старческого возраста вакцинация против столбняка крайне важна в виду повышения риска падений и сопряженных с ними возможных поврежденний.
Рекомендации по вакцинации против столбняка у лиц пожилого и старческого возраста

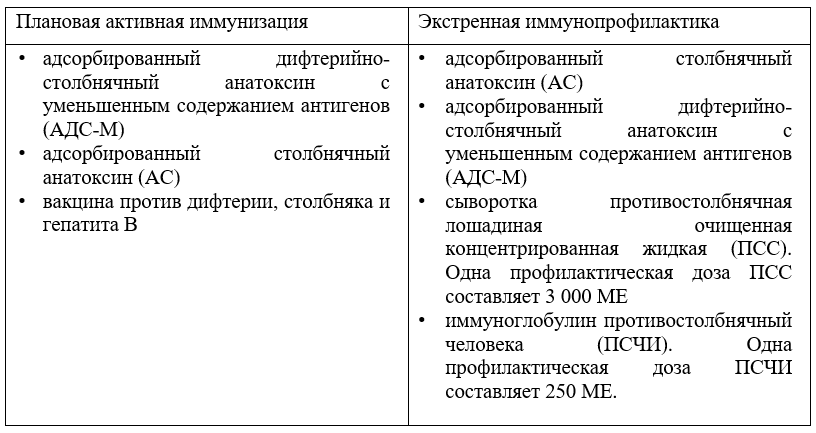
Виды профилактики столбняка
Плановая. Проводят зарегистрированными в РФ вакцинами, содержащими очищенный адсорбированный столбнячный анатоксин, в соответствии с инструкциями по применению и национальным календарём профилактических прививок [35].
Экстренная. Проводят до 20-го дня с момента получения травмы в виде
- пассивной иммунизации или серопрофилактики противостолбнячным человеческим иммуноглобулином (ПСЧИ), при его отсутствии – противостолбнячной сывороткой (ПСС).
- активно-пассивной профилактики, состоящей из одновременного введения в разные участки тела противостолбнячного человеческого иммуноглобулина (при его отсутствии ПСС) и столбнячного анатоксина (АС).
- экстренной ревакцинации столбнячным анатоксином (или дифтерийно – столбнячным анатоксином с уменьшенным содержанием антигенов – АДС-М) для стимуляции иммунитета у ранее привитых людей [36].
Экстренную профилактику проводят при:
- травмах с нарушением целостности кожных покровов и слизистых оболочек
- обморожениях и ожогах (термических, химических, радиационных) второй, третьей и четвертой степени
- проникающих повреждениях желудочно-кишечного тракта (ЖКТ), прободениях (при хирургических операциях на ЖКТ в стационарах экстренная профилактика не проводится)
- внебольничных абортах, родах вне медицинских учреждений
- гангрене или некрозе тканей любого типа, длительно текущих абсцессах, карбункулах, остеомиелитах
- укусах животными [36].
Выделяют активную иммунизацию, предусматривающую введение противостолбнячной вакцины и пассивную – введение столбнячно-специфического иммуноглобулина.
Таблица 4. Препараты, применяемые для плановой активной иммунизации против столбняка и экстренной иммунопрофилактики столбняка
3.4. Вакцинация против опоясывающего герпеса
Определение. Опоясывающий лишай является результатом реактивации латентного вируса ветряной оспы в сенсорных ганглиях. Опоясывающий лишай, или опоясывающий герпес, характеризуется односторонней корешковой болью и везикулярной сыпью, которая обычно ограничивается одним дерматомом. [91,92]
Характеристика возбудителя. Вирус ветряной оспы - высококонтагиозный нейротропный альфа-герпесвирус, который заражает людей без животных резервуаров. Первичная инфекция, обычно в детстве, вызывает ветряную оспу. Вирус остается латентным в чувствительных нервных ганглиях и впоследствии из-за ослабления клеточного иммунитета к ВВО (из-за старения или некоторых иммунодепрессивных состояний) может реактивироваться, вызывая опоясывающий лишай [39-40].
Эпидемиология. Смертность от ветряной оспы в странах с высоким уровнем дохода в период до вакцинации составляла около 3 на 100 000 случаев [41]. В 2010 году уровень смертности составлял 0,1 на 100 000 человек по сравнению с 1,7 и 1,1 для кори и коклюша соответственно [42]. Заболеваемость и тяжесть опоясывающего герпеса увеличиваются с возрастом; более половины всех людей, у которых развивается опоясывающий лишай, старше 60 лет. Осложнения возникают почти у 50 процентов пожилых людей с опоясывающим герпесом.
Введение вакцинации во многих странах мира оказали значительное влияние на заболеваемость, госпитализацию и уровень смертности, демонстрируя эффективность этой стратегии. Во всем мире заболеваемость составляет 2–3 случая / 1000 человек, до 5/1000 и 6–7 / 1000 человек / год в возрастных группах 20–50 лет, старше 60 лет и 70–80 лет соответственно [43,44]. Профилактика является приоритетной у лиц с хроническими заболеваниями (у пациентов с сахарным диабетом, аутоиммунными заболеваниями, почечной недостаточностью и новообразованиями). Вакцинация против Herpes zoster является экономические оправданной у пациентов старше 60 лет.
Клинические данные. Противовирусная терапия уменьшает тяжесть и продолжительность опоясывающего герпеса, но не предотвращает развитие постгерпетической невралгии. [93,94] Постгерпетическая невралгия может сохраняться годами и часто не поддается лечению [95].
В рандомизированном двойном слепом плацебо-контролируемом исследовании с включением 38 546 взрослых в возрасте 60 лет и старше было отмечено 957 подтвержденных случаев опоясывающего герпеса (315 в группе вакцины и 642 в группе плацебо). Общая заболеваемость опоясывающим герпесом была значительно ниже в группе вакцины: 11,12 на 1000 человеко-лет в группе плацебо, 5,42 на 1000 человеко-лет в группе вакцины (P <0,001) [96].
В ретроспективном когортном исследовании было показано, что вакцина против опоясывающего герпеса связана со снижением заболеваемости опоясывающим герпесом на 55%, что согласуется с эффективностью вакцинации 51%. Эти результаты соответствуют абсолютному снижению риска опоясывающего герпеса на 1,4% через 30 месяцев наблюдения; 1 эпизод опоясывающего герпеса будет предотвращен на каждые 71 вакцинированных [97].
Систематический обзор восьми рандомизированных плацебоконтролируемых исследований, которые охватили 52269 участников, удалось установить, что у лиц старшего возраста вакцина предотвращает один эпизод опоясывающего лишая на каждые 70 вакцинированных, то есть она была эффективна в снижении риска опоясывающего лишая почти на 50 %. Побочные эффекты, вызванные вакциной, были представлены в основном лёгкими и умеренными симптомами в месте инъекции. [108]
Рекомендации по вакцинации против опоясывающего герпеса у лиц пожилого и старческого возраста

В октябре 2019 года Консультативный комитет по практике иммунизации проголосовал за утверждение Рекомендованного графика иммунизации взрослых в возрасте 19 лет или старше в США на 2020 год. Вакцинация может быть рассмотрена для людей с ВИЧ без признаков иммунитета против ветряной оспы, у которых количество CD4 составляет ≥200 клеток / мкл [98].
Противопоказания к вакцинации против опоясывающего герпеса
Вакцина противопоказана для лиц старшего возраста с любым из следующих диагнозов или лечения:
- Первичный или приобретенного иммунодефицит (в том числе лейкемии, лимфомы или других злокачественных новообразований, влияющих на костный мозг или лимфатическую систему).
- На фоне химиотерапии или лучевой терапии.
- После трансплантации органов.
- Терапия кортикостероидами ежедневно в дозе ≥20 мг / день преднизолона (или эквивалент) курс ≥14 дней. [96,97]
3.5. Вакцинация против менингококковой инфекции
Определение. Менингококковая инфекция – острая антропонозная инфекционная болезнь, с аэрозольным путем передачи возбудителя (Neisseria meningitidis), проявляется интоксикацией, поражением слизистой оболочки носоглотки и генерализацией в виде специфической септицемии (менингококкемии) и/или гнойного менингита. Источником являются больные с клинически выраженными и стертыми формами болезни (назофарингит), здоровые бактерионосители.
Характеристика возбудителя. Возбудитель менингококковой инфекции - Neisseria meningitidis - грамотрицательный, неподвижный диплококк, относится к роду Neisseria, семейству Neisseriaceae. В типичных случаях располагается попарно внутри нейтрофилов. Возбудитель по своей антигенной структуре подразделяется на 12 серогрупп: A, B, C, X, Y, Z, W–135, 29E, K, H, L, I, которые в свою очередь подразделяются на субгруппы, различающиеся по генетической характеристике. К факторам патогенности менингококка относят капсулу, пили, липополисахарид (эндотоксин) и IgA-протеазы. В мазках спинномозговой жидкости менингококки локализуются преимущественно внутриклеточно в цитоплазме полиморфноядерных нейтрофилов, реже, в первые часы болезни - внеклеточно. Аналогично он располагается и в мазках крови, причем при фульминантных формах преимущественно внеклеточно, часто по несколько пар в виде микроколоний. Менингококк неустойчив во внешней среде, погибает при высыхании и действии прямых солнечных лучей, температуры ниже 22°, дезинфицирующих средств. Культивируется в аэробных условиях на средах, содержащих белок или набор аминокислот. Крупные эпидемии в 20-м столетии, охватывающие одновременно многие страны мира, вызывались менингококком серогруппы А. Локальные эпидемические подъёмы в границах одной страны – менингококком В и С. Спорадическая заболеваемость межэпидемического периода формируется разными серогруппами, из которых основными являются - А, В и С. [37]
Эпидемиология. В Российской Федерации показатель заболеваемости за последнее десятилетие не превышает 2 на 100 тыс. населения (2006-2016 гг.), а средний уровень летальности определяется на уровне 15-20%. В Российской Федерации имеет за последние два года наблюдается рост заболеваемости. Показатель заболеваемости вырос на 40% по сравнению с 2016 г. (0,5 на 100 тыс. населения) и составил в 2018 г. 0,7 на 100 тыс населения при среднемноголетней заболеваемости 0,88. Наибольшие показатели заболеваемости, превышающие среднероссийский в 2-3 раза, зарегистрированы в Москве (2,27 на 100 тыс. населения), Ямало-Ненецком автономном округе (2,05 на 100 тыс населения), Пензенской (2,09 на 100 тыс населения), Новгородской (1,64 на 100 тыс. населения), Ульяновской (1,52 на 100 тыс. населения) областях и Хабаровском край (1,43 на 100 тыс населения). На генерализованные формы менингококковой инфекции в 2018 г. пришлось 73,9% случаев (2017 г. – 81,7%).
Во время эпидемического подъёма в 86-98% очагов возникает по одному заболеванию генерализованной формой, в 2-14% очагов – от 2 случаев и больше. Высокий процент вторичных (последовательных) заболеваний возникает в домах престарелых, стационарах социального обслуживания (12-14%). Возникновению вторичных заболеваний способствуют переуплотнение, повышенная влажность воздуха в помещении, нарушения санитарно-противоэпидемического режима. [38].
Рекомендации п[MO1] о вакцинации против менингококковой инфекции у лиц пожилого и старческого возраста
Лица старше 60 лет относятся к группе риска инфицирования и заболевания менингококковой инфекцией. В настоящее время мало данных о распространенности менингококковой инфекции у пожилых. Отдельные исследования свидетельствуют, что показатели смертности от менингококковой инфекции у лиц в возрасте 65 лет и старше были значительно выше, чем общие показатели (32% по сравнению с 5%, P <0,01) [38]. Возможно поэтому отсутствие экспериментальных данных о переносимости и реактогенности вакцины против менингококковой инфекции не помешало включить эту вакцину в национальные календари профилактических прививок.
Вакцинация проводится в рамках календаря профилактических прививок по эпидемическим показаниям. При использовании 4-х валентной конъюгированной вакцины достаточно вводить одну дозу. [109]
3.6. Вакцинация против коклюша
Определение. Коклюш (Pertussis) – острое антропонозное инфекционное заболевание, вызываемое бактериями рода Bordetella, преимущественно Bordetella pertussis, передающееся воздушно-капельным путем, характеризующееся длительным приступообразным судорожным (спазматическим) кашлем, поражением дыхательной, сердечно-сосудистой и нервной систем. [46]
Характеристика возбудителя. Bordetella pertussis (B. pertussis) – маленькая, требовательная к питательной среде грамотрицательная коккобактерия с особой предрасположенностью к слизистой оболочке дыхательных путей человека. Иногда другие возбудители, особенно B.parapertussis, могут вызывать коклюшеподобное заболевание. Виды Bordetella могут изменять свой фенотипический статус в зависимости от условий окружающей среды и могут демонстрировать резкое проявление факторов вирулентности.
Эпидемиология. Источниками инфекции являются больные (дети и взрослые) типичными и атипичными формами коклюша. Наиболее интенсивная передача возбудителя происходит при кашле. Риск инфицирования окружающих особенно велик в начале спазматического периода, далее постепенно снижается и, как правило, к 25-у дню больной коклюшем становится незаразным. Инкубационный период колеблется от 7 до 21 дня. Бактерионосительство при коклюше существенной эпидемиологической роли не играет. Восприимчивость к коклюшу сохраняется высокой у детей до 1 года, у лиц, не привитых против коклюша, а также утративших иммунитет к коклюшной инфекции с возрастом. Заболеваемость коклюшем взрослых за последние годы возросла практически в 2 раза и составляет на данный момент 0,4 на 100 тыс. населения.
Клинические данные. Данные о заболеваемости коклюшем взрослых, включая лиц пожилого и старческого возраста, ограниченны, что во многом обусловлено стертостью клинической картины. У взрослых клинические проявления как правило не выражены, варьируют от легких респираторных до классических симптомов продолжительного спазматического кашля, часто расцениваются как простудные заболевания, что приводит к существенной недооценке распространённости инфекции в этой возрастной группе [47].
Расширение серологического тестирования и внедрение обязательного сообщения о положительных тестах лабораториями в органы здравоохранения указывают на то, что распространенность коклюша среди взрослых в странах Европы варьирует от 160 - 169 случаев на 100000 населения в Германии до 145 случаев на 100000 населения во Франции. Оценка уровней антител, указывающих на недавнюю инфекцию, в Израиле показала, что заболеваемость может составлять 6469 случаев на 100000 населения старше 65 лет. [110]
Принимая во внимание риск коклюшных инфекций у взрослых, особенно в возрасте 65 лет и старше, особое внимание следует уделять людям с хроническими респираторными заболеваниями, особенно с ХОБЛ. Хотя связь между ХОБЛ и коклюшем в клинических условиях широко не исследовалась, некоторые предварительные исследования показали увеличение риска коклюша у пациентов с ХОБЛ по сравнению с пациентами без ХОБЛ. [54,55]
Рекомендации по вакцинации против коклюша лиц пожилого и старческого возраста
Согласно национальному прививочному календарю в Российской Федерации вакцинация против коклюша (вместе с вакцинацией против дифтерии и столбняка) проводится в детском возрасте. Взрослые до 64 лет, которые не были полностью привиты против коклюша, дифтерии и столбняка могут получить комбинированную вакцину для профилактики дифтерии – с уменьшенным содержанием антигена, столбняка, коклюша (бесклеточную) в качестве одной (ревакцинирующей) дозы.[111,112] Исследования продолжительности поствакцинального иммунитета и данные изучения повторных введений этой вакцины подтверждают возможность ее применения с интервалом 10 лет вплоть до 64 лет вместо вакцин, содержащих только столбнячный и дифтерийный анатоксины. Людям, серия вакцинации которых была прервана, возобновляется серия вакцинации без повторения предыдущих доз [53]. Однократная ревакцинация против коклюша во взрослом возрасте принята в Германии и США, в то время как в Австрии лицам после 60 лет рекомендуется ревакцинация каждые 3 года. [113]
3.7. Вакцинация против дифтерии
Определение. Дифтерия – острое заболевание, вызываемое экзотоксином, который выделяется Corynebacterium diphteriae (С.diphteriae). Заболеваемость и смертность обусловлены бактериальным токсином, который может вызвать развитие обструктивных пленочных налетов в верхних отделах дыхательных путей (круп) или повреждений в миокарде и других тканях.
Характеристика возбудителя. C. diphteriae - это палочковидная, булавовидной формы, грампозитивная бактерия, существующая в четырех биотипах (gravis, mitis, belfanti и inetrmedius). В дополнение к бактериальному экзотоксину, такие компоненты клеточных стенок, как О- и К-антигены, играют важную роль в патогенезе заболевания. Температуроустойчивый О-антиген является общим для всех коринебактерий, а изменчивый и чувствительный к воздействию температуры К-антиген позволяет дифференцировать различные штаммы. В то время как Кантиген играет важную роль в прикреплении к слизистой, инвазивности содействует токсический гликолипид. Наиболее важным фактором вирулентности C.diphteriae является обусловливаемый бактериофагами экзотоксин, высокоустойчивый полипептид, кодируемый бактериальной хромосомой. Находясь вне клетки хозяина, экзотоксин сравнительно неактивен, но после прикрепления к клетке и интернализации нетоксичного фрагмента В, выделяется высокотоксичный фрагмент (А), который убивает клетку, подавляя клеточный синтез белка. Дифтерийный экзотоксин вызывает местное и системное разрушение клеток.
Эпидемиология. На протяжении истории дифтерия была одной из наиболее опасных детских болезней, однако в последние годы данные эпидемиологии меняются и все чаще заболеваемость дифтерией наблюдается у пожилых людей. Хотя в большинстве случаев инфекция протекает бессимптомно или имеет сравнительно мягкое клиническое течение, многие пациенты становятся жертвой обструкции дыхательных путей, вызываемой дифтерией гортани, или токсического миокардита. Во время крупной эпидемии дифтерии в Европе и Соединенных Штатах в 1880-е годы уровень летальности достигал в некоторых районах 50%. Летальность в Европе во время Первой мировой войны снизилась до примерно 15%, главным образом, в результате широкого применения антитоксина для лечения дифтерии. Эпидемии дифтерии также свирепствовали в Европе во время Второй мировой войны, вызвав в 1943 г. около 1 миллиона случаев заболевания и 50 000 летальных исходов. Согласно расчетам, до того, как в 1980-е годы дифтерийный анатоксин стал широко доступным, в развивающихся странах ежегодно случалось около 1 миллиона случаев дифтерии и от 50 000 до 60 000 летальных исходов. Даже в последние годы из некоторых эндемичных районов сообщалось о том, что летальность при дифтерии превышает 10%. [115]
Клинические данные. В Европе заболеваемость дифтерией низкая: 36 случаев дифтерии в год (в среднем с 2009 по 2014 год), но вакцинация против этих болезней по-прежнему важна. [116] Например, в популяционном поперечном сероэпидемиологическом исследовании, проведённом в Нидерландах было показано снижение титров антител и в связи с этим недостаточный иммунитет против дифтерии, в связи с чем необходима ревакцинация.[117
Всемирная организация здравоохранения (ВОЗ) в настоящее время рекомендует серию первичных вакцинаций против столбняка и дифтерии в детстве и регулярную ревакцинацию на протяжении всей жизни, и эта рекомендация выполняется во многих странах. Большинство европейских стран рекомендуют регулярную ревакцинацию в зрелом возрасте каждые 10–20 лет. Рекомендации в Хорватии и Польше включают только однократную ревакцинацию в зрелом возрасте. Некоторые страны не рекомендуют вакцинацию в зрелом возрасте. Лишь несколько стран выпустили конкретные рекомендации для пожилых людей с сокращенными интервалами ревакцинации в Австрии, Франции и Лихтенштейне и дополнительными дозами в Хорватии и Испании. Во всех других странах также выполняются рекомендации для взрослых для пожилых людей. Хорватия, Чехия, Мальта, Румыния и Словения выпустили противоречивые рекомендации по столбняку и дифтерии. [118]
Рекомендации по вакцинации против дифтерии.
В России используются АДС-М анатоксин и АД-М анатоксин.
АДС-М анатоксин используют в случае, если с момента последней прививки против дифтерии и столбняка прошло 10 лет и более или содержание дифтерийного и столбнячного антитоксинов в сыворотке крови менее защитного уровня (в РПГА менее 1:20, в реакции нейтрализации токсина менее 0,01 МЕ/мл). АД-М анатоксин применяют, если от момента последней прививки против столбняка прошло менее 10 лет, а против дифтерии - 10 лет и более или содержание дифтерийного антитоксина составляет менее 1:20, а столбнячный антитоксин содержится в титре 1:20 и выше.
3.8. Вакцинация против гепатита В
Определение. Хронический гепатит B – длительное диффузное воспалительное поражение печени, которое может переходить в более тяжелое заболевание – цирроз и первичный рак печени, оставаться без изменений или регрессировать под влиянием терапии или спонтанно. Основным критерием для причисления заболевания к хроническому гепатиту является сохранение диффузного воспаления печени более 6 месяцев [64] .
Характеристика возбудителя. Вирус гепатита B (Hepatitis В virus, HВV) является ДНК-содержащим вирусом, систематизирован в семейство Hepadnaviridae (гепаднавирусов) род Orthohepadnavirus, обладающим высокой контагиозностью и устойчивостью к действию факторов окружающей среды. Геном образует неполная (с разрывом одной цепи) кольцевая двухнитевая молекула ДНК. Его репликация происходит путем обратной транскрипции внутри гепатоцитов хозяина. Вирус имеет сложное строение, включая двухцепочечную ДНК (частица Дейна) и 4 антигена – поверхностный (HBsAg), сердцевидный (НВсАg), антиген инфекционности (НВеАg) и НвхАg [65,66,67]. HBsAg входит в состав оболочки вируса и циркулирует в крови инфицированного в виде сферической и веретенообразной форм. НВсАg находится в центре частиц Дейна (собственно вируса) и обнаруживается только в гепатоцитах инфицированного человека. НВеАg также связан с ядром вируса и может циркулировать в крови инфицированного.
Эпидемиология. Распространенность хронического гепатита В в различных регионах мира вариабельна. Выделяют три категории стран с учетом уровня данного показателя: 1. страны с низкой распространенностью (США, страны Западной Европы, Австралия и Новая Зеландия), HBsAg в сыворотке крови выявляют примерно у 0,1-2% обследуемых; страны со средней распространенностью (страны Средиземноморского региона, Япония, Индия, Сингапуре), HBsAg – у 3-5% обследуемых; страны с высокой распространенностью (страны Юго-Восточной Азии, африканские страны, расположенные южнее Сахары), HBsAg – у 10-20% населения. По данным ВОЗ в США примерно 5% населения перенесло острый гепатит В, в то время как в некоторых районах Юго-Восточной Азии и Африки – 100%. Заболеваемость хроническим гепатитом В на территории Российской Федерации в 2000-2009 гг. стабилизировалась на уровне 14,0-16,0 на 100 тыс. населения. С 2010 г. наметилась тенденция к снижению заболеваемости. В 2015 г. выявлено 15717 новых случаев, показатель заболеваемости составил 10,78 на 100 тыс. населения, что на 33 % меньше, чем в 2009 г. – 14,39 на 100 тыс. населения. Эпидемический процесс, проявляющийся хроническими формами инфекции, играет ведущую роль в поддержании непрерывности процесса. По данным США, Израиля и Франции среди общего количества больных вирусным гепатитом В доля заражённых людей пожилого возраста составляет от 17 до 23% [68,69,70].
Клинические данные. Все рекомбинатные дрожжевые вакцины против гепатита В, зарегистрированные в России, характеризуются высокой безопасностью эффективностью. Специальных исследований по переносимости вакцинации против гепатита В у лиц пожилого возраста не проводилось. Известно, что использование рекомбинантных дрожжевых вакцин против гепатита В вызывает слабые местные реакции у 4-13% и общие реакции у 1-4% привитых (в основном после 1-й прививки), не ухудшая при этом их самочувствия. [73].
Уровень антителообразования на вакцинацию против вируса гепатита В зависит от возраста [74]. При исследовании титров антител на введение рекомбинатной вакцины против гепатита В 512 добровольцам, работающим в сфере медицинского обслуживания, частота выработки неадекватно низкого уровня антител (<10 мМЕД/л) значительно увеличивалась с возрастом – от 2,8% среди людей младше 30 лет до 42,1% среди лиц старше 60 лет [75]. При мультицентровом исследовании возраст оказался независимым фактором, позволяющим предсказать уровень ответа на вакцинацию. Другие исследования, в ходе которых также иммунизировались медработники, продемонстрировали сходные результаты. При вакцинации лиц, находившихся в домах престарелых, обнаружено, что уровень сероконверсии снижался с возрастом с 69,2% в возрастной группе 61-70 лет до 39,5% в возрастной группе 81-90 лет [76]. Ослабление иммунного ответа на вакцинацию с возрастом объясняется ухудшением функции Т-хелперов и реактивности В-клеток у пожилых людей [77].
При изучении иммуногенности рекомбинантной вакцины против гепатита В у 112 здоровых добровольцев в возрасте 59-81 год обнаружено, что использование лекарств во время первой вакцинации являлось единственным независимым фактором, обуславливающим силу ответа на вакцинацию [78]. Иммунный ответ на вакцинацию был менее выражен у тех лиц, которые принимали лекарственные препараты и чье общее состояние здоровья было хуже. Отмечено, что у лиц, чей возраст превышает 50 лет и которые имели низкий уровень анти – HBs после 3 вакцинаций, на 4-ю вакцинацию (на 9-м месяце после 1-й вакцинации) вырабатывался усиленный антительный ответ.
Вакцинация взрослых рекомбинатной вакциной (20 мкг/доза) вызывает быструю сероконверсию и создаёт достаточную защиту и позволяет свести к минимуму эффект субоптимального иммунного ответа у лиц пожилого возраста. Следовательно, лица пожилого возраста подлежат вакцинации против гепатита В, схема и доза которой подбираются индивидуально.
Рекомендации по вакцинации против вирусного гепатита В
Вакцинация против ВГВ осуществляется в Российской Федерации с 1996 года и внесла значительный вклад в процесс борьбы с гепатитом В. Могут быть использованы стандартная схема вакцинации (0-1-6 мес или 0-3-6 мес) или ускоренная (0-1-2-12 мес) . Ускоренная схема применяется как в группах риска, к которым относятся медицинские работники и другие лица, которые могут подвергаться воздействию вируса в процессе выполнения своих профессиональных обязанностей, лица с сахарным диабетом, пациенты с хронической почечной недостаточностью, ВИЧ-позитивные лица и другие лица с ослабленным иммунитетом, путешественники, младенцы, родившиеся с весом менее 2000 граммов, беременные [79]. Люди пожилого и старческого возраста могут рассматриваться, как кандидаты на вакцинацию, особенно если они принадлежат к группам риска заражения гепатитом В.
Вакцинацию против гепатита В у лиц пожилого и старческого возраста необходимо проводить как можно раньше по схеме 0-1-6 мес. Вакцины вводятся в дозах, установленных инструкциями по применению препаратов. При наличии сопутствующей патологии (при злокачественных новообразованиях или ХПН) схема вакцинации и дозы препаратов могут быть изменены. Вакцинация против гепатита В может быть совмещена с введением других вакцинных препаратов в разные участки тела. Вакцинация проводится на фоне терапии, которую получают пациенты пожилого возраста при наличии сопутствующей патологии. Для профилактики гепатита В вакцинация может быть проведена как до, так и сразу после операции. В случае предстоящей плановой операции прививку следует провести не позже чем за 1 месяц до операции [72].
При необходимости экстренной вакцинации (например, у лиц, которым предстоит операция с переливанием крови) существует схема 0-7-21 день с ревакцинацией через 12 мес. Абсолютными противопоказанием к вакцинации является повышенная чувствительность к дрожжам и другим компонентам препарата или тяжёлые реакции на предыдущее введение вакцины против гепатита В.
3.9. Вакцинация путешественников
Туризм становится неотъемлемой частью жизни людей старших возрастных групп. Заблаговременное планирование путешествия, осведомленность об эпидемиологической ситуации в разных регионах мира и принятие соответствующих профилактических мер могут значительно снизить риск негативных последствий поездки для здоровья.
Согласно санитарным правилам СП 3.4.2318-08, к инфекционным заболеваниям, требующим проведения мероприятий по санитарной охране территории Российской Федерации, относятся натуральная оспа, полиомиелит, вызванный диким полиовирусом, человеческий грипп, вызванный новым подтипом, тяжелый острый респираторный синдром (ТОРС), холера, чума, желтая лихорадка, лихорадка Ласса, болезнь, вызванная вирусом Марбург, болезнь, вызванная вирусом Эбола, малярия (вызванная Plasmodium (P.) falciparum, P. vivax, P. malariae, P. ovale), менингококковая болезнь [58]. Очень важно, чтобы выезжающие за рубеж ребенок или взрослый были полностью привиты согласно Национальному календарю профилактических прививок. Такие инфекции, как корь, краснуха, паротит, коклюш, дифтерия, полиомиелит в некоторых странах еще не контролируются полностью.
Желтая лихорадка – острое арбовирусное заболевание, передаваемое комарами, характеризуется лихорадкой, тяжелой интоксикацией, тромбогеморрагическим синдромом, поражением почек и печени [99]. В основном она поражает людей и обезьян и передается через укусы комаров Aedes. Лекарства от этой болезни нет [100]. Прививка против желтой лихорадки обязательна для выезжающих в эндемичные зоны (Центральная, Западная и Восточная Африка, Центральная и Южная Америка, Карибы), особенно если планируется длительное пребывание с разъездами вне мегаполисов. Отечественная живая вакцина против желтой лихорадки включена в международный сертификат. Она предназначена для иммунизации детей (с возраста 9 мес.) и взрослых. После курса иммуносупрессивной терапии вакцину вводят не ранее чем через 1 год. Вакцину вводят не позднее чем за 10 сут до выезда в эндемичный район. Повторную вакцинацию проводят через 10 лет. Людям в возрасте 60 лет и старше из-за более высокого риска возникновения опасных для жизни побочных эффектов вакцину следует вводить только тогда, когда существует значительный и неизбежный риск заражения желтой лихорадкой, такой как поездка в район, где существует текущий или периодический риск передачи желтой лихорадки. [62,63].
Полиомиелит – острое вирусное заболевание, характеризующееся поражением нервной системы (преимущественно серого вещества спинного мозга) [99]. В одном из 200 случаев инфицирования развивается паралитическая форма полиомиелита. 5–10% из числа таких парализованных людей умирают из-за наступающего паралича дыхательных мышц [100, 101]. В мире остаются эндемичными по полиомиелиту 3 страны (Афганистан, Нигерия и Пакистан). Однако до тех пор пока в мире остается хоть один инфицированный ребенок, риску заражения полиомиелитом подвергаются дети во всех странах [101]. Обязательна прививка против полиомиелита также для совершающих хадж в Саудовскую Аравию [102].
Для выезжающих в эндемичные по полиомиелиту регионы мира рекомендованы следующие схемы вакцинации:
- вакцинированным в детстве вводится 1 доза полиовакцины;
- лицам, не вакцинированным или с неясным вакцинальным статусом, инактивированная полиовакцина вводится по схеме 0–1–12 мес или 0–1–2 мес., или 0–1 мес, или 1 доза с последующей ревакцинацией (в зависимости от того, сколько времени остается до выезда в эндемичный по полиомиелиту регион).
Японский энцефалит – одна из наиболее тяжелых трансмиссивных нейроинфекций человека. Заболевание вызывается фильтрующимися нейротропными вирусами, переносчиками которых являются комары. Резервуаром для вируса в природе служат животные и птицы [100]. Японский энцефалит является основной причиной вирусного энцефалита во многих странах Азии, ежегодно вызывая почти 68 тыс клинических случаев заболевания. Несмотря на то, что симптоматический японский энцефалит встречается редко, показатель летальности среди заболевших энцефалитом может достигать 30%. Необратимые неврологические или психиатрические осложнения могут развиться у 30–50% лиц, переболевших энцефалитом. В 24 странах Юго-Восточной Азии и Западной части Тихого океана существует эндемическая передача японского энцефалита, угрожающая риском заражения более чем 3 млрд человек. Лекарства от этой болезни не существует. Лечение ориентировано на облегчение тяжелых клинических симптомов и оказание больному поддержки с целью преодоления инфекции [103]. Существуют безопасные и эффективные вакцины для профилактики японского энцефалита. Выезжающим в Южную и Юго-Восточную Азию следует сделать прививку от японского энцефалита. В России вакцины против японского энцефалита не зарегистрированы.[MO2]
Брюшной тиф – бактериальная кишечная инфекция, вызываемая сальмонеллой (Salmonella typhi). Единственным источником и резервуаром инфекции является человек. Особую опасность представляют хронические бактерионосители брюшного тифа, которые, оставаясь практически здоровыми, выделяют сальмонеллы в течение продолжительного времени, продолжая при этом посещать общественные места, выполнять свои служебные обязанности, в т. ч. на объектах питания и водоснабжения [100]. За последние годы эпидемии брюшного тифа наблюдались в ряде стран СНГ, в Азии, Африке и Латинской Америке [105]. По данным ВОЗ, ежегодно в мире регистрируется более 21 млн случаев брюшного тифа, из которых 1–4% заканчиваются летальным исходом, чему способствует возрастающая лекарственная устойчивость Salmonella typhi [105]. Вакцинация против брюшного тифа рекомендована всем туристам, выезжающим в Азию, Африку и Латинскую Америку.
Вакцины против брюшного тифа вводят взрослым однократно с последующей ревакцинацией через 3 года [105].
Клещевой энцефалит – тяжелое нейроинфекционное заболевание, часто приводящее к инвалидности или смерти. Вызывается флавивирусом, передается иксодовыми клещами, описаны случаи заражения через парное молоко. Эндемичен в лесных и таежных зонах, регистрируется во многих областях России [100]. Наиболее адекватным и надежным средством защиты от клещевого энцефалита является профилактическая вакцинация. Взрослым старше 60 лет перед выездом в эндемичный по клещевому энцефалиту регион необходимо иметь достаточно времени (не менее 1 мес.), чтобы успеть ввести 2 дозы вакцины с интервалом от 14 дней до 1–3 мес. (в зависимости от вакцины). В последующем потребуется однократная ревакцинация через 1 год, а затем каждые 3 года. В исследовании с участием взрослых в возрасте от 64 лет и старше серопротекция составила 65% с более высокими показателями у лиц, которые ранее были вакцинированы против вируса клещевого энцефалита [59].
4. Особенности вакцинации в условиях пандемии новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2
В настоящее время нет данных, свидетельствующих о том, что пандемия новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2 (COVID-19), привела к появлению каких-либо особых рисков, связанных с вакцинацией. Следовательно, по мере возможности следует продолжать плановую иммунизацию на базе медицинских учреждений, насколько позволяют условия и меры по борьбе с COVID-19 в конкретном регионе. Однако при этом необходимо соблюдать стандартные правила профилактики инфекций, чтобы свести к минимуму риск передачи COVID-19 персоналу и Важно обеспечить своевременное получение всех плановых профилактических прививок. Своевременное проведение прививок имеет ключевое значение для защиты пожилых людей от серьезных и опасных для жизни инфекционных заболеваний; оно также позволяет избежать увеличения численности непривитых групп населения и возможной утраты коллективного иммунитета к инфекциям [122,123].
COVID-19 – это новое заболевание, процесс накопления информации о котором все еще продолжается. Однако, опираясь на опыт борьбы с другими инфекционными болезнями, мы знаем, что вакцинация против одного заболевания не ослабляет иммунную реакцию организма на другое заболевание [123-125]. Более того, продолжение плановой вакцинации во время пандемии COVID-19 позволит защитить их от вакциноуправляемых инфекций. Легкие симптомы, такие как повышенная температура тела и/или кашель, не обязательно являются противопоказанием для проведения вакцинации [122]. В соответствии с международными рекомендациями врачи первичного звена должны давать своим пациентам соответствующие рекомендации, опираясь на анализ соотношения рисков и пользы (например, тяжесть имеющихся у пациента симптомов, а также риски и тяжесть течения ВУИ).
5. Противопоказания к вакцинации, нежелательные поствакцинальные явления
Противопоказания к проведению вакцинации подразделяются на истинные и ложные [114]
Истинные противопоказания
- выраженные, тяжелые системные реакции на предыдущее введение вакцины (анафилактические реакции);
- гиперчувствительность к любому компоненту вакцины;
- острые инфекционные заболевания или обострение хронического процесса (основного заболевания)
Вакцинацию можно проводить через 1-2 недели после достижения ремиссии или выздоровления от острого инфекционного заболевания.
Ложные противопоказания
К ложным противопоказаниям относят случаи отвода от вакцинации по основаниям, выходящим за рамки реальных противопоказаний. Основной причиной ложных отводов и задержек вакцинации у людей пожилого и старческого возраста является наличие хронического заболевания. Поддерживающее лечение хронического заболевания само по себе не может служить отводом от прививок. Местное лечение стероидами в виде мазей, капель в глаза, спреев или ингаляций не сопровождается иммуносупрессией и не препятствует вакцинации.
Таблица 5. Ложные противопоказания к проведению вакцинации взрослых, включая лиц пожилого и старческого возраста

К поствакцинальным осложнениям относятся тяжёлые и (или) стойкие нарушения состояния здоровья вследствие профилактических прививок: анафилактический шок, тяжелые генерализованные аллергические реакции (ангионевротический отёк), синдромы Стивенса – Джонсона, Лайелла, сывороточной болезни, энцефалит,в акциноассоциированный полиомиелит, поражение центральной нервной системы с генерализованными или фокальными остаточными проявлениями, приводящими к ивалидности: энцефалопатия, серозный менингит, неврит, полиневрит, судорожный синдром.
6. Вакцинация и антимикробная резистентность
Вакцинация способна снизить распространённость резистентности микроорганизмов к антимикробным препаратам путём снижения общего числа случаев инфекционных заболеваний. В частности, возможно снижение количества случаев через прямой и непрямой (популяционный) эффект, снижение числа циркулирующих резистентных штаммов, а также достижение выраженного эффекта путем использования конъюгированных вакцин. Кроме того, противовирусные вакцины обладают косвенным эффектом. Например, вакцинация против гриппа помогает снизить количество вторичных бактериальных инфекций (S. pneumoniae, S. aureus), а также сократить необоснованные назначения антибиотиков при вирусных респираторных заболеваниях, что в целом позитивно влияет на сдерживание к антимикробным препаратам.
В Российской Федерации принята стратегия предупреждения распространения антимикробной резистентности на период до 2030 года, где отмечено, что особая роль в борьбе с устойчивостью микроорганизмов принадлежит вакцинопрофилактике, которая обеспечивает формирование специфического иммунитета, что приводит к снижению потребности в применении противомикробных препаратов. Необходимо отметить, что риски взрослых и пожилых людей возрастают в связи со старением иммунной системы, регулярными путешествиями и хроническими заболеваниями, и вакцинация позволяет им оставаться здоровыми и полноценными членами общества. Соблюдение рекомендуемого графика иммунизации может помочь защитить детей и взрослых от инфекционных заболеваний, предотвратить распространение болезней, предупреждаемых с помощью вакцинации, а также может позволить сократить объем назначения антибиотиков. Наряду с другими подходами, вакцинация представляет собой один из наиболее важных подходов по ограничению распространения антимикробной резистентности, что достигается посредством:
- Профилактики инфекционных заболеваний и распространения возбудителя (вакцины ограничивают возможность возбудителя закрепиться в организме хозяина, тем самым, снижая вероятность мутаций и передачи резистентных генов; популяционный эффект вакцинации, позволяющий снизить риск заражения в популяции и защитить иммунокомпрометированных и другие группы пациентов, которым может быть противопоказана вакцинация) [126-128];
- Снижения потребления антимикробных препаратов в целом за счет снижения заболеваемости (например, пнемококковыми инфекциями за счет использования пневмококковых конъюгированных и полисахаридных вакцин) [129];
- Профилактики появления и распространения резистентных штаммов возбудителей (эффекты, продемонстрированные на примере включения вакцинации против S.pneumoniae и H.influenzae в национальные программы иммунизации) [130, 131];
- Снижения некорректного использования антибактериальных препаратов (в частности, неадекватных назначений антибиотиков при острых респираторных вирусных инфекциях, острых кишечных инфекциях вирусной этиологии) [132-135];
- Снижения возможности присоединения бактериальной ко-инфекции или суперинфекции и потребности в назначении антибактериальных препаратов (например, S.pneumoniae, S.aureus или H.influenzae при гриппе или COVID-19, S.aureus при ветряной оспе и др.) [136-139];
- Разработки новых вакцин с более высоким и более качественным покрытием серотипов (пневмококковые конъюгированные вакцины), вакцин, направленных на проблемных бактериальных возбудителей (например, MRSA, P.aeruginosa и K.pneumoniae) [140-142].
7. Нормативно-правовые документы, регламентирующие вакцинопрофилактику у взрослых в Российской Федерации
Вакцинопрофилактика у взрослых, включая лиц пожилого и старческого возраста, регулируется следующими правовыми актами:
- Федеральным законом «О санитарноэпидемиологическом благополучии населения» №52-ФЗ от 30.03.1999 г.
- Федеральным законом «Об иммунопрофилактике инфекционных болезней» № 157 – ФЗ от 17 сентября 1998 г.
- Приказом Министерства здравоохранения РФ от 21 марта 2014 г. N 125н "Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниямс изменениями на 24 апреля 2019 года)"
Профилактические прививки у лиц пожилого и старческого возраста, не имеющим медицинских противопоказаний к их проведению, проводятся в соответствии с национальным календарем профилактических прививок с согласия граждан или иных законных представителей граждан, признанных недееспособными в порядке, установленном законодательством Российской Федерации.
Национальный календарь профилактических прививок включает в себя профилактические прививки против гепатита В, дифтерии, коклюша, кори, краснухи, полиомиелита, столбняка, туберкулеза, эпидемического паротита, гемофильной инфекции, пневмококковой инфекции и гриппа.
Согласно национальному календарю профилактических прививок взрослые от 18 лет (включая лиц пожилого и старческого возраста) подлежат ревакцинация против дифтерии, столбняка каждые 10 лет от момента последней ревакцинации, взрослые старше 60 лет подлежат вакцинации против гриппа. В рамках календаря профилактических прививок по эпидемическим показаниям лица старше 60 лет, страдающие хроническими заболеваниями легких, лица старше трудоспособного возраста, проживающие в организациях социального обслуживания подлежат вакцинации против пневмококковой инфекции.
Список литературы
- Вацинопрофилактика. Клинические рекомендации для врачей общей практики (семейных врачей). Общероссийская общественная организация Ассоциация врачей общей практики (семейных врачей) Российской Федерации. Приняты на IV Конгрессе врачей первичного звена здравоохранения Юга России, IX Конференции врачей общей практики (семейных врачей) Юга России 7 ноября 2014 г., г. Ростов-на-Дону. Москва ‒ Новокузнецк –Ростов-на-Дону. 2014 год[НБ1] .
- Adult immunization. Bharti Mehta, Sumit Chawla, Vijay Kumar Dharma, Harashish Jindal, and Bhumika Bhatt. Hum Vaccin Immunother. 2014 Feb 1; 10(2): 306–309.
- https://www.who.int/ru/news-room/feature-stories/ten-threats-to-global-health-in-2019
- Rambhia KJ, Watson M, Sell TK, Waldhorn R, Toner E. Mass vaccination for the 2009 H1N1 pandemic: approaches, challenges, and recommendations. Biosecur Bioterror. 2010;8:321–30. doi: 10.1089/bsp.2010.0043.
- Institute of Medicine. The 2009 H1N1 influenza vaccination campaign: Summary of a workshop series. Washington, DC: The National Academies Press; 2010.
- Trust for America's Health. Adult immunization: Shots to save lives. Washington, DC: Trust for America's Health; 2010.
- (Vaccination of Specific Population In. Immunization & Vaccines: Canadian Immunization Guide. Evergreen ed. Ottawa: Public Health Agency of Canada; 2013. Available from: http://www. phac-aspc.gc.ca/publicat/cig-gci/p03-02-eng.php [accessed 25 September 2013)
- Winston CA, Wortley PM, Lees KA. Factors associated with vaccination of medicare beneficiaries in five U.S. communities: Results from the racial and ethnic adult disparities in immunization initiative survey, 2003. J Am Geriatr Soc. 2006;54:303–10. doi: 10.1111/j.1532-5415.2005.00585.x.
- Centers for Disease Control and Prevention (CDC) Influenza vaccination coverage among pregnant women: 2011-12 influenza season, United States. MMWR Morb Mortal Wkly Rep. 2012;61:758–63.
- Community Preventive Services Task Force. Vaccinations to prevent diseases: universally recommended vaccinations. Available from: http://www.thecommunityguide.org/vaccines/universally/index.html [accessed on 21 September 2013]
- Community Preventive Services Task Force. The guide to community preventive services. Increasing appropriate vaccination: universally recommended vaccinations. Atlanta, GA: US Department of Health and Human Services, CDC; 2011. Available from:http://www.thecommunityguide.org/vaccines/universally/index.html [accessed on 21 September 2013]
- Aging of the Immune System. Mechanisms and Therapeutic Targets. Cornelia M. Weyandcorresponding author and Jörg J. Goronzy. Ann Am Thorac Soc. 2016 Dec; 13(Suppl 5): S422–S428.
- Bansilal S, Castellano JM, Fuster V. Global burden of CVD: focus on secondary prevention of cardiovascular disease. Int J Cardiol. 2015;201:S1–S7.
- Hurme M, Korkki S, Lehtimäki T, Karhunen PJ, Jylhä M, Hervonen A, Pertovaara M. Autoimmunity and longevity: presence of antinuclear antibodies is not associated with the rate of inflammation or mortality in nonagenarians. Mech Ageing Dev. 2007;128:407–408.
- Whiting CC, Siebert J, Newman AM, Du HW, Alizadeh AA, Goronzy J, Weyand CM, Krishnan E, Fathman CG, Maecker HT. Large-scale and comprehensive immune profiling and functional analysis of normal human aging. PLoS One. 2015;10:e0133627.
- Jagger A, Shimojima Y, Goronzy JJ, Weyand CM. Regulatory T cells and the immune aging process: a mini-review. Gerontology. 2014;60:130–137.
- Suzuki M, Jagger AL, Konya C, Shimojima Y, Pryshchep S, Goronzy JJ, Weyand CM. CD8+CD45RA+CCR7+FOXP3+ T cells with immunosuppressive properties: a novel subset of inducible human regulatory T cells. J Immunol. 2012;189:2118–2130.
- Wen Z, Shimojima Y, Shirai T, Li Y, Ju J, Yang Z, Tian L, Goronzy JJ, Weyand CM. NADPH oxidase deficiency underlies dysfunction of aged CD8+ Tregs. J Clin Invest. 2016;126:1953–1967.
- Olshansky SJ. Articulating the case for the longevity dividend. Cold Spring Harb Perspect Med. 2016;6:a025940.
- Чучалин А.Г., Брико Н.И., Авдеев С.Н., Белевский А.С., Биличенко Т.Н., Демко И.В., Драпкина О.М., Жестков А.В.,Зайцев А.А., Игнатова Г.Л., Ковалишена О.В., Коршунов В.А., Костинов М.П., Мишланов В.Ю., Сидоренко С.В., Трушенко Н.В., Шубин И.В., Фельдблюм И.В. Федеральные клинические рекомендации по вакцинопрофилактике пневмококковой инфекции у взрослых. Пульмонология. 2019; 29 (1): 19–34. DOI: 10.18093/0869-0189-2019-29-1-19-34
- Баранов А.А., Баранова Л.С., Брико Н.И., Чучалин А.Г., Таточенко В.К., Харит С.Р., Федосеенко М.В., Полибин Р.В., Сухова В.А., Вишнева Е.А., Селимзянова Л.Р. Вакцинопрофилактика пневмококковой инфекции. Федеральные клинические рекомендации. – Москва, 2015 – 24 с.
- Niroshan iriwardena A., Asgar Z., Coupland C. Influenza vaccination, pneumococcal vaccination and risk of acute myocardial infarction: matched case control study// - CMAJ, 2010.
- Niroshan iriwardena A., Asgar Z., Coupland C. Influenza and pneumococcal vaccination and risk of stroke or transient ischaemic attack - Matched case control study// - 2014.-32.-Р.1354-1361.
- SEO Y.B., Suk Choi W., Hyeon Baek J. et al. Effectiveness of the influenza vaccine at preventing hospitalization due to acute exacerbation of cardiopulmonary disease in Korea from 2011 to 2012 // Human Vaccines&Immunotherapeutics. – 2014. – 10.-2.-P.423-427.
- Grohskopf, L.A.; Sokolow, L.Z.; Broder, K.R.; Walter, E.B.; Fry, A.M.; Jernigan, D.B. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices—United States, 2018–2019 Influenza Season. MMWR Recomm. Rep. 2018, 67, 1–20, doi:10.15585/mmwr.rr6703a1.
- Buchy P, Badur S, Who and when to vaccinate against influenza, International Journal of Infectious Diseases (2020), doi: https://doi.org/10.1016/j.ijid.2020.02.040
- Национальное научное общество инфекционистов. Клинические рекомендации. Грипп у взрослых. 2017г. стр. 17-28.
- О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2019 г.: Государственный доклад. – М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2020.- 299с.
- Иммунопрофилактика-2018: справочник/В.К. Таточенко, Н.А. Озерцовский. – 13-е ищд.,расш. – М.:Боргес,2018.-266 с.
- Письмо Минздравсоцразвития РФ от 26.05.2010г. №24-2/10/2 – 4353 «Рекомендации по тактике иммунизации населения в предстоящий сезонный подъём заболеваемости гриппом и ОРВИ в 2010/2011 гг.»
- Приказ Минздрава России от 21 марта 2014 г. №125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям» (в ред. Приказов Минздрава России от 16.06.2016 №370н, от 13.04.2017 №175н, от 19.02.2019 №69н)
- Adapted from Task Force on Community Preventive Services. Recommendations regarding interventions to improve vaccination coverage in children, adolescents and adults. Am. J. Prev. Med. 2000; 18:92−96, and Task Force on Community Preventive Services. Recommendations to improve targeted vaccination coverage among high-risk adults. Am. J. Prev. Med. 2005; 28: 231−237.
- Документ позиции ВОЗ. Вакцины против столбняка//WER.-2017-6. – С. 53-76.
- Специалисты о прививках. Столбняк:http://www.yaprivit.ru/diseases/stolbnyak/; доступ 18.01.2018.
- Приказ Минздрава России от 21 марта 2014 года. №125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям» (в ред. Приказов Минздрава России от 16.06.2016 г №370н от 13.04.2017 №175н от 19.02.20219 №69н).
- Методические указания МУ 3.1.2436-09 «Эпидемиологический надзор за столбняком»
- Менингококковая инфекция у взрослых. Менингококкцемия. Клинические рекомендации. 2015г.
- Gunaratnam P, Massey P, Durrheim D, Torvaldsen S. Invasive meningococcal disease in elderly people, New South Wales, Australia, 1993 to 2012. Western Pac Surveill Response J, 2013 Dec 9;4(4):4-10.
- Арвин А.М. Вирус ветряной оспы . Clin Microbiol Rev . 1996; 9 ( 3 ): 361–381. doi: 10.1128 / CMR.9.3.361
- Heininger U, Сьюард Дж. Ф. Ветряная оспа . Lancet . 2006; 368 ( 9544 ): 1365–1376. doi: 10.1016 / S0140-6736 (06) 69561-5
- Riera-Montes M, Bollaerts K, Heininger U, et al. Estimation of the burden of varicella in Europe before the introduction of universal childhood immunization. BMC Infect Dis. 2017;17(1):353. doi:10.1186/s12879-017-2757-2
- Varicella and herpes zoster vaccines: WHO position paper, June 2014. Wkly Epidemiol Rec. 2014;(25):265–288. Available from: https://www.who.int/immunization/policy/position_papers/varicella/en/. Accessed March 1, 2019.
- Heininger U, Seward JF. Varicella. Lancet. 2006;368(9544):1365–1376. doi:10.1016/S0140-6736(06)69561-5
- Streng A, Grote V, Carr D, Hagemann C, Liese JG. Varicella routine vaccination and the effects on varicella epidemiology – results from the Bavarian Varicella Surveillance Project (BaVariPro), 2006-2011. BMC Infect Dis. 2013;13(1):303. doi:10.1186/1471-2334-13-303
- Hazzard’s Geriatric Medicine and Gerontology, Seventh Edition 7th Edition p. 91-109.
- Коклюш у детей. Клинические рекомендации. Минздрав России 2019г.
- Plotkin Stanley A., Orenstein Walter, Offit Paul A. Plotkin’s Vaccines. – Seventh Edition. – 2018.
- Njamkepo E et al. Thirty-five years’ experience with the whole-cell pertussis vaccine in France: vaccine strains analysis and immunogenicity. Vaccine, 2002, 20:1290–1294.
- Todar K. Bordetella pertussis and whooping cough. Madison (WI): Todar’s Online Textbook of Bacteriology; 2009.
- Paddock CD, Sanden GN, Cherry JD, Gal AA, Langston C, Tatti KM, Wu KH, Goldsmith CS, Greer PW, Montague JL, et al. Pathology and pathogenesis of fatal Bordetella pertussis infection in infants. Clin Infect Dis. 2008;47:328–38.
- Lamberti Y, Gorgojo J, Massillo C, Rodriguez ME. Bordetella pertussis entry into respiratory epithelial cells and intracellular survival. Pathog Disease. 2013;69:194–204. doi:10.1111/2049-632X.12072.
- Приказ Минздрава России от 21 марта 2014 г. №125н «Об утверждении национального календаря профилактических прививок по эпидемическим показаниям» (в ред. Приказов Минздрава России от 16.06.2016 №370н, от 13.04.2017 №175н, от 19.02.2019 №69н).
- Recommendations for Interupted or Delayed Routine Immunization – Summary of WHO Position Papers (updated August 2018).
- Bonhoeffer J, Bär G, Riffelmann M, Soler M, Heininger U. The role of Bordetella infections in patients with acute exacerbation of chronic bronchitis. Infection. 2005;33:13–17. doi:10.1007/s15010-005-4004-9.
- Hashemi SH, Nadi E, Hajilooi M, Seif-Rabiei MA, Samaei A. High seroprevalence of Bordatella pertussis in patients with chronic obstructive pulmonary disease: a case-control study. Tanaffos. 2015;14:172–76.
- Buck PO, Meyers JL, Gordon LD, Parikh R, Kurosky SK, Davis KL. Economic burden of diagnosed pertussis among individuals with asthma or chronic obstructive pulmonary disease in the USA: an analysis of administrative claims. Epidemiol Infect. 2017;145:2109–21.
- Федеральное агентство по туризму. Показатели выезда российских граждан за рубеж 2019 год. http://opendata.russiatourism.ru/7708550300-travellingabroad/3.
- Санитарные правила СП 3.4.2318–08 «Санитарная охрана территории Российской Федерации».
- Kling K1, Harder T1, Younger Z1, Burchard G2, Schmidt-Chanasit J2,3, Wichmann O1. Vaccination against Japanese Encephalitis with IC51: Systematic Review on immunogenicity, duration of protection, and safety. J Travel Med. 2020 Feb 10. pii: taaa016.
- The international society of travel medicine. Mission statement. Доступно на www.istm.org.
- Всемирная организация здравоохранения. http://www.who.int/. Центр по контролю за заболеваемостью и профилактике. http://www.cdc.gov.
- World Health Organization. Country list - Vaccination requirements and recommendations for international travellers; and malaria situation per country International Travel and Health 2019 [Accessed 25 November 2019]
- MHRA, PHE, NaTHNaC, HPS Yellow fever vaccine: stronger precautions in people with weakened immunity and those aged 60 years or older November 21, 2019[Accessed 25 November 2019]
- European Association for the Study of the Liver. EASL clinical practice guidelines:management of chronic hepatitis B virus infection. J Hepatol 2012; 57:167–85.
- National Institute for Health and Care Excellence (NICE). Hepatitis B (chronic): diagnosis and management of chronic hepatitis B in children, young people and adults [Internet]. London: NICE; 2013. Available from: http://www.nice.org.uk/guidance/cg165/resources/guidance-hepatitis-bchronic-pdf.
- Инфекционные болезни: национальное руководство / под ред. Н.Д. Ющука, Ю.Я. Венгерова. – 2-е изд., перераб. и доп. – М.: ГЭОТАР-Медиа, 2019. (Серия «Национальные руководства»)
- European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2017, 370-398
- Goodson J.D., Taylor P.F., Campion E.V. et.al The clinical course of acute hepatitis in the elderly patients// Arch. Intern. Med. – 1982. – Vol. 142. – P. 1485-1488.
- Sonnenblick M., Oren R., Tur-Kaspa R. Non A, non D hepatitis in the aged// Postgrad. Med. J. – 1990. – Vol. 66 – P. 462-464.
- Laverdant C., Algayers J.P., Daly J.P. Viral hepatitis in patients over 60 years of age: Clinical, etiologic and developmental aspects // Gastroenterol. Clin. Biol. – 1989.-Vol. 13. – P.499 – 504.
- Акимкин В.Г., Семененко Т.А. Эпидемиологическая и иммунологическая эффективность вакцинации медицинских работников против гепатита В//Эпидемиология и вакцинопрофилактика. – 2017г. – 4 (95)ю – С. 52-57
- Вакцинация против гепатита В, гриппа и краснухи взрослых пациентов с хроническими заболеваниями / Под ред. М.П.Костинова В.В. Зверева – М.: МДВ, 2009. С.174-176.
- Иммунопрофилактика. – М.: Изд-во Серебряные нити,- 2005г.
- Clements M.L., Miskovsky E., Davidson M. et al. Effect of age on the immunogenicity of yeast recombinant hepatitis B vaccine containing surface antigen (S) or preS2 + S antigen // J. Infect. Dis. – 1994. – Vol. 70. – P. 510-516.
- Roome A.J., Walsh S.J., Cartter M.L., Hadler J.M. Hepatitis B vaccine responsiveness in Connecticut public safety personnel // J.A.M.A. – 1993. – Vol. 270. – P. 2931-2934.
- Denis F., Mounier M., Hessel L. et al. Hepatitis B vaccination in the elderly // J. Infect. Dis. – 1984. – Vol. 149. – P. 1019.
- Adier W.H., Nagel J.E. Clinical immunology and aging. Principles of Geriatric Medicine and Gerontology. Ed. W.H. Hazzard, E. Bierman and J.D.Blass. – New York: McGraw-Hill, - 1994. – P. 1458 – 1478.
- De-Rave S., Heijtink R.A., Bakker-Bandik M. et al. Immunogenicity of standart and low dose vaccination using yeast recombinant hepatitis B surface antigen in elderly volunteers// Vaccine. – 1994. – Vol. 12. – P. 532-534.
- Документ позиции ВОЗ. Hepatitis D vaccines: WHO position paper – July 2017 // WER. – 2017. – 27. – P. 369-392.
- Tan L. Adult vaccination: now is the time to realize an unfulfilled potential. Human Vacc Immunother. 2015;9:2158–2166.
- Suhrcke M, McKee M, Sauto Arce R, Tsolova S, Mortensen J. The contribution of health to the economy in the European Union. European Communities, Luxembourg 2005. https://ec.europa.eu/health/archive/ph_overview/documents/health_economy_en.pdf. Last accessed 6 Feb 2018.
- European Commission, Directorate-General for Economic and Financial Affairs. Sustainability Report. Brussels, 2009. http://ec.europa.eu/economy_finance/publications/pages/publication15998_en.pdf. Last accessed 6 Feb 2018.
- World Health Organization. WHO report on healthy aging. Geneva 2015. http://apps.who.int/iris/bitstream/10665/186463/1/9789240694811_eng.pdf. Last accessed 6 Feb 2018.
- Всемирная организация здравоохранения. Доклад ВОЗ о здоровом старении. Женева, 2015 год. Http://apps.who.int/iris/bitstream/10665/186463/1/9789240694811_rus.pdf .
- Bula CJ, Ghiraldi G, Weitlisbach V, et al. Infections and functional impairment in nursing home residents: a reciprocal relationship. J Am Geriatr Soc. 2004;52:700–706.
- Gonzalez-Romo F., Picazo J.J. Rojas A.G. et al. [Con sensus document on pneumococcal vaccination in adults at risk by age and underlying clinical conditions. 2017 Update]. Rev.Esp. Quimioter. 2017; 30 (2): 142–168. Available at: http://www.seq.es/seq/0214-3429/30/2/gonzalez15feb2017.pdf. (in Spanish).
- John M McLaughlin, Qin Jiang, Raul E Isturiz,Heather L Sings, David L Swerdlow, Bradford D Gessner, Ruth M Carrico, Paula Peyrani, Timothy L Wiemken, William A Mattingly, Julio A Ramirez, and Luis Jodar.
- Greenberg R.N., Gurtman A., Frenck R.W. et al. Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naïve adults 60–64 years of age.Vaccine. 2014; 32 (20): 2364–2374.
- CDC. Tetanus surveillance—United States, 2001–2008. MMWR Morb Mortal Wkly Rep 2011;60:365–9.
- Borrow R, Balmer P, Roper MH. The immunologic basis of immunization series—Module 3: tetanus update 2006. Geneva, Switzerland: World Health Organization; 2007.
- Hope-Simpson RE. The nature of herpes zoster: a long-term study and a new hypothesis. Proc R Soc Med 1965;58:9-20
- Weller TH. Varicella and herpes zoster: changing concepts of the natural history, control, and importance of a not-so-benign virus. N Engl J Med 1983;309:1434-1440
- Gnann JW Jr, Whitley RJ. Herpes zoster. N Engl J Med 2002;347:340-346
- Kost RG, Straus SE. Postherpetic neuralgia -- pathogenesis, treatment, and prevention. N Engl J Med 1996;335:32-42
- Dworkin RH, Schmader KE. The treatment and prevention of postherpetic neuralgia. Clin Infect Dis 2003;36:877-882
- Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005; 352:2271.
- Tseng HF, Smith N, Harpaz R, et al. Herpes zoster vaccine in older adults and the risk of subsequent herpes zoster disease. JAMA 2011; 305:160.
- Mark Freedman, DVM, MPH; Andrew Kroger, MD, MPH; Paul Hunter, MD; Kevin A. Ault, MD; for the Advisory Committee on Immunization Practices. Clinical Guidelines. Recommended Adult Immunization Schedule, United States, 2020
- Избранные вопросы терапии инфекционных больных: руководство для врачей / Под ред. Ю.В. Лобзина. СПб: ООО «Издательство Фолиант», 2005. 912 с.
- Руководство по инфекционным болезням / Под ред. Ю.В. Лобзина. 3-е изд., доп. и перераб. СПб: ООО «Издательство Фолиант», 2003. 1040 с.
- ВОЗ. Полиомиелит. Информационный бюллетень №114. Май 2014 г. http://www.who.int/ mediacentre/factsheets/fs114/ru.
- WHO: International travel and health 2012 Edition, 265 pages. http://www.who.int/ith/en/index.html.
- ВОЗ. Японский энцефалит. Информационный бюллетень № 386. Март 2014 г http://www. who.int/mediacentre/factsheets/fs386/ru
- Travel Smart: Get Vaccinated http://www.cdc.gov/features/vaccines-travel.
- ВОЗ. Брюшнотифозные вакцины: документ с изложением позиции ВОЗ. Еженедельный эпидемиологический бюллетень. 2008. № 6. http://www.who.int/wer.
- Инструкция по применению ППВ-23. URL: https://www.rlsnet.ru/tn_
- index_id_249.htm(07 Февраля 2020).Чучалин
- Рудакова А.В., Брико Н.И.,Лобзин Ю.В., Намазова-Баранова Л.С., Авдеев С.Н., Игнатова Г.Л., Костинов М.П., Королева И.С, Полибин Р.В., Фомин И.В. Вакцинация взрослых против пневмококковой инфекции в российской федерации: социальные и фармакоэкономические аспекты // Журнал инфектологии. – 2018. - 10(3). - С.11-22 https://doi.org/10.22625/2072-6732-2018-10-3-11-22
- Gagliardi A. M., Gomes Silva B. N., Torloni M. R., Soares B. G. Vaccines for preventing herpes zoster in older adults. (англ.) // The Cochrane Database Of Systematic Reviews. — 2012. — 17 October (vol. 10). — P. 008858—008858. — doi:10.1002/14651858.CD008858.pub
- Вакцинация взрослых – от стратегии к тактике. Руководство для врачей. М.П. Костинов — М.: Группа МДВ, 2020. — 248 с. ISBN 978-5-906748-17-1).
- [Rendi-Wagner P, Tobias J, Moerman L, Goren S, Bassal R, Green M, et al. The seroepidemiology of Bordetella pertussis in Israel – Estimate of incidence of infection. Vaccine 2010;28(April (19)):3285–90]
- Ridda I, Yin JK, King C, MacIntyre CR, McIntyre P. The Importance of Pertussis in Older Adults: A Growing Case for Reviewing Vaccination Strategy in the Elderly. Vaccine. 2012 Nov 6;30(48):6745-52
- Вакцинация взрослых – от стратегии к тактике. Руководство для врачей. М.П. Костинов — М.: Группа МДВ, 2020. — 248 с.
- Triglav T,Poljak M. Vaccination indications and limits in the elderly. Acta Dermatovenerologica. 2013;22:65-70
- Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации Минздрава России. http://www.roszdravnadzor.ru/documents/63402
- WHO. Weekly epidemiological record, No. 3, 20 January 200
- Vaccine‐Preventable Diseases: Monitoring System. 2016. Available at: http://apps.who.int/immunization_monitoring/globalsummary (accessed 14 January 2016).
- B. Weinberger. Adult vaccination against tetanus and diphtheria: the European perspective. Clin Exp Immunol. 2017 Jan; 187(1): 93–99.
- Swart EM, van Gageldonk PG, de Melker HE, van der Klis FR, Berbers GA, Mollema L. Long-Term Protection against Diphtheria in the Netherlands after 50 Years of Vaccination: Results from a Seroepidemiological Study. PLoS One. 2016;11(2):e0148605.
- Вакцинопрофилактика работающего населения. Руководство для врачей / Под ред. И.В. Бухтиярова, Н.И. Брико. — Москва: МИА, 2019
- Брико, Н. И. Руководство по эпидемиологии инфекционных болезней : в 2 т. / Н. И. Брико, Г. Г. Онищенко, В. И. Покровский. - Москва : МИА. -2019..
- Брико Н.И., Намазова-Баранова Л.С., Костинов М.П., Симонова Е.Г. Федосеенко М.В. Эпидемиология, клиника и профилактика пневмококковой инфекции. Учебное пособие для врачей / Под редакцией Н.И. Брико. – Москва – Ремедиум - 2017. -112 с.
- Безопасность вакцин и ложные противопоказания к вакцинации. Учебное руководство. Копенгаген: Европейское региональное бюро ВОЗ; 2017 (http://www.euro.who.int/__data/assets/pdf_file/0009/351927/WHO-Vaccine-Manual.pdf, по состоянию на 10 июня 2020 г.).
- Руководство по плановой иммунизации во время пандемии COVID-19 в Европейском регионе ВОЗ. Копенгаген: Европейское региональное бюро ВОЗ; 2020 (http://www.euro.who.int/en/health-topics/communicable-diseases/hepatitis/publications/2020/guidance-on-routine-immunization-services-during-covid-19-pandemic-in-the-who-european-region-2020, по состоянию на 10 июня 2020 г.).
- Глобальный консультативный комитет по безопасности вакцин, 6–7 июня 2006 г. Ежемесячный эпидемиологический бюллетень. 2006: 28(81):273–84 (https://www.who.int/vaccine_safety/committee/reports/wer8128.pdf?ua=1, по состоянию на 10 июня 2020 г.).
- Miller E, Andrews N, Waight P, Taylor B. Bacterial infections, immune overload, and MMR vaccine. Arch Dis Child. 2003;88:222–3.
- Kennedy D.A., Read A.F. Why does drug resistance readily evolve but vaccine resistance does not? Proc Biol Sci. 2017; 284: 1-9.
- Rappuoli R. et al. Deploy vaccines to fight superbugs. Nature. 2017; 552: 165-7.
- Mallory M.L. et al. Vaccination-induced herd immunity: successes and challenges. J Allergy Clin Immunol. 2018; 142: 64-6.
- Centers for Disease Control and Prevention. Pneumococcal Disease. Drug Resistance. Available at: https://www.cdc.gov/pneumococcal/drug-resistance.html Accessed on 28 Oct 2020.
- Bisgard K.M. et al. Haemophilus influenzae invasive disease in the United States, 1994–1995: near disappearance of a vaccine-preventable childhood disease. Emerg Infect Dis. 1998; 4: 229-37.
- Rappuoli R. et al. Deploy vaccines to fight superbugs. Nature. 2017; 552: 165-7.
- Грекова, А.И. Выбор антибактериальной терапии острых кишечных инфекций у детей (результаты многоцентрового аналитического исследования) / А.И. Грекова, Л.П. Жаркова // Педиатрическая фармакология. – 2007. – Т. 4, № 3. – С. 16-19.
- Горбачева, Е.В. Фармакоэпидемиологический анализ антибактериальной терапии кишечных инфекций у детей.- Хабаровск: Изд. ДВГМУ, 2018.- 148 с.
- Рачина С.А., Козлов Р.С., Таточенко В.К., Анализ подходов к применению антибиотиков при инфекциях верхних дыхательных путей и ЛОР-органов у детей: результаты опроса участковых педиатров- Клин микробиол антимикроб химиотер 2016, Том 18, № 1.
- Buckley B.S. et al. Impact of vaccination on antibiotic usage: a systematic review and meta-analysis. Clin Microbiol Infect. 2019; 25: 1213-25.
- Kwong J.C. et al. The effect of universal influenza immunization on antibiotic prescriptions: an ecological study. Clin Infect Dis. 2009; 49: 750-756
- Klein E.Y. et al. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses. 2016; 10: 394-403.
- Johansson N. et al. Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods. Clin Infect Dis. 2010; 50: 202-9.
- Wolfson L.J. et al. The use of antibiotics in the treatment of pediatric varicella patients: real-world evidence from the multi-country MARVEL study in Latin America & Europe. BMC Public Health 2019; 19, 826.
- Masomian M. et al. Development of Next Generation Streptococcus pneumoniae Vaccines Conferring Broad Protection Vaccines (Basel). 2020 Mar; 8(1): 132.
- Tekle Y.I. et al. Controlling antimicrobial resistance through targeted, vaccine-induced replacement of strains. PLoS One. 2012; 7e50688.
- Hegerle N. et al. Development of a broad spectrum glycoconjugate vaccine to prevent wound and disseminated infections with Klebsiella pneumoniae and Pseudomonas aeruginosa. PLoS One. 2018; 13e0203143.
Комментарии • 0
Чтобы оставить комментарий, пожалуйста, войдите на портал