3.1 Врожденная диафрагмальная грыжа
Общие принципы лечения включают пренатальную помощь, постнатальное медикаментозное лечение, хирургическую коррекцию [1,2,47,48].
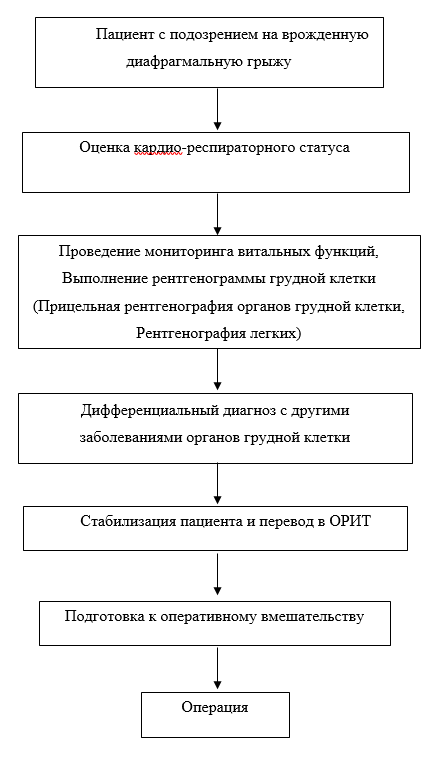
3.1.1 Пренатальная помощь
- Беременной женщине при обнаружении у плода диафрагмальной грыжи рекомендуется проведение консультации генетика. Пренатальная диагностика позволяет проводить информированное консультирование матери и семьи, включая варианты лечения и прогноз [2,68–70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В качестве пренатальной помощи возможно применение фетальных процедур: установка окклюзирующегго баллона в трахею плода с использованием фетоскопии. Эти баллоны вводятся под контролем УЗИ между 24 и 28 неделями беременности и удаляются на 34 неделе. Окклюзия трахеи плода при ВДГ остается недоказанной терапией и должна проводиться только как часть продолжающегося рандомизированного испытания [69,70]. Также имеются сообщения о применении медикаментозных препаратов для уменьшения легочной гипертензии у ребенка в постнатальном периоде. Несмотря на многообещающие рубежи в исследованиях пренатальных медицинских и фармакологических вмешательств для ВДГ, использование этих методов лечения остается неясным. На данный момент нет показаний для какой-либо пренатальной фармакотерапии при ВДГ [2,68].
3.1.2 Консервативное лечение
Консервативное лечение включает все виды лечения, направленные на стабилизацию пациента после рождения, предоперационную подготовку и послеоперационный период. Антибиотикотерапия, инфузионная терапия и парэнтеральное питание назначаются по стандартной методике [3].
3.1.2.1 Мероприятия в родильном зале
- После рождения ребенку с врожденной диафрагмальной грыжей рекомендуется [3,47,48]:
- выполнить интубацию трахеи,
- подключить к аппарату ИВЛ,
- согреть,
- выполнить катетеризацию периферической/центральной вены
- зондирование желудка.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В большинстве случаев о существовании ВДГ у новорожденного уже известно заранее, поэтому в родзале необходимо быть готовым к проведению мероприятий по оказанию специализированной помощи новорожденному. Вентиляция с использованием маски и неинвазивная искусстивенная вентиляция легких противопоказаны.
Допустимо использовать на короткое время катетер, установленный в пупочную вену (Катетеризация пупочных сосудов у новорожденных). При необходимости проводят реанимационные мероприятия [27] :
Этап | Действия |
Прогноз ВДГ по данным пренатальной диагностики | Благоприятный | Неблагоприятный |
Процедура EXIT – интубация трахеи на не пережатой пуповине | Рутинно не проводится | Возможна к применению, время проведения не более 60 с |
Респираторная терапия | Интубация трахеи сразу после рождения с последующим переводом на ИВЛ. У младенцев с ВДГ трахея может быть короче, и им требуется модифицированная формула расчета глубины интубационной трубки в сантиметрах от губ: 5,5 + вес при рождении (кг), чтобы избежать интубации правого главного бронха [1] Противопоказано проведение ИВЛ/СРАР лицевой маской и респираторная терапия СРАР любым способом Стартовые параметры ИВЛ (профилактика баро- и волюмотравмы): Ppeak до 25мм.рт.ст., РЕЕР 5мм.рт.ст., VR до 60/мин, FiO2 до 100% Целевые показатели оксигенации: предуктальная SpO2 80-95% постдуктальная SpO2 >70% Зондирование желудка |
Поддержание системного АД | Катетеризация пупочных сосудов новорожденных (вены)/обеспечение венозного доступа путем постановки катетера в периферическую вену (в случае технических сложностей) Волюмнагрузка натрия хлорид** 0,9% внутривенно струйно 10мл/кг |
Леченбно-охранительный режим [27] | Медикаментозная седация и аналгезия: #Фентанил** 5 мкг/кг внутривенно струйно #Мидазолам**” 0,05-0,1 мг/кг внутривенно струйно #Диазепам**” 0,1-0,25 мг/кг внутривенно болюсно каждые 6 часов, При необходимости и невозможности синхронизировать с ИВЛ дополнительно проводится миоплегия: #Атракурия безилат 0,6 мг/кг внутривенно струйно #Рокурония бромид**” 0,6 мг/кг внутривенно струйно |
Сердечно-легочная реанимация | При необходимости проводится полный цикл реанимационных мероприятий согласно действующему методическому письму «Реанимация и стабилизация состояния новорожденных детей в родильном зале», 2020г |
Транспортировка в отделение реанимации | На ИВЛ в транспортном кювезе при достижении ЧСС выше 100/мин |
” Относится к препаратам off-label у новорожденных. При назначении необходимо оформить в истории болезни заключение врачебной комиссии лечебного учреждения и согласие законных представителей ребенка на его применение.
Дальнейшая стабилизация пациента проводится в условиях ОРИТ.
3.1.2.2 Предоперационная стабилизация и послеоперационное лечение в ОРИТ
Дальнейшая стабилизация каждого пациента с врожденной диафрагмальной грыжей проводится в условиях ОРИТ.
- Пациентам с врожденной диафрагмальной грыжей рекомендуется проведение комплексных исследований при проведении искусственной вентиляции легких (мониторинг сердечной деятельности, мониторинг дыхания и анализ китслотно-основного состояния и газов крови) [2,3,47,71].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
1. Мониторинг сердечной деятельности включает:
- Измерение частоты сердцебиения
- Регистрация электрокардиограммы в трех стандартных отведениях, расшифровка, описание и интерпретация электрокардиографических данных
- Измерение артериального давления на периферических артериях
2. Мониторинг дыхания включает:
- Пульсоксиметрия (с ипользованием накожного датчика и регистрацией показателей на прикроватном мониторе). Пульсоксиметрию (исследование уровня кислорода крови (проводят предуктально (правая рука) и постдуктально (левая рука, стопы).
- Оценка показателей функции дыхания по монитору аппарата ИВЛ: a. Vt (дыхательный объем),b. С (растяжимость легких),c. R (сопротивление дыхательных путей),d. MAP (среднее давление в дыхательных путях)
- Капнометрия ЕТСО2 (концентрация углекислого газа в конце выдоха)
3. Анализ кислотно-основного состояния и газов крови (проводят в артериальном образце) не реже 2-х раз в сутки
- Исследование уровня водородных ионов (pH) крови
- Исследование уровня буферных веществ в крови
- Исследование уровня углекислого газа в крови
- Исследование уровня кислорода в крови
- Исследование уровня лактата в крови
- Исследование уровня глюкозы в крови
4. Термометрия общая
- Пациентам с врожденной диафрагмальной грыжей рекомендуется обеспечение сосудистого доступа [27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Центральный венозный доступ рекомендовано обеспечить каждому пациенту с целью проведения инфузионной терапии, парэнтерального питания, введения адренергических и дофаминергических средств, обезболивания, седации, антибактериальной терапии [3,47].
Рекомендовано выполнить катетеризацию сосудов нижней полой вены: бедренные вены по методу Сельдингера, методом открытой венесекции, транскутанным доступом. Аретериальный доступ обеспечивают пункционным или секционным доступом.
- Пациентам с врожденной диафрагмальной грыжей рекомендуется проведение респираторной поддержки для обеспечения адекватного газообмена [2,3,47,48,72,73].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В настоящее время рекомендации по проведению искусственной вентиляции легких у пациентов с ДГ в раннем неонатальном периоде одобряют стратегию, которая делает упор на защиту легких (сведение к минимуму баротравмы и волютравмы) с помощью легкой пермиссивной гиперкапнии и гипоксемии, также известной как “щадящая вентиляция легких” [4,5]. Для обеспечения щадящей вентиляции легких при ВДГ можно эффективно использовать как режимы CMV, так и ВЧО ИВЛ. Цель респираторной поддержки – обеспечить уровень предуктального насыщения крови кислородом на уровне 80-95%, постдуктального – выше 70% при РаСО2 от 50 до 70 мм.рт.ст.
Рекомендованные параметры вентиляции режима CMV:
Ppeak не выше 25мм.рт.ст.; РЕЕР 3-5 мм.рт.ст.; VR 40 – 60/мин; ДО 6-8 мл/кг. Если для достижения уровня РаСО2 50-70мм.рт.ст, требуется Ppeak выше 28 мм.рт.ст., необходимо рассмотреть альтернативные респираторные стратегии: ВЧО ИВЛ или ЭКМО [4,5].
Рекомендованные параметры вентиляции режима ВЧО ИВЛ:
1. Частота (Hz)
= 15 Гц (масса <1000 г)
= 11-14 Гц (масса 1000-2000 г)
= 8-10 Гц (более 2000 г)
2. Power (ΔP) /амплитуда колебательного давления:
Амплитуда рассчитывается по формуле: ΔP = 4 х М.т. (кг) + 25.
Контроль адекватности проведения ВЧО ИВЛ осуществляется рентгенологически. Об адекватности подобранных параметров можно судить в том числе по уровню стояния диафрагмы (VIII-IX ребро).
- Проведение гемодинамической поддержки и лечение легочной гипертензии рекомендуется всем пациента с диафрагмальной грыжей, у которых они зарегистрированы [2,3,47,48,71,74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: общее состояние новорожденного с ДГ после рождения может оставаться крайне тяжелым, что требует проведение реанимационных (противошоковых) мероприятий, направленных в первую очередь для поддержания стабильной гемодинамики [27]
Для поддержания гемодинамики используют адренергические и дофаминергические средства
Стартовыми препаратами для поддержания адекватного артериального давления является допамин** и добутамин**. При неадекватном ответе, а также при наличии метаболического ацидоза, необходимо допамин** заменить на эпинефрин**. При отсутствии эффекта от увеличения дозы эпинефрина** – назначаются кортикостероиды системного действия. – #гидрокортизон** (АТХ - H02А). Дозировка 1-2 мг/кг разовая доза, в водится внутривенно струйно каждые 6 часов, максимальная доза 2-2,5 мг/кг каждые 4 часа.
При неэффективности описанной терапии и подтвержденной нормальной сократимости миокарда возможно использование норэпинефрин**. Дозировка 0,1-0,3 мкг/кг/мин, внутривенно капельно в течение суток.
При изначальном (при рождении) декомпенсированном ацидозе (любом), адренергическим и дофаминергическим средством первой линии будет эпинефрин**. Дозировка 0,1-0,5 мкг/кг/мин, внтривенно капельнов течение суток.
Резистентная гипотония, включая случаи, требующие инфузии высоких доз адренергических и дофаминергических средств, является показанием для ВАЭКМО.
Легочная гипертензия является распространенным и серьезным осложнением у младенцев с ВДГ.
Препаратом первой линии для лечения легочной гипертензии является динитрогена оксид**.
Ингаляция динитрогена оксида** осуществляется в процессе традиционной ИВЛ или ВЧО ИВЛ путем подачи газовой смеси непосредственно в контур пациента (через дополнительный порт в коннекторе интубационной трубки или дыхательном контуре).
Обязательно мониторирование вдыхаемых газов для постоянного измерения концентраций NO и NO2 с отключением подачи газа, если концентрации NO или NO2 превышают допустимые пределы.
Простагландин Е1 (#Алпростадил**)” (Простагландины (С01ЕА)) [27]
Цель назначения – поддержание открытого артериального протока для облегчения право-левого сброса, снижения легочной гипертензии и правожелудочковой сердечной недостаточности. Дозировка 0,005-0,01 мкг/кг/мин внутривенно капельно в течение суток.
Длительность терапии определяется динамикой легочной гипертензии.
Ингибиторы фосфодиэстеразы 5 (ФДЭ5) – #Силденафил” (Ингибиторы фосфодиэстеразы, C01CE) [27]
Ингибиторы фосфодиэстеразы являются модуляторами циклического гуанозинмонофосфата (цГМФ), которые нацелены на ремоделирование сосудов путем ограничения пролиферации гладкомышечных клеток. #Силденафил наиболее активен в отношении висцеральных и сосудистых гладких мышц и используется самостоятельно или с оксидом азота для лечения ЛГ. Дозировка 1 мг/кг/сут в 4 приема через зонд, установленный в желудок (перорально), максимальная доза 3 мг/кг/сут.
Антигипертензивные средства для лечения легочной артериальной гипертензии C02KX – #Бозентан** [27]
#Бозентан** воздействует на эндотелин-1 уменьшая его концентрацию, снижает ЛГ, дозировка 4 мг/кг/сут в 2 приема через зонд (перорально)
Кардиотонические средства кроме сердечных гликозидов С01С – #Левосимендан**”[27]
Открывает АТФ чувствительные K+-каналы в гладких мышцах сосудов, и, таким образом, вызывает расслабление системных и коронарных артерий и вен. Является селективным ингибитором фосфодиэстеразы 3 (C01CE). #Левосимендан**” внутривенно капельно в течение суток 0,1мкг/кг в минуту.
#” Относится к препаратам off-label у новорожденных. При назначении необходимо оформить в истории болезни заключение врачебной комиссии лечебного учреждения и согласие законных представителей ребенка на его применение.
Экстракорпоральная мембранная оксигенация (ЭКМО)
- ЭКМО рекомендовано пациентам с врожденной диафрагмальной грыжей с нарастающей дыхательной и сердечной недостаточностью при отсутствии эффекта от консервативной терапии [47,48,76–78].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: ЭКМО – комплекс устройств, позволяющих осуществлять оксигенацию крови в обход легких. Показания к инициации ЭКМО определяются тяжестью респираторных и гемодинамических нарушений, сопутствующей патологией, длительностью предшествующей респираторной поддержки [27]:
Показания к ЭКМО | Рекомендации |
Дыхательная недостаточность (гипоксемическая или/и вентиляционная) | 1. Ppeak >26-28 мм.рт.ст. или МАР >15-18 мм.рт.ст. для достижения предуктальной SpO2 >85% 2. Невозможность достижения или поддержания предуктальной SpO2 >85% 3. Стойкий тяжелый респираторный ацидоз (pCO2 >70-80 мм.рт.ст.) при pH <7,20 |
Сердечная недостаточность | 1. Неадекватная системная доставка О2 с наличием метаболического ацидоза 2. Тяжелая рефрактерная системная артериальная гипотензия 3. Тяжелая дисфункция левого и/или правого желудочка |
Острое ухудшение клинической картины | 1. Предуктальная десатурация без возможности восстановления показателей 2. Стремительное ухудшение гемодинамики 3. Нарастание лактат-ацидоза |
Для определения показаний к ЭКМО применяется индекс оксигенации.
Индекс оксигенации рассчитывается по следующей формуле:
IO = (MAP × FiO2 / PaO2) × 100, где
МАР – среднее давление в дыхательных путях, если ребенок находится на традиционной вентиляции, или CDP при ВЧО ИВЛ.
FiO2 – фракционная концентрация кислорода
РаО2 – парциальное давление кислорода в артериальной крови пациента.
Индекс оксигенации выше 25 является показанием к проведению ЭКМО
Противопоказания к ЭКМО:
- значимые сопутствующие врожденные аномалии развития (сложные врожденные пороки сердца или пороки развития ЦНС)
- летальные хромосомные аномалии (трисомия 18) или другие летальные врожденные пороки развития
- внутричерепные кровоизлияния III-IV степени
- масса тела менее 1800г
- гестационный возраст менее 32-34 недель
- длительная (более 7 дней) ИВЛ с высоким давлением (МАР >15-18мм.рт.ст).
- Пациентам с врожденной диафрагмальной грыжей рекомендуется проводить оценку готовности к оперативному лечению каждые 24 часа [3,47,48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Сроки предоперационной подготовки определяются состоянием ребенка. Оперативное лечение у детей с ВДГ выполняется по неотложным показаниям при сохраняющихся стабильных показателях в течение суток:
- стабильная оксигенация: SpO2 >94 % при FiO2 0,5-0,6
- показатели ЧСС в пределах возрастной нормы; среднее АД в пределах возрастной нормы и выше давления в правом желудочке;
- степень легочной гипертензии со снижением или на уровне системного АД по данным ЭХО-КГ, без легочно-гипертензионных кризов;
- диурез ≥2 мл/кг/час;
- значения КОС: pH не ниже 7.2, pCO2 не выше 65 мм рт ст, лактат не выше 3 ммоль/л).
- Пациентам с врожденной диафрагмальной грыжей хирургическое лечение рекомендовано проводить с применением сбалансированной общей анестезии [48,79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Если ребенок находится на «жестких» параметрах ИВЛ, ВЧОИВЛ, получает ингаляцию динитрогена оксида** или высокие дозы адренергических и дофаминергических средств следует рассмотреть вопрос о проведении операции в условиях реанимационного зала – «на месте».
Чаще применяется тотальная внутривенная анестезия или ее комбинация с ингаляционной. Противопоказана ингаляция динитрогена оксида**
Во время операции продолжается инфузия адренергических и дофаминергических средств, которые вводились до операции.
- Пациентам с врожденной диафрагмальной грыжей при отсутствии противопоказаний возможно выполнение эпидуральной блокады [27]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Эпидуральную блокаду выполняют с целью аналгезии в послеоперационном периоде. Для обезболивания используют раствор ропивакаина** 0,2%. В дозе 0,2 мг/кг/час капельно в эпидуральное пространство длительностью до 72 часов.
Профилактика и лечение инфекционных осложнений проводятся согласно протоколу антибактериальной терапии у новорожденных в ОРИТ и отделении хирургии. Коррекция и назначение антибактериальных препаратов рекомендовано всем пациентам с диафрагмальной грыжей по результатам лабораторных исследований
3.1.3 Хирургическое лечение
- Пациентам с врожденной диафрагмальной грыжей рекомендуется оперативное лечение с целью восстановления целостности диафрагмы и разграничения грудной и брюшной полости после достижения стабильного состояния. Операция может быть выполнена эндоскопическим или открытым способом. При дефиците собственных тканей диафрагмы необходимо использовать имплантационный материал [1,2,27,38,80–87].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Существует два общих подхода к хирургическому восстановлению диафрагмального дефекта при ВДГ: открытый или минимально инвазивный. В пределах этих широких категорий существует несколько подкатегорий.
Открытое восстановление ВДГ может быть выполнено с использованием торакального или абдоминального доступа. Преимущества лапаротомии включают более легком перемещении внутренних органов из грудной клетки в брюшную полость, возможность мобилизовать задний край диафрагмы, более легкое управление ротационными аномалиями кишечника (при необходимости) и предотвращение торакотомических осложнений со стороны опорно-двигательного аппарата. Подавляющее большинство открытых неонатальных вмешательств при ВДГ выполняются через разрез в подреберье, но возможно и использование лапаротомии. При правосторонней ВДГ чаще используют торакотомию. Истинный грыжевой мешок, следует иссечь. Грудную и брюшную полости следует осмотреть на предмет сопутствующей легочной секвестрации. Следует уделять особое внимание пиковому давлению в дыхательных путях при закрытии брюшной фасции. В случае возникновения дыхательной недостаточности хирург должен рассмотреть возможность временного закрытия брюшной полости с формированием вентральной грыжи или закрытием операционной раны только кожным лоскутом. Оставление дренажа в плевральной полости не обязательно.
Эндоскопический способ коррекции может быть использован у пациентов со стабильной гемодинамикой. При сомнительном решении тестом для определения возможности проведения эндоскопической коррекции является поворот ребенка на здоровый бок и наблюдение за изменением уровня сатурации в течение 5-10 минут. Если состояние ребенка не стабильное, пациента укладывают на спину и выполняют лапаротомию. Наиболее частым доступом используют торакоскопическую коррекцию как при левосторонней, так и для правосторонней локализации грыжи. Лапароскопия в настоящее время для первичной коррекции используется очень редко.
В любом случае принцип оперативного вмешательства складывается из двух этапов: перемещение органов из грудной клетки в брюшную полость и закрытие дефекта диафрагмы. При дефектах типа А и В закрытие возможно выполнить путем наложения швов на края дефекта, при типе В рекомендуется выполнить сквозной латеральный шов. При дефектах типа С и D собственных тканей для закрытия диафрагмы недостаточно. Поэтому рекомендуется использовать имплант (пленка политетрафторэтиленовая пористая перфорированная и неперфорированная для хирургического лечения грыж различной локализации лапароскопическим и традиционным способами, стерильная). Для закрытия дефекта с целью профилактики рецидива необходимо провести полную мобилизацию задней губы дефекта диафрагмы, а при ее отсутствии фиксацию импланта выполнить за ребро.
3.1.4 Послеоперационный период
- Пациентам с врожденной диафрагмальной грыжей в послеоперационном периоде рекомендуется проведение обезболивания [27]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Для обезболивания в послеоперационном применяют эпидуральную аналгезию (см. выше) или внутривенную опиодную аналгезию. Для внутривенной аналгезии используют #Фентанил**” раствор 0,005%. Дозировка 5 мкг/кг внутривенно капельно в течение суток, #Морфина гидрохлорид**” раствор 1%. Дозировка 10-15 мкг/кг/час внутривенно капельно в течение суток. Длительность обезболивания в послеоперационном периоде 5 суток.
- Пациентам с врожденной диафрагмальной грыжей в послеоперационном периоде рекомендуется проводить мониторинг осложнений [1–3,71]:
- хилоторакс;
- раневая инфекция;
- желудочно-пищеводный рефлюкс;
- рецидив ВДГ.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Пик накопления жидкости в плевральной полости приходится на 2-5 сутки после операции. В последующем происходит резорбция жидкости на 5-10 сутки после операции [27].
Послеоперационный хилоторакс возникает примерно у 20 % новорожденных в послеоперационном периоде после восстановления диафрагмы и может явиться показанием к дренированию плевральной полости. Для диагностики хилоторакса исследуют плевральный выпот (преобладают лимфоциты более 80%, содержание белка соответствует плазме крови, и повышено содержание триглицеридов и ß-липопротеидов). Основные принципы консервативной терапии хилоторакса включают внутривенное капельное #октреотида** в стартовой дозе 5 мкг/кг/час с увеличением дозы на 5 мкг/кг/час каждые 24-48 часов [27] при отсутствии снижения количества отделяемого по плевральному дренажу и перевод на cпециализированный продукт диетического лечебного питания для детей с рождения и взрослых при дефектах окисления длинноцепочных жирных кислот, хилотораксе и лимфангиэктазии "Monogen" ("Моноген") (при нарушении обмена жирных кислот)****.
Энтеральную нагрузку начинают после полного восстановления пассажа по желудочно-кишечному тракту. Предпочтение отдают грудному молоку, которое начинают вводить капельно через зонд, установленный в желудок. Постепенно увеличивая объем кормления. После экстубации и стабилизации общего состояния пациента постепенно переходят на грудное вскармливание или кормление молочной смесью. Специализированное питание пациентам с ДГ, как правило, не требуется
3.1.5 Иное лечение
Иное лечение не предусмотрено
3.2 Грыжа пищеводного отверстия диафрагмы
3.2.1 Консервативное лечение
- Пациентам с диагностированной грыжей пищеводного отверстия диафрагмы консервативная терапия не рекомендуется как основной метод лечения [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Консервативное и медикаментозное лечение при диагностированной ГПОД не показано в связи с тем, что эти методы направлены на профилактику и лечение ГЭР, но не устраняют саму хиатальную грыжу. При наличии противопоказаний к хирургическому лечение ГПОД консервативное и медикаментозное лечение включают в себя возвышенное положение ребенка сразу после кормления и во время сна, диету и дробное кормление, назначение препаратов, повышающих тонус нижнего сфинктера пищевода (прокинетики), и препаратов, снижающих агрессивность желудочного содержимого (антациды, Н2-блокаторы гистамина, ингибиторы протоновой помпы). Рекомендуется назначать консервативную терапию на предоперационном этапе с целью лечения осложнений ГЭР.
3.2.2 Хирургическое лечение
- Пациентам с диагностированной грыжей пищеводного отверстия диафрагмы рекомендуется хирургическое лечение – лапароскопическая хиатопластика и фундопликация [39,58,88–91].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарий: Показание к хирургическому лечению – все формы ГПОД, протекающие с выраженной клинической картиной и пептическими осложнениями. При пептическом стенозе пищевода операция целесообразна после полной ликвидации стеноза бужированием на фоне медикаментозного лечения. Предоперационная подготовка направлена на ликвидацию последствий патологического желудочно-пищеводного рефлюкса: гипотрофии, пневмонии, анемии.
При эндохирургическом лечении ГПОД у детей наибольшую популярность получила фундопликация по Ниссену, впервые описанная в 1956 году. В настоящее время эту операцию применяют у детей любого возраста. По данным многих авторов при фундопликации по Ниссену положительные результаты получены у 85-90% детей. Операция заключается в лапароскопической коррекции грыжи пищеводного отверстия диафрагмы, иссечении грыжевого мешка и гастрофундопликации. Главное преимущество лапароскопических операций при коррекции ГПОД – возможность повторных вмешательств без особых технических трудностей, связанных со спаечным процессом в брюшной полости. Лапароскопическая коррекция ГПОД выполнима у детей независимо от возраста и массы тела, при любых пороках и при рецидиве заболевания. Особенно важна возможность лапароскопической коррекции ГПОД после ранее выполненных открытых операций с минимальной травматичностью и хорошими результатами.
Техника операции:
При лапароскопической коррекции ГПОД необходимо придерживаться принципов традиционной (открытой) операции. Основные этапы операции:
- низведение желудка и абдоминального отдела пищевода;
- иссечение грыжевого мешка;
- ушивание ножек диафрагмы (хиатопластика) и подшивание пищевода к диафрагме по периметру;
- мобилизация дна желудка и кардии;
- создание манжеты Ниссена высотой 1,5-2 см.
На операционном столе ребенка укладывают с углом наклона ножного конца на 10-15° вниз. В брюшную полость вводят 5 троакаров (подобно лапароскопической фундопликации по Ниссену): 1-й троакар устанавливают через пупок (эндоскоп); 2-й троакар – в правом подреберье; 3-й троакар – под мечевидным отростком; 4-й троакар – в левом подреберье; 5-й троакар – в левой подвздошной области.
В зависимости от возраста и веса больного используют троакары диаметром 3,5 и 5 мм. Первый троакар (диаметр 4,7 мм) вводят методом открытой лапароскопии чрезумбиликально. Через него в брюшную полость инсуффлируют углекислый газ (давление 10–14 мм рт.ст.). В этот же троакар вводят эндоскоп с угловой оптикой 30° (диаметр 4 мм). После создания карбоксиперитонеума в брюшную полость вводят остальные 4 троакара для эндоинструментов диаметром 3 или 5 мм. После осмотра брюшной полости низводят желудок и абдоминальный отдел пищевода в брюшную полость. При параэзофагеальной ГПОД необходимо полностью иссечь грыжевой мешок.
При лапароскопической коррекции ГПОД необходимо всегда придерживаться следующих правил:
- минимальная мобилизация брюшного отдела пищевода и кардии;
- сохранение печеночно-пищеводной связки и ветвей блуждающего нерва, идущих к печени, для профилактики послеоперационной дискинезии желчевыводящих путей;
- полное иссечение грыжевого мешка;
- фиксация пищевода к диафрагме отдельными узловыми швами;
- мобилизация дна желудка с пересечением коротких артерий желудка на небольшом протяжении (1-3 коротких артерий желудка);
- создание антирефлюксной круговой манжеты шириной 1,5-2 см.
3.2.3 Послеоперационное ведение
Послеоперационный период после лапароскопической коррекции ГПОД не отличается от такового после других лапароскопических вмешательств. Выписку из стационара можно планировать при достижении объема разового кормления возрастной нормы и удовлетворительном общем состоянии. Контрольное обследование (рентгеноконтрастное исследование, ЭГДС) при отсутствии жалоб и дисфагии при кормлении не проводится. Результаты хирургического лечения оценивают через 6 месяцев после операции [92].
3.3 Грыжа переднего отдела диафрагмы
3.3.1 Хирургическое лечение
- Пациентам с грыжей переднего отдела диафрагмы рекомендуется хирургическое лечение – лапароскопическая коррекция грыжи с иссечением грыжевого мешка [93–95].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
Комментарий: Лечение грыж переднего отдела диафрагмы только оперативное. В мировом хирургическом сообществе наиболее спорным аспектом коррекции грыж переднего отдела диафрагмы является выбор оперативного доступа. В настоящее время существует тенденция в использовании минимальноинвазивных методов.
Большинство коллег предпочитают лапароскопический доступ, отмечая его преимущества:
- относительная простота и безопасность
- хороший обзор обоих куполов диафрагмы
- возможность рассечения спаек и сращений между сальником и органами
- низкая частота конверсий и осложнений [95–97].
Лапароскопическая методика дополнительно позволяет уменьшить травматизацию тканей, потребность в послеоперационной аналгезии, сократить сроки госпитализации и реабилитации [93].
Торакоскопический доступ, предоставляющий возможность более прецизионного рассечения внутригрудных спаек, обладает рядом недостатков: существующим риском не обнаружить двустороннюю грыжу, а также менее оптимальными условиями для работы при иссечении грыжевого мешка. Все это ограничивает использование данного доступа в лечении пациентов с грыжами переднего отдела диафрагмы [94].
Открытые методики коррекции грыж переднего отдела диафрагмы в настоящее время становятся менее актуальными в использовании, хотя стоит отметить оптимальность трансстернального доступа в случае симультанной коррекции грыжи переднего отдела диафрагмы и сочетанного порока сердца [98].
Иссечение грыжевого мешка является обязательным этапом операции, чтобы избежать формирования кисты в оставленной полости и для профилактики рецидива заболевания. Опасения, связанные с иссечением грыжевого мешка, обусловлены возможностью интраоперационных осложнений в виде пневмоторакса и пневмомедиастинума с дыхательными или циркуляторными расстройствами, повреждения перикарда и структур средостения [95]. Хотя ряд хирургов предпочитают оставлять грыжевой мешок in situ, ссылаясь на отсутствие доказательств о существовании корреляции между частотой рецидивов и оставлением мешка [94]. Также сторонники оставления грыжевого мешка отмечают уменьшение времени операции и риска возникновения интраоперационных осложнений, таких как кровотечение из спаек, повреждения диафрагмального нерва, перикарда и плевры [26,99].
Наиболее оптимальный способ пластики диафрагмы заключается в наложении погружных U-образных узловых швов, проходящих сквозь переднюю брюшную стенку (грудную стенку в случае торакоскопии) и фиксирующих к ней диафрагму. В некоторых случаях можно использовать дополнительную фиксацию диафрагмы к ребру. Наряду с использованием U-образных швов [27,28,100], некоторые предпочитают П-образные швы, считая их более надежными [98,101].
Заплаты при пластике диафрагмы у детей с грыжами переднего отдела диафрагмы применяются нечасто [96,102]. Однако Y.W.Tan et al. связывают использование заплат с уменьшением риска возникновения рецидива [94]. Известны послеоперационные осложнения, связанные с аутопластикой диафрагмы: легочная гипертензия и дыхательная недостаточность, развитие гемо/пневмоторакса [103]. Ряд исследователей отметили рецидив после ушивания грыжи Морганьи-Ларрея в 2,8-5,7% случаев независимо от открытых и мини-инвазивных вмешательств с уменьшением количества осложнений при использовании сетки [29,102].
3.4 Релаксация (эвентрация) диафрагмы
3.4.1 Консервативное лечение
Лечение релаксации диафрагмы зависит от степени выраженности респираторного дистресс-синдрома. Обычно начинают с консервативной терапии, направленной на поддержание сердечной деятельности и адекватной легочной вентиляции. Помимо постоянной оксигенации периодически проводят дыхание с повышенным сопротивлением на выдохе. При отсутствии эффекта подключают вспомогательную или искусственную вентиляцию. При отсутствии эффекта через 2–3 недели выполняют хирургическое лечение.
3.4.2 Хирургическое лечение
- Пациентам с релаксацией диафрагмы рекомендуется хирургическое лечение – торакоскопическая пликация диафрагмы [1,104–110].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
Комментарии: Задачей хирургического вмешательства является восстановление исходного уровня стояния диафрагмы, в результате чего грудные и брюшные органы должны занять свое нормальное положение. Операция заключается в пластике диафрагмы собственными тканями. Среди различных методов пластики диафрагмы собственными тканями наиболее широкое распространение получила френопликация – формирование дупликатуры из складки диафрагмы или из двух ее фрагментов после резекции истонченного участка диафрагмы. При этом способе купол диафрагмы вытягивают настолько, чтобы обеспечить нормальное положение диафрагмы. Затем получившийся лоскут фиксируют несколькими рядами швов к грудной стенке и диафрагме. Однако, такая операция может быть эффективной только при сохраненных трофических свойствах диафрагмальной мышцы, как правило, в ранней стадии релаксации или при ее ограниченной форме. В случаях выраженной релаксации и истончения всего купола диафрагмы дупликатурный способ диафрагмопластики не гарантирует отсутствие рецидива заболевания.
Современным и перспективным направлением хирургии диафрагмы являются торакоскопические операции при ее релаксации. Общеизвестные преимущества эндоскопических операций – прежде всего минимальное повреждение дыхательной мускулатуры грудной стенки – приобретают здесь особое значение, так как любой из описанных ранее видов пластики диафрагмы не может восстановить функцию этой главной дыхательной мышцы, а лишь создает неподвижную грудобрюшную перегородку. Даже после успешно выполненной и эффективной операции дыхательные движения осуществляются за счет вспомогательной дыхательной мускулатуры и поэтому максимально возможное сохранение межреберных мышц, которое обеспечивает торакоскопический доступ, является чрезвычайно важным.
Доступ к комментариям ограничен 😔
Чтобы посмотреть комментарии других врачей и поделиться своим мнением, пожалуйста, войдите на Medpoint