Hetzel B. Iodine deficiency disorders (idd) and their eradication. Lancet. 1983; 322(8359):1126-1129. doi: 10.1016/s0140-6736(83)90636-0
Zimmermann M.B., Jooste P.L., Pandav C.S. Iodine-deficiency disorders. Lancet. 2008; 372(9645):1251-1262. doi: 10.1016/s0140-6736(08)61005-3
Таранушенко Т.Е. Йододефицитные заболевания у детей. Докторская диссертация. 1999.
Коваленко Т.В. Здоровье и развитие детей, рожденных в условиях зобной эндемии. Докторская диссертация. 2000.
Платонова Н.М. Йодный дефицит: современное состояние проблемы. Клиническая и экспериментальная тиреоидология. 2015; 11(1):12-21.
Hintze G., Koebberling J. Treatment of iodine deficiency goiter with iodine, levothyroxine or a combination of both. Thyroidology. 1992; 4:37-40.
Gartner R., Dugrillon A., Bechtner G. Evidence that iodolactones are the mediators of growth inhibition by iodine on the thyroid. Acta Med Austriaca. 1996; 23(1–2):47–51.
Трошина Е.А. Диффузный эутиреоидный зоб. Алгоритмы лечения и профилактика препаратами йода. Лекция. Проблемы эндокринологии. 2014; 60(5):49-56.
Шапкина Л.А. Зобная эндемия в Приморском крае: клинико-эпидемиологические и экологические аспекты. Кандидатская диссертация. 2005.
Малиевский О.А. Дифузный нетоксический зоб у детей в Республике Башкортостан: распространенность, структура, лечение, профилактика. Докторская диссертация. 2001.
Кичикова Ж.Д. Клинико-морфологические особенности эндемического зоба у жителей Калмыкии. Кандидатская диссертация. 2002.
Свинарев М.Ю. Эндемический зоб и некоторые показатели антитиреоидного аутоиммунитета (по материалам обследования детей Хвалынского района Саратовской области). Кандидатская диссертация. 1995.
Трошина Е.А., Платонова Н.М., Панфилова Е.А., Панфилов К.О. Аналитический обзор результатов мониторинга основных эпидемиологических характеристик йододефицитных заболеваний у населения Российской Федерации за период 2009-2015 гг. Проблемы эндокринологии. 2018; 64(1):21-37. doi: 10.14341/probl9308
Шапкина Л.А. Зобная эндемия в Приморском крае: клинико-эпидемиологические и экологические аспекты. Кандидатская диссертация. 2005.
Walker S.P., Wachs T.D., Gardner J.M., et al. International Child Development Steering Group. Child development: risk factors for adverse outcomes in developing countries. Lancet 2007; 369: 145–57.
Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers / WHO, United Nations Children’s Fund, International Council for the Control of Iodine Deficiency Disorders. – 3 rd ed. – Geneva, 2007. – Р. 1-97.
WHO, UNICEF and ICCIDD. Assessment of Iodine Deficiency Disorders and monitoring their elimination. Geneva: WHO, WHO/Euro/NUT, 2001.
Tan G.H., Gharib H. Thyroid incidentalomas: management approaches to nonpalpable nodules discovered incidentally on thyroid imaging. Ann Intern Med. 1997; 126:226–231.
Uppal A., White M.G., Nagar S., et al. Benign and malignant thyroid incidentalomas are rare in routine clinical practice: A Review of 97,908 Imaging Studies. Cancer Epidemiol Biomarkers Prev. 2015; 24(9):1327–1331. doi: 10.1158/1055-9965.EPI-15-0292
Gharib H., Papini E., Paschke R., et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. Endocr Pract. 2010; 16:468–475.
Walsh J.P. Managing thyroid disease in general practice. Medical Journal of Australia. 2016; 205:179.
Трошина Е.А. Зоб. -М.: Медицинское информационное агентство, 2012.
Braverman L. Iodine and the Thyroid: 33 Years of Study. Thyroid. 1994; 4(3): 351-356. doi: 10.1089/thy.1994.4.351
Eastman C. Screening for thyroid disease and iodine deficiency. Pathology. 2012; 44:153–9
Costante G., Meringolo D., Durante C., et al. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J Clin Endocrinol Metab. 2007; 92:450–455.
Chambon G, Alovisetti C, Idoux-Louche C, et al. The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients. J Clin Endocrinol Metab. 2011; 96:75–81.
Elisei R., Bottici V., Luchetti F., et al. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab. 2004; 89:63–168.
Rink T., Dembowski W., Schroth H.J., Klinger K. Stellenwert. Impact of serum thyroglobulin concentration in the diagnosis of benign and malignant thyroid diseases. Nuklearmedizin. 2000;39(5):133‐138.
Gray J.L., Singh G., Uttley L., Balasubramanian S.P. Routine thyroglobulin, neck ultrasound and physical examination in the routine follow up of patients with differentiated thyroid cancer-Where is the evidence? Endocrine. 2018; 62(1):26–33. doi: 10.1007/s12020-018-1720-3
Guth S., Theune U., Aberle J., Galach A., Bamberger C. M. Very high prevalence of thyroid nodules detected by high frequency (13MHz) ultrasound examination. Eur J Clin Invest. 2009; 39:699–706.
Haugen B.R., Alexander E.K., Doherty G.M., et al. American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer. The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-147.
Zimmermann M., Saad A., Hess S., Torresani T., Chaouki N. Thyroid ultrasound compared with World Health Organization 1960 and 1994 palpation criteria for determination of goiter prevalence in regions of mild and severe iodine deficiency. Eur J Endocrinol. 2000;143(6):727‐731. doi:10.1530/eje.0.1430727
Horvath E, Majlis S, Rossi R et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab. 2009; 94(5):1748-51. doi:10.1210/jc.2008-1724
Kwak J.Y., Han K.H., Yoon J.H. et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk. Radiology. 2011; 260(3):892-9. doi: 10.1148/radiol.11110206
Russ G., Bonnema S.J., Erdogan M.F., Durante C., Ngu R., Leenhardt L. European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur Thyroid J. 2017; 6:225–237. doi: 10.1159/000478927
Russ G., Leboulleux S., Leenhardt L., Hegedüs L. Thyroid incidentalomas: epidemiology, risk stratification with ultrasound and workup. Eur Thyroid J. 2014; 3:154–163.
Bonavita J.A., Mayo J., Babb J., Bennett G., Oweity T., Macari M., Yee J. Pattern recognition of benign nodules at ultrasound of the thyroid: which nodules can be left alone? AJR Am J Roentgeno.l 2009; 193:207–213.
Brito J.P., Gionfriddo M.R., Al Nofal A., Boehmer K.R., et al. The accuracy of thyroid nodule ultrasound to predict thyroid cancer: systematic review and meta-analysis. J Clin Endocrinol Metab. 2014; 99:1253–1263.
Na D.G., Baek J.H., Sung J.Y., et al. Thyroid imaging reporting and data system risk stratification of thyroid nodules: categorization based on solidity and echogenicity. Thyroid. 2016; 26:562–572.
Wei X., Li Y., Zhang S., Gao M. Meta-analysis of thyroid imaging reporting and data system in the ultrasonographic diagnosis of 10,437 thyroid nodules. Head Neck. 2016; 38:309–315.
Cibas E.S., Ali S.Z. The Bethesda System for Reporting Thyroid Cytopathology. Thyroid. 2009; 19(11):1159-65. doi: 10.1089/thy.2009.0274
Ali SZ, VanderLaan PA. The Bethesda System for Reporting Thyroid Cytopathology: Definitions, Criteria, and Explanatory Notes, 3rd ed. Springer: New York, NY, USA; 2023.
Детская тиреоидология. Под редакцией Габора Синнаи; Перевод с англ. под редакцией Петерковой В.А. - М.: ГЭОТАР-Медиа, 2016.
Brovin D., Peterkova V., Anikiev A., et al. The Value of Cytological, Histological and US Examination to Determine of Management Children with Nodular Goiter. Horm Res Paediatr. 2018; 90(1):88.
Lebbink, Chantal & Links, Thera & Czarniecka, Agnieszka & Dias, Renuka & Elisei, Rossella & Izatt, Louise & Krude, Heiko & Lorenz, Kerstin & Luster, Markus & Newbold, Kate & Piccardo, Arnoldo & Sorinho-Simoes, Manuel & Takano, Toru & Trotsenburg, A. S. Paul & Verburg, Frederik & Santen, Hanneke M. (2022). 2022 ETA Guidelines for the management of pediatric thyroid nodules and differentiated thyroid carcinoma. European thyroid journal. 11. 10.1530/ETJ-22-0146. P.16-18
Hoffman M.R., Meadows S.E., Langlois J.P. Clinical inquiries. What is the best approach to goiter for euthyroid patients? J Fam Pract. 2007; 56:479-480.
Schroeder P.R., Ladenson P.W. Toxic Nodular Goiter. Clinical Management of Thyroid Disease. 2009:203-219. doi: 10.1016/B978-1-4160-4745-2.00014-6
Bahn R.S., Burch H.B., Cooper D.S., et al. Hyperthyroidism and Other Causes of Thyrotoxicosis: Management Guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid. 2011; 21.
Weetman A.P. Radioiodine treatment for benign thyroid diseases. Clinical Endocrinology. 2007;66(6);757-764.
Hoermann R. Treatment Regimens in Toxic and Diffuse Goiters in Iodine Deficiency. Comprehensive Handbook of Iodine. 2009; 9:789-800. doi: 10.1016/B978-0-12-374135-6.00081
Toft A.D. Subclinical Hyperthyroidism. New England Journal of Medicine. 2001; 345(7):512-516. doi: 10.1056/NEJMcp010145
Ianni F., Perotti G., Prete A., et al. Thyroid scintigraphy: an old tool is still the gold standard for an effective diagnosis of autonomously functioning thyroid nodules. J Endocrinol Invest. 2013;36(4):233-6. doi: 10.3275/8471
Dutta D., Kumar M., Thukral A., et al. Medical management of thyroid ectopia: report of three cases. J Clin Res Pediatr Endocrinol. 2013; 5(3):212–215. doi: 10.4274/Jcrpe.1103
Tunkel D.E., Domenech E.E. Radioisotope scanning of the thyroid gland prior to thyroglossal duct cyst excision. Arch Otolaryngol Head Neck Surg. 1998; 124:597–599.
Sood A., Sood V., Sharma D.R., Seam R.K., Kumar R. Thyroid scintigraphy in detecting dual ectopic thyroid: a review. Eur J Nucl Med Mol Imaging. 2008; 35:843–846.
Medeiros-Neto G. Multinodular Goiter. 2016 [online] Ncbi.nlm.nih.gov. Available at: <https://www.ncbi.nlm.nih.gov/books/NBK285569/> [Accessed 20 May 2020].
Grussendorf M., Reiners C., Paschke R., Wegscheider K., on behalf of the LISA investigators. Reduction of thyroid nodule volume by levothyroxine and iodine alone and in combination: a randomized, placebo-controlled trial. J Clin Endocrinol Metab. 2011; 96:2786–95.
Wilders-Truschnig M.M., Warnkross H., Leb G. The effect of treatment with levothyroxine or iodine on thyroid size and thyroid growth stimulating immunoglobulins in endemic goiter patients. Clin. Endocrinol. (Oxf.). 1993; 39(3):281-286.
Фадеев В.В. Современные принципы лечения эутиреоидного зоба. Трудный пациент, 2010.
Ghaznavi S., Lithgow K., Agrawal V., Paschke R. Nontoxic Goiter. Encyclopedia Of Endocrine Diseases. 2018; 524-528. doi: 10.1016/b978-0-12-801238-3.96012-4
DeMaeyer E.M., Lowenstein F.W., Thilly C.W. and World Health Organization. The control of endemic goiter. 1979.
Szabolcs I., Podoba J., Feldkamp J., Dohan O., Farkas I., Sajgo M., Takats K.I., Goth M., Kovacs L., Kressinszky K., et al. Comparative screening for thyroid disorders in old age in areas of iodine deficiency, long-term iodine prophylaxis and abundant iodine intake. Clin Endocrinol. 1997; 47:87-92.
Kouame P., Koffi M., Ake O., Nama-Diarra A.J., Chaventre A. Management strategies for endemic goiter in developing countries. Med Trop (Mars). 1999;59(4):401‐410.
Трошина Е.А. Современные стандарты, регламентирующие применение калия йодида у беременных и кормящих женщин. Гинекология. 2013; 15(4):48-52.
Мельниченко Г.А., Фадеев В.В., Дедов И.И. Заболевания щитовидной железы во время беременности (диагностика, лечение, профилактика). Пособие для врачей. - М.: 2003.
Alexander E.K., Pearce E.N., Brent G.A., et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017; 27(3). doi:10.1089/thy.2016.0457
Pearce E.N., Lazarus J.H., Moreno-Reyes R., Zimmermann M.B. Consequences of iodine deficiency and excess in pregnant women: an overview of current knowns and unknowns. Am J Clin Nutr. 2016; 104:918S-23S.
Andersson M., De Benoist B., Delange F., Zupan J. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2 years old: conclusions and recommendations of the technical consultation. Public Health Nutr. 2007; 10:1606-1611
Van den Boogard E., Vissenberg R., Land J.A., et al. Significance of subclinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update. 2011; 17:605-619.
Hintze G., Köbberling, J. Treatment of iodine deficiency goiter with iodine, levothyroxine or a combination of both. Thyroidology Clinical and Experimental. 1992;4(1):37-40.
Haddow J.E., Palomaki G.E., Allan W.C., et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. New Engl J Med. 1999; 341:49-555.
Liu Q., Djuricin G., Prinz R.A. Total thyroidectomy for benign thyroid disease. Surgery. 1998; 123:2-7.
Bellantone R., Lombardi C.P., Bossola M., et al Total thyroidectomy for management of benign thyroid disease: review of 526 cases. World J Surg. 2002; 26:1468-1471.
Le Moli R., Wesche M.F., Tiel-Van Buul MM, Wiersinga W.M. Determinants of longterm outcome of radioiodine therapy of sporadic non-toxic goitre. Clin Endocrinol. 1999; 50:783–9.
Silva MN, Rubió IG, Romão R, Gebrin EM, Buchpiguel C, Tomimori E, Camargo R, Cardia MS, Medeiros-Neto G. Administration of a single dose of recombinant human thyrotrophin enhances the efficacy of radioiodine treatment of large compressive multinodular goitres. Clin Endocrinol (Oxf). 2004 Mar;60(3):300-308.
76 Huo Y, Xie J, Chen S, Wang H, Ma C. Recombinant human thyrotropin (rhTSH)-aided radioiodine treatment for non-toxic multinodular goitre. Cochrane Database Syst Rev. 2021 Dec 28;12(12):CD010622. doi: 10.1002/14651858.CD010622.pub2. PMID: 34961921; PMCID: PMC8712889. Новый источник Убираем источник Sorensen J.R., Watt T., Cramon P., Dossing H., Hegedus L., Bonnema S.J., Godballe C. Quality of life after thyroidectomy in patients with nontoxic nodular goiter: A prospective cohort study. Head Neck. 2017; 39(11):2232-2240.
Erdogan M.F., Küçük N.O., Anil C., et al. Effect of radioiodine therapy on thyroid nodule size and function in patients with toxic adenomas. Nucl Med Commun. 2004; 25:1083–1087.
Rokni H., Sadeghi R., Moossavi Z., Treglia G., Zakavi S.R. Efficacy of different protocols of radioiodine therapy for treatment of toxic nodular goiter: systematic review and meta-analysis of the literature. Int J Endocrinol Metab. 2014; 12(2):e14424. doi:10.5812/ijem.14424
Niedziela M., Breborowicz D., Trejster E., Korman E. Hot nodules in children and adolescents in western Poland from 1996 to 2000: clinical analysis of 31 patients. J Pediatr Endocrinol Metab. 2002; 15:823–830.
Schwab K.O., Pfarr N., van der Werf-Grohmann N., Pohl M., Radecke J., Musholt T., Pohlenz J. Autonomous thyroid adenoma: only an adulthood disease? J Pediatr. 2009; 154:931–933.
Percutaneous intranodular ethanol injection Goletti O., Monzani F., Lenziardi M., et al. Cold thyroid nodules: a new application of percutaneous ethanol injection treatment. J Clin Ultrasound. 1994; 22:175-178.
Monzani F., Lippi F., Goletti O., et al. Percutaneous aspiration and ethanol sclerotherapy for thyroid cysts. J Clin Endocrinol Metab. 1994; 78:800-802.
World Health Organization, UNICEF, International Council for Control of Iodine Deficiency Disorders. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. Geneva: World Health Organization; 2007.
WHO. Iodine and health. Eliminating iodine deficiency disorders safely through salt iodization. Geneva: WHO publ. 1994:1-7.
Haldimann M., Alt A., Blanc A., Blondeau K. Iodine content of food groups. J Food Comp Anal. 2005; 18:461–71.
Pearce E.N., Lazarus J.H., Moreno-Reyes R., Zimmermann M.B. Consequences of iodine deficiency and excess in pregnant women: an overview of current knowns and unknowns. Am J Clin Nutr. 2016; 104:918S-23S.
Nikiforov Y.E., Ohori N.P., Hodak S.P., et al. Impact of mutational testing on the diagnosis and management of patients with cytologically indeterminate thyroid nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab. 2011; 96:3390–3397.
Nikiforov Y.E., Carty S.E., Chiosea S.I., Highly accurate diagnosis of cancer in thyroid nodules with follicular neoplasm/suspicious for a follicular neoplasm cytology by ThyroSeq v2 next-generation sequencing assay. Cancer. 2014; 120:3627–3634.
Alexander E.K., Schorr M., Klopper J., et al. Multicenter clinical experience with the Afirma gene expression classifier. J Clin Endocrinol Metab. 2014; 99:119–125.
Verkaik-Kloosterman J. Neonatal heel prick screening TSH concentration in the Netherlands as indicator of iodine status. Nutr J. 2021;20(1):63. doi: 10.1186/s12937-021-00722-4.
González Martínez S, Prieto García B, Escudero Gomis AI, Delgado Álvarez E, Menéndez Torre EL. Neonatal TSH as a marker of iodine nutrition status. Effect of maternal ioduria and thyroid function on neonatal TSH. An Pediatr (Engl Ed). 2022; S2341-2879(22)00210-1. doi: 10.1016/j.anpede.2022.09.008.
Nazeri P, Mirmiran P, Kabir A, Azizi F. Neonatal thyrotropin concentration and iodine nutrition status of mothers: a systematic review and meta-analysis. Am J Clin Nutr. 2016;104(6):1628-1638. doi: 10.3945/ajcn.116.131953.
Zimmermann M.B., S. Hess Y., Molinari L. et al. New reference values for thyroid volume by ultrasound in iodine-sufficient schoolchildren: a World Health Organization/Nutrition for Health and Development Iodine J. Clinical Nutrition. 2004;79(2): 231-237.
ЮНИСЕФ; Глобальная сеть по йоду. Рекомендации по мониторингу программ йодирования соли и оценке статуса йодной обеспеченности населения (русскоязычная версия) // Клиническая и экспериментальная тиреоидология. – 2018. – Т. 14. – No2. – С. 100–112. doi: 10.14341/ket9734
Радионуклидная диагностика для практических врачей /. Под ред. Ю.Б. Лишманова, В.И. Чернова. – Томск: STT, 2004. –. 394 с. ISBN 5-93629-166-9. - 398 страниц
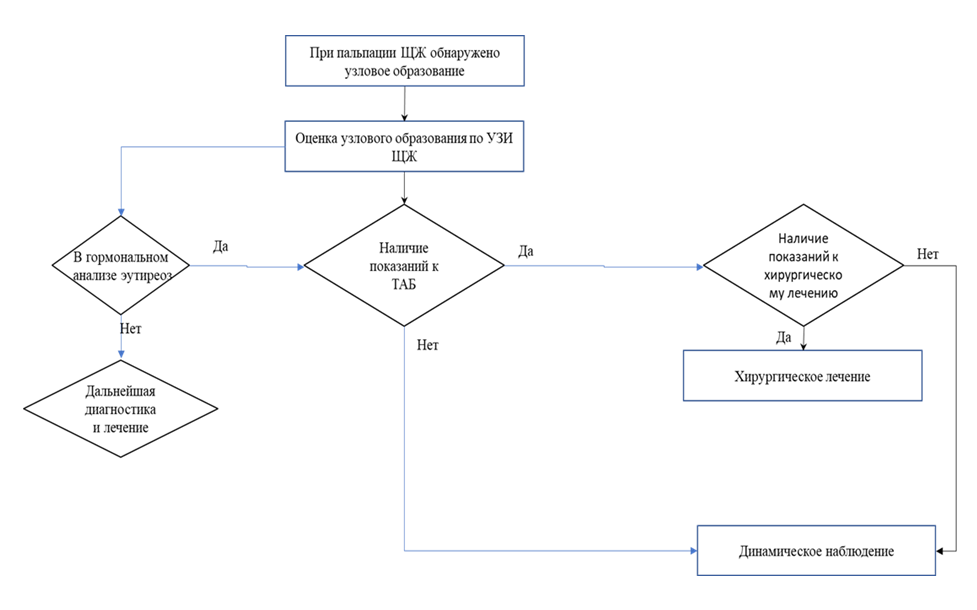
 2. Алгоритм действий врача «Узловой/многоузловой зоб»
2. Алгоритм действий врача «Узловой/многоузловой зоб»